
Теория электролитической диссоциации. Свойства растворов электролитов - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: углубить и обобщить знания, основные понятия электролитической диссоциации; научить применять их в составлении уравнений диссоциации, реакций ионного обмена; дать представление об универсальности теории электролитической диссоциации, применении ее для неорганической и органической химии.
Основные понятия: электролиты, неэлектролиты, диссоциация, ассоциация, гидратированные ионы, катионы, анионы, сильные, слабые электролиты, степень электролитической диссоциации, константа диссоциации.
Оборудование: кодотранспорант или распечатанные вопросы теста на столе, опорный конспект, лекция.
Ход урока
I. Организационный момент
Урок комбинированный. На уроке предусмотрена самостоятельная работа в момент изучения нового материала — тестовое задание, в ходе обсуждения которого обобщаются сведения по теории электролитической диссоциации.
Решение расчетных задач на количественную характеристику растворов.
II. Самостоятельная работа
|
Вариант I |
Вариант II |
|
|
|
Решение задач вариантов
Вариант I
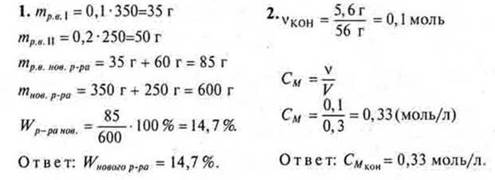
Вариант II
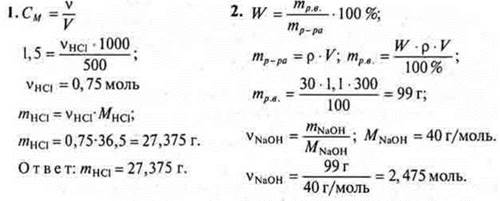
II. Изучение нового материала
План изложения
1. Работа учащихся с заданиями теста на кодотранспоранте по теме «Электролитическая диссоциация» с целью воспроизведения знаний учащихся.
2. Основные понятия теории электролитической диссоциации:
а) электролит и неэлектролит;
б) сильные и слабые электролиты;
в) степень диссоциации, константа диссоциации.
3. Диссоциация кислот, солей, оснований.
4. Реакции ионного обмена.
В 9 классе тема ТЭД нами была изучена. На данном уроке нам предстоит вспомнить узловые теоретические вопросы данной темы, «крепить основные понятия ТЭД, а также умение составлять уравнения диссоциации электролитов и реакции ионного обмена.
Вначале поработаем с тестом на кодотранспоранте (или: вопросы теста напечатаны в расчете один экземпляр на каждую парту).
1. Какие вещества называются электролитами, неэлектролитами?
а) выбрать электролиты: азот, хлорид калия (р-р), азотная кислота (Р↑), углекислый газ, сахароза;
б) выбрать неэлектролиты: глюкоза, хлорид цинка, спирт.
2. Дать определение диссоциации. Это процесс обратный?
3. Соотнести схемы диссоциации вещества:
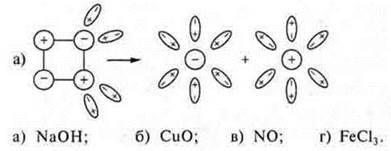
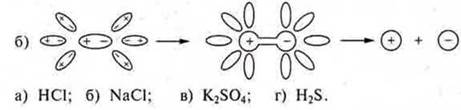
Что показывает степень электролитической диссоциации?
Выберите формулы а) сильных электролитов, б) слабых электролитов:
Fe(OH)3; HNO3; ВаСO3; Са3(РO4)2; Na2S; КОН; Н3РO4; NH4OH.
4. Выбрать и назвать а) катионы и б) анионы:
![]()
5. Какие вещества при диссоциации образуют силикат-ионы?
a) CaSiO3; б) Na2SiO3; в) H2SiO3; г) SiO2.
6. Какие вещества при диссоциации образуют катионы магния?
a) MgCl2; б) Mg3(PO4)2; в) MgO; г) Mg(NO3)2.
7. В растворах каких веществ присутствует избыток:
а) катиона водорода;
б) гидроксид-аниона вещества: соли? кислоты? щелочи?
8. Дать определение кислотам, солям, щелочам с точки зрения теории электролитической диссоциации.
9. Из предложенных формул веществ Fe2(SO4)2, Ва(ОН)2, Na2SiO3, H2SO4 выберите вещества, которые диссоциируют по схемам:
![]() —
катион металла;
—
катион металла;
![]() —
кислотный остаток;
—
кислотный остаток;
![]()
10. Что показывает степень электролитической диссоциации?
11. Даны растворы электролитов:
а) NaOH и H2SO4;
б) Ba(NO3)2 и НСl;
в) AgNO3 и NaBr;
г) Na2CO3 и НСl.
Возможны ли между ними реакции ионного обмена?
12. Соотнесите сокращенные ионные уравнения реакций:
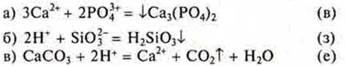
![]()
с левой частью молекулярных уравнений:
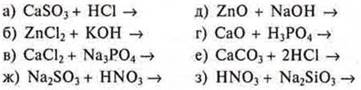
В ходе обсуждения ответов на вопросы учитель вводит дополнения по некоторым вопросам.
1. Электролиты — вещества, растворы и расплавы которых проводят электрический ток. Как правило, это соединения с ионной связью и с ковалентной полярной связью:
KCl — ионная связь; HNO3- — между Н+ и NO3 — ионная связь.
Неэлектролиты — вещества, растворы и расплавы которых не проводят электрический ток (органические соединения, газы):
С6Н12O6 — глюкоза, С2Н5ОН — этанол, спирт.
2. Диссоциация — распад электролита на ионы при растворении или расплавлении. Это процесс обратимый.
Процесс, обратный диссоциации, называется ассоциацией.
3. Показан механизм диссоциации:
а) веществ с ионной связью:
![]()
б) веществ с ковалентной полярной связью:
«диполь
воды» ![]() поляризует
связь, она становится ионной:
поляризует
связь, она становится ионной:
![]()
4. Катионы: Na+ — катион натрия; Са2+ — катион кальция; NH4+ — катион аммония.
Анионы: МnО4- — перманганат-анион; РO43- — фосфат-анион; NO2- — нитрит-анион; HCO3- — гидрокарбонат-анион.
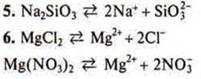
7. а) в растворах кислот:
![]()
б) в растворах щелочей:
![]()
8. Кислоты — электролиты, в растворах которых представлены в качестве катионов только катионы водорода:
![]()
Щелочи — электролиты, в растворах которых представлен в качестве анионов. Только гидроксид-анионы:
![]()
Соли — электролиты, в растворах которых при диссоциации образуются катионы металлов (или ион аммония) и анионы кислотных остатков.
9. ![]() —
основание
—
основание
![]() —
кислота
—
кислота
![]() —
соль средняя
—
соль средняя
![]() —
соль средняя
—
соль средняя
10. Степень электролитической диссоциации а показывает процент молекул, продиссоциированных к общему количеству молекул электролита:
![]()
а) электролиты сильные, α → 1. HNO3; Na2S; КОН. В их растворах равновесие полностью смещается в сторону прямой реакции:
![]()
б) электролиты слабые, α → 0. ВаСO3; Fe(OH)3; Са3(РO4)2; Н3РO4; NH4OH; Н2СO3.
Многие диссоциируют ступенчато.
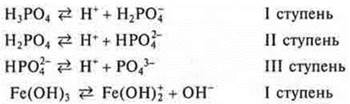
В растворах слабых электролитов равновесие смещается в сторону образования молекул, т. е. в сторону обратной реакции.
Для характеристики слабых электролитов используют константу диссоциации по каждой ступени

Константа диссоциации есть отношение произведения равновесных концентраций катионов и анионов, возведенных в степени коэффициентов равновесных концентраций, к концентрации непродиссоциированных молекул, Kд зависит от природы электролита, природы растворителя, температуры, но не зависит от концентрации. Иногда Kд вычисляют, используя концентрацию и степень диссоциации:
![]()
Пример:
при t° = 25° С

Итак, чем больше Кд, тем легче идет распад электролита на ионы, тем больше ионов в его растворе, тем сильнее электролит.
11. Реакции ионного обмена необратимы, если образуются осадок, газ, вода, слабый электролит:
![]() -
уравнение молекулярного вида
-
уравнение молекулярного вида
![]() -
общий ионный вид
-
общий ионный вид
![]() -
слабый электролит воды; уравнение краткого ионного вида
-
слабый электролит воды; уравнение краткого ионного вида
![]() —
реакция ионного обмена не имеет смысла
—
реакция ионного обмена не имеет смысла
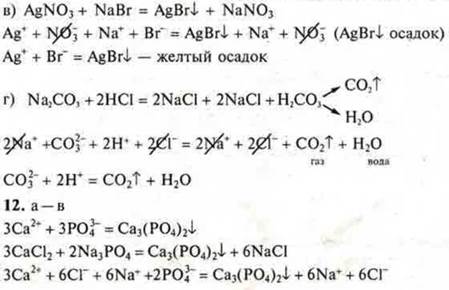
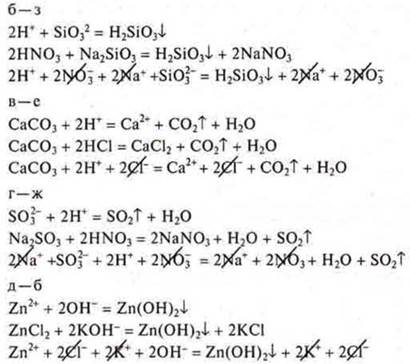
Ионы могут вступать в реакции окислительно-восстановительного взаимодействия с атомами, молекулами.
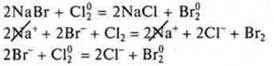
Обобщения и выводы по уроку.
IV. Домашнее задание
§ 15, с. 148-151, 154-155.
N° 1—2 (у). Следующие задания выполнить на отдельном листе по вариантам, на оценку.
|
Вариант I № 3 № 8 (а, б, в, ж) № 9 (а, в, д) № 10 (а, в, б, з) |
Вариант II № 4 № 8 (г, д, е, з) № 9 (б, е, б) № 10 (д, г, е, ж) |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.