
Металлы - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить и закрепить теоретические знания учащихся о строении атомов металлов, степенях окисления, химической связи, особенностях физических свойств металлов.
Основные понятия: металличность, электронное семейство, микроэлемент, микроэлемент, металлическая связь, полиморфизм, аллотропия, металлическая кристаллическая решетка, тяжелый и легкий металл, тугоплавкий и легкоплавкий металл, электропроводимость, пластичность, ферромагнитная, парамагнитная и диамагнитная способность.
Оборудование: коллекция «Металлы и сплавы», модели кристаллических решеток, таблица «Типы кристаллических решеток», олово белое и олово серое.
Ход урока
I. Самостоятельная работа
|
Вариант I |
Вариант II |
|
1. Будут ли данные соединения проявлять двойственные свойства? Дать обоснованный ответ. |
|
|
|
|
|
2. Записать структурные формулы изомеров (два), гомологов (два) состава. |
|
|
С5Н12О2 |
С5Н10О |
|
Дайте им названия и характеристику по классификации. |
|
Ответы на вопросы самостоятельной работы
Вариант I
1.
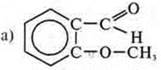 —
данное соединение гетерофункциональное; проявляет двойственные свойства.
—
данное соединение гетерофункциональное; проявляет двойственные свойства.
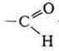 —
альдегидная группа. —О — группа простого эфира. Соединение проявляет свойства
ароматического альдегида и простого ароматического эфира.
—
альдегидная группа. —О — группа простого эфира. Соединение проявляет свойства
ароматического альдегида и простого ароматического эфира.
По классификации: циклическое, карбоциклическое, ароматическое, кислородосодержащее.
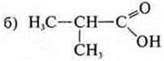 —
монофункциональное соединение;
—
монофункциональное соединение;
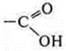 —
карбоновая кислота.
—
карбоновая кислота.
Ациклическое, предельное, кислородосдержащее.
2. C5H10О2CnH2nO2 — либо кислота, либо сложный эфир.
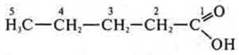 —
пентановая кислота.
—
пентановая кислота.
Ациклическое, предельное, кислородосодержащее.
Изомеры:
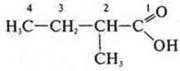 —
2-метилбутановая кислота;
—
2-метилбутановая кислота;
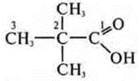 —
2,2-диметилпропановая кислота.
—
2,2-диметилпропановая кислота.
Гомологи:
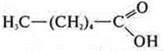 —
гексановая кислота;
—
гексановая кислота;
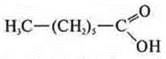 —
гептановая кислота.
—
гептановая кислота.
Сложный эфир — межклассовый.
Изомеры:
![]() —
пропиловый эфир этановой кислоты;
—
пропиловый эфир этановой кислоты;
![]() —
этиловый эфир пропановой кислоты.
—
этиловый эфир пропановой кислоты.
Гомологи (по карбоновой кислоте):
![]() —
пропиловый эфир пропановой кислоты;
—
пропиловый эфир пропановой кислоты;
![]() — пропиловый
эфир бутановой кислоты.
— пропиловый
эфир бутановой кислоты.
Вариант II
1.
а) Н3С—СН = СН—СН3 — ациклическое, непредельное, алкен; свойства алкенов;
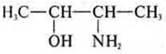 —
ациклическое, предельное, кислородо-азотосодержащее. —ОН — спирт одноатомный;
—NH2 — амин. Свойство спиртов и аминов — гетерофункциональное,
амино-спирт, двойственные свойства.
—
ациклическое, предельное, кислородо-азотосодержащее. —ОН — спирт одноатомный;
—NH2 — амин. Свойство спиртов и аминов — гетерофункциональное,
амино-спирт, двойственные свойства.
2. С5Н10О. СnН2nО — либо альдегид, либо кетон.
Альдегид:
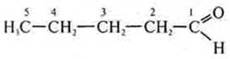 —
пентаналь; ациклическое, предельное, кислородосодержащее.
—
пентаналь; ациклическое, предельное, кислородосодержащее.
Изомеры:
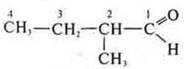 —
2-метилбутаналь;
—
2-метилбутаналь;
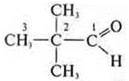 —
2,2-диметилпропаналь;
—
2,2-диметилпропаналь;
Гомологи:
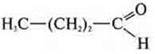 —
бутаналь;
—
бутаналь;
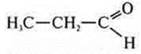 — пропаналь;
— пропаналь;
Кетон — межклассовый изомер:
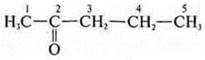 —
пентанон-2;
—
пентанон-2;
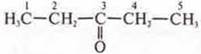 —
пентанон-3;
—
пентанон-3;
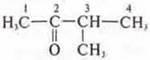 —
3-метилбутанон-2;
—
3-метилбутанон-2;
Гомологи:
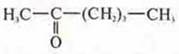 —
гексанон-2;
—
гексанон-2;
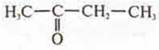 —
бутанон-2.
—
бутанон-2.
II. Изучение нового материала
План изучения
1. Химические элементы — металлы: положение в ПСХЭ Д.И. Менделеева; строение атомов металлов; электронное семейство: С.О. металлов на основании положения в системе; закономерности изменения металличности.
2. Простые вещества — металлы: химическая связь, кристаллическая решетка, общие физические свойства металлов, полиморфизм.
Учитель акцентирует внимание учащихся на значимости изучения данной темы и просит зачитать абзацы текста § 18, с. 192, которые начинаются так: «Простые вещества, образованные химическими элементами — металлами и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической “жизни” Земли».
По прочтении данных абзацев обращается внимание на понятия «макроэлемент», «микроэлемент». Учащимся предлагается вниманию таблица 16 с. 193 «Влияние недостатка и избытка ионов металлов на состояние растений и животных».
Видимо, такое исключительное значение металлов обусловлено их уникальными свойствами. Какие же свойства металлов известны? Учащиеся обязательно вспоминают электро- и теплопроводимость, пластичность, металлический блеск, твердость (кроме ртути) и т.д. Чтобы это все объяснить, необходимо последовательно ответить на вопрос, где расположены металлы в ПСХЭ Д.И.Менделеева.
Ответ: Если от В к At провести мысленно диагональ, то в нижнем левом углу системы расположены металлы, а также побочные подгруппы V, VI, VII, VIII группы.
В основном они расположены к началу периодов, к концу групп. У атомов металлов заполняются подуровни s-, р-, d-, f-, поэтому они образуют аналогичные семейства; s- и p-семейства — металлы главных подгрупп, d- и f- семейства — металлы побочных подгрупп.
Подавляющее большинство элементов в системе — металлические. На внешнем энергетическом уровне они имеют 1—2 электрона, реже 3—4. Для атомов металлов характерна небольшая электроотрицательность, они обладают только восстановительными свойвами — отдавать электроны. Восстановительная способность у металлов усиливается к началу периода и к концу главной подгруппы, т. к. возрастает атомный радиус.
У металлов побочных групп с увеличением заряда ядра радиус атома изменяется незначительно, т. к. заполняется предвнешний энергетический уровень. Поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
Таким образом, заряд ядра атома, радиус атома сказываются на восстановительных свойствах всех металлов.
С.О. металлов определяется валентными электронами внешнего и предвнешнего энергетического уровня:
У s- и р-элементов — количеством s электронов или суммой s- и р-электронов:
Na +1; Mg +2; Al +3.
У d-элементов С.О. определяется валентными электронами внешнею энергетического уровня — это минимальная С.О., а также суммой s-электронов внешнего энергетического уровня и d-электронов предвнешнего энергетического уровня — это максимальная C.О., она, соответственно, равна номеру группы.
d-элементы могут проявлять и промежуточные С.О., которые могут дать устойчивые соединения.
Пример: Мn.
Минимальная С.О. = +2
Максимальная С.О. = +7
Промежуточные С.О.: +4, +6
Для всех металлов простых веществ характерны общие физические свойства, которые обусловлены тем, что у всех металлов металлическая связь и тип решетки — металлический.
Вспомним, что из себя представляет металлическая связь, чем она обусловлена. Рассмотрим рисунки металлической связи по таблице и в учебнике на с. 196, а также прочтем определение данной связи.
Металлическая связь — это связь в металлах и сплавах между атомами-ионами металлов, расположенными в узлах кристаллической решетки, которая осуществляется обобществленными электронами.
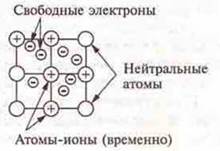
Особенности металлической связи обусловлены следующим. Небольшое количество электронов одновременно снизывают множество атомных ядер, связь эта нелокализована, электроны свободно перемещаются по всему кристаллу металла, они называются свободными; насыщаемостью и направленностью металлическая связь не обладает.
При изменении температуры наблюдается изменение амплитуды колебания ионов-атомов в кристалле, мешающее направленному движению электронов, и электропроводность изменяется.
При понижении t° электропроводность возрастает, при абсолютном нуле у большинства металлов появляется сверхпроводимость. Лучшие металлы по электропроводимости — Au, Ag, Сu,Al; менее электропроводны — Hg, Pb, Мn.
Теплопроводность изменяется с той же закономерностью. Свободные электроны сталкиваются с колеблющимися ионами-атомами, обмениваются с ними энергией, вследствие чего наблюдается выравнивание температуры по куску металла. У всех металлов такие показатели, как механическая прочность, температура плавления и кипения, плотность сильно отличаются.
Пример:
![]()
Причина такого различия заключается в том, что металлы образуют разные формы кристаллической решетки.
Для металлов характерна металлическая кристаллическая решетка нескольких форм:
а) кубическая гранецентрированная (Сu, Ni, Fe);
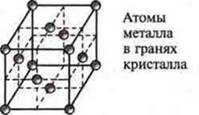
б) кубическая объемно-центрированная (V, Nb, W, Cr, Na и др.);
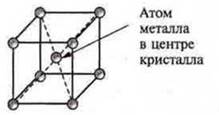
в) гексагональная (Mg, Ti, Sr, Zn). С. 34 (II ч.)
В соответствии с таким строением все металлы обладают общими физическими свойствами:
1. Пластичность — смещение слоев ионов металлов под внешним воздействием на кристалл относительно друг друга; т.к. свободные электроны перемещаются по всему кристаллу, то разрыва связей не происходит; ионные кристаллические решетки разрушаются). В учебнике с. 198, рис. 40.
2. Металлический блеск (наличие свободных электронов). В качестве сравнения отметим металлический блеск у твердого йодо-кремния. Это говорит о появлении определенной металличности некоторых неметаллов.
Свободные электроны отражают световые лучи, а не пропускают, как стекло (в зависимости от степени рассеивания все лучи пилимой части спектра). Металлы поэтому имеют серебристо-белый или серый цвет. Исключение составляют Sr, Au, Сu — они поглощают короткие лучи и отражают длинные волны светового спектра и имеют поэтому цвета: Sr — светло-желтый, Au — желтый, Сu — «медный цвет», красный. Если металл в виде порошка, го он не всегда имеет металлический блеск — черный или серый; если металл в виде тонкой фольги, то он может быть, например, (серебристо-голубого цвета, золотисто-зеленого цвета.
3. Электра- и теплопроводимость металлов обусловлена тем, что и кристалле хаотически двигающиеся электроны под действием напряжения приобретают направленное движение. Электрический ток — это и есть направленное движение заряженных частиц.
Некоторые металлы, в зависимости от условий, могут кристаллизоваться в двух и более кристаллических формах. Такое явление называется полиморфизмом (аллотропия).
Пример:
Олово — белое олово — β — устойчиво при t° выше 13,2°. Серое олово — α; устойчиво при t° ниже 13,2°.
Железо имеет четыре кристаллические модификации: α, β, γ, δ. При каких условиях указано в учебнике с. 196—197.
Металлы отличаются и по их отношению к магнитному полю:
металлы ферромагнитные — намагничиваются (Ni, Fe(α));
металлы парамагнитные — слабо намагничиваются (Аl, Сr);
металлы диамагнитные — не притягиваются к магниту; отталкиваются (Sn, Сu).
Для d-элементов характерно образование ковалентных связей (W, Мо, Сr, Os), поэтому они тугоплавкие, твердые и тяжелые.
Многие значения плотности, температур кипения, плавления запомнить сложно. Желательно знать следующую классификацию металлов по физическим свойствам.
|
Электропроводность |
Высокая |
(Ag, 6 · 107 ом-1 · м-1) |
|
Низкая |
(Мn, 5 · 105 ом-1 · м-1) |
|
|
Температура плавления |
Легкоплавкие |
t°пл < 1000° С |
|
Тугоплавкие |
t°пл > 100° С |
|
|
Плотность |
Легкие |
ρ < 5 г/см3 |
|
Тяжелые |
ρ > 5 г/см3 |
|
|
Твердость |
Мягкие |
Режутся ножом |
|
Твердые |
Царапают стекло |
По степени близости физических, химических свойств выделяют группы металлов: щелочные, щелочноземельные.
III. Домашнее задание
§ 18 до с. 201; № 1, № 2.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.