
Теоретическое занятие
по теме «Основные понятия и законы химии»
Дисциплина ХИМИЯ
Раздел Общая и неорганическая химия
Для специальности 34.02.01 Сестринское дело
Составитель Романова Л.В., преподаватель химии
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка теоретического занятия по теме «Основные понятия и законы химии» раздела «Общая химия» составлена на основе Рабочей программы по дисциплине для студентов 1 курса.
При изучении данной темы повторяются и обобщаются
фундаментальные понятия и представления, на основе которых, в дальнейшем,
строятся теоретические концепции химии. Поэтому необходимо, чтобы студенты
успешно усвоили важнейшие понятия, и в первую очередь такие, как
"атом", "молекула", "химическое явление",
"химическая формула", "вещество", "признаки смесей и
чистых веществ" и др., также основные химические законы. Глубокое понимание
атомно-молекулярной сущности строения вещества облегчит восприятие в дальнейшем
теории строения вещества и других теоретических вопросов предмета химии.
Значение вводной темы определяются еще и тем, что здесь закладывается основы
химического языка. Изучение
первой темы курса химии имеет большое значение для формирования научного
мировоззрения. Многие основные химические понятия используются на уроках
биологии, физики, это дает возможность продолжать формирование и развитие
знаний, умений, навыков на основе межпредметных связей.
Тип занятия : изучение нового материала
Вид занятия: лекция с элементами беседы
Цели занятия:
Внутрипредметные связи: строение атома, периодическая система
Методы обучения: объяснительно-иллюстративный
Оснащение занятия:
· Методическая разработка занятия
· Раздаточный материал для закрепления и проверки знаний по теме
· Периодическая система
Планируемый результат (студент должен знать): Знать основные понятия и законы химии
Структура занятия
Ход занятия
- Отметка присутствующих, подготовленность аудитории, средств обучения
- Актуализация, мотивация:
1. Химический элемент. Способы существования химического элемента.
2. Атомно -молекулярное учение.
3. Состав вещества.
4. Основные законы химии
5. Важнейшие количественные понятия химии
6. Чистые вещества и смеси
Методы контроля: фронтальный опрос, работа у доски, решение тестовых заданий
Аудиторная самостоятельная работа отсутствует
Внеаудиторная самостоятельная работа (содержание домашнего задания):
- прочитать лекцию, выучить основные определения,
- придумать 3 задачи разного типа и решить
Литература:
1. Габриелян ОС, Маскаев ФН и др, Химия 10 класс, 2013.
2. Рудзитис Г.Е, Фельдман Ф.Г. Химия 10 класс, 2009.
ЛЕКЦИЯ
5. Важнейшие количественные понятия химии
6. Чистые вещества и смеси
1.Химический элемент. Способы существования х/э.
Химия – наука о составе, строении, свойствах и превращениях веществ
Рассмотрим некоторые первоначальные понятия химии.
Предметом химии является вещество. Вещество – это один из видов материи, из которого образованы различные тела. Они включают 118 х/э. Вещества могут состоять из атомов, молекул или ионов, радикалов, также могут быть образованы одним или несколькими х/э.
Атом – это наименьшая химически неделимая частица вещества ( С, Мg, N, H, O, Cl)
Молекула – наименьшая частица вещества, состоящая из одного или нескольких видов атомов, обладающая свойствами этого вещества (HCl, NH3, H2, O2, H2O) Индексы показывают количество каждого вида атома в составе молекулы.
Ионы – заряженные частицы. Отрицательно заряженные – анионы (Cl-, H+, Mg2+, C4-), положительно заряженные – катионы.
Радикалы – это атомы или атомные группировки, имеющие по одному или нескольки неспаренных электронов (т.е., свободную валентность). Радикалы образуются, если молекулу разделить на группы атомов так, чтобы каждый получил по одному электрону из общей электронной пары: Сl**Cl ---- Cl* + Cl*
Вывод: химический элемент – это вид атомов, он существует в виде атома, молекулы, иона, радикала.
2. Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил
в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно
свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое
состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных
веществ — из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей
основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает
его дальше, поскольку Дальтон впервые пытался установить атомные массы известных
тогда элементов. Однако Дальтон отрицал существование молекул у простых
веществ, что по сравнению с учением Ломоносова является шагом назад. По
Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества —
из «сложных атомов» (в современном понимании — молекул).
3. Состав вещества
Различают качественный и количественный состав вещества. Качественный состав – это совокупность х/э, составляющих данное вещество. Количественный состав – это численное выражение количества атомов отдельных х/э , образующих данное вещество. По составу выделяют простые вещества (состоят из одного вида атомов) и сложные вещества (содержат несколько видов атомов)
Состав вещества записывается химической формулой. Она несет много информации – число отдельных атомов, количество вещества каждого вида атомов в 1 моль вещества, также дает возможность рассчитать относительную молекулярную и молярную массы.
Например: Н2SO4 . Есть несколько видов химических формул.
Молекулярная формула – истинная формула, отражает качественный и количественный состав, но не показывает порядок связей атомов: С2Н6, H2O.
Простейшая (эмпирическая) формула показывает качественный состав и соотношение химических элементов. Например простейшие формулы у этена и пропена совпадают: СН2.
Структурная формула отражает порядок соединения атомов и пространственное расположение частиц.
Н Н
Н – О – Н С = С
СН3 СН3
Закон постоянства состава вещества (Ж.Л.Пруст, 1799):
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Уже в начале 19 века К.Л.Бертолле доказал, что элементы могут соединяться друг с другом в разных соотношениях в зависимости от массы реагирующих веществ. Получены много соединений переменного состава: оксиды, карбиды, гидриды и другие вещества с ионной химической связью. Например, FeO, Fe2O3, Fe3O4.
Молекулярные вещества представляют собой жидкости и газы, реже легкоплавкие твердые вещества с ковалентной полярной связью: вода, спирты, сахар, аммиак, оксид серы, сера, фосфор, азот и др. Немолекулярные - очень твердые, тугоплавкие, с ионной кристаллической решеткой: поваренная соль, гидроксид калия, оксид железа, сульфид цинка.
Значит, закон постоянства состава справедлив только для веществ с молекулярным строением, часто жидких и газообразных.
Современная формулировка: Состав соединений молекулярной структуры является постоянным независимо от способа получения, а состав немолекулярных соединений не является постоянным и зависит от способов получения.
Закон Авогадро
В равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул
Следствия:
Отношение молярных масс двух газов называется относительной плотностью одного газа по другому и обозначается буквой D
D =M1 / M2 Например, DH2(XY) = M{XY) / M(H2)
Закон сохранения массы(М.В.ломоносов, 1748):
Масса веществ, ступивших в реакцию, равна массе продуктов реакции.
5. Важнейшие количественные понятия химии
Массы атомов и молекул очень малы. Например, масса атома водорода протия равна 1, 674*10-27 кг. Это неудобные для применения массы. Поэтому в химии используют не абсолютные, а относительные значения масс, сравненные с 1/12 массы атома углерода, равной 1 а.е.м, т.е. 1, 66057 *10-27кг.
Относительная атомная масса химического элемента (Аr) – это число, показывающее отношение средней массы атома элемента к 1/12 массы атома углерода.
Ar = m(атома х/э) // 1/12 m (C)
Она определяется с помощью периодической системы. Аr(Cl) = 35,5 Аr(S)= 32
Относительная молекулярная масса (Мr) равна сумме относительных атомных масс всех элементов, образующих молекулу вещества. Мr (Н2S) = Аr(H)*2 + Аr(S) = 1*2+32 = 34
Т.к. вещество состоит из огромного числа частиц, то количество вещества удобно измерять в крупных единицах измерения , содержащих большое число частиц. В международной системе СИ за единицу количества вещества (n) принята моль. Моль – это количество вещества, содержащее столько же формульных единиц, сколько атомов содержит 12 г изотопа углерода, оно содержит авогадрово число частиц 6,02*1023 .
Моль – это количество вещества, масса которого численно равна относительной молекулярной массе. Массу одного моля называют молярной массой и обозначают М, единицами измерения являются г/моль, кг/кмоль.
Мr(SO2) = 32 + 16*2 = 64 М(SO2) = 64г/моль
При расчетах количество вещества является основным связующим звеном между физическими величинами. Оно определяется по формулам:
n = m/M n = V/VM n = N/NA, где
m – масса вещества, M – молярная масса того же вещества,
V – объем газообразного вещества, VM – молрный объем, равный 22,4 л/моль
N – число атомов или молекул вещества, NA – число Авогадро 6,02*1023
Найти объем и массу 0.5 моль аммиака при н.у.
Решение.
1. Зная формулы нахождения количества вещества через массу и объем и преобразуя их можно легко найти массу и количество.
n = m/M n = V/VM
M(NH3) = 14 + 3 = 17 г/моль VM = 22.4 л/моль
m = n*M = 0.5 *17 = 8.5 г
V = n * VM = 0.5 моль * 22.4 л/моль = 11.2 л
Ответ: 8.5 г, 11.2 л.
В химии часто встречается понятие «доля».
В сложном веществе легко определить массовую долю отдельных элементов по формуле
w (элемента) = масса всех атомов данного элемента /молекулярная масса всего вещества * 100%
Доля – это безразмерная величина, она всегда меньше единицы, чаще долю выражают в %, для этого массовую долю умножают на 100%. Например: 0.25 или 25%
Вычислите массовые доли элементов в молекуле серной кислоты.
Решение.
1. Находим относительную молекулярную массу серной кислоты:
![]()
2. Вычислим массовую долю водорода:
![]()
3. Вычислим массовую долю серы:
![]()
4. Вычислим массовую долю кислорода:
![]()
Примечание. Содержание кислорода можно также вычислить по разности:
![]()
Ответ. Элементный состав ![]() следующий:
следующий:
массовая доля Н - 2,04%, массовая доля S - 32,65 % и массовая доля О - 65,31 %.
Массовая доля хлора в некотором оксиде 81,6%. Какова формула оксида?
Решение.
100 – 81,6 = 18,4%
2. Находим мольное отношение элементов хлора и кислорода. Для этого воспользуемся формулой нахождения количества вещества через массу:
n(Cl): n(О) = 81.6/35.5 : 18.4/16 = (2.298 : 1.15):1.15 = 2 : 1
Ответ: формула оксида хлора Cl2O.
6. Чистые вещества и смеси
В природе чаще встречаются смеси веществ: колодезная вода, воздух, металлические руды и др. Смесь цемента, песка и воды есть бетон.
Различия между смесями веществ и сложными веществами:
1. Смесь образуется с помощью физического процесса (смешивание чистых веществ).
2. Свойства чистых веществ, из которых составлена смесь,
остаются неизменными
3. Чистые вещества (простые и сложные) могут находиться в смеси в любом
массовом соотношении
4. Смесь может быть разделена на составные части (чистые вещества) с помощью
физических методов
Сложное вещество (химическое соединение):
- образуется с помощью химической реакции (синтез из простых веществ);
- свойства простых веществ, из которых получено сложное вещество, в последнем
не сохраняются;
- элементы, входящие в состав сложного вещества, всегда находятся в
определенном массовом отношении;
- может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции.
Массовая доля компонента в смеси (w) равна отношению массы компонента к общей массе смеси (часто умножается на 100%)
ω [«омега»] = mккомпонента / m смеси
Объёмная доля компонента в смеси (только для газов) — отношение объёма вещества к общему объёму всей газовой смеси.
φ [«фи»] = Vкомпонента / Vсмеси
Вычислить массовые доли компонентов в смеси 30 г сахарозы и 50 г фруктозы в %
Решение
Ответ 37.5%
Тест по теме «Первоначальные химические понятия»
1. Химия изучает…
1) химические свойства; 2) химические реакции;
3) вещества, их строение, свойства и превращения; 4) строение атома.
2. Какое из следующих явлений химическое?
1) плавление льда; 2) испарение воды; 3) фотосинтез; 4) возгонка йода.
3. В каком случае речь идет о кислороде как простом веществе?
1) кислород входит в состав воздуха; 2) кислород входит в состав воды;
3) кислород входит в состав углекислого газа; 4) кислород входит в состав глюкозы.
4. Химический элемент характеризуется …
1) числом нейтронов; 2) числом нуклонов; 3) зарядом ядра; 4) массой атома.
5. Какое из приведенных веществ является простым:
1) РН3; 2) Р4; 3) Р2 О3; 4) Р2 О5.
6. Укажите основные законы химии:
1) периодический закон, закон кратных отношений;
2) закон Авогадро; закон постоянства состава;
3) закон Гесса, закон Дальтона;
4) периодический закон, закон сохранения массы и энергии.
7. Простейшая (эмпирическая формула) указывает …
1) число атомов в молекуле; 2) соотношение между числом атомов в веществе;
3) порядок соединения атомов в молекуле; 4) молекулярную массу вещества.
8. Индивидуальным веществом является:
1) чугун; 2) хлорид лития; 3) соляная кислота; 4) воздух.
9. Элемент, который образует простое вещество, состоящее из трехатомных молекул, – это:
1) азот; 2) бром; 3) кислород; 4) водород.
10. Закон о равенстве числа молекул в равных объемах различных газов при одинаковых условиях открыл
1) Гесс; 2) Авогадро; 3) Гей-Люссак; 4) Дальтон.
11. Что означает число 1,00797 в первой клетке Периодической таблицы?
1) Массу атома водорода (в атомных единицах массы):
2) Среднюю массу протона и электрона (в атомных единицах массы) с учетом их распространенности в земной коре;
3) Массу протона (в атомных единицах массы);
4) Среднюю массу изотопов водорода (в атомных единицах массы) с учетом их распространенности в земной коре.
12. Относительная молекулярная масса …
1) имеет размерность «г»; 2) имеет размерность «г/моль»; 3) имеет размерность «а.е.м.»; 4) безразмерная.
13. Моль – это …
1) число частиц, содержащихся в 1 г любого вещества; 2) 1/12 часть массы атома изотопа углерода 12С; 3) единица, которой в химии измеряют количество вещества; 4) число молекул, содержащихся в 22,4л газа (н.у.).
14. Укажите аллотропное видоизменение кислорода:
1) кварц; 2) серный цвет; 3) озон; 4) корунд;
15. Все индивидуальные неорганические вещества по составу подразделяются на …
1) простые и сложные; 2) солеобразующие и несолеобразующие;
3) ионные и ковалентные; 4) твердые и жидкие.
16. Число простых веществ в ряду озон, азот, этанол, бромоводород, сера, карбид кальция, графит равно: 1) 1; 2) 2; 3) 3; 4) 4;
17. Свойства веществ определяются:
1) только качественным составом; 2) составом и строением молекул;
3) только количественным составом; 4) только строением.
18. Массовая доля азота является наибольшей в нитриде:
1) индия; 2) галлия; 3) бора; 4) алюминия.
19. В равных массах каких двух веществ число атомов кислорода одинаково?
1) MgO и NaOH; 2) CO2 и SO2; 3) Fe(OH)3 и Al2 O2; 4) CaO и К2О.
20. Одинаковые массы каких двух газов при одинаковых условиях занимают равные объемы?
1) CO2 и CO; 2) H2 и He; 3) N2 и CO; 4) H2 S и H2 Se.
21. Число атомов водорода одинаково в равных массах:
1) H2 O и H2 S ; 2) H3 PO4 и H3 PO3; 3) H2 SO4 и Cu(OH)2; 4) NH4 NO3 и Ca(H2 PO4 )2.
22. Сколько молей составляют 5,6 л азота (при н.у.) ?
1) 0,025; 2) 0,04; 3) 0,25; 4) 0,5.
23. Какой объём в литрах занимают 27,09 ∙ 1023 молекул оксида углерода (II) (при н.у.) ?
1) 100,8; 2) 12,4; 3) 1,008; 4) 0,56;
Ответы:
1 - 1 6 - 2,4 11 – 4 16 – 4 21 – 3
2 – 3 7 – 2 12 – 4 17 – 2 22 – 3
3 – 1 8 – 2,3 13 – 3 18 – 3 23 – 1
4 – 3 9 – 3 14 – 3 19 – 1
5 – 2 10 -2 15 – 1 20 - 3
Дополнительные задачи
1. Вычислите массовое отношение химических элементов в гидроксиде кальция.
Решение
1. Находим относительную молекулярную массу гидроксида кальция:
![]()
2. Находим отношение масс атомов кальция, кислорода, водорода:
Са : О : Н = 40 : 32 : 2 = 20 : 16 : 1.
Ответ. Отношение масс кальция, кислорода и водорода равно 20 : 16 : 1.
2. Вычислите массовое отношение химических элементов в карбонате кальция.
Решение.
1. Находим относительную молекулярную массу карбоната кальция:
![]()
Са : С : О = 40 : 12 : 48 = 10 : 3 : 12.
Ответ. Отношение масс кальция, углерода и кислорода равно 10 : 3 : 12.
3. Вычислите массовые доли элементов в молекуле оксида железа (III).
Решение.
1. Находим относительную молекулярную массу оксида железа (III):
![]()
2. Вычислим массовую долю железа:
![]()
3) Вычислим массовую долю кислорода
![]()
Ответ. Элементный
состав ![]() следующий:
следующий:
массовая доля Fe - 70%, массовая доля О - 30%.
4. Вычислите, сколько по массе фосфора содержится в 28,4
г оксида фосфора (г). Дано: ![]()
Найти: m(Р).
Решение.
1. Находим относительную молекулярную массу оксида фосфора:
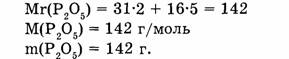
2. Вычисляем массу фосфора, содержащуюся в 28,4 г оксида фосфора:
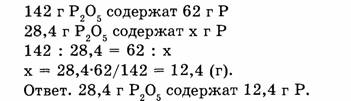
5. В какой массе оксида кальция содержится 1,6 г кальция?
Дано: m(Са) = 1,6 г.
Найти: m(СаО).
Решение.
1. Находим относительную молекулярную массу оксида кальция:
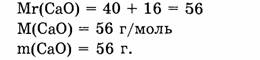
2. Вычисляем, в какой массе оксида кальция содержится 1,6 г кальция:
56 г СаО содержится 40 г Са
Х г СаО содержится 1,6 г Са
56 : X = 40 : 1,6
X = 56-1,6/40 = 2,24 г.
Ответ. 1,6 г содержатся в 2,24 г СаО,
6. Какое количество
вещества составляют ![]() молекул азота?
молекул азота?
Дано:

7. Сколько молекул содержится в воде массой 72 г?
Дано:
![]()
Найти: ![]()
Решение.
1. Определяем молярную массу воды:
![]()
2. Находим количество вещества воды:
![]()
3. Определяем число молекул воды:
![]()
8. Какое количество вещества заключено в углекислом газе массой 110 г?
Дано:
![]()
Найти:
![]()
Решение.
1. Определяем молярную массу углекислого газа:
![]()
2. Находим количество вещества, заключенного в углекислом газе:
![]()
9. Найти массу оксида меди количеством вещества 0,4 моль.
Дано:
![]()
Найти:
![]()
Решение.
1. Определяем молярную массу оксида меди:
![]()
2. Находим массу оксида меди:
![]()
Ответ. Оксид меди количеством вещества 0,4 моль имеет массу 32 г.
10. Какое количество вещества составляет 23,4 сульфида натрия?
Дано:
![]()
Найти: ![]()
Решение.
1. Находим молярную массу сульфида натрия:
![]()
2. Находим количество вещества сульфида натрия:
![]()
Можно рассуждать и так:
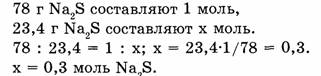
Ответ. 23,4 г сульфида натрия составляют 0,3 моль.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.