
Комплексные соединения
Комплексные соединения – большой класс неорганических веществ. В составе комплексных соединений выделяют центральный атом –комплексообразователь, роль которого выполняет ион или нейтральный атом металла побочной подгруппы. С комплексообразователем связаны донорно-акцепторной связью различные ионы или нейтральные молекулы, которые называются лигандами (или аддендами). Комплексообразователь и лиганды образуют внутреннюю среду комплексного соединения, устойчивую как в кристаллическом веществе, так и в растворе.
Строение комплексных соединений
Представления о координационном строении комплексных соединений дает теория Вернера А. (1891г. швейцарский химик). По этой теории в комплексных соединениях имеется правильное геометрическое расположение лигандов вокруг центрального атома или иона. Лиганды могут образовать квадрат, тетраэдр, куб, пирамиду и т.д. Комплексные соединения состоят из внутренней и внешней среды. Во внутреннюю среду входят комплексообразователь и лиганды, образуя комплексную частицу. Заряд ее определяется как алгебраическая сумма зарядов составных частей. Комплексная частица в формуле заключена в квадратные скобки:
Например, [Pt(NH3)4]2+ [Fe(CO)5]0
Здесь Pt2+ и Fe0 – комплексообразователи, а NH3 и CO – лиганды. Число лигандов, связанное с комплексообразователем, называется координационным числом (к.ч.). Чаще всего к.ч. равно 4 или 6, но может быть меньше 6 (2), и больше (max=12).
Внутренняя среда комплекса Pt имеет заряд +2, а комплекс железа – нейтрален. Заряд внутренней сферы комплекса нейтрализуется противоположно заряженной внешней сферой [Pt(NH3)4]SO4 ; K3[Fe(CN)6]
В первом случае во внешней сфере катионы SO42-, а во втором – катионы калия К+, связаны с комплексом ионной связью. Если комплексная частица нейтральна, внешняя среда отсутствует.
Классификация комплексных соединений
1. Комплексные электролиты и неэлектролиты.
Комплексные соединения, имеющие внутренние и внешние сферы, являются электролитами и диссоциируют на ионы:
K3[Fe(CN)6]D [Fe(CN)6]3-
Нейтральные комплексы – неэлектролиты.
2. Классификация комплексов по заряду комплексного иона.
|
катионные |
анионные |
Нейтральные |
|
[Ag+1(NH3)2]Cl |
K3[Al3+(OH)6] |
[Pt2+(NH3)2Cl2] |
|
|
|
|
3. Классификация комплексов по природе лигандов.
а) аммиачные комплексы
[Cu(NH3)4]SO4
б) аквакомплексы
[Cu(H2O)4]SO4
В) смешанные комплексы
K2[PtCl2Br2]
Г) комплексные кислоты, основания, соли.
H4[Fe(CN)6] – кислота
[Pt(NH3)4](OH)2 – основания
K4[Fe(CN)6] – соль
Номенклатура комплексных соединений
Для составления названия комплексного соединения существуют следующие правила:
1. В названии комплексной частицы сначала лиганды, потом комплексообразователь.
2. Количество лигандов обозначается греческими числительными: моно(1), ди (2), три (3), тетра (4), пета (5), гекса (6), Гента (7), окта (8). Моно – обычно опускается.
3. Названия лигандов – нейтральных молекул – берут без изменения, за исключением NH3 – амин; Н2О – аква; СО – карбонил. К названиям анионов добавляют букву «О» (хлоро, нитрато и т. д.).
4. Комплексообразователь называют латинским названием элементов.
5. К названиям комплексообразователя в анионных комплексах добавляют окончание – ат: [Fe(CN)6]4 – гексацианоферрат.
6. Степень окисления комплексообразователя обозначают римской цифрой в скобках после названия.
7. Если имеется несколько лигандов, то сначала называют заряженные лиганды, потом нейтральные.
[CO(NH3)3(NO2)3] – тринитротриамминкобальт (III)
K4[Fe(CN)6] – гексацианоферрат (II) калия
[Zn(H2O)4](NO3)2 – нитрат тетрааквацинка (III)
Природа химической связи в комплексных соединениях
Образование комплексных соединений происходит по донорно-акцепторному механизму, где ион комплексообразователя акцептор, а лиганды – доноры.
E
Например: СО3+
СО27 – 1s22s22p63s23p64s23d7
3d7 4s2 4p
3d6 4s0 4p
CO3+
При возбуждении электроны способны к спариванию.
3d 4s 4p
СО3+
Остается 6 свободных орбиталей, которые способны образовывать связи с молекулами или ионами, имеющими свободные электронные пары.
3d 4s 4p
×× ×× ×× ×× ×× ××
NH3 NH3 NH3 NH3 NH3 NH3
Происходит гибридизация d2sp3, образуя 6 гибридных орбиталей, образующих октаэдр.
Диссоциация комплексных соединений
I. Первичная диссоциация – на внешнюю и внутреннюю сферы.
K3[Fe(CN)6] D 3K+ + [Fe(CN)6]3-
[Cu(NH3)4]SO4 D [Cu(NH3)4]2+ + SO42 –
II. Вторичная (частичная) диссоциация комплексных ионов. Характеризуется константой нестойкости комплексных соединений.
[Fe(CN)6]3+ D Fe3+ + 6KN-
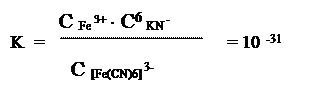
Чем меньше К нестойкости, тем устойчивее комплексный ион.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.