|
20 мин.
|
III. Актуализация
знаний.
По методу «Подумать-
сговориться- обсудить» проводит изучение новой темы.
кспериментальная
задача I. Уровень I
Получение
этилена.
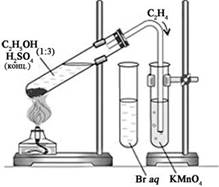
- Для опыта собираем прибор для
получения газов, в соответствии с рисунком.
- Этилен получаем нагреванием смеси этилового
спирта C2H5OH и серной кислоты H2SO4.
- Для этого в пробирку наливаем 1 мл
спирта и 3 мл концентрированной серной кислоты.
- ТБ: Добавлять следует именно
кислоту к спирту, а не наоборот, при этом кислоту нужно приливать
постепенно, перемешивая смесь в пробирке.
- Добавляем в пробирку 1-2 шпателя
чистого песка или кусочек
 пористой
керамики для равномерного кипения смеси. пористой
керамики для равномерного кипения смеси.
- Закрываем пробирку пробкой с
газоотводной трубкой.
- Закрепляем пробирку наклонно в
лапке держателя на штативе, как это показано на рис., и осторожно
нагреваем.
- Сразу же приступаем к исследованию
свойств выделяющегося газа! (экспериментальная задача II, III).
|
Тема: Получение этилена и
изучение его свойств
|
|
Исполнитель
|
Экспериментальная задача I
|
Комментатор
|
|
- Для опыта собираем прибор для получения газов, в
соответствии с рисунком.
|
|
|
- Этилен получаем нагреванием смеси этилового спирта C2H5OH
и серной кислоты H2SO4.
|
|
|
- Для этого в пробирку наливаем 1 мл спирта и 3 мл
концентрированной серной кислоты.
|
|
|
- ТБ: Добавлять следует именно кислоту к спирту, а не
наоборот, при этом кислоту нужно приливать постепенно, перемешивая
смесь в пробирке.
|
|
|
- Добавляем в пробирку 1-2 шпателя чистого песка или
кусочек пористой керамики для равномерного кипения смеси.
|
|
|
- Закрываем пробирку пробкой с газоотводной трубкой.
|
|
|
- Закрепляем пробирку наклонно в лапке держателя на
штативе, как это показано на рис., и осторожно нагреваем.
|
|
|
- Сразу же приступаем к исследованию свойств выделяющегося
газа! (экспериментальная задача II, III).
|
|
|
|
|
Экспериментальная
задача I. Уровень II
Получение
этилена.
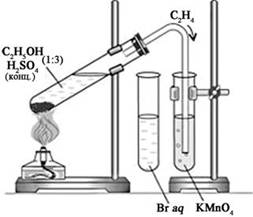
- Для опыта собираем прибор для
получения газов, в соответствии с рисунком.
- Этилен получаем нагреванием смеси
этилового спирта и серной кислоты.
- Для этого в пробирку наливаем 1 мл
спирта и 3 мл концентрированной серной кислоты.
- Добавляем в пробирку 1-2 шпателя
чистого песка или кусочек пористой керамики для равномерного кипения
смеси.
- Закрываем пробирку пробкой с
газоотводной трубкой.
- Закрепляем пробирку наклонно в
лапке держателя на штативе, как это показано на рис., и осторожно
нагреваем.
- Сразу же приступаем к исследованию
свойств выделяющегося газа! (экспериментальная задача II, III).
Экспериментальная
задача I. Уровень III
Получение
этилена
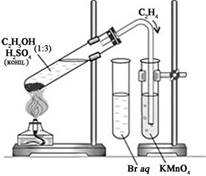
- Для опыта собираем прибор для
получения газов, в соответствии с рисунком.
- Этилен получаем нагреванием смеси
_________ и _________________.
- Для этого в пробирку наливаем 1 мл
________ и 3 мл концентрированной ______________ .
- Добавляем в пробирку 1-2 шпателя
 чистого
песка или кусочек пористой керамики для _____________________. чистого
песка или кусочек пористой керамики для _____________________.
- Закрываем пробирку пробкой с
газоотводной трубкой.
- Закрепляем пробирку наклонно в
лапке держателя на штативе, как это показано на рис., и осторожно
нагреваем.
 Сразу же
приступаем к исследованию свойств выделяющегося газа! (экспериментальная
задача II, III). Сразу же
приступаем к исследованию свойств выделяющегося газа! (экспериментальная
задача II, III).
Экспериментальная
задача I. Уровень IV
Получите
этилен из этилового спирта и серной кислоты, пользуясь рисунком.
Экспериментальная
задача II. Уровень I
Свойства
этилена.
- В две чистые пробирки наливаем по
2–3 мл раствора перманганата калия KMnO4 и бромной воды (получаем их у
преподавателя или лаборанта).
- Опускаем газоотводную трубку
сначала до дна пробирки с бромной водой.
- Пропускаем через неё выделяющийся
газ.
- Наблюдаем по мере пропускания газа
обесцвечивание бромной воды.
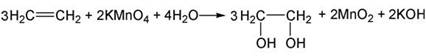
- Вывод: этилен взаимодействует с
бромной водой.
- Аналогичным образом пропускаем газ
через раствор перманганата калия KMnO4.
- Наблюдаем по мере пропускания газа
обесцвечивание раствора перманганата калия KMnO4.
- Вывод: этилен взаимодействует с
раствором перманганата калия KMnO4.
- Растворы оставляем для сравнения.
Экспериментальная
задача II. Уровень II
Свойства
этилена.
- В две чистые пробирки наливаем по
2–3 мл раствора перманганата калия и бромной воды (получаем их у
преподавателя или лаборанта).
- Опускаем газоотводную трубку
сначала до дна пробирки с бромной водой.
- Пропускаем через неё выделяющийся
газ.
- Наблюдаем по мере пропускания газа
____________ бромной воды.
- Вывод: этилен взаимодействует с
бромной водой.
- Аналогичным образом пропускаем газ
через раствор перманганата калия.
- Наблюдаем по мере пропускания газа
______________ раствора перманганата калия KMnO4.
- Вывод: этилен взаимодействует с
раствором перманганата калия.
- Растворы оставляем для сравнения.
Экспериментальная
задача II. Уровень III
Свойства
этилена.
- В две чистые пробирки наливаем по
2–3 мл раствора перманганата калия и бромной воды (получаем их у
преподавателя или лаборанта).
- Опускаем газоотводную трубку
сначала до дна пробирки с бромной водой.
- Пропускаем через неё выделяющийся
газ.
- Наблюдаем по мере пропускания газа
____________ бромной воды.
- Вывод: этилен взаимодействует с
______________.
- Аналогичным образом пропускаем газ
через раствор перманганата калия.
- Наблюдаем по мере пропускания газа ______________
раствора перманганата калия.
- Вывод: этилен взаимодействует с
раствором __________________.
- Растворы оставляем для сравнения.
Экспериментальная
задача II. Уровень IV
Осуществите
взаимодействие этилена с бромной водой и раствором перманганата калия.
Экспериментальная
задача III. Уровень I
Изучение
свойств пламени этилена.
- Направляем конец газоотводной
трубки с выделяющимся этиленом вертикально вверх.
- Спичками поджигаем выходящий газ.
- Наблюдаем, что цвет и яркость
свечения этиленового пламени от пламени обычного бытового газа
(природного, состоящего на 80% из CH4), который представляет
собой смесь пропана и бутана, отличается.
- Делаем вывод: цвет пламени более
светлый в сравнении с бытовым газом, что свидетельствует о повышении
массовой доли углерода в непредельных углеводородах в сравнении с
предельными.
- Поднесем к верхней части пламени
фарфоровую чашку, закрепленную в тигельных щипцах.
- Наблюдаем образование чёрного пятна
сажи, появление которой можно объяснить большим содержанием (%) углерода
в молекуле этилена и его неполным окислением:
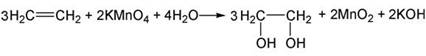
Н2С=СН2 + О2 —> СО2 +
С + Н2О + CO
- Приводим рабочее место в порядок.
|
Тема: Получение этилена и
изучение его свойств
|
|
Исполнитель
|
Экспериментальная задача
III
|
Комментатор
|
|
- Направляем конец газоотводной трубки с выделяющимся
этиленом вертикально вверх.
|
|
|
- Спичками поджигаем выходящий газ.
|
|
|
- Наблюдаем, что цвет и яркость свечения этиленового
пламени от пламени обычного бытового газа, который представляет собой
смесь пропана и бутана, отличается.
|
|
|
- Делаем вывод: цвет пламени более светлый в сравнении с
бытовым газом (природного, состоящего на 80% из CH4), что
свидетельствует о повышении массовой доли углерода в непредельных
углеводородах в сравнении с предельными.
|
|
|
- Поднесем к верхней части пламени фарфоровую чашку,
закрепленную в тигельных щипцах.
|
|
|
- Наблюдаем образование чёрного пятна сажи, появление
которой можно объяснить большим содержанием (%) углерода в молекуле
этилена и его неполным окислением:
Н2С=СН2 + О2 —>
СО2 + С + Н2О + СО
|
|
|
- Приводим рабочее место в порядок.
|
|
|
|
|
Экспериментальная
задача III. Уровень II
Изучение
свойств пламени этилена.
- Направляем конец газоотводной
трубки с выделяющимся этиленом вертикально вверх.
- Спичками поджигаем выходящий газ.
- Наблюдаем, что цвет и яркость
свечения этиленового пламени от пламени обычного бытового газа
(природного, состоящего на 80% из CH4), который представляет
собой смесь пропана и бутана, отличается.
- Делаем вывод: цвет пламени
_____________ в сравнении с бытовым газом, что свидетельствует о
повышении массовой доли углерода в непредельных углеводородах в
сравнении с предельными.
- Поднесем к верхней части пламени
фарфоровую чашку, закрепленную в тигельных щипцах.
- Наблюдаем образование _________
пятна сажи, появление которой можно объяснить бoльшим содержанием (%)
углерода в молекуле этилена и его неполным окислением:
Н2С=СН2 + О2 —> СО2 +
С + Н2О + СО
Задание для группы
1 группа
1.
Какова роль серной кислоты в реакции
получения этилена?
2.
Как опытным путем можно очистить
пропан от примеси бутена-1?
3.
Дайте оценку каждому участнику вашей
группы (насколько успешно справились со своими ролями, положительные моменты,
недочеты).
4.
Перечислите положения правил техники
безопасности при выполнении опыта №1.
5.
Составьте уравнение химической
реакции получения этилена.
6.
Оформите ход, наблюдения и выводы
проводимых опытов в своей тетради.
2 группа
1.
Как опытным путем отличить этилен от
этана?
2.
Как опытным путем можно очистить
бутан от примеси бутена-1?
3.
Дайте оценку каждому участнику вашей
группы (насколько успешно справились со своими ролями, положительные моменты,
недочеты).
4.
Перечислите положения правил техники
безопасности при выполнении опыта №2.
5.
Составьте уравнение химической
реакции взаимодействия этилена с перманганатом калия.
6.
Оформите ход, наблюдения и выводы
проводимых опытов в своей тетради.
3 группа
1.
Зависят ли свойства алкенов от
симметричного строения молекул? Приведите примеры.
2.
Как опытным путем можно очистить
бутан от примеси пентена-1?
3.
Дайте оценку каждому участнику вашей
группы (насколько успешно справились со своими ролями, положительные моменты,
недочеты).
4.
Перечислите положения правил техники
безопасности при выполнении опыта №3.
5.
Составьте уравнение химической
реакции взаимодействия этилена с йодной водой.
6. Оформите ход, наблюдения и выводы проводимых опытов в
своей тетради
|
