
Лекция № 23
Фенолокислоты
СООН ï
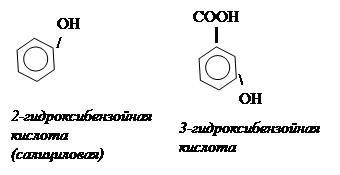
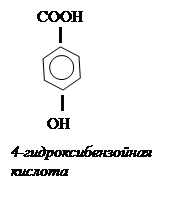
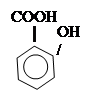
Фенолокислоты – ароматические гидроксикислоты, у которых ОН- группы
непосредственно связаны с бензольным кольцом. За основу принята бензойная
кислота.
Получение – прямым карбоксилированием фенолов.
|
ОН / СООН ï ОNa ï
![]()
![]()
![]()
![]() СО2 HCl
СО2 HCl
СООNa ï
![]()
![]() ® ®
® ®
салициловая кислота финолят Nа (сухой)
1250, р=5атм -NaCl
|
Химические свойства
Фенолокислоты вступают в реакции, характерные для карбоксильной группы, гидроксогруппы и углеводородного радикала.
1. Кислотные свойства
Салициловая кислота имеет два центра кислотности: -СООН и -ОН.
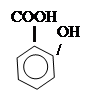
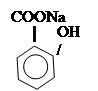
а)
салицилат Nа
+ NaHCO3 ® + CO2 + H2O
Происходит вытеснение соли слабой угольной кислоты.
|
СООNa ï ОН / СООН ï
![]()
![]()
![]()
![]() б)
б)
+ 2NaOH ® + 2H2O
|
2. Реакции карбоксильной группы – образование сложных эфиров.
 |
ОН / СООСН3 ï
![]()
![]() H2SO4
H2SO4
метилсалицат
+ СН3ОН
® + Н2О
СОО-С6Н5 ï фенилсалицат (салол) ОН /
![]()
![]() Метилсалицат применяется как противоревматическое
средство. Фенилсалицат – противовоспалительное средство, применяется при
кишечных заболеваниях.
Метилсалицат применяется как противоревматическое
средство. Фенилсалицат – противовоспалительное средство, применяется при
кишечных заболеваниях.
3. Реакции фенольной гидроксильной группы
|
|||||
 |
|||||
|
|||||
ацетилсалициловая кислота (аспирин) уксусный ангидрид салициловая кислота СООН ï
![]()
![]() + ® + СН3СООН
+ ® + СН3СООН
Качество аспирина проверяют при помощи FeCl3. Если он нормальный – фиолетового окрашивания нет, а если он разложился на салициловую кислоту - появляется фиолетовый цвет.
4. Декарбоксилирование
 |
|
|||
t0
фенол
![]()
![]() ® + СО2
® + СО2
Оксокислоты
Оксокарбоновые кислоты, т.е. альдегидо- и кетонокислоты, принадлежат к классу гетерофункциональных соединений. В зависимости от расположения функциональных групп различают a-, b-, g- оксокарбоновые кислоты.
2-оксопропановая (пировиноградная) кислота a-кетопропановая
кислота
b a
СН3- С - СООН
ïï
О
Пировиноградная кислота играет важную роль в процессах обмена веществ, являясь промежуточным продуктом распада углеводов.
ацетоуксусная кислота (3-оксобутановая кислота)
СН3- С -СН2-СООН
ïï
О
Ацетоуксусная кислота – один из продуктов биологического распада жиров. У больных сахарным диабетом в результате нарушения обмена веществ повышенное содержание в моче ацетоуксусной кислоты и продукта ее распада – ацетона.
СН3- С -СН2-СООН ® СН3- С -СН3-СО2
ïï ïï
ацетон
О О
Этиловый эфир ацетоуксусной кислоты (ацетоуксусный эфир) устойчив, существует в таутомерных формах.
Таутомерия – это подвижное равновесие между структурными изомерами.
-С= ï ОН
Таутомеры существуют в оном и том же
образе вещества и постоянно переходят друг в друга. Ацетоуксусному эфиру
присуща кето-енольная таутомерия (енольная группа
СН3- С -СН2-СООС2Н5 D СН3- С =СН-СООС2Н5
ïï ï
енольная форма кетонная форма
О ОН
Свойства кетонной формы – легко разлагается с образованием ацетона. Свойства енольной формы – взаимодействие с натрием, обесцвечивание бромной воды и красно- фиолетовое окрашивание хлорида железа – качественная реакция на енольную группу.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.