
ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ДЕНСАУЛЫҚ САҚТАУ МИНИСТРЛІГІ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ КАЗАХСТАН
ҚОСТАНАЙ ЖОҒАРЫ МЕДИЦИНАЛЫҚ КОЛЛЕДЖІ
КОСТАНАЙСКИЙ ВЫСШИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ

Бекітемін
ОЖ жөніндегі директордың
орынбасары___________
20__ж. «____» _______
ДӘРІС КЕШЕНІ
ЛЕКЦИОННЫЙ КОМПЛЕКС
Пәнінен/Дисциплины/модуля: код "Химия"
Мамандығы/Специальность: 0305000 «Лабораторная диагностика»
Біліктілігі/Квалификация: 0305013 "Медицинский лаборант"
Курс/Курс: 1
Семестр/Семестр:
Жалпы сағат саны/Общая трудоемкость всего часов/кредитов KZ
Қостанай, 2021ж.
Лекционный комплекс дисциплины/модуля составлен преподавателем Чапаксин И.В. бакалавр химии (ФИО, ученая степень, ученое звание)
На основании рабочей учебной программы по специальности
0302043 «Медицинская сестра общей практики»
Рассмотрен и рекомендован на заседании ЦМК 1
от «28 » августа 2020 г., протокол № _____
Председатель ЦМК ____________ ____________________
(подпись) ( ФИО )
Лекционный комплекс включает следующие разделы:
4.1. Тема.
4.2. Цель.
4.3. Тезисы лекции.
4.4. Иллюстративный материал.
4.5. Литература.
4.6. Контрольные вопросы (обратная связь)
|
№ |
Название этапа занятия |
Теоретическое занятие (лекция, комбинированное занятие, мин.) |
|
1 |
Организационный момент: а) организация рабочей обстановки на занятий б) определение целей и задач занятия |
15 минут |
|
2 |
Актуализация опорных знаний по пройденной теме (методы и приемы ) - тест |
20 минут |
|
3 |
Изложение нового материала (план лекции) А) Использование 3D программ моделирования, объяснение структуры атома; Б) Использование демонстрационных объектов планетарной модели атома и модели атома по Бору. |
125 минут |
|
4 |
Закрепление пройденного материала (методы и приемы) |
25 минут |
|
5 |
Итоговый этап занятия: а) оценивание учащихся б) задание на дом |
15 минут |
|
|
|
200 минут |
4.1. Тема: Периодический закон и периодическая система элементов Д.И.Менделеева в свете теории строения вещества
1. Основные положения современной теории строения атомов.
2. Состав атомных ядер.
3. Явление радиоактивности.
4.2. Цель: углубить, обобщить и систематизировать знания обучающихся о строении вещества.
4.3. Тезисы лекции: Курс химии построен логично: от изучения состава и строения атома к изучению состава и строения веществ, далее углубленное изучение химических реакций, а затем изучение химических свойства веществ, их получение и применение.
4.4. Иллюстративный материал: Развитие представлений о строении атома.
5) открытие электрона (1897 г.).
Все эти открытия свидетельствовали о том, что атом - это сложная частица и состоит из более мелких частиц. Поэтому был предложен ряд моделей строения атома.
Модель атома Томсона ( 1903 г.).
По Томсону атом состоит из положительного заряда, равномерно распределенного по всему объему атома. Этот положительный заряд нейтрализуется электронами, которые колеблются внутри этого положительного заряда.
Эта модель была опровергнута опытами Резерфорда, который создал ядерную модель атома.
Ядерная модель атома Э.Резерфорда (1911 г.).
Согласно этой модели атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. В ядре находится подавляющая часть массы атома (93-99%). Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома равен примерно 10-10 м, а диаметр ядра равен 10-15 - 10-14м. Вокруг ядра вращаются электроны по электронным орбитам подобно тому, как планеты вращаются вокруг Солнца (поэтому эта модель еще называется планетарной).
Эта модель была усовершенствована Нильсом Бором (Дания).
Модель атома Бора (1913 г.).
Нильс Бор создал модель атома. Основные положения теории Бора следующие:
1) Электрон в атоме может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам, которые называются стационарными.
2) Двигаясь по стационарной орбите, электрон не излучает и не поглощает энергии.
3) Поглощение или излучение атомом энергии происходит только при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом энергия испускается или поглощается в виде кванта электромагнитного излучения.
Следующим этапом в развитии теории строения атома явилась квантовая механика, которая изучала движение микрочастиц (электрон, фотон, нейтрон и др.).
В 1926 г. австрийский физик Э.Шредингер предложил волновое уравнение: (d2y/dх2) + (d2y/dу2) + (d2y/dz2) + (8p2m/h2) (E – U) y = 0,
где y - (ПСИ) – волновая функция, описывающая волновое движение электронов в атоме,
х, у, z - координаты трехмерного пространства,
h – постоянная Планка,
m – масса электрона,
Е – полная (общая) энергия электрона,
U – потенциальная энергия электрона.
Таким образом, волновое уравнение Шредингера связывает волновую функцию y с энергией электрона Е и с координатами электрона в атоме (х, у, z). Волновая функция y соответствует амплитуде волны (но до конца физический смысл y не установлен),поэтому y может иметь как положительное, так и отрицательное значение. Важный физический смысл имеет квадрат волновой функции, а именно
y2 · ΔV – это произведение представляет собой вероятность нахождения электрона в малом объеме атома ΔV. Решая уравнение Шредингера, можно для данного значения энергии электрона Е и заданных значений х, у, z рассчитать значение y, а значит и y2, т.е. найти вероятность нахождения электрона в данной точке атома с координатами х, у, z. Рассчитывая y при других значениях энергии Е, можно описать движение электрона в атоме.
Чем точнее определены координаты электрона в атоме (т.е. чем меньше неопределенность Δх), тем менее точно определена скорость v электрона (т.е. больше Δv) и наоборот. Так, если положение электрона определено с точностью Δх = 10-12 м, т.е. довольно точно, то неопределенность в скорости Δv будет равна 58 000 км/сек (при скорости электрона примерно 2000 км/сек), т.е. ошибка в определении скорости в 29 раз больше, чем сама скорость, поэтому скорость мы не определили.
На основании принципа неопределенности характер движения электрона в атоме не может быть точно установлен. Поэтому представления об электроне только как о материальной точке, движущейся в атоме по определенным орбитам (с точки зрения ядерной модели атома Э.Резерфорда), неправильно. Правильнее рассматривать лишь вероятность нахождения электрона в том или ином месте атома (и эта вероятность пропорциональна ψ2). Поэтому рассматривают изображение электрона «размазанного» (распределенного) по всему объему атома в виде электронного облака . Чем плотнее расположены точки в том или ином месте атома, тем больше величина ψ2 Δv, т.е. больше вероятность нахождения электрона в этом месте атома, тем больше плотность электронного облака.
Таким образом, электронное облако - это модель, описывающая состояние электрона в атоме с точки зрения квантовой механики. Пространство вокруг ядра, в котором наиболее вероятно пребывание электрона в атоме, называется атомной орбиталью.
Квантовые числа.
1) Главное квантовое число «n» характеризует энергию электрона в атоме, размеры электронного облака и его удаленность от ядра. Оно принимает значения целых чисел, т.е. n = 1, 2, 3, 4, 5, 6, 7 ...
Состояние электрона в атоме, которое характеризуется определенным значением главного квантового числа «n», называется энергетическим уровнем электрона в атоме. Если n = 1, то электрон находится на первом энергетическом уровне; если n = 2, то на втором уровне и т.д. При этом чем больше значение «n» (т.е. больше номер энергетического уровня), тем больше энергия электрона в атоме, тем больше размер электронного облака, а значит больше облако удалено от ядра.
Номер главного квантового числа «n» совпадает с номером периода, в котором находится данный элемент в таблице Д.И.Менделеева.
2) Побочное (или орбитальное) квантовое число «l» характеризует форму электронного облака. Оно принимает значения целых чисел от 0 до (n – 1), т.е. l = 0, 1, 2, 3... (n –1). Обычно численные значения «l» заменяют буквенными обозначениями:
---------------------------------------------
l 0 1 2 3
Буквенное обозначение s p d f
Cостояние электрона в атоме, которое характеризуется определенным значением побочного квантового числа l, называется энергетическим подуровнем электрона в атоме. Если 1 = 0, то это S – подуровень, если l = 1, то р – подуровень и т.д. (см. таблицу). S - электронное облако имеет форму шара. Р - электронное облако имеет форму гантели или объёмной восьмерки.
Таким образом, «l» характеризует форму электронного облака и распределение электронов данного энергетического уровня по подуровням. Число подуровней на данном уровне равно номеру этого уровня, т.е. на первом уровне - один S-подуровень, на втором уровне - два подуровня (S – и р- подуровни), на третьем уровне - три подуровня (S, p, d – подуровни) и на четвертом уровне - четыре подуровня (S, p, d, f – подуровни).
3) Магнитное квантовое число mе (или просто m) характеризует расположение орбиталей (электронных облаков) в пространстве. Оно принимает значения всех целых чисел от - 1 до +1, включая ноль. Магнитное квантовое число mе характеризует число орбиталей в данном подуровне. Так, если S – подуровень (l = 0), то mе = 0, т.е. принимает одно значение. Это значит, что на S – подуровне находится одна S – орбиталь (□). Если l = 1 (т.е. р – подуровень), то mе = -1, 0, +1, т.е. принимает 3 значения. Это значит, что на р – подуровне находится 3 орбитали (□□□): одна орбиталь расположена по оси х, другая - по оси у и третья орбиталь – по оси z.
Если l = 2 (т.е. d – подуровень), то mе = -2, -1, 0, +1, +2, т.е. на d – подуровне 5 орбиталей (□□□□□). Аналогично на f – подуровне (l = 3) будет 7 орбиталей (□□□□□□□).
Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n, l, mе называется атомной орбиталью. Например, 2 рх – орбиталь – это состояние электрона в атоме, для которого
n = 2, l = 1 и mе = +1.
4) Спиновое квантовое число ms (или просто S) характеризует вращение электрона вокруг собственной оси (электрон может вращаться вокруг своей оси или по часовой стрелке или против часовой стрелки). Поэтому ms принимает только два значения: +1/2 или -1/2. Графически спин электрона обозначается стрелкой. Обоначение ↓↑ показывает, что это два электрона с антипараллельными спинами, т.е. у одного электрона ms = +1/2, а у другого электрона ms = -1/2.
Электроны с параллельными спинами обозначаются ↑↑. У этих электронов ms или +1/2 или у обоих электронов ms = -1/2.
Согласно ядерной (планетарной) модели, атом — электронейтральная микросистема, состоящая из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Ядро состоит из нуклонов: протонов — р (положительные частицы) и нейтронов — n (частицы, не имеющие заряда).
Согласно современным представлениям электрон — ē проявляет двойственную природу, так как является частицей, но его движение вокруг ядра имеет волновой характер.
Количественные характеристики элементарных частиц представлены в таблице 1.
Таблица 1 — Количественные характеристики элементарных частиц
|
Частица |
Относительная масса |
Относительный заряд |
|
ē |
≈ 0 |
–1 |
|
р |
1 |
+1 |
|
n |
1 |
0 |
Заряд ядра (Z) является основной характеристикой атома. Вид атомов с одинаковым зарядом ядра называется химическим элементом.
Заряд ядра (Z) численно равен порядковому номеру элемента в периодической системе (N), равен числу протонов, равен числу электронов.
Например: железо в периодической системе имеет порядковый номер 26, следовательно, Z(Fe) = +26, т.е. ядро содержит 26 протонов, а вокруг ядра движется 26 электронов.
Поскольку относительная масса электрона ≈ 0, то масса атома сосредоточена в ядре и равна сумме числа протонов и числа нейтронов. Эта сумма называется массовым числом атома.
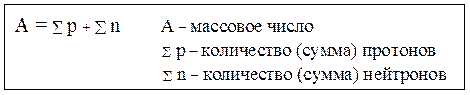
Атомы одного химического элемента, которые имеют разные массовые числа, называются изотопами. Атомы изотопов одного элемента имеют одинаковое число протонов и отличаются друг от друга числом нейтронов.
Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, внизу — порядковый номер (заряд ядра атома) элемента, т. е.
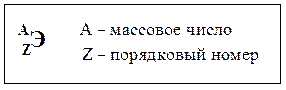
Например: изотоп углерода с массовым числом 12 — 126С;
изотоп кислорода с массовым числом 18 — 188О.
Элемент водород имеет три изотопа, у каждого из которых свое название (таблица 2).
Таблица 2 — Изотопы водорода
|
Название изотопа |
11H — протий |
21H — дейтерий |
31H — тритий |
|
Характеристика
|
1 протон, нейтронов нет |
1 протон, 1 нейтрон |
1 протон, 2 нейтрона |
В природе различные элементы имеют разное число изотопов с разным процентным содержанием каждого из них. Относительная атомная масса элемента (Ar), которая приводится в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом содержания каждого изотопа.
Например: хлор в природе встречается в виде двух изотопов: 35Сl (процентное содержание — 75,5 %) и 37Сl (24,5 %). Относительная атомная масса хлора: Ar(Сl) = 35∙0,755 + 37∙0,245 = 35,453 ≈ 35,5
Все относительные атомные массы элементов округляются до целого числа согласно правилам округления, за исключением, хлора: Ar(Сl) = 35,5.
Химические свойства всех изотопов одного элемента одинаковы: химические свойства элементов зависят не от атомной массы, а от заряда ядра.
Явление радиоактивности. Виды радиоактивного распада
Радиоактивность – самопроизвольное превращение одних атомных ядер в другие, сопровождаемое испусканием одной или нескольких частиц. Таким превращениям подвержены только нестабильные, радиоактивные ядра (радионуклиды). Самопроизвольное превращение ядра называют также радиоактивным распадом. Радиоактивный распад сопровождается выделением энергии и возбуждением в веществе других процессов, при этом выполняются законы сохранения энергии, импульса, момента импульса и электрического заряда. В процессе радиоактивного распада у ядра могут изменяться как массовое число А, так и атомный номер Z, но полное число нуклонов остается неизменным, хотя нуклоны одного вида способны превращаться в нуклоны другого вида (протоны – в нейтроны и наоборот).
Различают естественную и искусственную радиоактивность. Естественная радиоактивность наблюдается у существующих в природе изотопов, а искусственная – у изотопов, полученных в результате ядерных реакций.
Ядра, претерпевающие радиоактивные превращения, называют материнскими, а образующиеся в процессе радиоактивного распада – дочерними.
Радиоактивность – явление статистическое. Одинаковые радионуклиды распадаются независимо друг от друга за разное время. Однако наблюдение очень большого числа одинаковых радионуклидов показывает, что хотя нельзя указать, какие именно ядра распадаются за рассматриваемый промежуток времени, можно практически с полной достоверностью предсказать число ядер, которые испытают радиоактивный распад за этот промежуток времени. Чем больше исходное число радионуклидов, тем точнее это вероятностное предсказание.
Закон радиоактивного распада
Время, в течение которого претерпевает радиоактивный распад половина ядер данного радиоактивного элемента от первоначального его количества, называется периодом полураспада.
Для разных радионуклидов период полураспада различен, например для
238U – 4,5 млрд. лет, 14 С - 5730 лет,
232 Th - 13 млрд. лет, 226 Ra - 1620 лет,
214 Po – 160 мкс.
Закон радиоактивного распада записывается следующей формулой
N = N 0 * е (- 0,693 t/Т),
где N – количество ядер по истечении времени t; N0 – начальное количество ядер; t – время, в течение которого определяется количество распавшегося вещества; T – период полураспада данного радиоактивного элемента.
Если в начальный момент времени t=0 в радиоактивном препарате содержалось большое число N0 радионуклидов данного типа, то спустя некоторое время t их число уменьшится и станет равным
N = N0 e – lt,
где l - постоянная распада, характеризующая вероятность распада ядра за единицу времени. Эта формула также выражает основной закон радиоактивного распада. Время t можно отсчитать от любого момента, принимаемого за начальный.
Время Т1/2, в течение которого первоначальное число радиоактивных ядер (N0) уменьшается в два раза (N = 1/2N0), называется периодом полураспада.
Периоды полураспада у различных радионуклидов изменяются в очень широком интервале: от долей секунды до миллиардов лет. Очевидно, что спустя время Т1/2, 2Т1/2, 3Т1/2, 4Т1/2 и т.д. в радиоактивном препарате будет оставаться соответственно 1/2, 1/4, 1/8, 1/16 и т.д. часть первоначального числа радионуклидов.
Для каждого радионуклида и постоянная распада l, и период полураспада Т1/2 всегда имеют одно и то же значение. Это связано с тем, что процесс радиоактивного распада не зависит от способа получения радиоактивных ядер и от их общего количества, а также от внешних физических и химических условий (давления, температуры, химических реакций и т.д.).
Радиоактивное излучение не воспринимается обычными органами чувств человека. По своей природе его можно разделить на три основных вида, которые исторически получили названия α, β и γ - лучей. Эти лучи представляют собой либо поток частиц (α и β – излучение), либо поток электромагнитных волн (γ – лучи). В дальнейшем было установлено, что радиоактивный распад сопровождается испусканием самых разных элементарных частиц (протонов, нейтронов, нейтрино, позитронов и т.д.) и электромагнитных волн всех видов (радио волны, свет, рентгеновское излучение).
α – распад, когда наряду с дочерним ядром
возникает поток α – частиц, которые представляют собой ядра изотопа ![]() ;
;
β – распад, который сопровождается излучением либо потока электронов – е-, либо потока позитронов – е+, либо представляет собой захват ядром одного из электронов внутренних электронных оболочек атома. Это, в конечном итоге, приводит к превращению одного из протонов в нейтрон и испусканию атомом рентгеновского излучения;
спонтанное деление – самопроизвольный распад ядра на две примерно равные части;
однопротонный распад – сопровождается излучением одного протона на каждый акт распада;
двухпротонный распад – когда каждый распад приводит к излучению ядром двух протонов.
Все виды превращений ядер одного химического элемента в ядра другого протекают в соответствии с тремя правилами:
1. Закон сохранения электрического заряда – суммарный заряд продуктов распада равен заряду распадающегося ядра.
2. Закон сохранения числа нуклонов – сумма нуклонов в продуктах распада равна числу нуклонов в распадающемся ядре.
3. Закон сохранения полной энергии – полная энергия продуктов распада равна полной энергии распадающегося ядра.
4.5. Литература:
1.
Общая и неорганическая химия: учебное пособие / Под ред. Денисова В.В.,
Таланова В.М.. - Рн/Д: Феникс, 2018. - 144 c.
2. Аликина, И.Б. Общая и неорганическая химия. лабораторный практикум.: Учебное
пособие для вузов / И.Б. Аликина, С.С. Бабкина, Л.Н. Белова и др. - Люберцы:
Юрайт, 2016. - 477 c.
3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. - М.: Высшая
школа, 2009. - 743 c.
4.6. Контрольные вопросы (обратная связь)
· Ответьте на вопрос: правильность и достоверность теории планетарной модели атома Резерфорда.
· Согласно Принципу Гейзерберга – электрон невозможно предугадать в данный момент на отрезок расстояния, вопрос: как Нильсу Бору удалось избавится от данного момента своими Постулатами;
· На основе полученных данных, в программе ChemLaboratoriProdject смоделировать свою систему с разработкой ее способности к энергоиспусканию (делению радиоактивности).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.