
ЛЕКЦИЯ
ИММУНИТЕТ И ЕГО НАРУШЕНИЯ
Иммунитет — это способность многоклеточных организмов поддерживать постоянство своего макромолекулярного состава путем удаления чужеродных молекул, что обеспечивает устойчивость к инфекционным агентам и резистентность к опухолям. При этом под чужеродными макромолекулами понимают, прежде всего, продукты чужеродной генетической информации (по Р.В. Петрову), отличимые от продуктов собственных генов организма-хозяина.
По происхождению различают врождённый и приобретенный иммунитет.
Врождённый иммунитет является наследственным признаком данного вида животных. Например, рогатый скот не заболевает малярией, сифилисом и другими болезнями, заразными для человека. По прочности или стойкости видовой иммунитет разделяют на абсолютный и относительный.
Врожденный иммунитет реализуется клетками (преимущественно фагоцитами), практически не нуждающимися в межклеточных контактах и коммуникациях. В связи с этим отсутствует необходимость их локализации в специализированных органах иммунной системы: амебоциты беспозвоночных и миелоидные клетки позвоночных широко распределены по организму; особенно богаты ими барьерные ткани. До формирования адаптивного иммунитета (например, у беспозвоночных) специальные органы иммунной системы отсутствовали.
Адаптивный приобретенный иммунный ответ основан на постоянных межклеточных контактах и кооперации между клетками. Кроме того, в связи с клональной природой ответа возникает необходимость в особых механизмах концентрации (рекрутирования) клеток конкретных клонов в определенном месте. Обеспечение диалога между клетками и их вовлечение в иммунный ответ возможно лишь в условиях органной структуры. Поскольку адаптивный иммунный ответ обеспечивается лимфоидными клетками, органы иммунной системы являются прежде всего лимфоидными органами.
Иммунная система состоит из центрального и периферического отделов.
Центральный отдел содержит органы (первичные, или центральные, лимфоидные органы), в которых происходят дифференцировка и созревание лимфоцитов: костный мозг и тимус (вилочковая железа). Костный мозг - основной орган лимфо- и гемопоэза. Кроме того, он служит местом сосредоточения эффекторных клеток адаптивного иммунитета (например, плазмоцитов). Таким образом, только тимус является чисто центральным лимфоидным органом. Основная его функция - обеспечение развития Т-лимфоцитов (см. ниже). У птиц, некоторых рептилий, а также у жвачных млекопитающих имеется особый тип центральных лимфоидных органов или лимфоидных структур, в которых развиваются В-лимфоциты (у птиц и рептилий - сумка, или бурса Фабриция). Название центральных лимфоидных органов определило обозначение основных типов лимфоцитов: Т (тимусзависимые) и В (бурсазависимые). Название третьего типа лимфоидных клеток - NK-клеток - происходит от выполняемой ими функции (естественные киллеры - natural killers).
Периферический отдел иммунной системы образован вторичными (периферическими) лимфоидными органами: не инкапсулированными лимфоидными структурами, связанными со слизистыми оболочками, диффузно распределенными лимфоидными и миелоидными клетками и инкапсулированными (т.е. истинными, морфологически изолированными) лимфоидными органами. Лимфоидные органы взаимосвязаны путями рециркуляции лимфоцитов (лимфатическая и кровеносная системы). Выделяют 3 разновидности инкапсулированных лимфоидных органов - лимфатические узлы, селезенка и пейеровы бляшки.
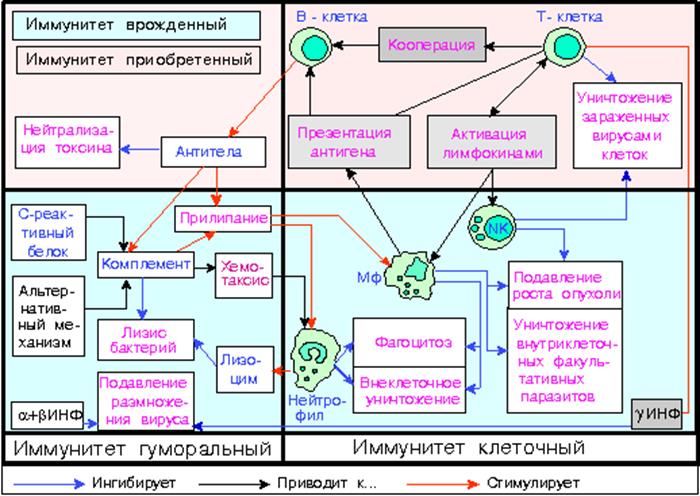
Системы иммунной зашиты
|
Иммунная защита |
Гуморальная защита |
Клеточная защита |
|
Неспецифическая |
Комплементарная система |
Гранулоциты |
|
Специфическая |
Иммуноглобулины: |
Т-лимфоциты |
Специфическую иммунную защиту в основном обеспечивают лимфоциты, осуществляющие это двумя путями: клеточным или гуморальным.
Клеточный иммунитет обеспечивают иммунокомпетентные Т-лимфоциты, которые образуются из стволовых клеток, мигрирующих из красного костного мозга, и тимуса. Попадая в кровь, Т-лимфоциты создают большую часть лимфоцитов самой крови (до 80%), а также оседают в периферических органах иммуногенеза (прежде всего в лимфатических узлах и селезенке), образуя в них тимус-зависимые зоны, которые становятся активными точками пролиферации (размножения) Т-лимфоцитов вне тимуса. Дифференциация Т-лимфоцитов происходит в трех направлениях. Первая группа дочерних клеток способна при встрече с “чужим” белком-антигеном (возбудителем болезни, или собственным мутантом) вступать с ним в реакцию и уничтожать его. Такие лимфоциты называются Т-киллерами (“убийцами”) и характеризуются тем, что способны собственными силами, без предварительной иммунизации и без подключения антител и защитного комплемента плазмы крови, осуществлять лизис (уничтожение путем растворения клеточных мембран и Связывание белков) клеток-мишеней (носителей антигенов). Таким образом, Т-киллеры является отдельной ветвью дифференциации стволовых клеток и предназначены создавать как бы первичный барьер в противовирусном и противоопухолевый иммунитет организма.
Другие две популяции Т-лимфоцитов называются Т-хелперы и Т-супрессоры и осуществляют клеточный иммунный защиту через регуляцию уровня функционирования Т-лимфоцитов в системе гуморального иммунитета. Т-хелперы (“помощники”) в случае появления в организме антигенов способствуют быстрому размножению эффекторных клеток (исполнителей иммунной защиты). Различают два подтипа клеток хелперов: Т-хелперы-1, выделяющие специфические интерлейкины типа (гормоноподобные молекулы) и интерфероны, связаны с клеточным иммунитетом (способствуют развитию Т-хелперов) Т-хелперы-2 выделяют интерлейкины типа ИЛ-4,5 и взаимодействуют преимущественно с Т-лимфоцитами гуморального иммунитета. Т-супрессоры способны регулировать активность В и Т-лимфоцитов в ответ на антигены.
Гуморальный иммунитет обеспечивают лимфоциты, которые дифференцируются из стволовых клеток мозга не в тимуса, а в других местах (в тонкой кишке, лимфатических узлах, глоточных миндалинах и т.д.) и называются В-лимфоцитами. Такие клетки составляют до 15% всех лейкоцитов. При первом контакте с антигеном чувствительны к нему Т-лимфоциты интенсивно размножаются. Некоторые из дочерних клеток дифференцируют в клетки иммунологической памяти и на уровне лимфоузлов в £-зонах превращаются в плазматические клетки, далее способны создавать гуморальные антитела. Способствуют этим процессам Т-хелперы. Антитела представляют собой большие протеиновые молекулы, имеющие специфическое родство к тому или иному антигену (на основе химической структуры соответствующего антигена) и называются иммуноглобулинов. Каждая молекула иммуноглобулина составлена из двух тяжелых и двух легких цепей связанных друг с другом дисульфидных связей и способных активизировать клеточные мембраны антигенов и присоединять к ним комплемент плазмы крови (содержит 11 протеинов, способных обеспечивать лизис или растворения клеточных мембран и Связывание белков клеток-антигенов). Комплемент плазмы крови имеет два пути активизации: классический (от иммуноглобулинов) и альтернативный (от эндотоксинов или ядовитых веществ и от лекарств). Выделяют 5 классов иммуноглобулинов (Ig): G, A, M, D, E, различающихся по функциональным особенностям. Так, например, IgМ привычно первым включается в иммунный ответ на антиген, активизирует комплемент и способствует поглощению этого антигена макрофагами или лизису клетки; IgА размещается в местах наиболее вероятного проникновения антигенов (лимфоузлах желудочно-кишечного тракта, в слезных, слюнных и потовых железах , в аденоидах, в молоке матери и т.д.) чем создает прочный защитный барьер, способствуя фагоцитозу антигенов; IgD способствует пролиферации (размножению) лимфоцитов при инфекциях, Т-лимфоциты “распознают” антигены при помощи включенных в мембрану гаммаглобулина, образующих антитело, связывая звена, конфигурация которых соответствует трехмерной структуре антигенных детерминированных групп (гаптенов или низкомолекулярных веществ, которые могут связываться с белками антитела, передючы им свойства белков антигена), как ключ соответствует замку. Активированные антигеном В- и Т-лимфоциты быстро размножаются, включаются в процессы защиты организма и массово погибают. В то же время не многие из активированных лимфоцитов превращаются в В- и Т-клетки памяти, которые имеют длительный срок жизни и при повторном инфицировании организма (сенсибилизации) В- и Т-клетки памяти “вспоминают” и распознают структуру антигенов и быстро превращаются в эффекторные (активные) клетки и стимулируют клетки плазмы лимфоузлов на изготовление соответствующих антител.
Неспецифический иммунитет, обусловленный наличием в крови “естественных” антител, которые часто возникают при контакте организма с кишечной флорой. Насчитывают 9 веществ, которые вместе образуют защитный комплемент. Одни из таких веществ способны нейтрализовать вирусы (лизоцим), вторые (С-реактивный белок) подавляют жизнедеятельность микробов, третьи (интерферон) уничтожают вирусы и подавляют размножение собственных клеток в опухолях и др. Неспецифический иммунитет обусловливают также специальные клетки-нейтрофилы и макрофаги, способные к фагоцитозу, т.е. к уничтожению (переваривания) чужеродных клеток.
Специфический и неспецифический иммунитет подразделяется на врожденный (передастся от матери), и приобретенный, который образуется после перенесенной болезни в процессе жизни.
Кроме этого существует возможность искусственной иммунизации организма, которая проводится либо в форме вакцинации (когда в организм вводят ослабленный возбудитель болезни и этим вызывают активизацию защитных сил что до образования соответствующих антител), либо в виде пассивной иммунизации, когда делают так называемое прививки против определенной болезни путем введение сыворотки (плазмы крови не содержащая фибриногена, или фактора ее свертывания, а зато имеет готовые антитела против определенного антигена). Такие прививки делают, например, против бешенства, после укусов ядовитых животных и так далее.
Искусственный иммунитет воспроизводят в целях предупреждения заразных болезней.
Активным искусственным иммунитетом называют иммунитет, который достигается введением здоровым людям, ослабленных патогенных микробов (вакцин), ослабленных токсинов (анатоксинов) или вирусов. Пассивный искусственный иммунитет воспроизводится путем введения человеку сыворотки, содержащей антитела против микробов и их токсинов. Особенно эффективны антитоксические сыворотки против дифтерии, столбняка, газовой гангрены. Получают такие сыворотки путем иммунизации лошадей соответствующими токсинами.
Антитоксический и антибактериальный иммунитет
Антитоксический иммунитет направлен на нейтрализацию микробных ядов. Этот вид иммунитета проявляется при таких инфекциях как дифтерия, столбняк, газовая гангрена, ботулизм.
Антибактериальный иммунитет направлен на уничтожение самих микробных тел. Антибактериальный иммунитет проявляется в ряде защитных реакций, главными из которых являются выработка антител и фагоцитоз. Антитела вызывают растворение или склеивание (агглютинацию) бактерий, или способствуют их фагоцитозу.
Противовирусный иммунитет
В механизмах иммунитета против вирусов имеет значение: выработка противовирусных антител; фагоцитоз вирусных частичек; образование в клетках лимфоидного ряда особого белка – интерферона, который подавляет размножение вирусов.
Патогенные микробы проникают в организм через кожу, слизистые оболочки, лимфу, кровь и другие ткани. Для большинства микробов эти «входные ворота» как бы «закрыты».
Защитная деятельность тканей, препятствующих проникновению микробов в организм обусловлена разными механизмами:
- механическим удалением микробов с кожи и слизистых;
- уничтожением микробов с помощью естественных жидкостей организма (слезы, пот, пищеварительные соки, отделяемое влагалища) или патологическими жидкостями, например, воспалительной жидкостью – экссудатом;
- фиксацией микробов в тканях и уничтожение их фагоцитами;
- уничтожение микробов с помощью специфических антител;
- выделение микробов и их ядов из организма.
Большинство из перечисленных механизмов являются неспецифическими факторами защиты и представляют собой как бы первую линию обороны.
К факторам неспецифической защиты относятся:
- фагоцитоз – поглощение инородных частиц (микробов или измененных собственных клеток организма) лейкоцитами;
- система комплемента;
- интерферон;
- непроницаемость покровов (кожа, слизистые);
- бактерицидные субстанции тканей (лизоцим, пропердин, кислая среда);
- гидролитические ферменты.
К специфическим факторам относятся:
- антитела;
- гиперчувствительность немедленного и замедленного типов;
- иммунологическая память;
- иммунологическая толерантность.
Иммунологическую функцию выполняет специализированная система клеток, тканей и органов, которую называют иммунной системой.
Иммунная система – это совокупность всех лимфоидных органов и скоплений лимфоидных клеток тела. Центральной клеткой иммунной системы является лимфоцит. Лимфоидная система - это морфологический синоним иммунной системы. Иммунная система имеет три особенности: она генерализована (разбросана) по всему телу; ее клетки постоянно рециркулируют по всему телу через кровоток и лимфоток; она обладает уникальной (единственной в своем роде) особенностью вырабатывать строго специфические молекулы антител в отношении каждого антигена.
Иммунные процессы осуществляются клетками костномозгового происхождения, относящимися к двум кроветворным линиям - миелоидной и лимфоидной. Миелоидные клетки отвечают за реакции врожденного, лимфоидные - преимущественно за реакции адаптивного и только частично - врожденного иммунитета
Иммунная система состоит из центральных органов: вилочковая железа (тимус), костный мозг, сумка Фабриция (у птиц) и периферических органов (селезенка, лимфатические узлы, лимфоидная ткань пищеварительной системы, миндалины, клетки Лангерганса кожи). Кроме того, она располагает подвижными иммуноцитами – лимфоцитами, переносимыми с током крови и лимфы.
Завершив развитие в костном мозгу, клетки поступают в кровь и некоторое время (обычно короткое) циркулируют в кровотоке. Из кровотока они мигрируют в ткани, в которых живут от нескольких суток до месяцев или лет. Кроме такого пути миграции, существует экстренная миграция клеток (в основном миелоидных) из кровотока в места контакта с патогеном и очаг воспаления. Миелоидные клетки, участвующие в иммунных процессах, представлены моноцитами, нейтрофильными, эозинофильными и базофильными гранулоцитами. Некоторые разновидности миелоидных клеток практически не выявляются в кровотоке (хотя они тоже проходят стадию циркуляции), но присутствуют в тканях: тучные клетки и 2 типа тканевых клеток, образующихся из моноцитов, - макрофаги и дендритные клетки.
В- и Т-лимфоциты распознают антигены, однако это распознавание происходит по-разному. Иммуноглобулиновый рецептор В-клеток (BCR) дает им возможность распознавать нативный антиген как в свободной, так и в связанной с мембранами формах. Рецептор Т-клеток (TCR) распознает только фрагменты антигена, связанные с молекулами MHC. В процессе дифференцировки в Т- и В-лимфоцитах происходит перестройка генов, кодирующих рецепторы для антигенов. В результате каждая клетка экспрессирует рецептор, уникальный по специфичности. Рецепторы такой же специфичности имеют все потомки этой клетки (клон). В процессе селекции погибает большинство опасных аутоспецифических клонов как Т-, так и В-клеток. Популяции Т- и В-лимфоцитов участвуют в иммунных реакциях клонального типа, при которых в ответ вовлекаются только клетки клонов, экспрессирующих рецепторы нужной специфичности (в отличие от естественных киллеров, не отличающихся друг от друга по специфичности).
Популяции лимфоцитов гетерогенны не только по структуре антигенраспознающего рецептора. К естественным (т.е. формирующимся в процессе нормальной дифференцировки, не связанной с действием чужеродных антигенов) относят 3 субпопуляции В-клеток. Число естественных субпопуляций Т-лимфоцитов значительно больше.
Главной функцией иммунной системы является поддержание антигенного гомеостаза в организме. Иммунная система обеспечивает:
- распознавание чужеродных агентов (антигенов);
- удаление их из организма;
- запоминание, обеспечивающее ускоренную реакцию организма при повторной встрече с тем же чужеродным агентом.
Таким образом, иммунная система выполняет защитную функцию.
Антигены – это вещества (чаще всего белки или полисахариды), генетически чужеродные для конкретного организма, вызывающие в организме иммунный ответ, то есть специфическую реакцию, направленную на удаление антигена из организма. Антигены - высокомолекулярные соединения, способные специфически стимулировать иммунокомпетентные лимфоидные клетки и обеспечивать тем самым развитие иммунного ответа. Распознавание антигенов происходит индивидуально. Антигены распознаются антигенспецифическими рецепторами, представленными на клетках одного типа - лимфоцитах. Распознавание антигенов - позднее эволюционное приобретение, связанное с возникновением адаптивного иммунитета.
Антигенными свойствами обладают микробы и вирусы, различные яды (токсины) животного, растительного или микробного происхождения, опухолевые клетки, которые приобретают черты чужеродности вследствие мутации.
Чужеродность - не обязательное, но очень важное свойство факторов, против которых направлены реакции иммунитета. Именно поэтому должна существовать четкая граница, отделяющая внутреннюю среду организма от внешней - барьерные ткани (кожа и слизистые оболочки). Однако иногда возникает необходимость расширить или сузить границы чужеродности. Так, отнюдь не на все компоненты содержимого кишечника и других трактов развивается иммунный ответ (например, компоненты пищи, микроорганизмы-симбионты не рассматриваются иммунной системой как чужеродные), а некоторые участки внутренней среды организма, в силу особого рода изоляции, оказываются в значительной степени исключенными из зоны контроля со стороны адаптивного иммунитета (например, ЦНС, полость глаза) и при нарушении изоляции, становятся объектом иммунной атаки. Молекулы трех названных выше групп распознаются тремя типами рецепторов клеток иммунной системы.
Антигенраспознающие рецепторы представлены только на В- и Т-лимфоцитах. Важная особенность этих рецепторов - гигантская вариабельность их антигенраспознающих доменов (миллионы вариантов в пределах одного организма). Все варианты антигенраспознающих рецепторов не могут быть одновременно представлены на одной клетке. Они распределяются между клетками клонально, т.е. рецепторы, отличающиеся по специфичности, представлены на разных клонах лимфоцитов. Выделяют 3 разновидности антигенраспознающих рецепторов. На В-клетках представлены В-клеточные рецепторы (BCR - B-cell reseptors), имеющие иммуноглобулиновую природу. При дифференцировке В-лимфоцитов в плазматические клетки в ходе иммунного ответа эти рецепторы секретируются в растворимой форме, называемой антителами. BCR распознают свободный и связанный с мембраной антиген, точнее, фрагмент молекулы антигена, называемый эпитопом. Т-клеточные рецепторы (TCR - T-cell receptor) существуют в двух вариантах. По названию входящих в их состав полипептидных цепей, эти рецепторы обозначают как αβTCR и γδTCR. Они представлены на мембране двух различных типов Т-клеток и не секретируются. αβTCR распознает не нативный антиген, а его фрагмент (эпитоп), презентируемый в составе специализированных молекул главного комплекса гистосовместимости - MHC (Major histocompatibility complex), которые экспрессируются на поверхности клеток.
Существует 2 класса молекул MHC - I и II. MHC-I присутствуют на всех клетках и связывают эндогенные пептиды, транспортируемые в эндоплазматический ретикулум - место синтеза MHC - из цитозоля. MHC-II экспрессированы только на специализированных - антигенпрезентирующих клетках (АПК) и связывают пептиды экзогенного происхождения, попадающие в клетку в результате эндоцитоза. Соответственно распознавание чужеродных пептидов в составе MHC-I сигнализирует о цитозольной локализации патогена или его продуктов, а распознавание таких пептидов в составе MHC-II - о внеклеточной локализации патогена или присутствии его в эндосомах или фагосомах. В распознавании TCR-комплексов антигенного пептида с молекулами MHC принимают участие корецепторы - CD4 и CD8, обладающие сродством соответственно к молекулам MHC-II и MHC-I (но не к антигенному пептиду). Таким образом, антигенный пептид в составе молекул MHC-I распознают Т-клетки, несущие корецептор CD8, а в составе MHC-II - Т-клетки, несущие CD4. Распознавание липидных эпитопов происходит при участии неклассических молекул MHC - CD1. Эти комплексы распознаются αβTCR ограниченной вариабельности, экспрессируемыми T-клетками популяции NKT. Условия распознавания антигена γδTCR изучены слабо; известно, что для этого не требуется образования комплекса фрагментов антигена с молекулами MHC.
Иммунная система обеспечивает жизненно важное свойство организма – иммунологическую реактивность, которая представляет собой способность организма отвечать на действие антигена клеточными и гуморальными реакциями, специфичными по отношению к антигену. Эта способность обусловлена двумя видами иммуноцитов: Т-лимфоцитами и В-лимфоцитами. Различают несколько подвидов (субпопуляций) Т-лимфоцитов функционально способных к иммунологическому взаимодействию с антигеном. Это Т-киллеры (убийцы), разрушающие клетки с антигеном; Т-хелперы (помощники), помогающие другим Т- и В-лимфоцитам реагировать на антиген; Т-супрессоры – лимфоциты, тормозящие реакцию других лимфоцитов на антиген и Т-лимфоциты – медиаторы гиперчувствительности замедленного типа.
Т-лимфоциты реагируют с антигеном непосредственно и осуществляют клеточные реакции в организме.
В-лимфоциты под действием антигена превращаются в плазматические клетки, которые вырабатывают иммуноглобулины, то есть отвечают за гуморальные иммунные реакции.
У человека образуется пять классов иммуноглобулинов: IgM; IgD; IgЕ; IgA; IgG. Иммуноглобулины – это молекулы, предназначенные для распознавания и связывания антигенов. Они существуют в двух формах – связанной с мембранами B-лимфоцитов и в свободной растворимой форме. Когда иммуноглобулин связан с мембраной В-клеток, он исполняет роль рецептора, распознающего антигены, а если он растворим и циркулирует в крови, то выполняет функцию антитела.
ВЗАИМОДЕЙСТВИЕ ИММУНОКОМПЕТЕНТНЫХ КЛЕТОК В ИММУННОМ ОТВЕТЕ
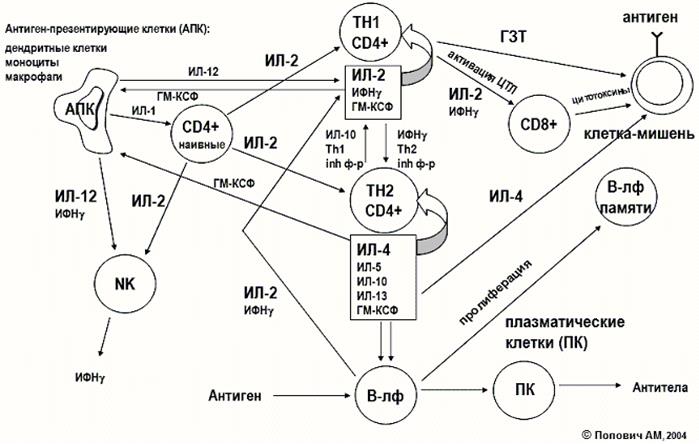
Наиболее важную роль в запуске иммунных процессов играют макрофаги благодаря наличию на поверхности и в цитоплазматических гранулах рецепторов, распознающих эпитоп. Распознав патоген, макрофаги активируются и начинают выделять активные белковые вещества - провоспалительные цитокины, способствующие дальнейшей активации клеток врожденного иммунитета. Таким образом, активация макрофагов, приводящая к секреции цитокинов, - это первая реакция системы врожденного иммунитета на проникновение во внутреннюю среду организма патогенов. При этом цитокины выполняют 2 основные функции:
1) вовлечение в защитную реакцию других клеток (например, эпителиальных, эндотелиальных, дендритных) без обязательного их контакта с патогеном (хотя эти клетки также могут распознавать патоген и реагировать на него непосредственно); 2) организация эмиграции лейкоцитов из кровотока в очаг воспаления.
Это событие особенно важно, поскольку, как правило, содержание макрофагов и других эффекторных клеток в месте проникновения патогена невелико и достаточно только для запуска реакции. Приток лейкоцитов из крови способствует реализации полноценной местной защитной реакции с участием факторов врожденного иммунитета. Сначала в очаг воспаления поступают наиболее мобильные лейкоциты - нейтрофилы, обладающие высоким защитным потенциалом, реализуемым главным образом в виде фагоцитоза. Затем мигрируют моноциты, дифференцирующиеся в макрофаги, которые, помимо фагоцитоза, выполняют регуляторные функции, стимулируют пролиферацию клеток и вызывают другие проявления репаративных процессов. Одновременно вовлекаются вспомогательные гуморальные факторы: происходит активация системы комплемента, синтезируются белки острой фазы, выделяются бактерицидные вещества. При вирусной инфекции патоген распознают в основном плазмоцитоидные дендритные клетки и естественные киллеры (при этом происходит их активация).
Развитие иммунного ответа включает индуктивную и продуктивную (эффекторную) фазы. Индуктивная фаза состоит в формировании исполнительных механизмов адаптивного иммунитета и реализуется в первые 7 сут после появления патогена в организме. В этот период основную роль в иммунной защите играет врожденный иммунитет. По мере развития эффекторных механизмов адаптивного иммунитета они берут на себя основную нагрузку в защите организма.
TCR распознает антигенный пептид в составе молекул MHC с участием корецепторов CD4 (Т-хелперы) и CD8 (цитотоксические Т-клетки или Т-киллеры). Этому способствует сродство корецепторов к молекулам MHC (CD4 - к MHC-II, CD8 - к MHC-I). Процесс представления антигенного пептида Т-клеткам в составе молекул MHC называют презентацией антигена. Таким образом, Т-хелперы распознают комплекс MHC-II-антигенный пептид. Это служит необходимым, но недостаточным условием для активации Т-клеток. Дополнительные активационные стимулы клетки получают через костимулирующие молекулы. В их роли на дендритных клетках выступают молекулы В7 (CD80 и CD86), а на Т-клетках - CD28. Сигнал, поступающий в Т-клетку через молекулу CD28, дополняет сигнал от TCR, что обеспечивает активацию клетки. Если CD28 исходно присутствует на большинстве Т-клеток, то молекула CD80 на дендритных клетках барьерных тканей почти отсутствует, а CD86 представлена на них в количествах, недостаточных для костимуляции. Усиление экспрессии молекул В7 на дендритных клетках (а также макрофагах и других клетках, способных презентировать антиген) происходит при распознавании PAMP и тесно связано с другими проявлениями врожденного иммунитета. Таким образом, для запуска адаптивного иммунитета необходима предварительная активация клеток врожденного иммунитета.
Запуск Th1-зависимого иммунного ответа происходит, если клетка фагоцитировала микроорганизм, но не смогла его убить и расщепить. В этом случае фагоцит (макрофаг) получает стимулирующие сигналы со стороны Т-хелперов типа Th1. Взаимодействие между клетками осуществляется в форме повторной презентации антигенного пептида Т-клетке - на этот раз макрофагом. В виде ответной реакции Th1-клетка активируют макрофаг, передавая костимулирующий сигнал через мембранную молекулу CD40 и секретируемый цитокин - интерферон (IFN) γ.
В-клетка распознает антиген в его нативном состоянии без участия дендритной клетки. Более того, она сама выступает в роли АПК: поглотив комплекс антигена с рецептором, В-лимфоцит обрабатывает его, встраивая антигенный пептид в состав молекулы MHC-II. В-клетка презентирует пептид Th2-клетке, получая при этом от нее активационные сигналы через ту же костимулирующую молекулу CD40 (как и макрофаги) и цитокин IL-4 (фактор роста В-клеток). Это вызывает сначала пролиферацию клонов активированных В-лимфоцитов (в реакцию вовлекаются клоны, распознавшие антиген), а затем их дифференцировку в антителообразующие клетки – плазмоциты.
Особую роль играет третий вариант реакции адаптивного иммунитета - ответ цитотоксических Т-лимфоцитов. Презентацию антигенного пептида этим Т-клеткам тоже осуществляют дендритные клетки, но с участием молекул MHC-I. Цитотоксические клетки, предназначенные для защиты от вирусов и других внутриклеточных патогенов (присутствуют в цитозоле), в меньшей степени зависят от Т-хелперов.
Эффекторные механизмы иммунитета
Наиболее разнообразные эффекторные механизмы задействованы в защите от внеклеточных патогенов, при которой преобладает гуморальный иммунный ответ. Основные эффекторные молекулы при этом - антитела, секретируемые плазматическими клетками, дифференцирующимися из В-лимфоцитов при участии Th2-клеток.
Более универсальны защитные механизмы, реализуемые антителами с участием других факторов или клеток. Главный из них - опсонизация - покрытие клеток молекулами иммуноглобулинов, облегчающими их распознавание и поглощение фагоцитами, которые имеют на мембране рецепторы для хвостовой части антител (Fc-рецепторы). Опсонизация значительно ускоряет фагоцитоз патогенов. Другой механизм защитного действия антител состоит в активации комплемента по классическому пути. Комплекс антиген-антитело связывает сывороточный фактор C1q, что вызывает каскадную активацию других компонентов комплемента. Этот процесс имеет 2 основных эффекта. Первый и главный из них - опсонизация клеток, но не антителами, а продуктами расщепления С3-компонента - C3b. Фагоциты имеют рецепторы к фрагментам С3 компонента и легко распознают опсонизированный патоген. Второй результат, опосредующий защитный эффект комплемента, - цитолиз клетки за счет формирования мембраноатакующего комплекса. Кроме того, имеющие Fc-рецепторы естественные киллеры распознают опсонизированную антителами клетку и вызывают ее лизис по контактному механизму. Наконец, антитела облегчают распознавание патогенов макрофагами, имеющими высокоаффинные Fc-рецепторы, что резко усиливает защитные свойства этих клеток.
Защита от другой разновидности внеклеточных патогенов - макропаразитов (гельминтов) также осуществляется по Th2-зависимому механизму. Однако в этом случае наибольшую роль играют эозинофилы, привлекаемые цитокинами, которые секретируют Th2-лимфоциты и тучные клетки. Эозинофилы располагаются по поверхности паразита и выделяют содержащиеся в их эозинофильных гранулах высокоактивные белки, убивающие паразитов.
Антитела не способны проникнуть внутрь клеток, и фактически бессильны против патогенов, имеющих внутриклеточную локализацию. Для защиты от внутриклеточных патогенов иммунная система имеет 2 стратегии. Как уже упоминалось, Th1-клетки активируют макрофаги. При взаимодействии этих клеток Тh1-лимфоцит получает дополнительный стимул через TCR, а макрофаг - через действие IFNγ и костимулирующую молекулу CD40. Этот диалог приводит к дополнительной активации макрофагов, в частности, к повышению бактерицидной активности этих клеток и формированию нового фактора - оксида азота и его производных (благодаря экспрессии макрофагами индуцибельной NO-синтазы). Это стимулирует разрушение внутриклеточных патогенов, резистентных к действию факторов врожденного иммунитета до подключения Т-хелперов.
Другая стратегия борьбы с внутриклеточными патогенами направлена на элиминацию локализующихся в цитозоле патогенов (микоплазмы, лямблии и т.д.) или вирусов, геном которых интегрируется в геном клетки. Если в основе предыдущего механизма лежит усиление активности эффекторных клеток врожденного иммунитета, позволяющее им излечиться от патогена, то в данном случае иммунная система выбирает более радикальный путь – убивает инфицированную клетку вместе с патогеном (убитая клетка затем фагоцитируется). Функцию киллеров выполняют цитотоксические СD8+ Т-лимфоциты, отличающиеся от естественных киллеров не столько механизмом цитолиза, сколько специфичностью: прежде чем убить клетку, цитотоксический Т-лимфоцит должен распознать антигенный пептид патогена, выносимый на поверхность клетки-мишени в составе молекул MHC-I. Такой же механизм иммунная система использует при борьбе с опухолевыми клетками и при отторжении чужеродного трансплантата. Он же может участвовать в развитии аутоиммунной патологии (сахарный диабет I типа и др.).
Сопоставляя эффекторные механизмы врожденного (реализуемые на первой линии защиты) и адаптивного иммунитета (формируются в ходе иммунного ответа), следует отметить их сходство; при адаптивном ответе они незначительно модифицируются. Действительно, и во врожденном, и в адаптивном иммунитете используется киллинг патогенов или инфицированных клеток, регулируемый цитокинами или антителами. Таким образом, под влиянием факторов адаптивного иммунитета фагоцитоз интенсифицируется и становится более целенаправленным. Т-киллеры действуют подобно натуральным киллерам, но спектр их мишеней ограничен специфичностью их рецепторов, т.е. Т-киллеры действуют более избирательно. Внеклеточный цитолиз, осуществляемый эозинофилами, при адаптивном ответе проявляется локально благодаря выработке цитокинов, привлекающих эозинофилы к гельминтам. Наконец, реакции комплемента, активируемого через альтернативный и классический пути, приводят к одинаковым результатам, но включаются по антигенспецифическому механизму только во втором случае.
В процессе иммунного ответа происходит элиминация патогена. Устойчивость к нему, называемая протективным иммунитетом, поддерживается упомянутыми эффекторными факторами (антитела, цитотоксические Т-лимфоциты, другие активированные клетки адаптивного иммунитета).
При иммунном ответе одновременно с эффекторными клетками образуются клетки памяти, не вовлекаемые в текущий иммунный ответ, но формирующие пул защитных клеток при повторной встрече с тем же антигеном. Это ускоряет развитие иммунного ответа при повторной встрече с антигеном - вторичного иммунного ответа.
Иммунологическая толерантность
Под иммунологической толерантностью понимают отсутствие иммунной реакции на конкретный антиген, то есть «терпимость» организма в отношении этого антигена. Ярким примером иммунологической толерантности является отсутствие иммунных реакций на собственные антигены организма. Потеря толерантности к собственным антигенам приводит к развитию аутоиммунных заболеваний, а потеря толерантности к чужеродным антигенам приводит к развитию повышенной чувствительности – сенсибилизации. Основой формирования иммунологической толерантности является удаление лимфоцитов, специфических к соответствующим антигенам.
Иммунологическая толерантность – это состояние ареактивности в отношении того или иного антигена; ее индуцирует предшествующий контакт с этим антигеном. Активно функционирующие механизмы толератности необходимы для предупреждения воспалительных реакций в ответ на многие безвредные антигены, попадающие в организм с воздухом и пищей и действующие на слизистую оболочку дыхательных путей и желудочно-кишечного тракта. Однако наиболее важна толерантность к собственным антигенам организма; она предотвращает иммунный ответ против собственных тканей. Между тем возможность такого ответа существует, поскольку иммунная система продуцирует самые разнообразные антигенспецифичные рецепторы, в том числе способные реагировать с аутоантигенами. Поэтому клетки, имеющие подобные рецепторы, должны быть функционально или физически элиминированы.
Существуют три возможных пути, посредством которых предотвращается реакция аутореактивных лимфоцитов на собственные антигены.
• Клональная делеция: физическое удаление клеток из репертуара на той или иной стадии их жизненного цикла.
• Клональная анергия: подавление самого механизма иммунного ответа.
• Супрессия: подавление клеточной активности в результате взаимодействия с другими клетками, в частности продуцирующими цитокины-ингибиторы, или с идиотип-специфичными лимфоцитами, распознающими антиген-специфичный рецептор аутореактивных клеток.
Клональная делеция. В тимусе происходит отбор Т-клеток с рецепторами, способными связывать антигены в комплексе с молекулами МНС, и делеция клеток, высокоавидных к собственным антигенам. Высокая скорость пролиферации тимоцитов сочетается с их массовой гибелью: подавляющее большинство тимоцитов погибает в тимусе. К причинам этого относятся аберрантная перестройка генов ТкР, отрицательная селекция и неспособность клеток пройти положительный отбор. Положительная селекция и коммитирование Т-клеток происходят на определенной стадии их развития. Тимоциты в процессе своего развития утрачивают одну из корецепторных молекул и становятся либо CD4+-, либо CD8+-клетками.
Периферическая, или посттимическая толерантность к собственным антигенам
Как правило, некоторые потенциально аутореактивные Т-лимфоциты не погибают в тимусе и поступают в пул периферических лимфоцитов. Для предотвращения аутоагрессивного действия избежавших делеции Т-лимфоцитов существует четыре механизма:
• «игнорирование» Т-клетками антигенов собственных тканей организма;
• анергия Т-клеток;
• гибель Т-клеток;
• иммунное отклонение или иммуносупрессия.
Потенциально
аутореактивные клетки могут «игнорировать» собственные антигены.
Этот феномен представляет собой пассивную форму толерантности к аутоантигенам и
наблюдается в следующих случаях:
• если аутореактивные Т-лимфоциты не могут проникнуть через эндотелиальный барьер, отделяющий клетки с соответствующими аутоантигенами;
• при недостаточности или отсутствии экспрессии молекул МНС на тканевых клетках, несущих данный аутоантиген.
Анергия как механизм периферической толерантности
Анергией называют такое состояние клеток, при котором они сохраняют жизнеспособность, но не могут осуществлять некоторые функции в ответ на оптимальную стимуляцию. Анергию Т-лимфоцитов можно легко индуцировать in vitro, стимулируя клетки через них ТкР в отсутствие костимуляции и действия цитокинов (ИЛ-2).
Периферический механизм клеточной гибели
Для поддержания толерантности к собственным антигенам
и гомеостаза иммунной системы большое значение имеет делеция Т-клеток вне
тимуса, когда после активации антигеном большинство Т-клеток погибает в
результате апоптоза. Этот механизм служит для контроля аутоиммунных реакций и
поддержания оптимального пула лимфоидных клеток.
Периферическую делецию Т-клеток инициирует взаимодействие либо антигена Fas с
его лигандом, либо ФНО с рецептором ФНО. Последующая цепь передачи сигналов
активирует ферментоподобные протеазы, которые опосредуют запрограммированную
клеточную гибель.
В некоторых тканях система Fas служит для защиты от нежелательных иммунных реакций. Так, ткани яичка и сетчатки экспрессируют лиганд Fas, который предохраняет их от действия активированных Т-лимфоцитов.
Иммунное отклонение
Существуют две популяции Т-лимфоцитов, продуцирующие разные цитокины. Известно, что многие воспалительные аутоиммунные заболевания вызываются Txl-клетками, которые образуют цитокины ИФγ и ФНОα. Цитокины, продуцируемые Тх2-лимфоцитами, – ИЛ-4, ИЛ-5, ИЛ-6 и др. – поддерживают антитело-образование. Однако наряду с этим синтезируемые Тх2-клетками цитокины, в частности ИЛ-10, оказывают важный дополнительный эффект подавления эффекторных функций макрофагов, включая презентацию антигена Тх1-лимфоцитам и не стимулированным Т-клеткам. Таким образом, Тх2-клетки способны подавлять воспалительные реакции. В свою очередь секретируемый Тх1-лимфоцитами ИФγ может предотвращать дифференцировку Тх0-клеток в Тх2-лимфоциты. Впоследствии было высказано предположение о том, что способность антигена вызывать либо «гуморальный», либо «клеточный» иммунный ответ отражает активацию им одного из двух, функционально антагонистичных один другому, механизмов иммунной системы. Феномен иммунного отклонения распространяется и на собственные антигены, поскольку развитие таких заболеваний, как диабет и воспалительный процесс в кишечнике, вызываемых Txl-клетками, может быть предотвращено стимулированными антигеном Тх2-лимфоцитами.
Толерантность В-клеток к собственным антигенам
Продукция высокоаффинных IgG зависит от Т-клеток. Порог чувствительности Т-клеток к индукции толерантности ниже, чем у В-клеток, потому ареактивность В-лимфоцитов по отношению к собственным антигенам определяется отсутствием Т-клеточной помощи. Таким образом, толерантность В-клеток может возникать как во время их развития, так и после антигенной стимуляции во вторичных лимфоидных тканях.
Аутореактивные В-клетки могут делетироваться или становиться анергичными в зависимости от аффинности В-клеточного рецептора и природы антигена. Индукция толерантности к собственным антигенам может приводить либо к делеции клеток, либо к их анергии. Эти В-клетки имеют короткую продолжительность жизни и, можно сказать, обречены на гибель обычно еще до поступления в периферические лимфоидные ткани. В периферических лимфоидных тканях аутореактивные В-лимфоциты не делетируются, подвергаясь воздействию растворимых антигенов, а переходят в состояние анергии. Одно лишь связывание ТкР без сопутствующей костимуляции. ведет к анергии.
Иммунодефицитные состояния
Как в любой системе организма, так и в иммунной системе могут развиваться патологические процессы. Выделяют четыре типа иммунопатологических процессов:
1 – иммунная недостаточность (иммунодефициты) развивается в результате дефектов развития или в результате действия повреждающих факторов на иммунную систему;
2 – гиперчувствительность или изменение реактивности основной формой которой является аллергия;
3 – аутоиммунная патология;
4 – опухоли иммунной системы, прежде всего пролиферативные процессы.
Недостаточность и дисфункция иммунной системы
Нарушения функции иммунной системы могут проявляться в виде: 1. гиперфункции; 2) дисфункции и 3) гипофункции.
При гиперфункции иммунной системы создаются условия для развития аллергии.
Дисфункция иммунной системы может развиваться при понижении функции Т-лимфоцитов. Из-за дефицита Т-супрессоров может усиливаться функция В-лимфоцитов, что влечет за собой увеличенную выработку гуморальных антител, например, IgЕ, а это приводит к развитию аллергии.
Гипофункция иммунной системы встречается чаще всего. Заболевания, связанные с гипофункцией иммунной системы по этиологическому фактору разделяются на наследственные (иммунодефицитные) и приобретенные (иммунодепрессивные).
Иммунодефицитные заболевания
Иммунодефицнтные состояния (ИДС) - группа заболеваний, основой которых является иммунопатология, обусловленная дефектом одного или нескольких механизмов иммунного ответа.
Различают первичные (врожденные) и вторичные (приобретенные) иммунодефициты.
Наследственные или иммунодефицитные заболевания называются первичными.
Этиология из – генетические дефекты.
Классификация первичных ИДС
I. Недостаточность гуморального звена иммунной системы:
• Агаммаглобулинемия, болезнь Брутона.
• Дисгаммаглобулинемии - дефицит или избыток различных классов иммуноглобулинов.
П. Недостаточность клеточных иммунных реакций:
• Лимфоцитарная дисгенезия.
• Гипоплазия вилочковой железы (синдром Ди Джорджи).
III. Комбинированные ИДС (тяжелая комбинированная иммунологическая недостаточность - ТКИН):
• Швейцарский тип иммунодефицита.
• Наследственный алимфоцитоз, лимфоцитофтиз.
• Синдром "голых" лимфоцитов.
• ИДС с тимомой.
• Синдром Вискотта-Олдрича.
• Синдром Луи-Барр.
IV.Нарушения в системе интерлейкинов и кооперации клеток в иммунном ответе.
V. ИДС при наследственных аномалиях ответа.
VI.Недостаточность системы комплемента.
VII. Недостаточность фагоцитоза:
• Нарушения хемотаксиса, миграции и дегрануляции.
• Нарушение процессов переваривания (киллинга) микробов.
• Дефекты опсонизации и поглощения.
VIII. Патология местного иммунитета.
IX. Малые (минорные) или
компенсированные аномалии иммунной
системы.
Наследственные (иммунодефицитные) состояния
Иммунодефицитные заболевания, связанные с изменениями в системе Т-лимфоцитов.
Нарушение размножения Т-лимфоцитов может возникать в различные периоды их созревания.
Первичная недостаточность Т-клеток. Гипоплазия вилочковой железы (синдром Ди Джорджи). Заболевание развивается в результате нарушения эмбрионального развития вилочковой железы, что приводит к отсутствию Т-клеток. У таких больных возникают дефекты лица, пороки системы кровообращения, дефекты развития щитовидной и паращитовидных желез. Не развиваются иммунные реакции клеточного типа, что сопровождается развитием инфекций вирусной и грибковой этиологии.
Иммунодефицитные заболевания, связанные с изменениями в системе В-лимфоцитов
Классической формой В-иммунодефицита является гипогаммаглобулинемия Брутона – это сцепленное с Х-хромосомой заболевание, характеризующиеся отсутствием сывороточных иммуноглобулинов, полным отсутствием зрелых В-лимфоцитов в крови, селезенке, лимфоузлах, отсутствием плазматических клеток. Система Т-лимфоцитов и ее функции сохранены. Заболевание проявляется у мальчиков. Клинически гипогаммаглобулинемия Брутона характеризуется тяжелыми повторяющимися инфекционными заболеваниями, начинающимися с 8-9 месяцев, когда из крови ребенка начинают исчезать материнские иммуноглобулины. Основными возбудителями инфекции являются стафилококки, стрептококки, вызывающие воспаление коньюктивы глаз, бронхиты, отиты, воспаления легких и кожные инфекции.
Бывает поздняя гипоглобулинемия, которая развивается в 25-30 лет.
Комбинированные иммунодефицитные заболевания
с одновременным дефектом Т и В-лимфоцитов
Швейцарский тип иммунодефицита является наиболее тяжелой формой иммунодефицита, так как проявляется дефектом гуморального и клеточного иммунитета. Клинически заболевание проявляется уже в первые недели жизни ребенка и характеризуется уменьшением содержания лимфоцитов, гипогаммаглобулинемией. Дети с этим синдромом погибают в первый год жизни, так как не имеют защиты против всех форм вирусных, грибковых и бактериальных инфекций.
При иммунодефицитах наблюдается значительный рост опухолевых заболеваний; при дефицитах системы Т-лимфоцитов частота развития опухолей возрастает в 1000 раз. Недостаточность иммунной системы характеризуется увеличением аутоиммунных заболеваний.
Иммунный дефицит с тромбоцитопенией и экземой (синдром Вискотта-Олдрича)
Для этого синдрома характерна триада: тромбоцитопения, экзема и повышенная склонность к инфекционным заболеваниям. Наследуется рецессивно, передается с Х-хромосомой.
Клинически это заболевание проявляется очень рано. У детей имеются кожные кровоизлияния, в основном петехиальные, и кровавая диарея. В более поздний период появляются носовые кровотечения. Кровоизлияния бывают фатальными. В первые три месяца жизни появляется экзема, часто осложненная кровоизлияниями. Могут быть другие проявления аллергии с высокой эозинофилией. В первом полугодии жизни ребенка в течении болезни появляются тяжелые инфекции дыхательных путей, осложненная экзема, менингит, сепсис. С возрастом углубляется и отягощается иммунный дефицит. Наиболее частыми возбудителями инфекций являются пневмококки, которые вызывают рецидивирующие пневмонии, отиты, менингиты и сепсис. Эти заболевания возникают в раннем грудном возрасте. Когда уже поражается и клеточный иммунитет, заболевания могут вызываться грибками и вирусами.
Атаксия, телеангиэктазия (синдром Луи-Барра)
Синдром Луи-Барра – это комплексное заболевание иммунной, нервной и эндокринной систем, с частым поражением кожи и печени. Заболевание наследуется через патологический аутосомно-рецессивный ген.
Характерным симптомом болезни является прогрессирующая церебральная атаксия, которая появляется обычно в школьном возрасте у детей. В возрасте от трех до шести лет устанавливаются телеангиэктазии (изменения в сосудах). Чаще всего поражаются конъюнктивы (малые вены сильно расширены и извилисты). При этом кожа выглядит преждевременно постаревшей, и часто встречается поседение волос в период полового развития. У больных в 80 % случаев обнаруживается склонность к инфекциям, которые поражают в основном дыхательные пути.
Кроме основных симптомов, имеются также и эндокринологические отклонения (нарушения в половой сфере, низкий рост, непереносимость глюкозы, сахарный диабет, резистентный к инсулину) и нарушения печеночной функции. У больных имеется склонность к злокачественным заболеваниям лимфоретикулярного типа. При этом заболевании частой иммунологической аномалией является селективный дефицит IgА. Большинство больных имеют признаки нарушенного клеточного иммунитета.
Вторичные приобретенные иммунодефициты (иммунодепрессивные)
Вторичные (приобретенные) иммунодефицитные состояния - нарушения иммунной защиты организма, которые формируются в постнатальном периоде при воздействии на организм неблагоприятных факторов, непосредственно не связанных с генетическим аппаратом.
Этиологические факторы вторичных иммунодефицитных состояний:
1) инфекции (ВИЧ, ЦМВ, вирус Эпштейн-Барр, протозойные и глистные инвазии и др.);
2) акцидентальная инволюция тимуса у детей;
3) тимомегалия у детей;
4) возрастная недостаточность тимуса;
5) хирургическая атимия;
6) продолжительное стрессовое воздействие;
7) длительные неадекватные физические нагрузки на организм;
8) резкая смена условий жизни;
9) оперативное вмешательство, травмы;
10)патологические состояния, связанные с потерей белка (ожоговая болезнь);
11) экссудативные энтеропатии и др.;
12)патология обмена веществ (сахарный диабет, дефицит микроэлементов);
13)эндокринопатии (нарушение межсистемных связей гормональной-нервной-иммунной);
14)онкопатология;
15) проживание в экологически неблагоприятных условиях;
16)работа в условиях профвредностей;
17)нарушение питания;
18)физические факторы воздействия: СВЧ-облучение, ионизирующая радиация и т.д.
19)иммуносупрессивная терапия.
Вторичные иммунодефициты классифицируют по этиологическому фактору. Йегер выделял шесть основных видов факторов, которые могут привести к развитию вторичного иммунодефицита:
1. Заболевания иммунной системы:
- дефект В-звена иммунной системы (болезнь Вальденстрема, хронический лимфолейкоз, неходжкинские лимфомы);
- дефект Т-звена иммунной системы (саркоидоз, лимфогранулематоз).
2. Генерализованное поражение костного мозга (миелоз, миелофиброз).
3. Инфекционные заболевания:
- вирусные инфекции;
- бактериальные инфекции.
4. Нарушение обмена веществ и интоксикации:
- дефицит микроэлементов;
- потери белка;
- истощение;
- ожог;
- уремия;
- опухоли.
5. Экзогенные воздействия:
- облучение;
- лекарственные воздействия – иммуносупрессивные препараты, цистостатики, кортикостероиды, антилимфоцитарная сыворотка).
6. Иммунодефициты при старении.
Механизмы, обеспечивающие надежность функционирования иммунной системы. Проблему развития вторичных иммунодефицитных состояний следует рассматривать с позиции надежности функционирования иммунной системы. К числу таких механизмов следует отнести следующие:
1. Структурная организация иммунной системы, представленная центральными и периферическими органами, популяциями и субпопуляциями лимфоидных и макрофагальных клеток, тесно взаимодействующих между собой.
2. Внутрисистемная и межсистемная (в первую очередь нейроэндокринная) регуляция иммунного ответа.
3. Клонально-селекционный принцип специфического иммунного ответа и разнообразие репертуара иммуноглобулинов.
4. Механизмы репарации ДНК, обусловливающие восстановление клеточных структур.
5. Наличие субпопуляций клеток и цитокинов, выполняющих дублирующие функции.
Согласно структурной организации иммунной системы, теоретически возможны 5 основных синдромов вторичных иммунодефицитных состояний: нарушение функции моноцитов/макрофагов, Т-лимфоцитов, В-лимфоцитов, неспецифических факторов защиты, комбинированные нарушения.
Единой общепринятой классификации вторичных иммунодефицитных состояний на сегодня не существует. Классификацию, основанную на иммунопатогенезе и степени нарушения:
А) функциональные вторичные иммунодефицитные состояния;
Б) структурные вторичные иммунодефицитные состояния с преимущественным нарушением:
• Т-лимфоцитов;
• В-лимфоцитов;
• моноцитов/макрофагов;
• неспецифических факторов защиты;
• комбинированные формы.
Самым важным из вторичных иммунодефицитов является синдром приобретенного иммунодефицита (СПИД).
СПИД
Синдром приобретенного иммунодефицита – единственная самостоятельная нозологическая форма вторичного иммунодефицита. СПИД развивается в результате инфицирования вирусом иммунодефицита человека (ВИЧ).
Доказано, что поверхностный гликопротеин ВИЧ имеет высокое сродство к рецептору СD4. Это объясняет избирательное поражение вирусом Т-хелперов и макрофагов, которые имеют на своей поверхности этот рецептор. Соединяясь с рецептором, вирус внедряется в клетку. В результате изменяется геном вируса, что приводит к образованию провирусной ДНК, которая внедряется в геном клетки-хозяина, вирус начинает размножаться.
Главным событием в развитии СПИДа является поражение вирусом Т-хелперов, приводящее к их гибели. Гибель Т-хелперов, выполняющих главную регуляторную функцию в запуске реакций клеточного и гуморального специфического иммунитета и его неспецифических механизмов нарушает формирование иммунного ответа.
Для больных СПИДом характерно:
1. Снижение резистентности (устойчивости) к условно-патологическим инфекционным возбудителям, что обусловливает развитие инфекционных осложнений, особенно пневмонии.
2. Развитие грибковых поражений слизистых оболочек.
3. Развитие дисбактериоза кишечника.
4. Угнетение противоопухолевого иммунитета, что проявляется развитием характерных опухолей: саркомы Капоши (из эндотелиальной ткани); злокачественных лимфом (из лимфоидной ткани).
5. Поражение ЦНС, вызывающее неврологические нарушения.
Итак, иммунологическая недостаточность может развиваться как в результате генетических дефектов, затрагивающих формирование и функционирование иммунной системы (первичные иммунодефициты), так и под влиянием внешних и внутренних факторов, действующих на сформировавшийся организм (вторичные и иммунодефицитные состояния).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.