
Контрольная работа
Учебная дисциплина: ОУД.10 Естествознание
Раздел: Химия. Общая и неорганическая химия
Тема: Периодический закон и Периодическая система химических элементов Д.И.Менделеева
1 вариант
1. Рассмотрите фрагмент периодической таблицы в том виде, в котором ее создал Д.И. Менделеев.
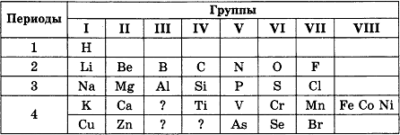
Какой элемент должен стоять за цинком? Какие элементы будут обладать свойствами, сходными с этим элементом? Как изменяются свойства элементов-аналогов в главной подгруппе?
2. Покажите на примере одного периода, что Периодический закон, как и любой закон природы, выполняет объясняющую функцию.
3. Расположите элементы в ряд по увеличению электроотрицательности: Р, Cl, Na, Al, S, Mg, Si. Укажите причину увеличения электроотрицательности.
4. Расположите гидроксиды в порядке увеличения их основных свойств: LiOH, RbOH, NaOH, CsOH, КОН.
2 вариант
1. Рассмотрите фрагмент Периодической таблицы в том виде, в котором ее создал Д.И. Менделеев.

Какой элемент должен стоять перед мышьяком? Какие элементы будут обладать свойствами, сходными с этим элементом? Как изменяются свойства оксидов элементов-аналогов в главной подгруппе?
2. Покажите на примере одной подгруппы, что Периодический закон, как и любой закон природы, выполняет объясняющую функцию.
3. Расположите элементы в ряд по увеличению металлических свойств: Bа, Са, Sr, Ве, Ra, Mg. Укажите причину увеличения металлических свойств.
4. Расположите оксиды в порядке увеличения их кислотных свойств: Р2O5, SO3, N20, Аl2O3, Cl2O7, MgO.
1. Если следовать принципу расположения элементов по увеличению значения Мr, то, после открытия инертных газов, фрагмент периодической таблицы выглядел бы так:
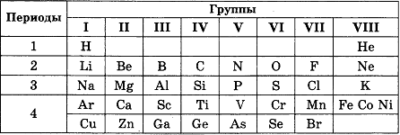
Какие элементы следует поменять местами? Почему? Какие элементы будут обладать свойствами, сходными с каждым из этих элементов? Как будут изменяться свойства элементов в периоде, атомы элементов в котором содержат три энергетических уровня?
2. Астат — радиоактивный элемент, полученный искусственно, и короткоживущий. Экспериментально изучать свойства астата проблематично. Покажите на примере астата, что Периодический закон, как и любой закон природы, выполняет предсказательную функцию.
3. Расположите элементы в ряд по увеличению окислительных свойств: О, Li, С, F, Ве, N, В. Укажите причину увеличения окислительных свойств.
4. Расположите оксиды в порядке увеличения их основных свойств: Аl2O3, Тl2O3, В2O3, Ga2O3, In2O3.
Ответы на контрольную работу по ОУД.10 Естествознание,
Раздел: Химия. Общая неорганическая химия, на тему: Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Вариант 1.
1.Элемент — галлий. Сходные свойства имеют: В,
Al, In, Tl. С увеличением порядкового номера в подгруппе увеличиваются радиус
атома, металлические и восстановительные свойства. Уменьшаются неметаллические
свойства, окислительные свойства и электроотрицательность.
2.Например: неметаллические свойства элементов увеличиваются
по периоду, так как увеличивается число электронов на внешнем энергетическом
уровне.
3. Na, Mg, Al, Si, Р,
S, Cl.
4. LiOH, NaOH, КОН, RbOH, CsOH.
Вариант 2.
1.Элемент — германий. Сходные свойства имеют С,
Si, Sn, Рb. Кислотные свойства оксидов ослабевают.
2.Например: металлические свойства элементов в
главных подгруппах возрастают, так как увеличивается радиус атомов.
3. Ве, Mg, Са, Sr, Bа, Ra.
4.В порядке увеличения кислотных свойств оксиды
располагаются так:
Na2O, MgO, Аl2O3, Р2O5, SO3, Сl2O7.
Вариант 3.
1.Поменять местами следует К и Ar. Аналоги К:
Li, Na, Rb, Cs, Fr. Аналоги Ar: Не, Ne, Kr, Хе, Rn. По 3-му периоду возрастают
неметаллические, окислительные свойства и электроотрицательность. Уменьшаются
металлические, восстановительные свойства и радиус атома.
2.Астат — аналог элементов F, Cl, Br, I, так как
он содержит 7 электронов на внешнем энергетическом уровне. Степени окисления:
-1 и +7. Формула кислотного оксида: At2O7, гидроксида: HAtO4 ,
летучего водородного соединения: НАt, в растворе является кислотой.
3. Li, Ве, В, С, N, О, F.
4. В2O3, Аl2O3, Ga2O3 , In2O3, Тl2O3.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.