
Итоговая контрольная работа за курс химии 8 класса. Вариант 5.
Задание 1. К каждому из заданий №№ 1 – 10 даны 4 варианта ответа, из которых только один правильный.
1. В атоме химического элемента, расположенном в третьем периоде, VII A группе общее число электронов равно
1) 3 2) 7 3) 17 4) 35
2. Химический элемент, заряд ядра которого + 16
1) кислород 2) сера 3) алюминий 4) хлор
3. Химический элемент, в ядре атома которого содержится 15 протонов:
1) азот 2) кислород 3) фосфор 4) сера
4. Число электронных слоев и число электронов во внешнем слое в атоме F равны соответственно:
1) 9 и 7 2) 7 и 2 3) 3 и 7 4) 2 и 7
5. Степень окисления + 3 азот проявляет в соединении
1) N2O5 2) Ca(NO3)2 3) N2O3 4) NO2
6. Степень окисления хлора в соединениях KСlO3 и CaCl2 равна соответственно
1) +5 и – 2 2) +6 и – 1 3) +3 и -1 4) +5 и -1
7. На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата железа(II)?
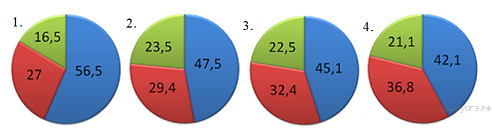
8. Наибольшее количество катионов образуется при диссоциации 1моль
1) K2CO3 2) Na3PO4 3) AlCl3 4) Fe(NO3)3
9. Наибольшее число ионов образуется при диссоциации 1 моль
1) Na2SO4 2)CuSO4 3) Cr2(SO4)3 4) AlCl3
10. Выберите верную запись правой части уравнения диссоциации карбоната натрия в водном растворе
1) = Na+ + HCO3 - 2) = 2Na+ + CO32- 3) = Na+ + CO32 - 4) = 2Na+ + 2CO32-
Задание 2. При выполнении заданий к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
2.1. Каждый тип реакции иллюстрирован одним уравнением.
|
Тип химической реакции |
Уравнение реакции |
|
А) реакция соединения |
1) C+ CuO = Cu + CO |
|
Б) реакция разложения |
2) 2FeCl2 + Cl2 = 2FeCl3 |
|
В) реакция замещения |
3) 2 Fe(OH)3 = Fe2O3 + 3H2O |
|
Г) реакция обмена |
4) Na2CO3 + BaCl2 = 2NaCl + BaCO3 |
2.2. Каждый тип связи иллюстрирован более чем одним примером веществ
|
Тип химической связи |
вещества |
|
А) ковалентная неполярная |
1. CaCl2 |
|
Б) ковалентная полярная |
2. S8 |
|
В) ионная |
3. HBr |
|
Г) металлическая |
4. BaBr2 |
|
|
5. N2O |
|
|
6. Fe |
|
|
7. KH |
|
|
8. MgO |
|
|
9. Li2O |
|
|
10. O2 |
|
|
11. PCl5 |
|
|
12. Ag |
2.3. Каждая группа веществ представлена одним или несколькими представителями
|
Класс веществ |
вещества |
|
А) основные оксиды |
1. Na2O |
|
Б) кислотные оксиды |
2. Li2O |
|
В) основания (нерастворимые гидроксиды) |
3. Fe(OH)2 |
|
Г) щелочи (растворимые гидроксиды) |
4. MgO |
|
Д) кислоты |
5. H2SO3 |
|
Е) соли |
6. FeSO4 |
|
|
7. KOH |
|
|
8. Ba(NO3)2 |
|
|
9. AgCl |
|
|
10. Na2CO3 |
|
|
11. SO2 |
|
|
12. H2SiO3 |
Задание 3. Осуществить цепочку превращений. Представить 2, 3 уравнения в ионном виде (с позиции ТЭД)
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al
Задание 4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой приведена. Определите окислитель и восстановитель.
Cl2 + KOH → KClO + KCl + H2O
Задание 5. Вычислите массу осадка, образующегося при взаимодействии 200 г 12,25%-го раствора серной кислоты с раствором нитрата бария.
Итоговая контрольная работа за курс химии 8 класса. Вариант 6.
Задание 1. К каждому из заданий №№ 1 – 10 даны 4 варианта ответа, из которых только один правильный.
1. В атоме химического элемента, расположенном в третьем периоде, II A группе общее число электронов равно
1) 3 2) 2 3) 24 4) 12
2. Химический элемент, заряд ядра которого + 14
1) азот 2) кремний 3) литий 4) алюминий
3. Химический элемент, в ядре атома которого содержится 9 протонов:
1) бериллий 2) калий 3) фтор 4) неон
4. Число электронных слоев и число электронов во внешнем слое в атоме С равны соответственно:
1) 2 и 6 2) 2 и 4 3) 4 и 2 4) 3 и 4
5. Степень окисления + 7 хлор проявляет в соединении
1) Cl2O 2) CaCl2 3) HClO4 4) KClO3
6. Степень окисления серы в соединениях Li2SO3 и Na2S равна соответственно
1) +6 и – 2 2) +4 и – 1 3) -2 и +6 4) +4 и -2
7. На какой диаграмме распределение массовых долей элементов соответствует количественному составу силиката кальция?
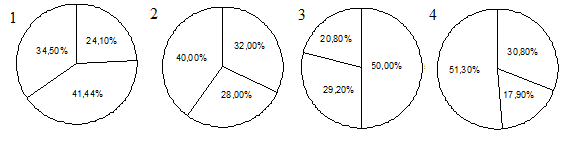
8. Наименьшее количество катионов образуется при диссоциации 1моль
1) K3PO4 2) NaCl 3) Li2SiO3 4) H2S
9. Наибольшее число ионов образуется при диссоциации 1 моль
1) FeCl3 2) Al2(SO4)3 3) Na2SO3 4) H2SO4
10. Выберите верную запись правой части уравнения диссоциации нитрата алюминия в водном растворе
2) = Al3+ + NO3 - 2) = Al3+ + NO2- 3) = Al3+ + 3 NO3 - 4) = 3 Al3+ + NO3-
Задание 2. При выполнении заданий к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
2.1. Каждый тип реакции иллюстрирован одним уравнением.
|
Тип химической реакции |
Уравнение реакции |
|
А) реакция соединения |
1) 2 Fe(OH)3 + 6 HCl= 2FeCl3 + 3H2O |
|
Б) реакция разложения |
2) Mg(NO3)2 = MgO+ NO2 + O2 |
|
В) реакция замещения |
3) SO2+ CaO = CaSO3 |
|
Г) реакция обмена |
4) Fe + H2SO4= H2 + FeSO4 |
2.2. Каждый тип связи иллюстрирован более чем одним примером веществ
|
Тип химической связи |
вещества |
|
А) ковалентная неполярная |
1. AlCl3 |
|
Б) ковалентная полярная |
2. S6 |
|
В) ионная |
3. Na2S |
|
Г) металлическая |
4. BaO |
|
|
5. Al |
|
|
6. H2S |
|
|
7. KBr |
|
|
8. Cu |
|
|
9. Ag2O |
|
|
10. O3 |
|
|
11. P2O5 |
|
|
12. N2O |
2.3. Каждая группа веществ представлена одним или несколькими представителями
|
Класс веществ |
вещества |
|
А) основные оксиды |
1. CuO |
|
Б) кислотные оксиды |
2. Li2O |
|
В) основания (нерастворимые гидроксиды) |
3. FeCl3 |
|
Г) щелочи (растворимые гидроксиды) |
4. Ba(OH)2 |
|
Д) кислоты |
5. H2SO3 |
|
Е) соли |
6. NaOH |
|
|
7. Fe(OH)3 |
|
|
8. Ba(NO3)2 |
|
|
9. Mg(OH)2 |
|
|
10. K2SiO3 |
|
|
11. SO3 |
|
|
12. HCl |
Задание 3. Осуществить цепочку превращений. Представить 2, 3 уравнения в ионном виде (с позиции ТЭД)
Cr→ Cr2O3 → Cr(NO3)3 → Cr(OH)3 → Cr2O3 → Cr
Задание 4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой приведена. Определите окислитель и восстановитель.
NO + KClO + KOH → KNO3 + KCl + H2O
Задание 5. Вычислите массу осадка, образующегося при взаимодействии 400 г 8,35%-го раствора иодида калия с избытком раствора нитрата свинца (II).
Итоговая контрольная работа за курс химии 8 класса. Вариант 7.
Задание 1. К каждому из заданий №№ 1 – 10 даны 4 варианта ответа, из которых только один правильный.
1. В атоме химического элемента, расположенном во втором периоде, IIIA группе общее число электронов равно
1) 3 2) 2 3) 11 4) 5
2. Химический элемент, заряд ядра которого + 19
1) фтор 2) неон 3) калий 4) кальций
3. Химический элемент, в ядре атома которого содержится 4 протона:
1) бериллий 2) гелий 3) калий 4) углерод
4. Число электронных слоев и число электронов во внешнем слое в атоме Са равны соответственно:
2) 2 и 2 2) 2 и 4 3) 4 и 2 4) 5 и 2
5. Степень окисления + 1 хлор проявляет в соединении
1) HClO4 2) MgCl2 3) HClO 4) KClO3
6. Степень окисления азота в соединениях NH3 и HNO3 равна соответственно
1) +5 и – 3 2) +3 и +5 3) -3 и -5 4) -3 и +5
7. На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата меди (II)?
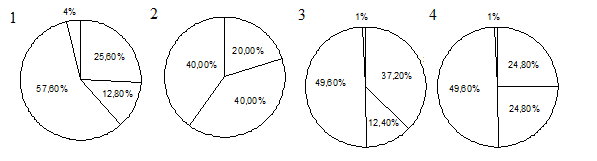
8. Наибольшее количество анионов образуется при диссоциации 1моль
1) K3PO4 2) FeCl3 3) K2SO3 4) Ba(NO3)2
9. Наибольшее число катионов образуется при диссоциации 1 моль
1) FeCl3 2) Al2(SO4)3 3) H2SO4 4) H3PO4
10. Выберите верную запись правой части уравнения диссоциации сульфата алюминия в водном растворе
3) = Al3+ + SO4 2- 2) = 2Al3+ + 3 SO32- 3) = Al3+ + 3 HSO4 - 4) = 2Al3+ + 3 SO42-
Задание 2. При выполнении заданий к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
2.1. Каждый тип реакции иллюстрирован одним уравнением.
|
Тип химической реакции |
Уравнение реакции |
|
А) реакция соединения |
1) 2КNО3 = 2КNО2 + О2 |
|
Б) реакция разложения |
2) SO3+ H2O = H2SO4 |
|
В) реакция замещения |
3) Ca(OH)2 + 2 HCl= CaCl2 + 2H2O |
|
Г) реакция обмена |
4) Fe2O3 + Al= Fe + Al2O3 |
2.2. Каждый тип связи иллюстрирован более чем одним примером веществ
|
Тип химической связи |
вещества |
|
А) ковалентная неполярная |
1. Cl2 |
|
Б) ковалентная полярная |
2. H2S |
|
В) ионная |
3. N2O5 |
|
Г) металлическая |
4. CaO |
|
|
5. Ca |
|
|
6. SO2 |
|
|
7. Br2 |
|
|
8. CuO |
|
|
9. Cl2O |
|
|
10. Zn |
|
|
11. PH3 |
|
|
12. Li2S |
2.3. Каждая группа веществ представлена одним или несколькими представителями
|
Класс веществ |
вещества |
|
А) основные оксиды |
1. Ca(NO3)2 |
|
Б) кислотные оксиды |
2. LiOH |
|
В) основания (нерастворимые гидроксиды) |
3. Mg(OH)2 |
|
Г) щелочи (растворимые гидроксиды) |
4. HBr |
|
Д) кислоты |
5. H2SO4 |
|
Е) соли |
6. KOH |
|
|
7. BaO |
|
|
8. Fe2(SO4)3 |
|
|
9. Cu(OH)2 |
|
|
10. K2CO3 |
|
|
11. SO2 |
|
|
12. Li2O |
Задание 3. Осуществить цепочку превращений. Представить 2, 3 уравнения в ионном виде (с позиции ТЭД)
Сa→ CaO → Ca(NO3)2 → Ca(OH)2 → CaO → CaCl2
Задание 4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой приведена. Определите окислитель и восстановитель.
NaMnO4 + NaOH → Na2MnO4 + O2 + H2O
Задание 5. Вычислите массу осадка, образующегося при взаимодействии 34,2 г 5 %-го раствора гидроксида бария с избытком раствора карбоната калия.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.