
Основы термодинамики
Цель: ввести основные понятия термодинамики; сформулировать начала термодинамики; вычислить внутреннюю энергию, теплоемкость и работу идеального газа в различных процессах; рассмотреть круговые процессы и вычислить их КПД.
Основные понятия:
Термодинамическая система – физическая система, состоящая из большого числа частиц, которые совершают тепловое движение и взаимодействуют между собой.
Термодинамический процесс – переход системы из начального состояния в конечное через последовательность промежуточных состояний.
Теплоемкость – количество теплоты, затрачиваемое для повышения температуры тела на один кельвин.
Обратимый процесс – процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния.
Парообразование – явление перехода вещества в пар называется.
Испарение и кипение – формы парообразования.
Конденсация – явление перехода пара в жидкое состояние.
Динамическое равновесие пара и жидкости – состояние, при котором за одно и то же время испаряется и конденсируется одинаковое число молекул пара.
Плавление – переход вещества из твердого состояния в жидкое.
Кристаллизация – переход вещества из жидкого состояния в твердое кристаллическое.
8.1. Теплоемкость.
При сообщении системе
теплоты Q ее температура изменяется на ![]() .
Величина
.
Величина
![]()
называется теплоемкостью. Теплоемкость измеряется количеством теплоты, затрачиваемым для повышения температуры тела на один кельвин.
Нагревая тела с одинаковыми массами, но состоящие из различных веществ, можно обнаружить, что для повышения их температуры на 1 К требуются различные количества теплоты; следовательно, теплоемкость тела зависит от его природы.
Теплоемкость зависит, очевидно, от массы тела. Теплоемкость, отнесенная к массе тела, называется удельной
![]() .
.
Зная теплоемкость вещества, можно определить количество теплоты, необходимое для нагревания тела массой m от температуры T1 до температуры T2:
![]() .
.
Теплоемкость зависит от условий, в которых телу сообщается теплота и изменяется его температура. Например, если газу сообщается количество теплоты DQ и при этом газ расширяется, совершая работу, то его температура поднимается меньше, чем если бы при сообщении теплоты DQ газ не расширился. Этот пример показывает, что выражение для теплоемкости не является определенным и может быть равным любому значению. Для придания теплоемкости определенного значения необходимо указать условия, о которых идет речь. Эти условия обозначаются в виде индексов у величин, входящих в выражение для теплоемкости.
Теплоемкость при постоянном объеме определяется как
![]() .
.
В термодинамике используется также теплоемкость при постоянном давлении, но выражение для нее приводить здесь не будем.
Насыщенный пар – пар, находящийся в динамическом равновесии с жидкостью.
Абсолютная и относительная влажность воздуха – физические величины, показывающие количество водяных паров в воздухе.
Точка росы – это температура, при которой пар, находящийся в воздухе, становится насыщенным.
8.2. Испарение.
Молекулы газов и жидкостей хотя и малы по размерам, но имеют конечные размеры и определенную форму и между ними существуют довольно значительные силы взаимодействия. В этом состоит главное отличие реальных газов и жидкостей от идеальных, как упрощенной модели реальных объектов.
При изучении идеальных газов отмечалось, что многие его свойства не зависят от природы газа. Однако чем ниже температура и больше давление, тем заметнее зависимость свойств газа от его природы. Газ в таких условиях называют паром, тем самым указывая, что он образовался из определенной жидкости.
Явление перехода вещества в пар называется парообразованием. В природе парообразование происходит в виде испарения и кипения.
Парообразование с открытой поверхности жидкости называется испарением.
Испаряются не только жидкости, но и твердые тела. Испарение твердых тел называется сублимацией.
Рассмотрим процесс испарения жидкостей. Так же как диффузия, испарение происходит вследствие непрерывного хаотического движения молекул жидкости. Всякая молекула, движущаяся из глубины жидкости к ее поверхности, испытывает в поверхностном слое действие силы, препятствующей вырыванию молекулы с поверхности жидкости. Чтобы пройти сквозь поверхностный слой, молекула должна обладать достаточной кинетической энергией для совершения работы выхода с поверхности жидкости. Скорости молекул жидкости, как и молекул газа, различны. Жидкость покидают наиболее «быстрые» молекулы, вследствие чего средняя кинетическая энергия оставшихся молекул уменьшается, что ведет к понижению температуры жидкости. Для поддержания постоянной температуры жидкости ей необходимо сообщать энергию извне, например, в виде теплоты. Количество теплоты Q, необходимое для превращения в пар 1 кг жидкости при постоянной температуре, называется удельной теплотой парообразования:
![]() .
.
В СИ удельная теплота парообразования выражается в джоулях на килограмм (Дж/кг).
После того как молекула жидкости переместилась от границы поверхностного слоя на расстояние, большее радиуса действия молекулярных сил жидкости, она становится молекулой пара. Молекулярные силы действуют на сравнительно коротких расстояниях (порядка 10 нм).
8.3. Конденсация.
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называют конденсацией. При конденсации пара некоторой массы выделяется столько энергии, сколько затрачивается при испарении жидкости такой же массы. Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
Если жидкость находится в открытом сосуде, то молекул испаряется больше, чем конденсируется, и масса жидкости уменьшается.
Следует обратить внимание, что процесс парообразования связан с увеличением внутренней энергии вещества, а процесс конденсации – с уменьшением ее.
Следовательно, конденсация и парообразование происходят только в процессе обмена энергией между окружающей средой и веществом.
8.4. Кипение.
Испарение жидкости происходит с ее свободной поверхности при любой температуре. Чем выше температура, тем быстрее идет испарение.
Кипением называется процесс бурного парообразования не только с поверхности жидкости, но и по всему ее объему. Для этого жидкость должна быть нагрета до достаточно высокой температуры. При кипении важную роль играют пузырьки газа, имеющиеся в жидкости. Такие пузырьки образуются на границе жидкости и твердого тела. Пузырьки заполнены насыщенным паром жидкости.
При повышении температуры жидкости давление пара в пузырьке возрастает и его объем увеличивается. Выталкивающая сила, действующая на пузырек по закону Архимеда, возрастает с ростом его объема. При определенных условиях она станет больше силы сцепления между пузырьками и твердой стенкой. В этом случае пузырек отрывается от стенки, всплывает и лопается, выбрасывая пар.
Кипение жидкости возможно в том случае, если в ней имеются пузырьки достаточно больших размеров (для воды порядка миллиметра). Кипение начнется в том случае, когда давление насыщенного пара станет равно внешнему давлению над поверхностью жидкости.
Давление насыщенного пара определяется только температурой жидкости. Точка кипения зависит от внешнего давления – с ростом внешнего давления растет и точка кипения. Точка кипения воды при разных давлениях может быть найдена с помощью специальной таблицы.
Количество теплоты, необходимой для превращения жидкости в пар, нагретой до температуры кипения, определяется по формуле
![]() ,
,
где r – удельная теплота парообразования, m – масса жидкости, превращенной в пар.
8.5. Плавление и кристаллизация
Вещество существует в твердом кристаллическом состоянии при определенных значениях давления и температуры. В этом состоянии вещество находится до тех пор, пока кинетической энергии атомов недостаточно, чтобы преодолеть силы взаимного притяжения. Эти силы удерживают атомы на некотором расстоянии друг относительно друга, не позволяя им перемещаться. При этом атом колеблется около положения своего равновесия. При нагревании твердого тела кинетическая энергия атомов (или молекул) возрастает. При этом амплитуды колебаний могут стать настолько большими, что уже будут сравнимы с периодом решетки, произойдет нарушение дальнего порядка, кристаллическая решетка начнет разрушаться. При дальнейшем увеличении температуры происходит плавление твердых тел, т. е. переход вещества из твердого состояния в жидкое. Этот процесс изотермический. При плавлении температура тела остается постоянной. Вся подводимая извне теплота идет на разрушение кристалла. После разрушения кристалла и образования жидкости подводимая извне теплота идет на нагревание жидкости.
При плавлении кристаллическое тело находится одновременно и в твердом, и в жидком состояниях.
Температура плавления зависит от рода кристаллического тела. Для большинства кристаллических тел она повышается при увеличении атмосферного давления.
При плавлении происходит уменьшение плотности (исключением являются, например, висмут и лед – их плотность увеличивается при плавлении).
Отношение количества теплоты Q, необходимого для того чтобы перевести твердое тело в жидкость при температуре плавления, к массе этот тела называют удельной теплотой плавления:
![]() .
.
В СИ удельная теплота плавления выражается в джоулях на килограмм (Дж/кг). Из последней формулы следует
![]() .
.
При плавлении увеличивается внутренняя энергия тела.
Если расплав прекратить нагревать, а потом охладить до температуры плавления, то начнется кристаллизация – переход вещества из жидкого состояния в твердое кристаллическое. Этот процесс сопровождается выделением теплоты кристаллизации, которая равна теплоте плавления. Во время этого процесса происходит упорядочение движения молекул жидкости, в результате они начинают колебаться около узлов кристаллической решетки. Процесс кристаллизации изотермический. Температура кристаллизации и удельная теплота кристаллизации равны соответственно температуре плавления и удельной теплоте плавления для одного и того же тела при одном и том же давлении. Когда кристаллизация закончится, тело начнет охлаждаться.
У некоторых твердых тел, таких, например, как нафталин, иод, камфора, твердая углекислота (сухой лед), наблюдается переход сразу из твердого состояния в газообразное, т. е. происходит испарение. Переход тела из твердого состояния в газообразное, минуя жидкое, называют сублимацией. Обратный процесс называют десублимацией. Все твердые тела сублимируют, но процесс сублимации у разных тел протекает с различной скоростью. При комнатной температуре скорость протекания этого процесса настолько мала, что сублимацию практически нельзя обнаружить.
Процесс сублимации протекает как при нагревании твердого тела, так и без подвода теплоты извне. Во втором случае происходит перераспределение внутренней энергии между твердым и газообразным состояниями. При сублимации тело охлаждается, так как его покидают наиболее быстрые молекулы, обладающие кинетической энергией, которая достаточна для преодоления молекулярного притяжения и отрыва молекул от поверхности твердого тела. Средняя кинетическая энергия оставшихся молекул уменьшается; следовательно, тело охлаждается. Для того чтобы температура сублимирующего тела оставалась постоянной, к нему извне нужно подводить теплоту.
Вариант 1
1. Вместимость сосуда 20 л в него влили горячую воду при температуре 80 0С и холодную воду при температуре 5 0С. Какие объемы той и другой воды надо взять, чтобы установилась температура 60 0С.
2. Какое количество теплоты выделится при конденсации 500 г водяного пара, имеющего температуру 1000С, и охлаждения образовавшейся воды до температуры 50 0С.
3. Какое количество теплоты потребуется, чтобы расплавить 300 г льда, взятого при температуре -10 0С, а затем полученную воду нагреть до 30 0С?
4. Какое количество теплоты потребуется для плавления 25 кг алюминия, взятого при температуре 45 0С?
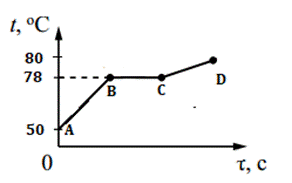
5. На рисунке изображен график изменения температуры 400 г свинца. Каким процессам соответствуют участки графика АВ, ВС, СD? Рассчитайте количество теплоты для процесса АD.
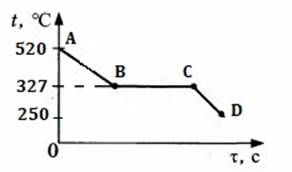
Вариант 2
1. В сосуд влили 300 мл горячей воды при температуре 95 0С и 200 мл холодной воды при температуре 20 0С. Какая температура установится в смеси?
2. Какое количество теплоты необходимо затратить, чтобы 200 г воды с начальной температурой 10 0С довести до кипения и превратить ее в пар?
3. Какое количество теплоты потребуется, чтобы расплавить 500 г льда, взятого при температуре -20 0С, а затем полученную воду нагреть до 50 0С?
4. Какое количество теплоты потребуется для плавления 30 кг меди, взятой при температуре 80 0С?
5. На рисунке изображен график изменения температуры 100 г ртути. Каким процессам соответствуют участки графика АВ, ВС, СD? Рассчитайте количество теплоты для процесса АD.
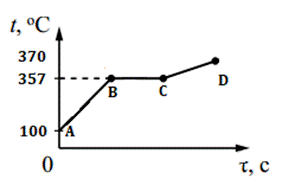
Вариант 3
1. Вместимость сосуда 10 л в него влили горячую воду при температуре 90 0С и холодную воду при температуре 10 0С. Какие объемы той и другой воды надо взять, чтобы установилась температура 40 0С.
2. Какое количество теплоты выделится при конденсации 250 г водяного пара, имеющего температуру 1000С, и охлаждения образовавшейся воды до температуры 30 0С.
3. Какое количество теплоты потребуется, чтобы расплавить 400 г льда, взятого при температуре -15 0С, а затем полученную воду нагреть до 70 0С?
4. Какое количество теплоты потребуется для плавления 40 кг олова, взятого при температуре 100 0С?
5. На рисунке изображен график изменения температуры 100 г серебра. Каким процессам соответствуют участки графика АВ, ВС, СD? Рассчитайте количество теплоты для процесса АD.
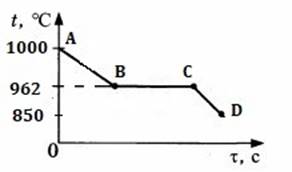
Вариант 4
1. В сосуд влили 500 мл горячей воды при температуре 80 0С и 100 мл холодной воды при температуре 15 0С. Какая температура установится в смеси?
2. Какое количество теплоты необходимо затратить, чтобы 350 г воды с начальной температурой 60 0С довести до кипения и превратить ее в пар?
3. Какое количество теплоты потребуется, чтобы расплавить 150 г льда, взятого при температуре -3 0С, а затем полученную воду нагреть до 25 0С?
4. Какое количество теплоты потребуется для плавления 50 кг чугуна, взятой при температуре 1000 0С?
5. На рисунке изображен график изменения температуры 200 г золота. Каким процессам соответствуют участки графика АВ, ВС, СD? Рассчитайте количество теплоты для процесса АD.
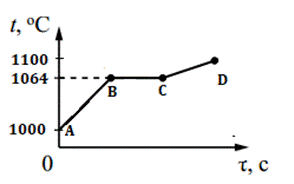
Вариант 5
1. Вместимость сосуда 50 л в него влили горячую воду при температуре 85 0С и холодную воду при температуре 35 0С. Какие объемы той и другой воды надо взять, чтобы установилась температура 65 0С.
2. Какое количество теплоты выделится при конденсации 300 г водяного пара, имеющего температуру 1000С, и охлаждения образовавшейся воды до температуры 63 0С.
3. Какое количество теплоты потребуется, чтобы расплавить 350 г льда, взятого при температуре -12 0С, а затем полученную воду нагреть до 67 0С?
4. Какое количество теплоты потребуется для плавления 30 кг магния, взятого при температуре 350 0С?
5. На рисунке изображен график изменения температуры 250 г цинка. Каким процессам соответствуют участки графика АВ, ВС, СD? Рассчитайте количество теплоты для процесса АD.
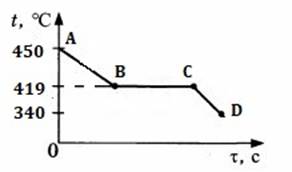
Вариант 6
1. В сосуд влили 350 мл горячей воды при температуре 78 0С и 550 мл холодной воды при температуре 23 0С. Какая температура установится в смеси?
2. Какое количество теплоты необходимо затратить, чтобы 230 г воды с начальной температурой 46 0С довести до кипения и превратить ее в пар?
3. Какое количество теплоты потребуется, чтобы расплавить 300 г льда, взятого при температуре -20 0С, а затем полученную воду нагреть до 70 0С?
4. Какое количество теплоты потребуется для плавления 25 кг латуни, взятой при температуре 650 0С?
5. На рисунке изображен график изменения температуры 300 г спирта. Каким процессам соответствуют участки графика АВ, ВС, СD? Рассчитайте количество теплоты для процесса АD.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.