
Тема 5. Коррозия и защита металлов
5.1. Определение и классификация коррозийных процессов
Коррозия – это разрушение металла в результате его физико–химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Коррозия приводит к большим потерям. Безвозвратные потери металлов от коррозии составляют 15% от ежегодного их выпуска.
Однако во многих случаях косвенные убытки от коррозии могут значительно превышать прямые потери за счет растворения металла. Замена прокорродировавшего котла или конденсатора на большой теплоэлектростанции может нанести энергосистеме существенный ущерб. Кроме того, к убыткам от коррозии можно отнести также стоимость потерянного продукта, например масла, газа, воды, через систему с прокорродированными трубами или антифриза через прокорродировавший радиатор.
В целом потери народного хозяйства от коррозии исчисляются многими миллиардами рублей ежегодно. Изучение коррозии и разработка методов защиты металлов от неё представляют теоретический интерес и имеют большое народнохозяйственное значение. По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Среда в которой металл подвергается коррозии (коррозирует) называется коррозионной или агрессивной средой.
В случае с металлами, говоря об их коррозии, имеют ввиду нежелательный процесс взаимодействия металла со средой. Физико-химическая сущность изменений, которые претерпевает металл при коррозии является окисление металла.
Любой коррозионный процесс является многостадийным:
1) Необходим подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
2) Взаимодействие среды с металлом.
3) Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Известно что большинство металлов ( кроме Ag,Pt,Cu,Au) встречаются в природе в ионном состоянии: оксиды, сульфиды, карбонаты и др., называемые обычно руды металлов.
Ионное состояние более выгодно, оно характеризуется более меньшей внутренней энергией. Это заметно при получение металлов из руд и их коррозии. Поглощенная энергия при восстановлении металла из соединений свидетельствует о том , что свободный металл обладает более высокой энергией, чем металлическое соединение. Это приводит к тому, что металл находящийся в контакте с коррозионно-активной средой стремится перейти в энергетически выгодное состояние с меньшим запасом энергии.
То есть можно сказать, что первопричиной коррозии металла является термодинамическая неустойчивость металлов в заданной среде.
Классификация коррозионных процессов.
1. По механизму процесса различают химическую и электрохимическую коррозию металла.
Химическая коррозия - это взаимодействие металлов с коррозионной средой, при котором окисляется металл и восстанавливается окислительные компоненты коррозионной среды протекают в одном акте. Так протекает окисление большинства металлов в газовых средах содержащих окислитель (например, окисление в воздухе при повышении температуры)
Mg+ O -> MgO
4Al + 3O -> 2AlO
Электрохимическая коррозия - это взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительной компоненты среды происходит не водном акте, и их скорости зависят от электродного потенциала металла. По такому процессу протекают, например, взаимодействие металла с кислотами:
Zn + 2HCl -> Zn +2Cl +H
эта суммарная реакция состоит из двух актов:
Zn -> Zn + 2e
2H + 2e -> H
2. По характеру коррозионного разрушения.
Общая или сплошная коррозия при которой коррозирует вся поверхность металла. Она соответственно делится на равномерную (1а), не равномерную (1б) и избирательную (1в), при которой коррозионный процесс распространяется преимущественно по какой-либо структурной составляющей сплава.
Местная коррозия при которой коррозируют определенные участки металла:
а) коррозия язвами - коррозионные разрушения в виде отдельных средних и больших пятен (коррозия латуни в морской воде)
б) межкристаллическая коррозия при ней процесс коррозии распространяется по границе металл-сплав (алюминий сплавляется с хромоникелем) и другие виды коррозии.
3. По условиям протекания процесса.
а) Газовая коррозия - это коррозия в газовой среде при высоких температурах. (жидкий металл, при горячей прокатке, штамповке и др.)
б) Атмосферная коррозия - это коррозия металла в естественной атмосфере или атмосфере цеха (ржавление кровли, коррозия обшивки самолета).
в) Жидкостная коррозия - это коррозия в жидких средах: как в растворах электролитов, так и в растворах не электролитов.
г) Подземная коррозия - это коррозия металла в почве
д) Структурная коррозия - коррозия из-за структурной неоднородности металла.
е) Микробиологическая коррозия - результат действия бактерий
ж) Коррозия внешним током - воздействие внешнего источника тока (анодное или катодное заземление)
з) Коррозия блуждающими токами - прохождение тока по непредусмотренным путям по проекту.
и) Контактная коррозия - сопряжение разнородных электрохимических металлов в электропроводящей среде.
к) Коррозия под напряжением - одновременное воздействие коррозионной среды и механического напряжения.
Скорость коррозии выражают несколькими способами. Наиболее часто пользуются массовым и глубинным показателями коррозии. Первый из них даёт потерю массы (в граммах или килограммах) за единицу времени (секунду, час, сутки, год), отнесенную к единице площади (квадратный метр) испытуемого образца.
Глубинный показатель коррозии выражается уменьшением толщины металла в единицу времени.
5.2. Химическая коррозия
Наибольшее практическое значение имеет химическая коррозия в среде раскаленных газов, которая называется газовой коррозией.
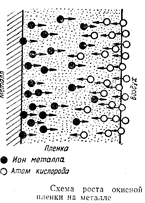
В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для дальнейшего продолжения коррозии необходимо, чтобы ионы металла или кислород (или оба одновременно) диффундировали через эту пленку. Обычно с поверхности раздела металл – оксид в направлении от металла к внешней поверхности пленки происходит диффузия ионов металла, а не атомов, так как ионы металлов по размерам меньше атомов.
Одновременно в этом же направлении должны перемещаться электроны. Ионы О2– имеют больший радиус, чем атомы, поэтому с поверхности раздела оксид – газ в глубь пленки двигаются не ионы, а атомы кислорода, которые в пленке ионизируются (О + 2е– = О2–) и, встречаясь с ионами металла, образуют оксиды.
Защитные свойства пленок зависит от соотношения между объёмами продуктов коррозии Vок и металла Vме, из которого они образовались:
Если Vок/ Vме<1, то образующаяся пленка не может быть сплошной и защищать металл от коррозии. Скорость роста пленки во времени у таких металлов остается постоянной.
Для металлов, у которых в результате химической коррозии получаются сплошные пленки (Vок/Vме>1), процесс коррозии будет тормозиться диффузией реагентов через пленку, и по мере утолщения пленки дальнейший рост её будет все время замедляться.
При этом пленка должна иметь некоторую оптимальную толщину, чтобы в достаточной степени тормозить встречную диффузию молекул агрессивного агента и ионов металла.
Скорость коррозии возрастает с увеличением температуры из–за повышения коэффициента диффузии и изменения защитных свойств пленки. Быстрое разрушение защитной пленки часто вызывают резкие температурные изменения. Это связано прежде всего с различными коэффициентами линейного расширения металла и пленки.
До сих пор рассматривалось образование, устойчивость и разрушение защитных оксидных пленок, возникающих на металле при химическом взаимодействии его с кислородом. Но помимо кислорода ряд других газов может обладать сильными агрессивными свойствами по отношению к металлам при повышенных температурах.
Наиболее активными газами являются фтор, диоксид серы, хлор, сероводород. Их агрессивность по отношению к различным металлам, а следовательно, и скорость коррозии последних не одинаковы.
Так, например, алюминий и его сплавы, хром и стали с высоким содержанием хрома устойчивы в атмосфере, содержащей в качестве основного агрессивного агента кислород, но становятся совершенно неустойчивыми, если в атмосфере присутствует хлор. Никель неустойчив в атмосфере диоксида серы, а медь вполне устойчива.
Коррозия низколегированных и углеродистых сталей в выхлопных газах двигателей внутреннего сгорания, в топочных и печных газах сильно зависит от соотношения СО и О2. Повышение содержания О2 увеличивает скорость газовой коррозии и, наоборот, повышение содержания СО ослабляет коррозию. Ряд металлов (СО, Ni, Cu, Pb,Cd, Ti) устойчив в атмосфере чистого водяного пара при температуре выше температуры кипения воды.
5.3. Электрохимическая коррозия
Электрохимическая коррозия возникает при условии, соли неоднородный металл или сплав находится в электролите, т. е. в растворе, содержащим ионы различных веществ. Электролитами обычно являются водные растворы солей, кислот или щелочей.
Было установлено, что при контакте металла и электролита начинает работать большое количество гальванических микроэлементов, в которых перенос электрических зарядов совершается так же, как и в обычных гальванических элементах, где один из электродов (анод) разрушается, поэтому такая коррозия называется электрохимической.
Рассмотрим подробно механизм электрохимической коррозии.
Если сначала отдельно погрузить какой–либо металл в электролит, то практически могут быть два случая: либо часть положительно заряженных ионов металла (катионов) перейдет в раствор и металл зарядится отрицательно, либо часть положительных ионов осядет из раствора на металле и зарядит его положительно.
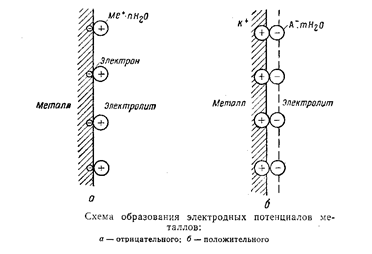
Электролит при этом заряжается электричеством обратного знака, т.е. в первом случае положительно, а во втором–отрицательно. В обоих случаях металл приобретает определенный электрический заряд, количественно выражаемый его электродным потенциалом.
Значение потенциала определяется соотношением тех сил, которые, с одной стороны, удерживают ионы в кристаллической решетке металла, а с другой–в электролите. Таким образом, электродный потенциал зависит от природы металла, состава электролита, а также от температуры, поскольку последняя влияет на величину указанных сил.
Нам уже известно, что для выбранного электролита все металлы можно расположить в порядке изменения их потенциалов.
Рассмотрим теперь, что произойдет, если два металла, например медь и цинк, обладающие разными потенциалами, погрузить в общий электролит.
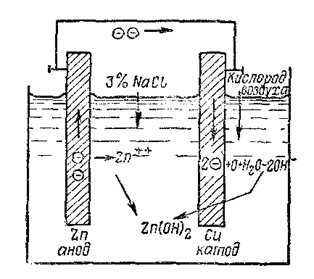
В данном случае анодом будет цинк, а катодом–медь. С анода перейдет в раствор большое число ионов металла [Zn++], соответственно на аноде скопится большой избыток электронов.
Если теперь соединить электроды между собой внешним проводником, то при наличии внешнего проводника электроны будут перемещаться по нему от анода к катоду, т. е., по проводнику потечёт электрический ток.
Притекая к катоду (меди), электроны начнут изменять его потенциал в отрицательную сторону; такое явление представляет частный случай поляризации.
Вообще поляризацией называется всякое изменение потенциала работающего электрода. Наоборот, восстановление первоначального значения потенциала называют деполяризацией, а вещества, способствующие этому, деполяризаторами.
В данном случае таким деполяризатором служит кислород, попадающий в электролит из воздуха путем растворения.
Этот кислород при участии воды может воспринимать электроны, попавшие на катод; при этом образуются гидроксильные ионы [ОН–];
О + Н2О + 2е ® 2ОН–
Таким образом, в итоге деполяризации, с одной стороны, с катода отводятся электроны, а с другой – вблизи него возникают гидроксильные группы. Оба эти процесса имеют важное значение. Отвод электронов с катода обеспечивает возможность притока к нему новых электронов со стороны анода, а это ведет к дальнейшему переходу ионов анода в раствор, т.е. к разрушению (коррозии) цинка. А образующиеся у катода гидроксильные ионы, перемещаясь в растворе путем диффузии, встречаются с ионами цинка и образуют продукт коррозии––гидрат окиси цинка:
Zn++ + 2OH–®Zn (OH)2
Рассмотренный случай представляет собой пример коррозии с кислородной диполяризацией; по такой схеме корродируют стали и алюминиевые сплавы в обычных эксплуатационных средах.
В некоторых условиях процессы на катоде протекают иначе. Притекающие к катоду электроны соединяются с ионами водорода [Н+], всегда находящимися в водных растворах, при этом образуются нейтральные атомы водорода, которые, соединяясь попарно, образуют молекулы водорода, который выделяется с катода в виде газа:
2Н + 2е® Н2
Данный случай представляет коррозию с водородной деполяризацией. По такой схеме коррозии, сопровождающейся выделением водорода, разрушаются, например, под действием морской воды магниевые сплавы, сюда же относятся случаи растворения металлов в кислотах.
Как видно, процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах.
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты. Схема электрохимической коррозии железа в контакте с углеродом. На анодных участках происходит реакция окисления железа
Fe – 2e®Fe2+
На катодных участках происходит восстановление водорода
2Н+ + 2е– ®Н2
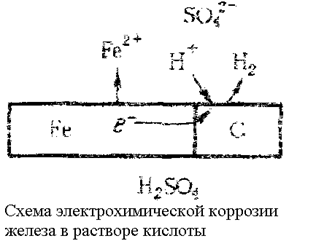
На рисунке представлена схема коррозии металла с энергетически неоднородной поверхностью, имеющей участки железа и углерода
Поэтому катодный процесс в основном будет протекать на этих участках; они называются катодными участками. Наличие участков, на которых катодные реакции протекают быстрее, увеличивает скорость коррозионного процесса. На других участках будет протекать в основном растворение металла и поэтому они называются анодными участками.
Катодные и анодные участки чередуются и имеют очень малые размеры, т. е. речь идет о микроанодах и микрокатодах и соответственно о коррозионных микроэлементах.
Таким образом, при наличии энергетической неоднородности поверхности металла коррозионный процесс заключается в работе числа коррозионных элементов. Коррозионный элемент в отличие от гальванического является короткозамкнутым микроэлементом.
Факторы, влияющие на коррозию
Факторы, влияющие на коррозию, распределяются на внутренние, зависящие от состава и строения имеющихся сплавов, и внешние, определяемые характером эксплуатационной среды.
Внутренние факторы.
Состав сплава - некоторые металлы и сплавы на их основе обладают значительной коррозионной стойкостью. Это прежде всего металлы, которые обладают положительными значениями электродных потенциалов: медь, золото, платина и т.п. Кроме того, к ним относятся металлы, которые при окислении способны образовывать хорошие защитные окисные пленки, например: хром, алюминий и алюминиевые сплавы, медные сплавы.
Наиболее стойкими являются сплавы, имеющие однородное строение, т.к. в этом случае зерна металла или сплава обладают одинаковыми потенциалами и электрохимическая коррозия не сможет развиваться.
Особенно неблагоприятными являются случаи, когда анодные участки располагаются по границам зерен сплава, так как при этом развивается очень опасная межкристаллитная коррозия.
К внутренним причинам, вызывающим коррозию, относятся также внутренние напряжения, возникающие при термической обработке или в эксплуатации, т. к. напряженный металл имеет более отрицательный потенциал.
Внешние факторы.
К ним относятся состав коррозионной среды и условия коррозии: температура, давление, скорость движения среды. Среда и условия, в которых эксплуатируется авиационная техника являются весьма неблагоприятными, т.к. самолеты круглый год находятся на открытом воздухе, подвергаются действию осадков, пыли, солнечных лучей.
Важнейшим фактором, способствующим коррозии, является влага.
1. Обычно атмосферная влага содержит небольшие примеси солей, кислот, а также окислов азота, образующихся при грозовых разрядах. Часто она бывает загрязнена промышленными газами––сернистым газом (SO2), сероводородом (Н2S), хлористым водородом (HCl), аммиаком (NH3) и др. Все эти вещества, растворяясь в воде, образуют электролиты; т. е. активную коррозионную среду.
Влажный воздух приморских районов всегда содержит много солей, попавших из морской воды.
2. Другим естественным фактором, вызывающим коррозию, является пыль. Даже при отсутствии видимой влаги осевшая на металле пыль может явиться источником коррозии.
Дело в том, что пыль обычно содержит различные соли, обладающие гигроскопичностью и способные поглощать атмосферную влагу. В итоге в месте осевшей пылинки создается коррозийнный очаг, вызывающий местную коррозию металла; образующиеся при этом продукты коррозии также большей частью бывают гигроскопичными.
3. Коррозию способны вызвать различные жидкости, используемые в эксплуатации (охлаждающие, гидросмеси, кислоты и др.).
4. Причиной коррозии является контакт разнородных материалов в конструкции. Например, в контакте с медными сплавами разрушаются стали, алюминиевые и магниевые сплавы; последние разрушаются в контакте со сталью.
Зная потенциалы отдельных сплавов в данной эксплуатационной среде, можно заранее предсказать ход процесса коррозии и выбрать правильный метод защиты.
5.4. Защита металлов от коррозии
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изменением состава металла и др. При разработке методов защиты от коррозии, используют указанные способы снижения коррозии и условий ее протекания. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозийной среды; д) рациональное конструирование изделий.
Легирование металлов
Легирование металлов – эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав вводят компоненты, вызывающие пассивацию металла. Пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса. Пассивность в основном вызывается образованием на поверхности металла оксидных или иных защитных слоев. В качестве таких пассивирующих компонентов применяют хром, никель, вольфрам и др.
Защитные покрытия
Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно–декоративным. Выбор вида покрытия зависит от условий, в которых используется металл. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Cu, Ni, Ag.
При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород.
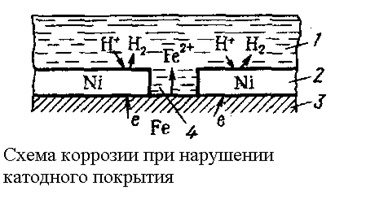
(1- раствор;2- покрытие;3- основной металл; 4- пора)
Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют более отрицательный потенциал основного металла. Примером анодного покрытия может служить цинк на стали. В этом случае основной металл будет катодом коррозийного элемента, поэтому он не корродирует.
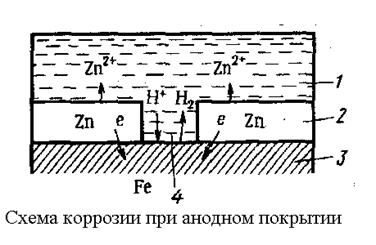
(1- раствор;2- покрытие;3- основной металл;4- пора)
Для получения металлических защитных покрытий применяются различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация, термодиффузионный и химический.
При термодиффузионном способе нанесения покрытия изделие помещают в смесь, содержащую порошок металла покрытия. При повышенной температуре происходит диффузия наносимого металла в основной металл.
Термодиффузионный способ широко используется для получения жаростойких покрытий алюминием (алитирование), кремнием (силицирование), хромом (хромирование), титаном (титанирование). Жаростойкие покрытия позволяют сочетать высокую жаропрочность основного материала с высокой жаростойкостью поверхностного слоя.
Химический способ получения металлических покрытий заключается в восстановлении соединений металла с помощью водорода гидрозинa (продукт частичного откисления аммиака N2H4) и других восстановителей.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Ряд покрытий, получаемых химической обработкой металла, включает защитные покрытия, образующие непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных пленок в технике называют оксидированием. Некоторые процессы имеют специальные названия. Так, например, процессы нанесения на сталь оксидных пленок иногда называют воронением, а электрохимическое оксидирование алюминия – анодированием. Защитные свойства оксидных пленок повышают пропиткой их маслом.
Фосфатные покрытия на стали получают из растворов ортофосфорной кислоты и ортофосфатов марганца или цинка (например, ZnHPO4 +H3PO4). При реакции образуется пористый кристаллический фосфат металла, хорошо сцепленный с поверхностью стали. Сами по себе фосфатные покрытия не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин. Защитные свойства фосфатной пленки, полученной на металле, значительно повышаются после покрытия ее (или пропитки) лаком, маслом, воском.
Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью. К некоторым покрытиям предъявляются специальные требования: повышенная стойкость при высоких температурах, стойкость против кислот, щелочей, бензина и т.п.
Электрохимическая защита
Этот метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала––протектора, а также катодной или анодной поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной электрической проводимостью.
Катодная поляризация используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, морским трубопроводам и оборудованию химических заводов.
Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспомогательный электрод (анод) растворяется, на защищаемом сооружении (катоде) выделяется водород. Если вспомогательный анод изготовлен из металла, имеющего более отрицательный потенциал, чем защищаемый металл, то возникает гальванический элемент. При этом отпадает необходимость в наложении тока от внешнего источника. Анод растворяется со скоростью, достаточной для создания в системе необходимого электрического тока.
Подобные вспомогательные электроды называют протекторами. Для их изготовления большей частью используют магний и его сплавы, цинк, алюминий.
Изменение свойств коррозионной среды
Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфаты, гидразин и т. п.). агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании). Для защиты от коррозии широко применяют ингибиторы.
Ингибитором называется вещество, при добавлении которого в среду, где находится металл, значительно уменьшается скорость коррозии металла. Ингибиторы применяют главным образом в системах, работающих с постоянным или мало обновляемым объемом раствора, например в некоторых химических аппаратах, системах охлаждения, парогенераторах и т. п. Особенно большое применение находят замедлители в процессах травления металлов для удаления с поверхности окалины или ржавчины.
Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных или анодных процессов.
Катодные замедлители уменьшают скорость коррозии за счет снижения интенсивности катодного процесса или сокращения площади катодных участков. К катодным ингибиторам относятся органические вещества, содержащие азот, серу и кислород, например диэтиламин, уротропин, формальдегид, тиокрезол.
В последние годы широко применяют летучие парофазные ингибиторы. Их используют для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при перевозке и хранении. Летучие ингибиторы вводятся в контейнеры, в упаковочные материалы или помещаются в непосредственной близости от рабочего аппарата.
Рациональное конструирование изделий
Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных с точки зрения коррозии участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.