
План.
1. Введение. Роль химии в биологии и пищевой промышленности.
2. Основные классы неорганических соединений и их свойства.
а) классификация оксидов, их получение. Химические свойства оксидов;
б) классификацияоснований, их получение. Химические свойства оснований. Амфотерные основания;
г) классификация кислот, их получение. Химические свойства кислот;
в) классификациясолей, их получение. Химические свойства солей;
3. Химические элементы
В общей системе наук – химия относится к фундаментальным естественным наукам, так как она наряду с физикой, биологией и другими науками занимается изучением явлений и объектов природы.
Химия – это наука о строении, свойствах вещества и превращении природных или искусственных веществ, а также о явлениях, которые сопровождают эти превращения.
Химия изучает состав и троение вещества. Под веществом понимают совокупность материальных частиц (атомов, молекул, нуклонов, электронов), которые имеют собственную массу покоя. Вещество и поле являются основными формами существования материи. Основным свойством материи является ее универсальная способность двигаться. Формы движения разнообразны: механические, физические, химические, биологические и др. Предметом изучения для химии является химическая форма движения материи. Превращения веществ, сопровождающиеся изменением состава молекул, называют химическими реакциями.
Химическая реакция – превращение одних веществ в другие путем изменения состава и химического строения.
Традиционная химия изучает реакции, которые происходят на макроскопическом уровне и интерпретируют их на атомно-молекулярном уровне. Известно, например, что метан горит на воздухе. Это макроскопическое явление. На молекулярном уровне происходит взаимодействие молекул О2 с молекулами СН4, при этом электронная плотность в молекулах перераспределяется таким образом, что разрываются связи О=О и С-Н и образуются новые связи С=О и О-Н. Часть энергии химической реакции выделяется в виде электромагнитного излучения, которое придает пламени цвет.
Современная химия содержит целый ряд специальных разделов, являющихся самостоятельными науками. Эти науки отличаются как по объектам, так и по методам их исследования. Сложившиеся в ХIХ веке деление химии на органическую и неорганическую связано с двумя основными классами изучаемых веществ.
Объектом неорганической химии являются все химические элементы и их соединения, другие вещества на их основе. Вместе с тем, крупнейшие разделы химии возникли на границе с физикой (физическая химия) с биологией (биохимия), а также такие науки как аналитическая химия, коллоидная химия и множество направлений прикладной химии (химия полимеров, красителей, электрохимия, химия строительных материалов, нефтехимия, углехимия и др.). Самой молодой областью химии является математическая химия. Её задача – применение математических методов с использованием компьютерной техники для обработки результатов химических экспериментов, поиска связей между строением и свойствами веществ и др.
Современная химия тесно связана с другими естественными науками и со всеми отраслями промышленного и сельскохозяйственного производства. Химия всегда была и остается наукой, имеющей важнейшее практическое значение. С древнейших времен и до современности она тесно связана с химической технологией, целью которой является получение из природного сырья химических продуктов нужного качества.
Достижения химической науки лежат в основе научно технического прогресса, успешного влияния химии на технологии в различных отраслях. Химическая промышленность вырабатывает разнообразные полимерные материалы, которые применяются во многих отраслях промышленности, высокоэффективное топливо, конструкционные материалы, различные сплавы, красители, лекарственные и ветеринарные препараты, препараты санитарии и гигиены, дезинфицирующие средства, минеральные удобрения, средства защиты растений от вредителей и болезней, гербициды, дефолианты, стимуляторы роста, пищевые и кормовые добавки, консерванты для хранения кормов в животноводстве, строительные материалы, энергоносители, особо чистые материалы для электроники и многие другие продукты.
Резкое увеличение производства пищевых продуктов в настоящее время обусловлено широким применением удобрений, пестицидов и средств борьбы с сорняками. Так без применения этих веществ, производство зерновых за три года уменьшилось бы наполовину.
Изучение общей и неорганической химии позволит инженеру технологу разбираться в свойствах различных веществ, используемых в его практической деятельности.
Перед химиками стоит задача создания безотходных технологий производства, удовлетворяющих высоким экологическим требованиям, от специалистов же различных различных отраслей производства требуется грамотное использование химических продуктов и технологий с их применением.
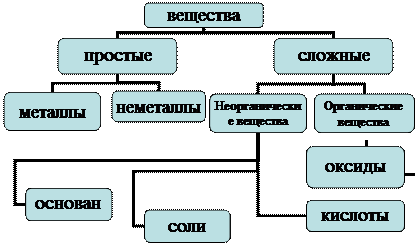
Классификация простых и сложных веществ
Природные химические вещества обычно представляют собой сложные смеси различных соединений, которые подвергаются разделению как физическими, так и химическими методами. В результате процессов разделения и очистки получают индивидуальные химические вещества, которые могут быть охарактеризованы определенными и постоянными для каждого чистого индивидуального соединения физическими свойствами.
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ и очень многочисленную группу сложных веществ.
Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов. Простые вещества, в свою очередь, разделяются на металлы и неметаллы.
Металлы отличаются характерным «металлическим» блеском, ковкостью, пластичностью, обладают хорошей теплопроводностью и электрической проводимостью. Все металлы при комнатной температуре находятся в твердом состоянии (кроме ртути). Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят тепло и электрический ток.
Неорганическая химия охватывает химию всех элементов периодической системы. Свойства органических соединений существенно отличаются от свойств неорганических, а элементоорганические занимают промежуточное положение. Сложные неорганические вещества обычно делят на четыре важнейших класса: ычно делят на четыре важнейших класса: оксиды, основания, кислоты и соли
 |
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.
Оксиды делят на две группы: солеобразующие и несолеобразующие, а каждую из групп, в свою очередь, подразделяют на несколько подгрупп.
Многие элементы проявляют переменную валентность и дают оксиды различного качественного состава, поэтому предварительно следует рассмотреть номенклатуру оксидов.
В последние годы осуществлен переход на современную международную номенклатуру соединений. Согласно этой номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SО2 – оксид серы (IV), SО3 – оксид серы (VI), Сr2О3 – оксид хрома (III), СrО – оксид хрома (II), СrО3 – оксид хрома (VI).
Солеобразующие оксиды принято делить на три группы: основные, амфотерные и кислотные оксиды. К основным оксидам относятся оксиды щелочных и щелочноземельных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов. Основные оксиды могут быть получены несколькими методами.
1. Окисление металлов:2Мg + О2 = 2МgО;
2Са + О2 = 2СаО.
2. Обжиг сульфидов:
2СuS + 3О2 = 2СuО + 2SО2↑;
4FеS2 + 11О2 = 2Fе2О3 + 8SО2.
3.Разложение оснований:
Сu(ОН)2![]() СuО
+ Н2О.
СuО
+ Н2О.
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
ВаСО3![]() ВаО + СО2;
ВаО + СО2;
2Рb(NО3)2
![]() 2РbО + 4NО2↑ + О2↑;
2РbО + 4NО2↑ + О2↑;
4FеSО4 ![]() 2Fе2О3 + 4SО2↑
+ О2↑.
2Fе2О3 + 4SО2↑
+ О2↑.
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
Zn2(OH)2CO3![]() 2ZnO+ СО2↑+ Н2О.
2ZnO+ СО2↑+ Н2О.
Свойства основных оксидов.
Большинство основных оксидов образованы по ионному типу связи, твердые кристаллические вещества, обладающие высокими температурами плавления и кипения.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути, серебра и благородных металлов. Основные оксиды могут вступать в реакции с кислотными и амфотерными оксидами с образованием соли, с кислотами. Оксиды щелочных и щелочноземельных металлов реагируют с водой:
К2О + Н2О = 2КОН;
ВаО + Н2О = Ва(ОН)2;
СаО + А12О3 = Са(А1О2)2;
MgO + SiО2 = MgSiО3;
Ag2О + 2HNО3 = 2AgNО3 + H2О.
Реакции с кислотными оксидами (ангидридами кислот) происходят обычно при нагревании и лучше всего идут с двуокисью кремния, так как кислотные оксиды, образованные другими элементами, обычно летучи, а поэтому при нагревании испаряются.
Наиболее типична реакция основных оксидов с кислотами с образованием солей и воды:
СuО + Н2SО4 = СuSО4 + Н2О;
CuO+2H+ = Cu2++H2O.
С помощью этой реакции в большинстве случаев можно отличить основные оксиды от других типов оксидов.
Основные оксиды, как и другие типы оксидов, могут вступать в окислительно-восстановительные реакции, причем восстановлению (и в редких случаях окислению) подвергаются ионы металла:
Fe2О3+2Al = 2Fe+Al2О3;
СuО + Н2 = Сu + Н2О;
2РbО + С = 2Рb + СО2;
MnO + CO = Mn+CO2.
Кислотные оксиды. Кислотные оксиды представляют собой оксиды неметаллов и переходных металлов в высоких степенях окисления (СО2, SО2, SО3, N2О5, SiО2. Сr2О3, Мn2О7) им соответствуют кислоты (Н2СО3, Н2SО3, Н2SО4, НNО3, Н2SiО3, Н2СrО4, НМnО4).
По современной номенклатуре их называют оксидами элемента с указанием степени его окисления: оксид серы (IV) - SO2, оксид серы (VI) – SО3 или по количеству атомов кислорода: SO2 - диоксид серы, SO3 - триоксид серы. Однако до настоящего времени широко используется устаревшая система названия кислотных оксидов как ангидридов кислот — продуктов отщепления воды от соответствующих кислот: SO2 — сернистый ангидрид, SО3 — серный ангидрид.
Кислотные оксиды могут быть получены методами, аналогичными методам получения основных оксидов.
1.Окисление неметаллов или их оксидов в более низких степенях окисления, окисление солей бескислородных кислот или водородных соединений неметаллов:
4Р + 5О2 = 2Р2О5;
2ZnS + 3О2 = 2ZnО + 2SО2↑;
2Н2S + 3О2 = 2SО2↑ + 2Н2О;
Nа2SiО3 + 2 НСl = 2 NаСl + SiО2↓ + Н2О.
2.Разложение кислот или солей кислородсодержащих кислот:
Н2SiО3 ![]() SiО2 + Н2О;
SiО2 + Н2О;
Н2SО3![]() SО2 + Н2О.
SО2 + Н2О.
Свойства кислотных оксидов. Многие кислотные оксиды взаимодействуют с водой с образованием кислот:
SO3 + H2O = H2SO4;
Р2О5 + 3Н2О = 2Н3РО4;
СО2 + Н2О ↔ Н2СО3.
Более общими для кислотных оксидов являются реакции со щелочами и основными оксидами:
Р2О5 + 6NаОН = 2Nа3РО4 + 3Н2О;
СО2+2КОН = К2СО3 + Н2О;
SО2 + СаО = СаSО3.
Кислотные оксиды, как и другие типы оксидов, могут вступать в окислительно-восстановительные реакции:
СО2 +С = 2СО;
2SО2+О2 = 2SО3.
Амфотерные оксиды. Амфотерные оксиды обладают двойственной природой, они одновременно способны к реакциям, в которых выступают как основные, так и кислотные оксиды, т. е. подобно основным оксидам реагируют с кислотами и аналогично кислотным оксидам - со щелочами:
Аl2О3+6НСl = 2 АlСl3+3Н2О;
Al2O3+2NaOH = 2NaAlO2+ H2О;
или Al2O3+2NaOH+3H2O = 2NаAl(OH)4.
К числу амфотерных оксидов относятся оксид алюминия — Аl2О3, оксид хрома (Ш) - Сr2О3, оксид бериллия - ВеО, оксид цинка - ZnO, оксид свинца (II)- РbО, оксид олова (II) - SnO и ряд других соединений. Понятие амфотерность не является очень строгим, так, могут быть даны одновременно два определения, описывающие поведение амфотерных соединений. Обычно амфотерными соединениями называют соединения, способные реагировать с кислотами и основаниями. Уравнение реакции растворения оксида алюминия в кислоте и щелочи отвечает определению амфотерности именно в этом смысле.
К амфотерным оксидам можно также отнести воду, которая диссоциирует с образованием одинаковых количеств водорода (кислотные вещества) и гидроксид-иона (основные вещества)
Несолеобразующие оксиды (наиболее важные из них СО, NО, N2О, Н2О2, Nа2О2), не способны взаимодействовать с кислотами или основаниями с образованием солей.
Смена химических свойств оксидов от основного через амфотерный до кислотного связано с закономерностями смены свойств элементов от металлов до неметаллов.
Основания (гидроксиды металлов)
Основаниями называют соединения, в которых положительно заряженный ион металла связан с отрицательно заряженным гидроксид-ионом: NaOH, Mg(OH)2, А1(ОН)3. Раньше этот класс называли гидроокисями металлов, но по современной номенклатуре их принято называть гидроксидами элементов с указанием степени окисления.
Основания принято делить на две группы: растворимые в воде основания, или щелочи (образованные щелочными и частично щелочноземельными металлами), и нерастворимые в воде основания. Основное различие между ними заключается в том, что концентрация гидроксид-иона в растворах щелочей может быть достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Получение оснований. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
NiSO4+2KOH=Ni(OH)2↓ + K2SO4;
К2СО3+Ва(ОН)2 =2КОН + ВаСО3↓.
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
Щелочи в технике обычно получают электролизом водных растворов солей соляной кислоты:
2NaCl+2Н2О ![]() 2NaOH+H2+Cl2.
2NaOH+H2+Cl2.
При электролизе растворов галогенидов других металлов можно также получить и нерастворимые в воде основания:
2АlСl3+ 6Н2О
![]() 2Аl(ОН)3+ 3Н2+3Сl2.
2Аl(ОН)3+ 3Н2+3Сl2.
Щелочи могут также быть получены взаимодействием щелочных или щелочноземельных металлов с водой или оксидов щелочноземельных металлов с водой:
2Na+2H2O = 2NaOH+H2↑;
Ca +2H2O=Ca(OH)2+H2↑;
BaO+H2O=Ba(OH)2.
Химические свойства оснований. Все нерастворимые в воде основания, а при сильном нагревании и гидроксиды щелочноземельных металлов разлагаются с образованием оксидов. Гидроксиды щелочных металлов при нагревании не распадаются:
2Fе(ОН)3 ![]() Fе2О3+3Н2О;
Fе2О3+3Н2О;
Са(ОН)2 ![]() СаО + Н2О;
СаО + Н2О;
NaOH ![]() не разлагается.
не разлагается.
Наиболее характерной реакцией оснований является их взаимодействие с кислотами - реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые в воде основания:
NaOH+HNO3=NaNO3+2H2О;
или в ионном виде: ОН¯+Н+ = Н2О.
Cu(OH)2+H2SO4=CuSO4+2H2О;
или в ионном виде: Cu(OH)2 +2H+ = Cu2++ 2H2O.
Щелочи могут вступать во взаимодействие с кислотными оксидами:
2NaOH+CO2=Na2CO3+H2O;
Ca(OH)2+SO2=CaSO3+H2O.
Подобные реакции малохарактерны для нерастворимых в воде оснований, так как подавляющее большинство соответствующих им солей также нерастворимо в воде, а в тех случаях, когда реакция возможна (например, с SO3), то либо в растворе кислотный оксид реагирует с водой, либо в твердом состоянии при нагревании распадается соответствующий гидроксид.
Основания могут вступать в реакцию с кислыми солями:
2NaHSO3+2KOH=Na2SO3+ K2SO3 +2H2O.
Однако эти реакции, по существу, являются обычными реакциями нейтрализации.
Щелочи могут реагировать в растворах с некоторыми неметаллами - галогенами, белым фосфором, кремнием, бором, причем в этих случаях происходят окислительно-восстановительные реакции:
2NaOH+Cl2=NaCl+NaOCl + H2O, (на холоде);
2NaOH+Si+H2O=Na2SiO3+2H2;
6КОН + 3S = К2SО3 + К2S + 3Н2О;
3КОН + 4Р + 3Н2О = РН3↑ + 3КН2РО2.
Кислоты
К кислотам относятся химические соединения, в состав которых входит один или несколько атомов водорода, которые способны замещаться на атомы металлов с образованием солей. Группа атомов, которая остается после отщепления от молекулы кислоты атомов водорода, называется кислотным остатком.
По количеству атомов водорода, входящих в состав кислоты и способных замещаться атомами металлов, определяется ее основность. Существуют одноосновные кислоты (НСl, НNО3, НСlО4 и т.д.), двухосновные (Н2SО4, Н2СО3, Н2SiО3), трехосновные (Н3РО4, Н3ВО3, Н3АsО3 и т.д.), четырехосновные (Н4SiО4, Н4Р2О7 и т.д.).
По химическому составу кислоты делят на бескислородные (НF, НСl, НВr, НI, Н2S, НСN, Н2Sе и т.д.) и кислородсодержащие (Н2SО3, Н2СО3, НNО3, Н2SО4, Н3РО4, НСlО4 и т.д.).
Структурные (или графические) формулы кислот в большей степени передают их строение, чем формулы для оксидов и оснований, так как кислоты имеют молекулярное строение и существуют в виде отдельных молекул (или иногда в виде ассоциированных частиц - димеров и полимеров за счет образования водородных связей).
В формулах бескислородных кислот атомы водорода непосредственно связаны с атомом неметалла:
Н-Вr Н-S-Н
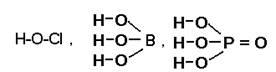 В кислородсодержащих кислотах, практически
всегда атомы водорода связаны с атомом элемента кислотообразователя через
кислород. Остальные атомы кислорода, входящие в состав кислотного остатка, соединены
с неметаллом кратными связями или же образуют кислородные мостики:
В кислородсодержащих кислотах, практически
всегда атомы водорода связаны с атомом элемента кислотообразователя через
кислород. Остальные атомы кислорода, входящие в состав кислотного остатка, соединены
с неметаллом кратными связями или же образуют кислородные мостики:
Водород в кислородсодержащих кислотах только в очень
редких случаях может быть связан с неметаллом непосредственно, а не через
кислород. Это относится главным образом к органическим кислотам, например
уксусной: 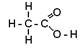 .
.
Однако и в этом случае атом водорода, определяющий основность кислоты, связан с атомом неметалла через кислород. В неорганической химии, таких примеров почти нет (упомянем только фосфорноватистую Н3РО2 и фосфористую Н3РО3 кислоты):
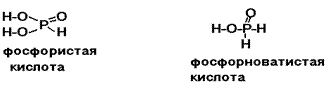 |
Н2+Сl2 = 2НСl,
Н2+S↔Н2S.
Кислородсодержащие кислоты нередко могут быть получены при взаимодействии кислотных оксидов с водой, а также обменными реакциями между солями и кислотами.
SО3+Н2О= Н2SО4;
Р2О5+Н2О= 2НРО3;
АgNО3+ НСl = НNО3+ АgСl↓;
Nа2SiО3+ 2НNО3= Н2SiО3↓+2NаNО3;
ВаВr2+ Н2SО4 = 2НВr + ВаSО4↓;
СuSО4+Н2S = Н2SО4+ СuS↓.
Химические свойства кислот можно подразделить на две группы: общие для всех кислот реакции, связанные с наличием в их растворах иона водорода Н+ (иона гидроксония Н3О+), и специфические, т.е. характерные для отдельных конкретных кислот.
В водных растворах ион водорода представляет собой ион гидроксония Н3О+, дополнительно гидратированный молекулами воды.
При взаимодействии кислот с металлами, стоящими в ряду напряжений до водорода, происходит восстановление ионов водорода, и образуется свободный водород:
2Н+ + Zn = Zn2+ + Н2.
Эта реакция будет протекать с любой растворимой в воде кислотой, (которая следовательно, частично или полностью диссоциирована) и не проявляет специфического окислительного действия за счет элемента, входящего в состав аниона в высокой степени окисления:
Са+2СН3СООН=Н2+(СН3СОО)2Са;
Pb + H2S=H2+PbS↓.
К кислотно-основному типу реакций кислот относятся реакции с основными оксидами, основаниями, средними, основными (а иногда и кислыми) солями, с аммиаком:
СuО + 2НNО3 = Сu(NО3)2 + Н2О;
НСl+КОН = КСl +Н2О;
2Аl(ОН)3+3Н2SО4 = Аl2(SО4)3+ 6Н2О;
ZnS + Н2SО4 = ZnSО4 + Н2S;
К2СО3+ Н3РО4 = К2НРО4 + СО2↑+ Н2О;
Сu2(ОН)2СО3 + 2Н2SО4 = 2СuSО4+СО2↑+ Н2О;
NаНСО3 + НВr = NаВr + СО2↑+ Н2О;
2NН3 + Н2SО4 = (NН4)2SО4.
Для некоторых кислородсодержащих кислот, напротив, более характерны окислительные свойства за счет высокой степени окисления элемента-кислотообразователя. При этих реакциях проявляются окислительные свойства не протона, как в растворах кислот, а центрального атома (S6+, N5+, Cr6+), и эти реакции характерны для азотной и хромовой кислот при любых концентрациях, а для серной кислоты при достаточно высокой концентрации:
2H2SO4+Cu=CuSО4 +SO2↑+2H2O;
4HNО3+Pb=Pb(NО3)2 +2NO2↑+2 H2O;
[Н2Сr2О7] + 3Н2SО3 = Сr2(SО4)3 + 4Н2О;
C+2H2SО4 =CO2+2SО2 +2H2О;
6P + 10HNО3+4H2O = 6H3PO4+10NO↑.
Соли
Соли рассматривают обычно как продукты замены атома водорода в кислотах на атомы металлов или гидроксильных групп в основаниях на кислотные остатки. С точки зрения теории электролитической диссоциации солями называются сложные вещества, которые при растворении в воде (или при плавлении) дают в растворе катионы металлов и анионы кислот.
Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода кислоты (гидроксильные группы основания) полностью заменены атомами металла (кислотными остатками), которые при растворении посылают в раствор только катионы металла и анионы кислоты:
Nа2SО4↔ 2Nа+ + SО42-.
В кислых солях замена атомов водорода в кислотах проведена не до конца, и при растворении они наряду с катионами металла посылают в раствор ионы водорода:
NаНSО4↔ Nа+ + Н+ + SО42-.
Кислые соли образуют многоосновные кислоты Н2S, Н2SО3, Н2SО4, Н2СО3, Н3РО4 и т.д., особенно характерно их образование для слабых кислот, диссоциирующих ступенчато.
Соответственно основные соли можно рассматривать как продукты неполной замены гидроксильных групп в многоосновном основании на кислотные остатки, и они при растворении в воде посылают в раствор гидроксид-анионы:
Мg(ОН)Сl ↔Мg(ОН)+ + Сl- ↔Мg2+ + ОН‾ + Сl‾.
Соли представляют собой ионные соединения, и их названия строятся по названиям металлов и кислот.
Способы получения. Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого другого класса соединений. Рассмотрим возможные случаи получения солей из других классов соединений.
Металлы образуют соли при взаимодействии с неметаллами, кислотами, солями:
2Fе + 3Сl2 = 2FеСl3;
2Аl + 3Н2SО4(разб) = Аl2(SО4)3 + 3Н2↑;
Fе + 2FеСl3 = 3FеСl2.
Неметаллы могут образовывать соли при реакции с металлами и солями:
S+ Fе = FеS;
Сl2 + СаВr2 = СаСl2 + Вr2.
В некоторых случаях соли могут быть получены как из неметаллов, так и из металлов при взаимодействии с растворами щелочей:
3Сl2 + 6КОН = КСlО3 + 5 КСl + 3Н2О;
2Аl + 6Н2О + 2NаОН = 2Nа[Аl(ОН)4] + 3Н2↑.
Основные оксиды образуют соли при взаимодействии с кислотами, кислотные оксиды образуют соли при взаимодействии с основными оксидами и основаниями, амфотерные оксиды могут давать соли при реакциях с основными и кислотными оксидами, кислотами и основаниями:
СаО + SiО2 = СаSiО3;
СuО + 2НNО3 = Сu(NО3)2 + Н2О;
СО2+ ВаО = ВаСО3;
Р2О5 + 6NаОН = 2Nа3РО4 + 3Н2О;
Аl2О3 + МgО = Мg(АlО2)2;
Аl2О3 + 3SО3 = Аl2(SО4)3;
Сr2О3 + 3Н2SО4 = Сr2(SО4)3 + 3Н2О.
Основания могут образовывать соли при взаимодействии с кислотными и амфотерными оксидами, амфотерными основаниями, кислотами, солями:
Са(ОН)2+ СО2 = СаСО3 + Н2О;
2NаОН + Сr2О3 = 2 NаСrО2 + Н2О;
КОН + Аl(ОН)3 = КАlО2 + 2Н2О;
2НСl + Мg(ОН)2 = МgСl2 + 2Н2О;
Ва(ОН)2 + Nа2SО4 = ВаSО4↓ + 2 NаОН;
2NаОН + 2АgNО3 = 2NаNО3 + Аg2О↓ + Н2О.
Кислоты образуют соли при взаимодействии с металлами, основными и амфотерными оксидами, основаниями и солями:
2НВr + Fе = FеВr2 + Н2↑;
2НВr + Сu(ОН)2= СuВr2 + 2Н2О;
6НСl + Fе2О3 = 2FеСl3 + 3Н2О;
Н2SО4 + ZnО = ZnSО4 + Н2О;
2НСl + СаСО3 = СаСl2+ СО2↑ + Н2О.
Кислоты могут образовывать соли при реакциях с аммиаком, аминами и некоторыми другими классами соединений:
NН3 + НNО3 = NН4NО3;
Са3Р2 + 6НСl = 3СаСl2 + 2 РН3↑;
С6Н5NН2 + Н2SО4 = С6Н5NН3+ + НSО4¯.
Химические свойства солей. Большинство солей устойчиво при нагревании. Однако соли аммония, а также соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, достаточно часто при нагревании разлагаются:
СаСО3 = СаО + СО2↑;
NН4Сl = NН3↑ + НСl↑;
2АgNО3 = 2Аg + 2NО2+ О2↑;
NН4NО3 = N2О+ 2Н2О.
2КСlО3= 2КСl+3О2↑.
Кислые и основные соли. По международной номенклатуре кислый атом водорода, входящий в состав кислой соли, отличается приставкой "гидро", а гидроксид-ион в основных солях приставкой "гидроксо" (или "гидроксид"):
NаНS – гидросульфид натрия, NаНSО3 – гидросульфит натрия, NаНSО4 - гидросульфат натрия, Са(Н2РО4)2 – дигидрофосфат кальция, СаНРО4 – гидрофосфат кальция, Мg(ОН)Сl – гидроксохлорид магния, Аl(ОН)2Сl –дигидроксохлорид алюминия, Сu2(ОН)2СО3 –дигидроксокарбонат димеди.
Способы получения и свойства. Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли:
NаОН + Н2SО4 = NаНSО4 + Н2О;
NаСl + Н2SО4 = NаНSО4 + НСl.
При нагревании многие кислые соли разлагаются:
2NаНСО3 = Nа2СО3 + СО2↑ + Н2О;
Са(НСО3)2 = СаСО3 + СО2↑ + Н2О.
Кислые соли при растворении в воде дают в раствор ионы металла, волорода и анионы кислот, поэтому для них характерны свойства не только солей, но и кислот:
NаНСО3 ↔ Nа+ + НСО3- (полная диссоциация);
НСО3-↔ Н+ + СО32- (частичная).
Кислые соли способны к реакциям с металлами, основными и амфотерными оксидами, основаниями, солями, кислотами, т.е. к реакциям в которые вступают средние соли и кислоты:
2NаНSО4 + Fе = Nа2SО4 + FеSО4 + Н2↑;
2Н+ + Fе = Fе2+ + Н2↑;
2КНSО4 + СuО = К2SО4 + СuSО4 + Н2О;
СuО + 2Н+ = Сu2+ + Н2О;
Са(НСО3)2 + 2NаОН = СаСО3↓ + Nа2СО3 + 2Н2О;
НСО3- + ОН- = СО32- + Н2О;
NаНСО3 + НСl = NаСl + СО2 + Н2О;
НСО3- + Н+ = [Н2СО3] → Н2О + СО2↑.
Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
АlСl3 + 2NаОН = Аl(ОН)2Сl + 2NаСl;
2МgСl2+ 2Nа2СО3 + Н2О = [Мg(ОН)]2СО3 + СО2↑ + 4NаСl.
Основные соли обычно образуются при частичной нейтрализации малорастворимых оснований. Образование основных солей нехарактерно для сильных оснований. Обе указанные реакции, ведущие к образованию основных солей, связаны со смещением равновесия процессов гидролиза.
Основные соли при нагревании легко разлагаются:
[Сu(ОН)]2СО3 = 2СuО + СО2↑ +Н2О;
Подобно малорастворимым основаниям они способны реагировать с кислотами:
[Zn(ОН)]2СО3 + 2Н2SО4 = 2ZnSО4 + СО2↑ +3Н2О;
Образование кислых и основных солей имеет большое значение при объяснении процессов гидролиза.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.