
|
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный Профессия «Повар, кондитер» Дисциплина «Химия» |
|
|
|
|
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ЛАБОРАТОРНО-ПРАКТИЧЕСКИМ РАБОТАМ
|
|
|
|
|
|
Торжок, 2017
|
|
|
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж» |
|
|
Рецензент должность, место работы __. __. 2017 |
УТВЕРЖДАЮ зам. директора по УМР _____________ О.В.Гамелько __. __. 2017
|
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ЛАБОРАТОРНО-ПРАКТИЧЕСКИМ РАБОТАМ для профессии «Повар, кондитер»
Органическая химия
Составлена в соответствии с ФГОС СПО
|
|
|
Преподаватель высшей категории ___________Т.В.Королёва
Председатель ПЦК ____________ Т.В.Королёва __. __. 2017 Методист ____________ Т.В.Белякова __. __. 2017 Рецензент Преподаватель ___ категории ____________ _____________ __. __. 201
|
|
|
Введение |
7 |
|
Лабораторная работа № 1«Изготовление моделей молекул органических веществ. Составление структурных формул углеводородов” |
12 |
|
Практическая работа № 1«Обнаружение углерода и водорода в органическом соединении. Обнаружение галогенов (проба Бейльштейна)» |
15 |
|
Лабораторная работа № 2“Изготовление моделей молекул алканов и галогеналканов» |
16 |
|
Лабораторная работа № 3«Ознакомление со свойствами парафинов. Получение метана и изучение его свойств» |
17 |
|
Лабораторная работа № 4«Ознакомление с образцами полиэтилена и полипропилена» |
19 |
|
Практическая работа № 2“Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с бромной водой, раствором перманганата калия» |
20 |
|
Лабораторная работа № 5«Изготовление моделей молекул алкинов и их их изомеров» |
21 |
|
Лабораторная работа № 6 «Определение наличия непредельных углеводородов в нефтепродуктах и растительном масле. Растворимость различных нефтепродуктов друг в друге» |
24 |
|
Практическая работа № 3 «Изучение растворимости спиртов в воде. Окисление спиртов. Получение диэтилового эфира. Получение глицерата меди» |
26 |
|
Практическая работа № 4«Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди (II). Взаимодействие формальдегида с гидросульфитом натрия» |
28 |
|
Практическая работа № 5«Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты. Сравнение степени ненасыщенности твердого и жидкого жиров. Омыление жира. Получение мыла и изучение его свойств: пенообразования, реакций ионного обмена, гидролиза, выделения свободных жирных кислот» |
30 |
|
Лабораторная работа № 7«Ознакомление с физическими свойствами глюкозы. Кислотный гидролиз сахарозы. Обнаружение крахмала» |
30 |
|
Практическая работа №6«Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу. Обнаружение лактозы в молоке. Действие йода на крахмал» |
31 |
|
Лабораторная работа № 8«Растворение белков в воде и их коагуляция. Обнаружение белка в курином яйце и молоке» |
32 |
|
Практическая работа №7«Денатурация белка. Цветные реакции белков» |
36 |
|
Лабораторная работа № 9 «Изготовление объемных и шаростержневых моделей азотистых гетероциклов» |
38 |
|
Практическая работа №8 «Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Обнаружение D в рыбьем жире или курином желтке» |
39 |
|
Список литературы и источников информации |
41 |
Введение
Содержание лабораторно-практических занятий по дисциплине «Химия» направлено на достижение следующих целей:
• формирование у обучающихся умения оценивать значимость химического знания для каждого человека;
• формирование у обучающихся целостного представления о мире и роли химии в создании современной естественно-научной картины мира; умения объяснять объекты и процессы окружающей действительности: природной, социальной, культурной, технической среды, — используя для этого химические знания;
• развитие у обучающихся умений различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
• приобретение обучающимися опыта разнообразной деятельности, познания и самопознания; ключевых навыков, имеющих универсальное значение для различных видов деятельности (навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни).
Освоение содержания учебной дисциплины «Химия», обеспечивает достижение студентами следующих результатов:
• личностных: чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
− готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
− умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
• метапредметных:
− использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
− использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
• предметных:
− сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
− владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
− владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
− сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
− владение правилами техники безопасности при использовании химических веществ;
− сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
На выполнение практических заданий отводиться 30 часов из 94 по рабочему учебному плану.
Рекомендации по работе с методическими указаниями
Для того чтобы практические занятия приносили максимальную пользу, необходимо помнить, что упражнение и решение задач проводятся по вычитанному на лекциях материалу и связаны, как правило, с детальным разбором отдельных вопросов лекционного курса.
При самостоятельном решении задач нужно обосновывать каждый этап решения, исходя из теоретических положений курса. Если студент видит несколько путей решения проблемы (задачи), то нужно сравнить их и выбрать самый рациональный. Полезно до начала вычислений составить краткий план решения проблемы (задачи). Решение проблемных задач или примеров следует излагать подробно, вычисления располагать в строгом порядке, отделяя вспомогательные вычисления от основных. Решения при необходимости нужно сопровождать комментариями, схемами, чертежами и рисунками. Следует помнить, что решение каждой учебной задачи должно доводиться до окончательного логического ответа, которого требует условие, и по возможности с выводом. Полученный ответ следует проверить способами, вытекающими из существа данной задачи.
Лабораторная работа № 1
«Изготовление моделей молекул
органических веществ.
Составление структурных формул углеводородов”
Цель работы:
1. Научиться составлять модели молекул органических веществ.
2. Научиться записывать структурные формулы углеводородов и назвать их по международной номенклатуре.
Теоретический материал. Углеводороды это органические вещества, состоящие из атомов углерода и водорода. Атом углерода во всех органических соединениях четырехвалентен. Атомы углерода могут образовывать цепочки прямые, разветвленные, замкнутые. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов между собой. Вещества, имеющие одинаковую молекулярную формулу, но разное строение называются изомерами. Приставки указывают количество ди – два, три – три, тетра - четыре; цикло - означает замкнутый.
Суффиксы в названии углеводородов указывают на наличие кратной связи:
ан одинарная связь между атомами
углерода (С ![]() С);
С);
ен двойная связь между атомами углерода (С = С);
ин тройная связь между атомами
углерода (С ![]() С);
С);
диен две двойных связи между атомами углерода (С
= С ![]() С =
С);
С =
С);
Радикалы: метил -СН3; этил -С2Н5; хлор -Сl; бром -Br.
Пример. Составьте модель молекулы пропана.
Молекула пропана C3H8 содержит
три атома углерода и восемь атомов водорода. Атомы углерода соединены между
собой. Суффикс – ан указывает на наличие одинарной связи между
атомами углерода. Атомы углерода располагаются под углом 109![]() 28
минут.
28
минут.
Молекула имеет форму пирамиды. Атомы углерода изображайте черными кругами, а атомы водорода – белыми, атомы хлора – зелеными.
При изображении моделей соблюдайте соотношение размеров атомов.
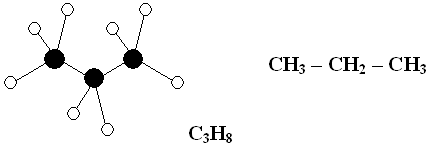
Молярную массу находим, пользуясь периодической таблицей
М (С3Н8 ) = 12 · 3 + 1 · 8 = 44 г/моль.
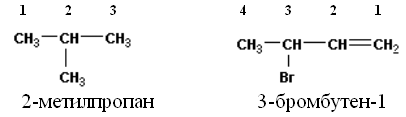
Что бы назвать углеводород надо:
1. Выбрать самую длинную цепочку.
2. Пронумеровать, начиная с того края, к которому ближе радикал или кратная связь.
3. Указать радикал, если радикалов несколько указывают каждый. (Цифра перед названием).
4. Назвать радикал, начиная с меньшего радикала.
5. Назвать самую длинную цепочку.
6. Указать положение кратной связи. (Цифра после названия).
Пример
При составлении формул по названию надо:
1. Определить число атомов углерода в цепочке.
2. Определить положение кратной связи. (Цифра после названия).
3. Определить положение радикалов. (Цифра перед названием).
4. Записать формулы радикалов.
5. В последнюю очередь определить количество и расставить атомы водорода.
Массовая доля элемента определяется по формуле:
![]() где
где
![]() – массовая доля химического элемента;
– массовая доля химического элемента;
n – число атомов химического элемента;
Ar – относительная атомная масса химического элемента;
Mr – относительная молекулярная масса.
При решении задачи примените формулы расчета:
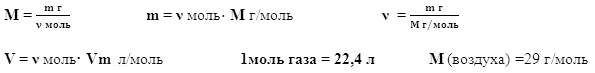
Относительная плотность газа Dг показывает во сколько раз плотность одного газа больше плотности другого газа. D(Н2) - относительная плотность по водороду. D(воздуха) - относительная плотность по воздуху.
![]()
Оборудование: Набор шаростержневых моделей молекул, пластилин разных цветов, спички, таблица “Предельные углеводороды”, периодическая таблица. Индивидуальные задания.
Ход работы. Выполнение заданий по вариантам.
Вариант №1.
Задание №1. Составьте модели молекул: а) бутана, б) циклопропана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
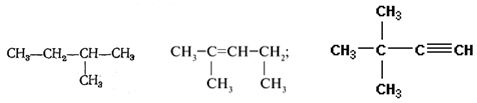
Задание №2. Назовите вещества:
Задание №3. Составьве структтурные формулы веществ:
а) бутен-2, напишите его изомер;
б) 3,3 - диметилпентин-1.
Задание №4. Решите задачи:
Задача 1 Определить массовую долю углерода и водорода в метане.
Задача 2. Сажа применяется для производства резины. Определить сколько г сажи (С) можно получить при разложении 22 г пропана?
Вариант №2.
Задание №1. Составьте модели молекул: а) 2-метилпропана, б) циклобутана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества:
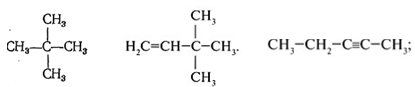
Задание №3 Составьве структурные формулы веществ:
а) 2-метилбутен-1, напишите его изомер;
б) пропин.
Задание №4. Решите задачи:
Задача 1. Определить массовую долю углерода и водорода в этилене.
Задача 2. Сажа применяется для производства резины. Определить массу сажи (С), которую можно получить при разложении 36г пентана?
Вариант №3.
Задание №1. Составьте модели молекул: а) 1,2-дихлорэтана, б) метилциклопропана
Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Определите во сколько раз дихлорэтан тяжелее воздуха?
Задание №2. Назовите вещества:

Задание №3. Составьве структурные формулы веществ:
а) 2-метилбутен-2 напишите его изомер;
б) 3,4-диметилпентин-1.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу вещества, содержащего 92,3% углерода и 7,7% водорода. Относительная плотность по водороду равна 13.
Задача 2. Какой объем водорода выделится при разложении 29 г бутана (н.у.)?
Вариант №4.
Задание №1. Составьте модели молекул: а) 2,3-диметилбутана, б) хлорциклопропана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества
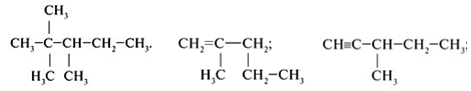
Задание №3. Составьве структурные формулы веществ:
а) 2-метибутадиентен-1,3; напишите изомер.
б) 4-метилпентин-2.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу вещества, содержащего 92,3% углерода и 7,7% водорода. Относительная плотность по водороду равна 39.
Задача 2. Какой объем углекислого газа выделится при полном сгорании 72 г автомобильного топлива, состоящего из пропана?
Практическая работа № 1
«Обнаружение углерода и водорода в органическом соединении.
Обнаружение галогенов (проба Бейльштейна)»
Цель:
Реактивы: парафин, оксид меди (II), сульфат меди (II), известковая или баритовая вода, медная проволока, хлороформ, гексан, гексен-1, 5%-й спиртовой раствор фенилацетилена, толуол, раствор перманганата калия, карбонат натрия, бромная вода, аммиачный раствор хлорида меди (I).
Посуда и оборудование: лабораторный штатив, штатив для пробирок, пробирки, пробка с газоотводной трубкой, спиртовка, спички.
Обнаружение углерода и водорода
Присутствие углерода в органических соединениях в большинстве случаев
можно обнаружить по обугливанию вещества при осторожном его прокаливании. Наиболее
точным методом открытия углерода и одновременно с ним водорода является
сожжение органического вещества в смеси с мелким порошком оксида меди.
Углерод образует с кислородом оксида меди(П) углекислый газ, а водород — воду.
Оксид меди восстанавливается до металлической меди, например:
С13Н28 + 40СuО —> 13С02 + 14Н20
+ 40Сu
Ход работы
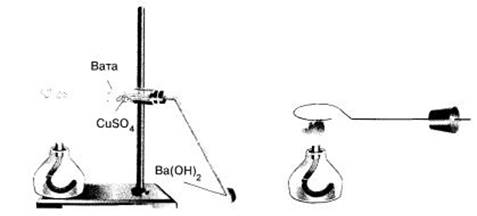
Опыт № 1 Определение углерода и водорода в органическом соединении (парафин)
Соберите прибор, как показано на рисунке .
Смесь 1—2 г оксида меди(II) и -0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди(II). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди(II). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди(II). Нижний конец газоотводной трубки должен быть погружен в пробирку с баритовой водой (раствор гидроксида бария) или известковой водой (раствор гидроксида кальция). Нагрейте пробирку в пламени горелки. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только баритовая вода помутнеет, пробирку с ней следует удалить и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(ІІ) и не вызовут его посинения.
После изменения окраски сульфата меди(ІІ) следует прекратить нагревание.
Вопросы:
1.Почему помутнел раствор баритовой воды?
2.Напишите уравнение реакции.
3.Почему белый порошок сульфата меди(ІІ) стал голубым?
4.Напишите уравнение реакции.
Вывод
Обнаружив образовавшиеся в результате реакции углекислый газ и воду, вы установили в исследованном веществе наличие углерода и водорода. Так как эти элементы не содержались в добавленном оксиде меди(ІІ), то они могли находиться только во взятом для анализа органическом веществе.
Опыт № 2 Обнаружение галогенов (проба Бейльштейна)
Галогены можно обнаружить при помощи реакции окрашивания пламени, предложенную русским химиком Ф. Ф. Бейльштейном.
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в небольшую пробку .
Держа за пробку, прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди(ІІ), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
Лабораторная работа № 2
“Изготовление моделей молекул алканов
и галогеналканов»
Цель работы:
1. Научиться составлять модели молекул органических веществ.
2. Научиться записывать структурные формулы углеводородов и назвать их по международной номенклатуре.
Теоретический материал. Углеводороды это органические вещества, состоящие из атомов углерода и водорода. Атом углерода во всех органических соединениях четырехвалентен. Атомы углерода могут образовывать цепочки прямые, разветвленные, замкнутые. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов между собой. Вещества, имеющие одинаковую молекулярную формулу, но разное строение называются изомерами. Приставки указывают количество ди – два, три – три, тетра - четыре; цикло - означает замкнутый.
Суффиксы в названии углеводородов указывают на наличие кратной связи:
ан одинарная связь между атомами
углерода (С ![]() С);
С);
ен двойная связь между атомами углерода (С = С);
ин тройная связь между атомами
углерода (С ![]() С);
С);
диен две двойных связи между атомами
углерода (С = С ![]() С =
С);
С =
С);
Радикалы: метил -СН3; этил -С2Н5; хлор -Сl; бром -Br.
Задание
Составьте модели молекул бутана, хлорметана.
Лабораторная работа № 3
«Ознакомление со свойствами парафинов.
Получение метана и изучение его
свойств»
Цель работы: при помощи виртуальной лаборатории получить метан и изучить его свойства
Оборудование: Виртуальная химическая лаборатория
|
Название опыта |
Оборудование и вещества |
Наблюдения, выводы, УХР |
|
Опыт 1. Получение метана
|
|
|
|
Опыт 2. Горение метана
|
|
|
|
Опыт 3. Отношение метана к раствору перманганата калия и бромной воде |
|
|
Задания:
Задание №1. Составьте модели молекул: а) 2,3-диметилбутана, б) хлорциклопропана. Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества
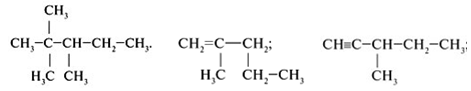
Задание №3. Составьве структурные формулы веществ:
а) 2-метибутадиентен-1,3; напишите изомер.
б) 4-метилпентин-2.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу вещества, содержащего 92,3% углерода и 7,7% водорода. Относительная плотность по водороду равна 39.
Задача 2. Какой объем углекислого газа выделится при полном сгорании 72 г автомобильного топлива, состоящего из пропана?
Лабораторная работа № 4
«Ознакомление с образцами полиэтилена и полипропилена»
Цель работы: Ознакомление с образцами полиэтилена и полипропилена; определение их свойств.
Оборудование: тигельные щипцы, фарфоровая чашка, стеклянная палочка, спиртовка, спички, спиртовка, образцы полиэтилена, перманганат калия KMnO4, гидроксид натрия NaOH концентрированный.
Теоретический материал
Практически наиболее важными свойствами полиэтилена (-СН2-СН2 )n являются его термопластичность, высокая химическая стойкость, нерастворимость в растворителях и отсутствие электропроводности. В состав сополимеров (PP-В/PP-C) входит полиэтилен, поэтому сополимеры обладают высокой пластичностью и могут использоваться при температуре до -20°С, но по сравнению с гомополимером менее устойчивы к высоким температурам.
Полипропилен (РР) получают полимеризацией газа пропилена с применением катализаторов. Полипропилен обладает высокой ударной вязкостью и повышенной износостойкостью, стоек к многократным изгибам (при холодной гибки ограничен радиус изгиба), физиологически безвреден и годен к контакту с питьевой водой и пищевыми продуктами, водонепроницаем, обладает коррозионной стойкостью, низкой теплопроводностью, точка плавления 160˚С. Полипропилен не обладает запахом, не тонет в воде, в огне горит без дыма, запах при горении острый и сладковатый, плавится каплями. По способу полимеризации полипропилен делится на гомополимер, получаемый полимеризацией одинаковых мономеров, и сополимер, получаемый полимеризацией разных мономеров. Гомополимеры (PP-H) обладают высокой твердостью, жесткостью и прочностью на растяжение, но при температуре близкой к нулю становятся хрупкими
Задание:
Определить свойства полиэтилена и полипропилена.
Порядок работы:
1) Изделие из полиэтилена нагреть в фарфоровой чашке над пламенем спиртовки. Заметьте, что материал быстро размягчается, а затем плавиться.
2) Стеклянной палочкой измените его форму (вытяните в нить) и дайте изделию остыть.
3)Попытайтесь изменить форму образца при обычной температуре. Приданная ему при этом форма прочно закрепляется.
Контрольные вопросы:
1) Какое свойство полиэтилена лежит в основе наблюдаемых явлений? При каких условиях это свойство проявляется? Какое практическое значение оно имеет?
2) Обратите внимание, горит ли полиэтилен вне пламени? Какого цвета пламя? Образуется ли при этом копоть? Обладают ли продукты сгорания запахом?
Содержание отчета:
1. Дать ответы на контрольные вопросы;
2. Оформить работу в тетради в виде таблицы:
Практическая работа № 2
“Получение этилена дегидратацией этилового спирта.
Взаимодействие
этилена с бромной водой, раствором перманганата калия»
Цель работы: при помощи виртуальной лаборатории получить метан и изучить его свойства
Оборудование: Виртуальная химическая лаборатория
Основные теоретические положения
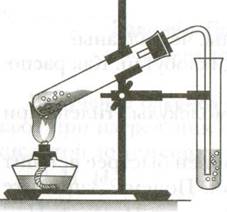
В пробирку налить 1 мл этилового спирта С2Н5ОН и осторожно добавьте 6—9 мл концентрированной серной кислоты H2SO4 .
Затем всыпать немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении).
Закрыть пробирку пробкой с газоотводной трубкой, закрепить ее в штативе и осторожно нагреть содержимое пробирки.
|
Название опыта |
Оборудование и вещества |
Наблюдения, выводы, УХР |
|
Опыт 1. Получение этилена
|
|
1. При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь. 2. При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь. 3. В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода.
|
|
Опыт 2. Горение этилена
|
|
|
|
Опыт 3. Отношение этилена к раствору перманганата калия и бромной воде |
|
|
Задания:
1. Что общее и в чем отличие химических свойств метана (алкан) и этилена (алкен)?
Лабораторная работа № 5
«Изготовление моделей молекул алкинов
и их их изомеров»
Цель работы:
1. Научиться составлять модели молекул органических веществ.
2. Научиться записывать структурные формулы углеводородов и назвать их по международной номенклатуре.
Теоретический материал. Углеводороды это органические вещества, состоящие из атомов углерода и водорода. Атом углерода во всех органических соединениях четырехвалентен. Атомы углерода могут образовывать цепочки прямые, разветвленные, замкнутые. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов между собой. Вещества, имеющие одинаковую молекулярную формулу, но разное строение называются изомерами. Приставки указывают количество ди – два, три – три, тетра - четыре; цикло - означает замкнутый.
Суффиксы в названии углеводородов указывают на наличие кратной связи:
- ан одинарная связь между атомами
углерода (С ![]() С);
С);
- ен двойная связь между атомами углерода (С = С);
- ин тройная связь между атомами
углерода (С ![]() С);
С);
- диен две двойных связи между атомами
углерода (С = С ![]() С =
С);
С =
С);
Радикалы: метил -СН3; этил -С2Н5; хлор -Сl; бром -Br.
Задание
Составьте модели молекул ацетилена, пропина-1.
Лабораторная работа № 6
“Определение наличия непредельных углеводородов в нефтепродуктах и растительном масле.
Растворимость различных
нефтепродуктов друг в друге»
Цель работы: состоит в применении знаний о качественной реакции на кратные связи для обнаружения непредельных соединений в жидких нефтепродуктах и растительном масле.
Оборудование: керосин, растительное масло, перманганат калия
Теоретический материал.
Непредельными (или ненасыщенными) называются углеводороды, имеющие в молекуле хотя бы одну кратную (двойную, тройную) углерод - углеродную связь.
Если кратных связей в молекуле нет, вещество называют предельным (насыщенным).
Стабильность топлива - способность сохранять свои свойства в условиях хранения и эксплуатации.
Система контроля качества топлива при помощи различных методов позволяет судить о пригодности топлива к применению. Товарные реактивные топлива, представляющие собой преимущественно продукты прямой перегонки нефти, состоят в основном из насыщенных углеводородов, которые весьма стабильны. Продолжительность их хранения без заметного изменения качества должна измеряться годами. Однако в топливе при хранении под влиянием молекулярного кислорода воздуха могут протекать процессы, связанные с образованием смол.
Окисляемость топлива в условиях хранения в основном зависит от его химического состава, а также от метода получения, очистки и условий хранения.
Известно, что основной причиной малой стабильности является наличие в топливе непредельных соединений. Исследованием окисления топлив типа керосина в условиях температур окружающего воздуха было установлено, что топливо ТС-1, полученное прямой перегонкой, окисляется с большим трудом и продукты окисления накапливаются в нем очень медленно.
В топливах, полученных путем термического крекинга, продукты окисления накапливаются быстро. Это объясняется тем, что продукты термического крекинга содержат значительное количество малостабильных непредельных углеводородов. Окисление непредельных углеводородов протекает, в первую очередь, по С—Н связи с образованием гидроперекисей (соединений типа R—О—О—Н и R—О—О—R).
Применение нефтепродуктов с большим содержанием смол приводит к образованию смолистых отложений во впускных патрубках и клапанах карбюраторных двигателей, закоксовыванию форсунок двигателей и к другим неполадкам. Образующиеся в процессе автоокисления перекиси снижают детонационную стойкость бензинов, а появление органических кислот обусловливает склонность таких нефтепродуктов вызывать сильную коррозию топливных систем баков и тары.
Опыт № 1. Определение наличия олефинов (смол) в бензинах
Для определения наличия непредельных углеводородов в пробирку налить 3 мл исследуемого керосина, добавить 2 мл слабого раствора перманганата калия KMnO4 (раствор слабо малинового цвета) и несколько капель раствора серной кислоты H2SO4. Содержимое пробирки тщательно перемешать в течение 20 с и поставить в штатив. После расслоения жидкостей отметить окраску нижнего водного слоя. Малиновый цвет свидетельствует об отсутствии в бензине олефинов, обесцвечивание водного слоя – подтверждает присутствие непредельных углеводородов в данном виде топлива.
Контрольные вопросы
1. Почему недопустимо наличие непредельных углеводородов в нефтепродуктах?
2. Чем обусловлено появление смолистых отложений на деталях двигателя?
3. Что вызывает коррозию топливных систем?
4. Чем можно охарактеризовать стабильность нефтепродуктов?
5. Какой способ применяется для определения содержания непредельных углеводородов?
Опыт № 2. Растворимость различных нефтепродуктов (бензина, керосина, дизельного топлива, вазелина, парафина) друг в друге.
Поочередно проделать опыты с выданными вам веществами. Каждое вещество испытать на растворимость.
Полученные результаты занести в таблицу:
|
|
Бензин |
Керосин
|
Дизельное топливо |
Вазелин
|
Парафин
|
|
Бензин |
|
|
|
|
|
|
Керосин |
|
|
|
|
|
|
Дизельное топливо |
|
|
|
|
|
|
Вазелин |
|
|
|
|
|
|
Парафин |
|
|
|
|
|
Сделайте вывод: какие органические растворители самые эффективные на ваш взгляд.
Практическая работа № 3
“Изучение
растворимости спиртов в воде. Окисление спиртов. Получение диэтилового эфира.
Получение глицерата меди»
Цель: Изучить растворимость спиртов в воде. Провести реакции окисления спиртов различного строения хромовой смесью, получить диэтиловый эфир и глицерат меди.
Ход работы
Вопросы для повторения
1. Какие вещества называются спиртами?
2. Классификация спиртов?
3. Химические свойства спиртов.
4. В чем опасность употребления спиртных напитков?
5. Осуществите превращения:
метан →хлорметан→этан→этен→этанол→этилат натрия
Выполните виртуальные опыты (раздел «Спирты»), заполните таблицу
|
Название опыта |
Оборудование |
Вещества |
Что делаем |
УХР |
|
Опыт № 1 Растворимость спиртов в воде
|
|
|
В отдельные пробирки прилейте по 1—2 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2—3 мл воды и взболтайте. Отметьте, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде маслянистого слоя над водой.
|
|
|
Опыт № 2 Получение глицерата меди
|
|
|
В пробирку налейте около 1 мл 10% -ного раствора сульфата меди(II) и добавьте немного 10% -ного раствора гидроксида натрия до образования голубого осадка гидроксида меди(II). К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.
|
|
|
Опыт № 3 Окисление этилового спирта хромовой смесью
|
|
|
В пробирке смешайте 2 мл 5% -ного раствора дихромата калия, 1 мл 20%-ного раствора серной кислоты и 0,5 мл этилового спирта. Отметьте цвет раствора. Осторожно нагрейте смесь на пламени горелки до начала изменения цвета. При этом ощущается характерный запах уксусного альдегида, образующегося в результате реакции.
|
|
Вопросы к опыту 2:
1. Какая реакция лежит в основе получения гидроксида меди(II)? Напишите уравнение этой реакции.2. Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II).3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Вопросы к опыту 3:
1. Почему цвет раствора меняется с оранжевого до синевато-зеленого? Напишите уравнение реакции окисления этилового спирта.
2. Можно ли заменить серную кислоту в данной реакции на соляную?
Практическая работа № 4
«Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди (II). Взаимодействие формальдегида с гидросульфитом натрия»
Цель работы: закрепить знания о свойствах альдегидов и с помощью качественных реакций распознавать альдегиды среди органических соединений.
Оборудование и реактивы приведены после условия каждого этапа работы.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!










Оборудование:
Справочники, виртуальная химическая лаборатория.
Порядок выполнения работы:
I. Повторение .Вопросы:
Опишите физические свойства альдегидов и карбоновых кислот.
Опишите где применяются альдегиды и карбоновые кислоты.
II. Тестирование
Тема: «Альдегиды»
1. Выберите альдегидную группу:
a) COH; б) COOH; в) OH
2. Формула уксусного альдегида:
a) НCOH; б) CH3COOH; в) CH3COH
3. Формула формальдегида:
a) НCOH; б) CH3OH; в) CH3COH
4. Формула метаналя:
a) НCOH; б) CH3COOH; в) C 6H12O6
5. Альдегиды:
a) содержат гидроксильную группу; б) содержат альдегидную группу;
в) содержат карбоксильную группу
6. Название вещества CH3COH:
a) ацетальальдегид; б) уксусная кислота; в) этанол
7. Формула этанола:
a) НCOH; б) C 2H5OH; в) CH3COH
8. Выберите многоатомный спирт:
a) CH2OHCHOHCH2OH; б) C 3H7OH; в) CH3COH
9. Выберите формулу пропанола:
a) C 2H2; б) C 3H7OH; в) CH3COH
10. Выберите формулу бутаналя:
a) CH2OHCHOHCH2OH; б) C 3H7OH; в) C3H7COH
III. Свойства альдегидов и карбоновых кислот
(Виртуальная химическая лаборатория)
Заполните таблицу
|
Название опыта |
Вещества и оборудование |
Наблюдения, УХР, выводы |
|
Получение альдегидов
|
|
|
|
Реакция серебряного зеркала |
|
|
|
Реакция с гидроксидом меди |
|
|
Ш. Осуществите превращения
1. Метан→ ацетилен →уксусный альдегид →уксусная кислота →этиловый эфир уксусной кислоты
2. Хлорэтан→бутан →бутен→бутин→бутанол→бутаналь→бутановая кислота →метиловый эфир бутановой кислоты
Практическая работа № 5
«Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты. Сравнение степени ненасыщенности твердого и жидкого жиров. Омыление жира. Получение мыла и изучение его свойств: пенообразования, реакций ионного обмена, гидролиза, выделения свободных жирных кислот»
Цель работы: закрепить знания о свойствах карбоновых кислот и с помощью качественных реакций распознавать карбоновые кислоты среди органических соединений.
Оборудование и реактивы приведены после условия каждого этапа работы.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!










Оборудование:
Справочники, виртуальная химическая лаборатория.
Порядок выполнения работы:
Карбоновые кислоты
11. Выберите карбоксильную группу:
a) COH; б) COOH; в) OH
12. Формула уксусной кислоты:
a) НCOH; б) CH3COOH; в) CH3COH
13. Формула муравьиной кислоты:
a) НCOOH; б) CH3OH; в) CH3COH
14. Муравьиная кислота содержится:
a) в муравьях и крапиве; б) в хвоще; в) в мёде
15. Одноосновные карбоновые кислоты содержат:
a) содержат две карбоксильные группы;
б) содержат три карбоксильные группы;
в) содержат одну карбоксильную группу
16. Качественная реакция на карбоновые кислоты:
a) взаимодействие с перманганатом калия; б) взаимодействие с хлоридом железа; в) взаимодействие с бромом
17. Уксусная кислота:
a) Жидкость; б) бесцветное кристаллическое вещество с характерным запахом; в) газ
8. Карбоновые кислоты взаимодействуют с металлами:
a) 2CH3COOH + 2Na= 2CH3COO Na + H2;
б) 2C2H5OH + 2Na= 2C2H5ONa + H2;
в) 2CH3OH + 2Na= 2CH3ONa + H2;
9. Валерьяновая кислота содержится в:
а) корнях валерьяны; б) хвое; в) подорожнике
10. Уксусная кислота может взаимодействовать с этанолом в результате образуется: а) простой эфир; б) сложный эфир; в) альдегид
Свойства карбоновых кислот
(Виртуальная химическая лаборатория)
Заполните таблицу
|
Название опыта |
Вещества и оборудование |
Наблюдения, УХР, выводы |
|
Получение карбоновых кислот
|
|
|
|
Реакция этерификации |
|
|
|
Выделение карбоновых кислот из мыла |
|
|
Ш. Осуществите превращения
1. Метан→ ацетилен →уксусный альдегид →уксусная кислота →этиловый эфир уксусной кислоты
2. Хлорэтан→бутан →бутен→бутин→бутанол→бутаналь→бутановая кислота →метиловый эфир бутановой кислоты
Лабораторная работа № 7
«Ознакомление с физическими свойствами глюкозы.
Кислотный гидролиз сахарозы.
Обнаружение крахмала»
Цель работы: закрепить знания о свойствах углеводов и с помощью качественных реакций распознавать углеводы среди органических соединений.
Оборудование и реактивы приведены после условия каждого этапа работы.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!










Оборудование:
Справочники, виртуальная химическая лаборатория.
(Виртуальная химическая лаборатория)
Заполните таблицу
|
Название опыта |
Вещества и оборудование |
Наблюдения, УХР, выводы |
|
Ознакомление с физическими свойствами глюкозы.
|
|
|
|
Кислотный гидролиз сахарозы.
|
|
|
|
Обнаружение крахмала |
|
|
Практическая работа №6
«Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу. Обнаружение лактозы в молоке. Действие йода на крахмал»
Цель работы: закрепить знания о свойствах углеводов и с помощью качественных реакций распознавать углеводов среди органических соединений.
Оборудование и реактивы приведены после условия каждого этапа работы.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!










Оборудование:
Справочники, виртуальная химическая лаборатория.
(Виртуальная химическая лаборатория)
Заполните таблицу
|
Название опыта |
Вещества и оборудование |
Наблюдения, УХР, выводы |
|
Реакция «серебряного зеркала» глюкозы.
|
|
|
|
Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. |
|
|
|
Действие аммиачного раствора оксида серебра на сахарозу. |
|
|
|
Обнаружение лактозы в молоке. |
|
|
|
Действие йода на крахмал |
|
|
Лабораторная работа № 8
«Растворение белков в воде и их коагуляция. Обнаружение белка в курином яйце и молоке»
Цель: Овладение навыками проведения химических опытов, подтверждающих свойства белков.
Оборудование и реактивы:
Штатив с пробирками, держатель, горелка, спички, дистиллированная вода, раствор хлористого калия, кератин (шерсти или волос), раствор медного купороса, раствор ацетата свинца (или «Виртуальная химическая лаборатория»)
Белками или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки - амфотерные электролиты. При определенном значении рН среды число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка.
Большинство белков относятся к высокомолекулярным соединениям, которые хорошо растворяются в воде. Растворение белков в воде связано с гидратацией его молекул и образованием вокруг частиц белка гидратной оболочки. Любые физические и химические факторы, нарушающие гидратацию молекул белка и нейтрализующие их заряд, приводят к понижению растворимости белка и способствуют выпадению его в осадок. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, а в щелочной - белки, обладающие основными свойствами. Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов. Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.).
Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести – седиментацией. Обычно коагуляция происходит при прибавлении к золю электролита, другого золя, частицы которого имеют противоположный заряд, и при нагревании. Чаще всего золи коагулируют прибавлением электролита. В этом случае происходит нейтрализация зарядов коллоидных частиц ионами электролита. Причем золи, содержащие положительно заряженные частицы, коагулируют под действием анионов, а золи, содержащие отрицательно заряженные частицы, - под действием катионов. Признаком коагуляции служит помутнение золя и дальнейшее образование осадка. Минимальная концентрация электролита, вызывает явную коагуляцию.
Ход работы
Чтобы успешно выполнить задания, воспользуйтесь следующими рекомендациями:
1.Познакомьтесь с темой, целью и содержанием задания.
2.Проверьте наличия на вашем столе необходимого оборудования.
3.Соблюдайте последовательность действия, придерживайтесь инструкции, предложенной в тетради.
4.Отчет о выполнении химического эксперимента составьте согласно указаниям в тетради. В этом вам помогут содержание тетради, таблицы, схемы.
5.Обратите внимание на правильность записанных уравнений химических реакций, сделанных выводов из проделанной работы.
Выполнение работы
1. Растворение белков в воде.
1.1.В пробирку с водой поместите немного куриного белка и перемешайте стеклянной палочкой. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка. Запишите наблюдения.
Приготовление раствора белка. Для этого белок куриного яйца растворяют в 150 мл воды.В пробирку наливают 4-5 мл раствора белка и нагревают до кипения. Охлаждают содержимое пробирки. Разбавляют водой в 2 раза.
Почему раствор белка при нагревании мутнеет? Почему образующийся при нагревании осадок не растворяется при охлаждении и разбавлении водой?
1.2. В пробирки поместите по 2-3 мл растворителя (воды, соляной кислоты, гидроксида натрия). В каждую пробирку бросьте кусочек ногтя, волос, шерсть, перо. Нагрейте пробирки. Что наблюдаете?
2.1. Осаждение белка солями тяжелых металлов.
В 2 пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжелыми металлами. Запишите наблюдения.
Контрольные вопросы
1. Какой состав имеет молекула белка?
2. Какова структура белковой молекулы?
3. С чем связано растворение белков в воде?
4.От чего зависит растворимость белка в воде?
5.Что называется коагуляцией?
6. Какие условия необходимы для коагуляции?
Обнаружение белков в курином яйце и молоке
Выполнение работы
1. Обнаружение белка в курином яйце и молоке.
1.1. Приготовление раствора белка. Для этого белок куриного яйца растворите в 150 мл воды.
1.2.В одну пробирку прилейте 4мл раствора куриного яйца а, в другую пробирку - 4мл молока и в каждую пробирку добавьте 4мл щелочи NaOH и 2мл раствора соли CuSO4. Появление характерного фиолетового окрашивания указывает на наличие белка.
Контрольные вопросы
1. Какой состав имеет молекула белка?
2. Какова структура белковой молекулы?
3. Какие химические соединения в организме используются для синтеза белков?
4. Что происходит с белками под действием внешних факторов?
Практическая работа №7
«Денатурация белка. Цветные реакции белков»
Цель: Овладение навыками проведения химических опытов, подтверждающих свойства белков.
Белками или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки - амфотерные электролиты. При определенном значении рН среды число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка.
Большинство белков относятся к высокомолекулярным соединениям, которые хорошо растворяются в воде. Растворение белков в воде связано с гидратацией его молекул и образованием вокруг частиц белка гидратной оболочки. Любые физические и химические факторы, нарушающие гидратацию молекул белка и нейтрализующие их заряд, приводят к понижению растворимости белка и способствуют выпадению его в осадок. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, а в щелочной - белки, обладающие основными свойствами. Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов. Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.).
Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести – седиментацией. Обычно коагуляция происходит при прибавлении к золю электролита, другого золя, частицы которого имеют противоположный заряд, и при нагревании. Чаще всего золи коагулируют прибавлением электролита. В этом случае происходит нейтрализация зарядов коллоидных частиц ионами электролита. Причем золи, содержащие положительно заряженные частицы, коагулируют под действием анионов, а золи, содержащие отрицательно заряженные частицы, - под действием катионов. Признаком коагуляции служит помутнение золя и дальнейшее образование осадка. Минимальная концентрация электролита, вызывает явную коагуляцию.
(Виртуальная химическая лаборатория)
Заполните таблицу
|
Название опыта |
Вещества и оборудование |
Наблюдения, УХР, выводы |
|
Денатурация белка. |
|
|
|
Цветные реакции белков |
|
|
|
Ксантопротеиновая реакция |
|
|
|
Биуретовая реакция |
|
|
Лабораторная работа № 9
«Изготовление объемных и шаростержневых моделей азотистых гетероциклов»
Цель работы:
-дать представление о шаростержневых и объемных моделях азотистых гетероциклов;
-научить моделировать молекулы азотистых гетероциклов на компьютере, используя обучающий диск «Виртуальная лаборатория 8-11 класс»,
-закрепить умения, подтверждающие теоретические знания по темам «Теория строения органических соединений А.М.Бутлерова» и «Нуклеиновые кислоты», моделированием на компьютере органические соединения.
Оборудование: компьютер, проектор, экран, обучающий диск «Виртуальная лаборатория 8-11 класс».
Задание. Изготовление шаростержневых и объемных моделей молекул азотистых гетероциклов: тимина, цитозина, аденина, гуанина и их радикалов.
Смоделируйте по желанию одну молекулу гетероцикла на компьютере. Обратите внимание на пространственные формы, на цвет и размер атомов водорода, углерода, кислорода и азота, на образование σ- и π-связи между атомами, их длину и угол связи С-С, вид гибридизации атома углерода.
Ответьте на вопросы:
1.Приведите определение «гетероциклические соединения» и составьте по выбору одну структурную формулу, назовите ее.
2.Какиеми свойствами кислотными или основными они обладают и почему?
3.В чем заключается сущность комплементарности?
4.Какие пары гетероциклов комплементарны?
5.Какой химической связью связаны между собой комплементарные основания?
6.В состав каких кислот входят гетероциклические соединения?
7.Объясните биологическое значение нуклеиновых кислот.
Практическая работа №8
«Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Обнаружение D в рыбьем жире или курином желтке»
Цель: Овладение навыками проведения химических опытов, подтверждающих свойства витаминов.
Опыт 1. Определение витамина А в подсолнечном масле. Условия выполнения работы: В пробирку налили 1 мл подсолнечного масла и добавили несколько капель 1%-го раствора FeCl3. Если наблюдается ярко-зелёное окрашивание, то в масле содержался витамин А.
Опыт 2. Определение витамина С в яблочном соке. Условия выполнения работы: В пробирку налили 2 мл сока и добавили воды, доведя объём до 10 мл. Затем добавили немного крахмального клейстера. Затем по каплям до появления устойчивого синего окрашивания на 10-15 с добавляют раствор иода.
Техника определения витамина С основана на том, что молекулы аскорбиновой кислоты легко окисляются иодом. Как только иод окислит всю аскорбиновую кислоту, следующая же капля, прореагировав с крахмалом, окрасит раствор в синий цвет.
Опыт 3. Определение витамина D в рыбьем жире. Условия выполнения работы: В пробирку налили 1 мл рыбьего жира и прилили 1 мл раствора брома. Если наблюдается зеленовато-голубое окрашивание, то в жире содержался витамин D.
I. Решение задач
1. Определить формулу органического соединения, если известно, что в нем углерода содержится 82,8 %, водорода - 17,2 %, плотность вещества 2,59 г/ л.
2. Определить формулу органического соединения, если известно, что в нем углерода содержится 82,3 %, водорода - 7,7 %, плотность вещества 1,16 г/ л.
3. Осуществить превращения: метан®ацетилен®уксусный альдегид®уксусная кислота
4. Осуществить превращения: этан®этен®этанол®хлорэтан
Список литературы и источников информации
Основные источники:
1 Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2014.
2 Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2013.
3 Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2014.
4 Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. – М., 2014.
5 Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2012.
6 Габриелян О.С. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Г.Г.Лысова. – М., 2014.
7 Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2012.
8 Габриелян О.С. Химия: орган. химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова – М., 2015.
Дополнительные источники:
1 Габриелян О.С. Химия для преподавателя: учебно-методическое пособие / О.С. Габриелян, Г.Г. Лысова – М., 2006.
2 Габриелян О.С. Настольная книга учителя химии: 10 класс / О.С. Габриелян, И.Г. Остроумов – М., 2004.
3 Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская – М., 2004.
4 Аршанский Е.А. Методика обучения химии в классах гуманитарного профиля – М., 2003.
5 Кузнецова Н.Е. Обучение химии на основе межпредметной интеграции / Н.Е. Кузнецова, М.А. Шаталов. – М., 2004.
6 Чернобельская Г.М. Методика обучения химии в средней школе. – М., 2003.
7 Габриелян О.С. Лысова Г.Г. Химия для преподавателя: методическое пособие. – М., 2004.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.