
Кубанский медицинский институт
Кафедра функциональных дисциплин
МАТЕРИАЛЫ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО НОРМАЛЬНОЙ ФИЗИОЛОГИИ
ФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
учебно-Методическое пособие
ДЛЯ СТУДЕНТОВ ЛЕЧЕБНОГО, ПЕДИАТРИЧЕСКОГО И СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТОВ медицинских вузов
А. П. Парахонский

Краснодар
2019
Под системой крови понимают периферическую кровь, циркулирующую по сосудам и состоящую из жидкой части и форменных элементов, органы кроветворения (гемопоэза) и органы кроверазрушения (гемодиереза). Все эти элементы объединяются в одно целое регуляторными механизмами, обеспечивающими постоянство состава форменных элементов крови в норме и его разнообразные изменения в условиях патологии. Особенности крови:
- все её составные части образуются за пределами сосудистого русла;
- межклеточное вещество ткани является жидким;
- основная часть крови находится в постоянном движении.
Кровь выполняет следующие функции:
- транспортную, определяющую перенос кислорода, энергетического и пластического материала, а также регулирующих веществ гормонов и некоторых биологически активных субстанций к клеткам организма и удаление из них продуктов метаболизма (углекислый газ и др.);
- защитную, характеризующуюся проявлениями клеточного и гуморального иммунитета;
- гемостатическую – поддержание реологических свойств (текучесть) и остановка кровотечения при повреждении стенки сосудов;
- гомеостатическую (поддержание кислотно-основного баланса и водно-солевого обмена, температуры тела).
Кровь – это внутренняя среда организма, обеспечивающая клеткам, тканям и органам возможность осуществлять процессы их жизнедеятельности.
Способность крови выполнять свои физиологические функции зависит от функциональных, морфологических и регуляторных свойств этой системы. Какие же это свойства?
1). Высокая митотическая активность гемопоэтической ткани обусловливает оптимальную концентрацию клеток эритроцитарного и лейкоцитарного ряда, что обеспечивает необходимую кислородную ёмкость крови и резистентность организма к микроорганизмам и другим антигенам.
2). Наследственно закрепленная закономерность размножения и дифференцировки.
3). Регуляция образования клеток крови с помощью эритро-, лейко- и тромбоцитопоэтинов, при дефиците которых возникают изменения крови, имеющие отрицательное биологическое значение.
Физико-химические свойства крови.
Цвет крови определяется наличием в эритроцитах белка гемоглобина.
Плотность крови определяется по отношению к вязкости воды и соответствует 4,5-5,0. Вязкость плазмы 1,8-2,2.
Осмотическое давление крови зависит в основном от растворённых в ней низкомолекулярных соединений (солей – в основном NaCl). ОСМОС – направленное движение жидкости через биологическую полупроницаемую мембрану в направлении большей концентрации веществ. ОсмД – это сила, способствующая движению жидкости из менее в более концентрированный раствор. ОД крови равно 7,6 атм.
Онкотическое давление является частью осмотического и зависит от содержания крупномолекулярных соединений (белков) в растворе. В крови оно в большей степени зависит от альбуминов и не превышает 30 мм рт. ст. ОнкД способствует удержанию воды в сосудистом русле.
Температура крови. Зависит от интенсивности обмена веществ и энергии (37-40°С).
Концентрация Н+ и регуляция рН крови.
Постоянство pН внутренней среды является необходимым условием существования человека и высших организмов. Оно обеспечивается определенным соотношением кислот и щелочей (оснований) в биологических средах, при нарушениях которого организм может погибнуть. Кислотами называются вещества, которые в растворах отдают ионы водорода (доноры протонов), а основаниями – вещества, связывающие эти ионы (акцепторы протонов).
Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода. Показателем этого содержания служит pН артериальной крови при температуре 37оС. В норме pН колеблется в пределах 7,37-7,43, составляя в среднем 7,4. Сдвиг pН на 0,1 за пределы физиологических колебаний приводит к значительным нарушениям функционирования жизнеобеспечивающих систем, сдвиг на 0,3 обычно вызывает коматозное состояние, а на 0,4 – часто несовместимо с жизнью.
В организме имеются мощные гомеостатические механизмы, которые способны, во-первых, экстренно взаимодействовать с избытком водородных ионов или высвобождать дополнительное их количество при их недостатке; во-вторых, более или менее быстро удалять из крови углекислоту; в-третьих, достаточно медленно экскретировать нелетучие кислоты и основания. Данные механизмы, поддерживающие постоянство pН, осуществляются при участии: буферных систем крови и клеток; дыхательной системы; выделительных органов. Под буфером понимают водный раствор слабой кислоты и сопряженного с ней хорошо растворимого основания. Общим свойством буферов является способность препятствовать изменению pН раствора при внесении в него щелочей или кислот.
Постоянство рН крови поддерживается буферными системами: гемоглобиновой, карбонатной, фосфатной и белками плазмы. На долю гемоглобиновой приходится 75% буферной ёмкости крови. Главная роль гемоглобиновой буферной системы заключается в ее участии в транспорте CO2 от тканей к легким.
Кислород в эритроците соединяется с гемоглобином, образуя оксигемоглобин (HbO2), имеющий очень кислую реакцию, но pН крови не изменяется, так как в эритроците есть бикарбонат калия (KHCO3). К оксигемоглобину присоединяется калий (KHbO2), а ион бикарбоната (HCO3)- взаимодействует с водородным ионом (Н+), образуя угольную кислоту (H2CO3), которая является более слабой кислотой, чем HbO2 (оксигемоглобин). Под влиянием карбоангидразы угольная кислота диссоциирует на воду и углекислый газ (H2O и CO2). CO2, раздражая дыхательный центр, выводится из организма через легкие.
Суспензионная устойчивость крови (СОЭ).
Кровь – суспензия (взвесь). Все клетки крови имеют отрицательный заряд. При его уменьшении (адсорбция крупномолекулярных белков) образуются «монетные столбики», нарушающие микроциркуляцию.
Величина СОЭ зависит от пола и возраста. У новорожденных – 1-2 мм/ч, у детей> 1 года и у мужчин – 6-12 мм/ч, у женщин 8-15 мм/ч, у пожилых людей – 15-20 мм/ч. Увеличение содержания фибриногена (> 4 г/л) повышает СОЭ (особенно при беременности). СОЭ повышается при патологии. Уменьшение СОЭ – неблагоприятный признак.
В здоровом организме весь объем циркулирующей крови (ОЦК) условно разделяют на два постоянно взаимодействующих друг с другом объема крови. Объем быстро циркулирующей крови (около 60% ОЦК – центральный объем крови, участвующий в обеспечении макроциркуляции, заполняющий полости сердца, аорту и сосуды диаметром более 100 мк, а также артериовенозные шунты) и медленно циркулирующий объем крови (около 40% ОЦК), который заполняет функционирующие сосуды микроциркуляторного русла.
При уменьшении ОЦК любого происхождения включаются компенсаторные механизмы, обеспечивающие нормализацию кровоснабжения жизненно важных органов, головного мозга, сердца. Это достигается перераспределением крови – медленно циркулирующий объем крови уменьшается и за счет него нормализуется быстро циркулирующий объем. Этот механизм осуществляется благодаря спазму прекапилляров и артериол и расширению артериовенозных анастомозов кожи, подкожной клетчатки, печени, мышц кишечника и других органов.
Такое шунтирование позволяет некоторое время поддерживать неизменным быстро циркулирующий (центральный) объем крови. По мере уменьшения ОЦК медленно циркулирующий объем крови начинает увеличиваться, что отражает процесс декомпенсации. Расширяются артериолы, прекапилляры, происходит патологическое депонирование крови в сосудах микроциркуляторного русла.
Объем циркулирующей крови у человека величина постоянная. На нормальном уровне она поддерживается механизмами транскапиллярного обмена жидкости и клеточного состава крови. У взрослых здоровых людей ОЦК составляет 7-8% от массы тела, (80-85 мл/кг веса) т.е. в среднем около 5 литров. ОЦК зависит от пола, возраста и содержания жировой ткани. У детей первых месяцев жизни ОЦК составляет 10-11% от массы тела. ОЦК повышается при увеличении содержания жировой ткани.
ОЦК является суммой объема плазмы и форменных элементов, главным образом эритроцитов. Относительные объемы плазмы и эритроцитов определяют путем центрифугирования крови с антикоагулянтами. Объем форменных элементов по отношению к объему плазмы называется гематокритом (Ht). В норме Ht равен 45:55. У мужчин Ht – 0,44 – 0,46. У женщин Ht – 0,41 – 0,43
Гематокрит является важным показателем, по которому судят о различных нарушениях общего объема крови и изменениях соотношения плазмы и форменных элементов крови. Гематокрит определяется по методу Унитроба, с помощью центрифугирования (центрифуга Шкляра) путем разделения в стандартной пробирке (или капилляре) на плазму и эритроциты. Значение гематокрита крови, взятой из разных органов, различаются благодаря особым реологическим свойствам эритроцитов. Гематокрит связан с вязкостью крови.
Вязкость Н2О = 1,0. Вязкость крови = 4,5 (3,5-5,4). Вязкость плазмы = (1,9-2,6)
Увеличение гематокрита сопровождается увеличением вязкости крови и как следствие повышению нагрузки на сердце.
При патологии возможно, как увеличение, так и уменьшение ОЦК.
Нормальный объем циркулирующей крови называется нормоволемией. Различают следующие виды нормоволемии:
- простая нормоволемия, когда гематокрит не изменен и равен норме 45:55;
- полицитемическая нормоволемия характеризуется нормальным объемом циркулирующей крови и увеличением числа форменных элементов, что сопровождается увеличением гематокрита. Этот вид нормоволемии бывает при переливании небольших количеств крови.
нормоволемия
![]()
![]() 45% 55%
45% 55%
простая нормоволемия
![]() олигоцитемеческая нормоволемия
олигоцитемеческая нормоволемия
![]() полицитемеческая
нормоволемия
полицитемеческая
нормоволемия
![]()
простая гиповолемия
![]()
олигоцитемическая гиповолемия![]()
полицитемическая гиповолемия
![]()
![]() гиперволемия
простая гиперволемия
гиперволемия
простая гиперволемия
гиперволемия
олигоцитемическая гиперволемия
![]()
![]()
полицитемическая гиперволемия
![]()
![]()
![]() форменные элементы плазма
форменные элементы плазма
Увеличение общего объема циркулирующей крови называется гиперволемией и может происходить как за счет одновременного нарастания объема плазмы и форменных элементов, так и за счет увеличения только форменных элементов (эритроцитов) или только плазмы. В соответствии с этим различают следующие виды гиперволемии:
- гиперволемию простую с нормальным соотношением форменных элементов и плазмы; олигоцитемическую; полицитемическую.
Простая гиперволемия бывает редко, наблюдается непосредственно после переливания больших доз крови.
Олигоцитемическая гиперволемия возникает в результате увеличения объема плазмы (гематокрит снижен). Олигоцитемическая гиперволемия может быть результатом избыточного поступления жидкости в организм (при быстром удовлетворении чувства жажды, переливании плазмы или плазмозаменителей) или результатом снижения выведения жидкости из организма. Нормальным состоянием, при котором развивается олигоцитемическая гиперволемия, является беременность (во время беременности ОЦК возрастает на 30-40%, гематокрит снижается, что улучшает микроциркуляцию и обеспечивает нормальный трансплацентарный обмен).
Уменьшение объема крови называют гиповолемией.
Различают три вида гиповолемии:
- гиповолемия простая одновременное уменьшение плазмы и форменных элементов при сохранении их соотношения, т.е. гематокрит не изменяется. Развивается сразу после острой кровопотери и сохраняется в течение 3-6 часов пока жидкость из тканей не перейдет в кровь;
- гиповолемия полицитемическая характеризуется уменьшением объема плазмы при относительном увеличении объема форменных элементов (гематокрит увеличен) Наблюдается при обезвоживании организма, при рвоте, сильном поносе, потере жидкости, при обширных ожогах, усиленном потоотделении, при перегревании организма;
- гиповолемия олигоцитемическая характеризуется уменьшением ОЦК за счет форменных элементов (гематокрит снижен). Наблюдается в период, когда после кровопотери жидкость поступает из тканей в сосудистое русло, а также при анемии Аддисона-Бирмера.
Серьезную опасность для жизни человека представляет потеря 50% объема циркулирующей крови. Смертельной является потеря свыше 60% ОЦK. Срочные механизмы регуляции ОЦК:
- рефлекторный спазм кровеносных сосудов, приводящий к повышению сопротивления в сосудах внутренних органов (за исключением головного мозга и сердца) и кожи, выходу крови из депо, что приводит к повышению артериального давления, это ведет к восстановлению ОЦК и улучшению кровоснабжения жизненно важных органов;
- рефлекторное учащение ритма сердечных сокращений;
- учащение и углубление дыхания, способствующие устранению гипоксемии и гипоксии;
- повышение свертываемости крови, прекращение кровотечения.
Долговременные механизмы компенсации проявляются в более поздние сроки и выражаются: усилением кроветворения и восстановлением белкового состава крови. Повышение гемопоэтическая активность костного мозга связано с увеличением продукции эритропоэтина в почках. Стимулом для усиления синтеза эритропоэтина является гипоксия почечной ткани и повышение уровня молочной кислоты. Белковый состав крови обычно нормализуется на 8-10 сутки после кровопотери в результате увеличения синтеза белков в печени. В случае обильной и быстрой потери крови и недостаточности компенсаторных реакций может развиться терминальная стадия кровопотери, приводящая к гибели организма.
Удельный вес плазмы = 1,025 – 1,029
рН = 7,37 – 7,43 (средн. 7,4)
![]()
![]() Желудок
кишечник
Желудок
кишечник
![]()
![]()
![]()
![]()
![]()
![]() плазма
крови 3 л обмен более 70
% всей межклеточная интерстициальная
жидкости
плазма
крови 3 л обмен более 70
% всей межклеточная интерстициальная
жидкости
![]()
![]()
![]()
![]() жидкость 10
л плазмы происходит
внутриклеточная жидкость 30 л за 1 мин.
жидкость 10
л плазмы происходит
внутриклеточная жидкость 30 л за 1 мин.
Состав плазмы и интерстициальной жидкости различается лишь по концентрации белков (крупные белки не могут свободно проходить через стенки капилляров).
Электролиты плазмы.
Катионы: Na, K, Ca, Mg. Анионы: Cl, HCO3, HRO4, хлор, бикарбонат, фосфат, сульфат, органические кислоты, белки. Не электролиты: глюкоза, мочевина.
Осмотическое давление плазмы.
Концентрация растворенных в плазме веществ может быть выражено как осмотическое давление – в норме 7,3 атм (5600 мм рт. ст.). Любое отклонение осмотического давления плазмы крови и интерстициальной жидкости от нормальных величин приводит к перераспределению воды между клетками и окружающей их средой. Гипотоническая межклеточная жидкость приводит к поступлению Н2О в клетку (она набухает). Гипертоническая среда приводит к потере Н2О самой клетки – она сжимается. В норме концентрация NaCl в межклеточном пространстве и клетках должны быть изотоничными, равными 0,9%.
Электрофорез белков плазмы является важным методом клинической диагностики. Многие заболевания сопровождаются характерными применениями в составе этих белков. Электрофорезом называется – движение электрически заряженных частиц, находящихся во взвешенном состоянии или растворенных в жидкой среде, по градиенту напряжения.
Электрофорез
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +
-
+
-
бум. лента
![]()
![]()

![]()
![]()
![]()

 Альбумины
альбумины 59,2 %
Альбумины
альбумины 59,2 %a1- глобулины 3,9 %
a2 – глобулины 7,5 %
глобулины b-глобулины 12,1 %
g - глобулины 17,3 %
a1 a2 b g
![]()
- Питание (на 3 литра плазмы приходится 200 г белка) это достаточный запас питательных веществ.
- Транспорт – благодаря наличию гидрофильных и гидрофобных участков, белки способны связываться с молекулами и жироподобными веществами и осуществлять их перенос по руслу крови. Кроме белка плазмы (БП) связывают 2/3 кальция плазмы переводя его в недиффуидируемую форму.
- Создание коллоидно-осмотического давления (онкотическое) между плазмой и межклеточной жидкостью создается градиент концентрации белков.
Онкотическое давление плазмы – 25 мм рт. ст. (3,3 кПа). Онкотическое давление межклеточной жидкости – 5 мм рт.ст. (0,7 кПа) (Разница 20 мм рт. ст.). На сдвиги онкотического давления существенно влияет содержание альбумина. Снижение концентрации альбумина приводит к задержке Н2О в межклеточном пространстве (интерстициальный отек). Искусственные кровезаменители должны обладать таким же онкотическим давлением, как и плазма крови.
Буферная функция – поддерживает постоянство рН крови путем связывания Н+ или ОН-.
Предупреждение кровопотери обусловлено наличием в плазме крови фибриногена. Цепь реакций (факторов), в которых участвуют белки плазмы заканчивается превращением растворенного в плазме фибриногена в сеть из молекул Фибрина, образующую сгусток (тромб).
Свойства и функции отдельных белковых фракций
Альбумин плазмы – этот белок определяет на 80 % коллоидно-осмотическое (онкотическое) давление плазмы. 60 % общего белка плазмы приходится на долю альбумина (35-45 г/л). Альбумин пикомолекулярное соединение и поэтому хорошо подходит для выполнения функции переносчиков многих транспортируемых кровью веществ. Альбумин связывает: билирубин, уробилин, жирные кислоты, соли желчных кислот, пенициллин, ртуть. При воспалительных процессах и поражении печени и почек количество альбумина снижается.
Глобулины плазмы
a1-глобулины, иначе их называют – гликопротеинами 2/3 всего количества глюкозы плазмы присутствует в связанной форме в составе гликопротеинов. К субфракции гликопротеинов относится группа углеводосодержащих белков – протеогликаны (мукопротеины).
a2-глобулины – это протеогликан или иначе медьсодержащий белок церулоплазмин, который связывает 90 % всей меди, содержащейся в плазме.
b-глобулин – это белковые переносчики липидов и полисахаридов. Важное значение гликопротеинов состоит в том, что они удерживают в растворе нерастворимые в воде жиры и липоиды и обеспечивают тем самым их перенос кровью.
g-глобулины. Это неоднородная группа белков, выполняющих защитные и обезвреживающие функции, иначе называемые иммуноглобулинами. Размеры и состав g-глобулинов существенно варьирует. При всех заболеваниях, особенно воспалительных, содержание g-глобулинов в плазме повышается. К g-глобулинам относятся агглютинины крови: Анти-А и Анти-В.
Фибриноген – растворимый предшественник фибрина, последний превращается в нерастворимую форму. Молекула фибрина имеет удлиненную форму (соотношение длины и ширины – 17:1)). Высокая вязкость растворов фибриногена обусловлена свойством его молекул образовывать сгустки в виде «ниток бус».
Эритроциты (нормоциты) – красные кровяные тельца, составляют основную массу форменных элементов крови. В норме содержание эритроцитов периферической крови составляет у мужчин 4-5,1×1012/л, у женщин 3,7-4,7×1012/л, уровень гемоглобина соответственно 130-160 и 120-140 г/л, или 8,1-9,9 ммоль/л и 7,4-8,7 ммоль/л. При беременности число эритроцитов может снижаться до 3,0×1012/л. Масса крови составляет в среднем 1/13 массы тела. Масса эритроцитов, циркулирующих в крови, определяется по соотношению эритроциты/плазма (определяемому по гематокритному числу) умноженному на массу циркулирующей крови. Гематокритный показатель определяют путем центрифугирования венозной или капиллярной крови в гематокритной трубочке с делениями до получения плотного столбика форменных элементов и жидкой части крови. В норме гематокрит приблизительно равен 45%. В соответствии с показателями гематокрита общее количество эритроцитов во всей крови составляет 25 триллионов клеток, а общая площадь эритроцитов в 1500 раз превышает всю поверхность тела.
Чтобы получить приблизительное представление об этих цифрах, достаточно привести следующие примеры: если сложить все эритроциты рядом в одну линию, то получится «цепочка» длиной 167000 км; если сложить все эритроциты как монеты один на один, то получится столбик высотой 62000 км. Чтобы пересчитать все эритроциты с быстротой 100 эритроцитов в минуту, то понадобится затратить 475000 лет!
Эритроциты имеют форму двояковогнутых дисков правильно круглых или слегка овальных очертаний, окрашивающихся по Романовскому в розовый цвет. При изменениях состава цитоплазмы эритроциты принимают плосковогнутую или блюдцеобразную форму. Двояковогнутая форма дает возможность кислороду проникать внутрь клетки.
Проницаемость эритроцитов по отношению к электролитам, органическим веществам плазмы (сахар, аминокислоты), алкалоидам (хинин), наркотикам связана с постоянно меняющимся составом белково-липидной оболочки эритроцитов. Это позволяет эритроциту участвовать в физиологических процессах организма.
Основное назначение гемоглобина – транспорт O2 и CO2. Кроме того, он обладает буферными свойствами, а также способностью связывать токсические вещества. HbA, F и др. Hb + O2 - оксигемоглобин, Hb - O2 - восстановленный, редуцированный Hb. Hb + 10-20% СO2 - карбгемоглобин.
Карбоксигемоглобин - Hb + СO. Сродство Hb к СO в 300>, чем к O2.
Метгемоглобин – окисленный Hb, прочно связанный с O2.
Содержание гемоглобина 33 µg в одном эритроците условно принимается за единицу (1) и называется цветовым показателем. В 100 мл крови содержится 16,67г% гемоглобина. ЦП – степень насыщения эритроцитов гемоглобином.
По цветовому показателю судят о том, является ли содержание гемоглобина в эритроците нормальным, пониженным (меньше 1) или повышенным (больше 1). Концентрация гемоглобина в эритроците имеет предельную величину (33 µg). При условии предельной насыщенности эритроцита гемоглобином содержание гемоглобина и величина цветового показателя зависит от величины эритроцита. Повышение содержания гемоглобина в каждом отдельном эритроците, делающее цветовой показатель выше единицы обусловлено повышением насыщения эритроцита гемоглобином за счёт увеличения объема клетки. Снижение цветового показателя наблюдается или из-за уменьшения объема эритроцита (микроцитоз) или в результате пониженного содержания гемоглобина в нормальных по объему эритроцитах. Следовательно, гипохромия – это выражение недостаточной насыщенности эритроцита гемоглобином. Она является показателем или дефицита железа, или нарушения синтеза гемоглобина в эритробластах. Цветовой показатель определяется по формуле
ЦП=0,03×Хнв/Хэр,
где Хнв – концентрация гемоглобина у данного пациента, а Хэр содержание у него эритроцитов. Например, при концентрации гемоглобина 90 г/л и содержании эритроцитов 4,2´1012 получаем ЦП=0,03x90/4,2=0,64.
В норме цветовой показатель равен 0,82-1,05!
Гипохромия не всегда сочетается с микроцитозом - она может быть и при нормоцитозе. Гиперхромия обязательно сочетается с макроцитозом и мегалоцитозом.
Для правильного суждения об общей картине крови необходимо иметь представление о размерах эритроцита, что важно для диагностики анемии и лечения больного.
Большинство эритроцитов имеют диаметр 7,5 – 8,3 µ.
Эритроциты с диаметром меньше 7µ называются микроцитами, а с диаметром больше 9,0 µ называются макроцитами, с диаметром больше 12,0 µ относятся к мегалоцитам.
Изменение величины эритроцитов называется анизоцитозом. Изменение формы эритроцитов называется пойкилоцитозом.
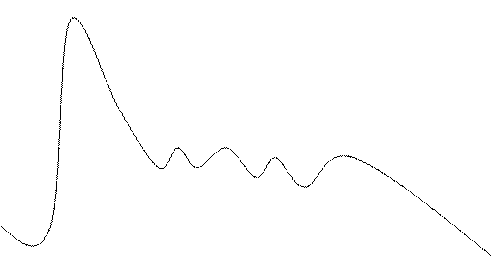
Аномалии формы, структуры и размера эритроцитов приведены в таблице и рисунке.
Таблица. Аномалии формы, размера, структуры и цвета эритроцитов и их диагностическое значение (по Роузу, Берлинер, 2000).
|
№ на рис. 1-4. |
Традиционное название |
Клиническая значимость |
|
Особенности формы, размера, цвета |
||
|
1. |
Эритроцит (нормоцит) |
В норме и при апластических анемиях |
|
2. |
Полихроматофильные клетки |
В норме до 1%, увеличение (полихроматофилия) — при ретикулоцитозе |
|
З. |
Макроовалоцит |
Мегалобластические состояния |
|
4. |
Макросфероцит |
Аномалии липидов ПМ |
|
5. |
Микроцит |
Гипохромные анемии |
|
6. |
Микросфероцит |
Наследственный микросфероцитоз и другие гемолитические анемии с внесосудистым гемолизом |
Могут быть Шистоциты (каскообразные клетки), Дрепаноциты (серповидные клетки), Анулоциты (кольцевидные клетки), Дакриоциты (каплевидные клетки).
|
Внутриэритроцитарные включения |
||
|
18. |
Ядро (эритрокариоцит) |
Оксифильные и иные эритробласты. Свидетельство гиперрегенераторного состояния |
|
19. |
Тельца Жолли |
Остатки ядра, характерны для гипоспленизма, мегалобластических состояний |
|
20. |
Базофильная пунктация |
Талассемия, мегалобластические и сидероахрестические анемии, отравления |
|
22. |
Кольца Кабо (Кэбота) |
Мегалобластические состояния. |
Примечание. ПМ — плазматическая мембрана.
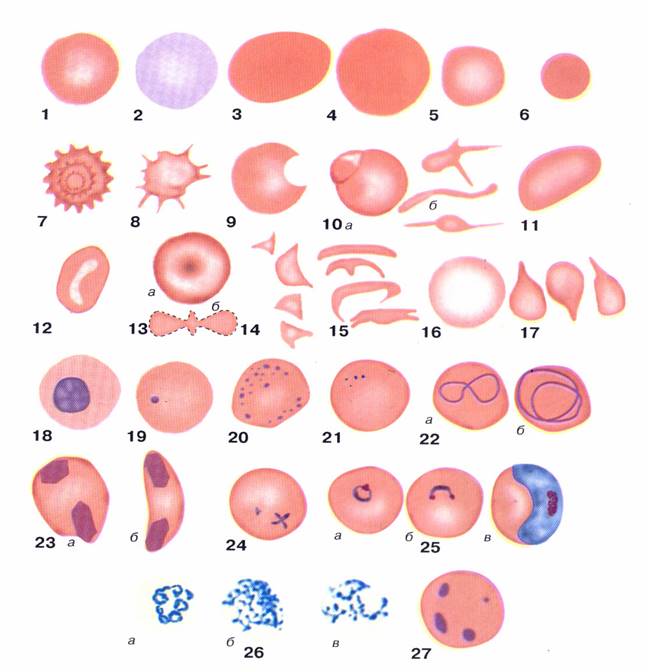
Рис. 1-4. Аномалии формы, структуры и размера эритроцитов по М. Дж. Роузу, Н. Берлинер, 2000 г.: 1 – эритроцит; 2 – полихроматофильная клетка; 3 – макроовалоцит; 4 – макросфероцит; 5 – микроцит; 6 – микросфероцит; 7 – эхиноцит; 8 – акантоцит; 9 – дегмацит; 10 а – пузырчатая клетка; 10 б – пойкилоцитоз; 11 – эллиптоцит (овалоцит); 12 – стоматоцит; 13 а – мишеневидная клетка (кодоцит); 13 б – условная схема кодоцита «в профиль»; 14 – шистоциты (каскообразные клетки); 15 дрепаноциты (серповидные клетки); 16 – анулоцит (кольцевидная клетка); 17 – дакриоциты (каплевидные клетки); 18 – оксифильный эритробласт или «эритрокариоцит»; 19 – тельце Жолли (Хауэлла-Жолли); 20 – базофильная пунктация эритроцитов; 21 – тельца Паппенгеймера; 22 а, б кольца Кабо (Кэбота); 23 а, б – кристаллы гемоглобина С; 24 – фигуры мальтийского креста (при бабезиозе); 25 а – перстневидные, б – наушникообразные, в – бананообразные паразиты при малярии. Во всех видах 1-25 окраска по Май-Грюнвальду-Гимза. 26 а-в – ретикулоциты с Substantia reticulofilamentosa (суправитальная окраска бриллиант-крезил-блау); 27 – тельца Гейнца (суправитальная обработка кристалвиолет-ацетилфенилгидразин). По Алексееву, Кассирскому, 1970.
Изменение формы эритроцитов, так же, как и изменение их величины, имеет значение для суждения о характере костномозгового кроветворения и патогенезе малокровия (анемии).
В норме показатель сферичности эритроцита равен 3,4 – 3,9. Показатель ниже, чем 3,4 говорит о склонности эритроцита к сфероцитозу, т.е. переходу его в шар, а больше 3,9 к планоцитозу, т.е. к форме плоского диска. Особое значение имеет выявление сфероцитоза при гемолитических анемиях в связи с решением вопроса о показании к удалению селезенки.
Определение размеров эритроцитов не только уточняет представление о морфологии крови, но и позволяет с большой точностью судить о качественных сдвигах кроветворения, не прибегая к пункции костного мозга.
Направленность кроветворения в сторону микронормобластоза, отражающая недостаточность железа в организме, получает отражение в картине периферической крови в виде сдвига в сторону микроцитоза эритроцитов. Напротив, мегалобластический тип эритропоэза, свидетельствующий о глубоких нарушениях кроветворения, связанного с дефицитом витамина B12, отражается на составе периферической крови в виде сдвига в сторону макроцитоза и мегалоцитоза.
Установлена зависимость между формой эритроцитов и их стойкостью по отношению к гипотоническим растворам (NaCl). Чем эритроцит площе, тем больше у него запас для набухания в гипотоническом растворе и тем позднее произойдет его гемолиз (разрушение). Наоборот, чем сферичнее эритроцит, тем быстрее он гемолизируется в гипотоническом растворе. Устойчивость эритроцитов по отношению к гипотоническим растворам NaCl называется осмотической резистентиостью. Начальное появление гемолиза эритроцитов в гипотоническом растворе называется минимальной осмотической резистентностью. В норме минимальная резистентность эритроцитов колеблется от 0,46 до 0,42. Полный гемолиз эритроцитов в гипотоническом растворе называется максимальной осмотической резистентностью, которая в норме равна от 0,36 до 0,32. При гемолитической анемии эритроциты принимают форму шара, а это значит, что их осмотическая резистентность снижается.
1. Транспортная – обеспечивают доставку всем клеткам многих веществ (O2 и CO2, аминокислоты, углеводы, полипептиды, белки, липиды, холестерин, ферменты, гормоны, БАВ – сигнальные молекулы: медиаторы, цитокины, микроэлементы).
2. Защитная – они принимают участие с сосудисто-тромбоцитарном гемостазе, свёртывании крови и фибринолизе, играют роль в обеспечении неспецифической резистентности.
3. Регуляторная – они поддерживают кислотно-основной ионный состав крови и водный баланс.
ЭРИТРОН – совокупность эритроцитов, функционирующих в кровяном русле, органы, осуществляющие продукцию эритроцитов и их разрушение, вместе с комплексом соответствующих нервных и гуморальных механизмов. Это замкнутая система.
Эритропоэз – процесс структурной, метаболической и функциональной дифференцировки от полипотентной стволовой клетки до зрелого эритроцита, протекает у эмбриона, плода и взрослого человека в разных органах.
У эмбриона этот процесс начинается на 19 – 21-й день в кровяных островках желточного мешка и в мезодермальной ткани. После 5-й недели внутриутробного развития плода кроветворение идет преимущественно в печени и селезенке. На 4–5-ом месяце начинается костномозговой период гемопоэза, который сохраняется и у взрослых. Дифференцировка и размножение клеток эритроидного ряда осуществляется под влиянием эритропоэтина, вырабатываемого в эпителиальных клетках почек в ответ на малейшее снижение снабжения этих клеток кислородом. Эритропоэтин является физиологическим регулятором эритропоэза. Эритропоэтин обеспечивает следующие эффекты:
- ускоряет и усиливает переход стволовых клеток костного мозга в
эритробласты;
- стимулирует пролиферацию и созревание ранних и промежуточных эритропоэтин-чувствительных клеток (КОЕ-Э);
- стимулирует конечную дифференцировку поздних эритропоэтин-чувствительных клеток;
- ускоряет созревание нормобластов и ретикулоцитов в костном мозге;
- ускоряет выход ретикулоцитов и эритроцитов из костного мозга в кровь.
Велика роль микроокружения. Ряд гемопоэтических факторов образуется стромой костного мозга. Фибробласты и эндотелиальные клетки являются источником ростовых факторов кроветворения. На полипотентную стволовую клетку влияют и способствуют её дифференцировке цитокины: интерлейкины-1,
-2, -3, -6, -11, фактор некроза опухолей (ФНО), образуемые иммуно-компетентными клетками и фибробластами.
Эритроциты являются важным звеном в поддержании постоянства снабжения тканей кислородом и обеспечения адаптации организма к гипоксии. Поэтому при острой и хронической гипоксии в крови увеличивается содержание эритропоэтина, который усиливает размножение и дифференцировку предшественников эритроцитов и увеличивает содержание ретикулоцитов в крови. Для нормального эритропоэза необходимо железо (основной компонент гемоглобина), витамины (В12, кислота фолиевая), которые обусловливают образование в эритробластах нуклеиновых кислот, являющихся одним из основных строительных материалов клетки.
Все гормоны, регулирующие обмен белков (СТГ, тироксин и др.) и кальция (паратгормон, тиреокальцитонин) необходимы для нормального эритропоэза. Андрогены стимулируют эритропоэз, эстрогены – тормозят его, что обусловливает меньшее число эритроцитов у жен Белки переносчики для железа – трансферрин, ферритин. Медь способствует включению железа в гем. Продолжительность жизни эритроцита составляет 100 – 130 дней. После этого они разрушаются в основном в селезенке, печени и костном мозге при участии фагоцитирующих клеток. Известно два типа эритропоэза: нормобластический и мегалобластический.
Нормобластический эритропоэз – это единственный физиологический тип кроветворения человека в постнатальном периоде. Важным этапом развития эритроцита является превращение эритробласта через стадию пронормобласта в гемоглобинсодержащую клетку – нормобласт. Пронормобласт генетически и морфологически близок к эритробласту, но меньших размеров, а в ядре нет нуклеол. С появлением в клетке гемоглобина пронормобласт становится нормобластом. Нормобласт – последняя стадия развития ядерной красной клетки, близок по размеру к зрелому эритроциту. Постепенно нормобласт утрачивает ядро и превращается в нормоцит. В физиологических условиях инволюция ядра идет параллельно накоплению гемоглобина.
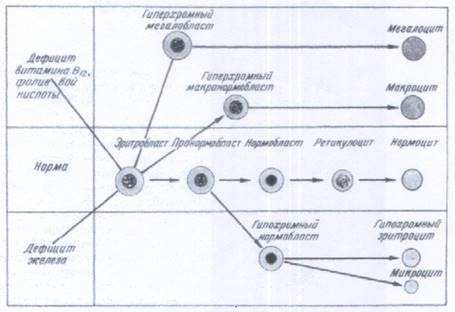
Генез различных типов эритроцитов
Ретикулоцитами называются эритроциты, содержащие базофильную сеточку, выявляемую при прижизненной окраске клетки бромкрезиловым синим. В норме количество ретикулоцитов не превышает 0,8 – 1%. Прежде чем ретикулоциты появятся в периферической крови, они задерживаются в костном мозге от 2 до 4 дней. При гипоксическом состоянии их количество увеличивается. Полный цикл развития эритроцита у человека равен 82 часам, из которых 44 часа приходится на стадию ретикулоцита. В периферической крови ретикулоциты циркулируют около суток. За это время они окончательно теряют «сеточку» и превращаются в зрелый эритроцит.
Ретикулоцитоз может иметь положительное значение, когда он предшествует повышению количества эритроцитов (физиологическая регенерация эритроцитов), но если он держится долго и не сопровождается повышением числа эритроцитов, то это может быть свидетельством развития гипопластического состояния костного мозга. В некоторых случаях ретикулоцитоз может указывать на существование источника раздражения костного мозга. Так, например, гемолиз при желтухе, кровотечение при язвенной болезни, интоксикация при брюшном тифе. Как патологическое явление может наблюдаться поступление в кровь Незрелые эритроциты, окрашиваются как кислыми, так и щелочными красителями, т.е. полихроматофильно, что может указывать на развитие патологии в костном мозге. В этих случаях получаются неполноценные полихроматофильные эритроциты с базофильной зернистостью. Реже бывает процесс, когда гемоглобинизации цитоплазмы завершается при сохранении ядра или его остатков, в результате в кровь поступают ядерные эритроциты – нормобласты, а также эритроциты с тельцами Жолли и азурофильной зернистостью ядерного происхождения.
Сидероциты – эритроциты, содержащие включения железа (ферритина) в виде мелких гранул. В нормальных условиях сидероциты в периферической крови не обнаруживаются. Они появляются в крови при некоторых гемолитических анемиях, талассемии, свинцовой интоксикации, при многократном переливании крови или внутривенных вливаниях препаратов железа. В этих случаях сидероциты надо рассматривать как признак перегрузки организма железом.
Мегалобласты принимают участие в нормальном эритропоэзе только в раннем эмбриональном периоде. В постэмбриональном периоде мегалобластический эритропоэз наблюдается при пернициозной злокачественной анемии Аддисона-Бирмера и других патологических состояниях, связанных с дефицитом физиологических факторов кроветворения (витамин В12, фолиевая кислота).
Биологической особенностью мегалобласта является его неспособность превращаться в нормальный эритроцит. Лишь небольшая часть мегалобластов созревает до конечной стадии своего развития, превращаясь в безъядерные мегалоциты, поступающие в периферическую кровь. Большая часть, завершив гемоглобинизацию, распадается в костном мозге.
Последовательные этапы развития мегалобластов
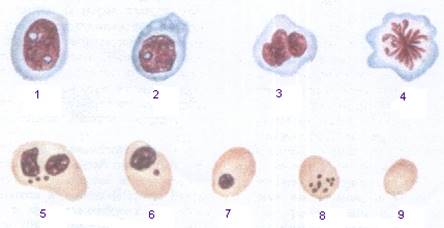
1 – промегалобласт; 2 – базофильный мегалобласт; 3, 4 – полихроматофильные;
5-8 - ортохромные мегалобласты; в клетках 5, 6, 8 видно образование телец Жолли из ядерной субстанции; 9 – мегалоцит.
Мегалоциты имеют большие размеры, насыщены гемоглобином. Процент ретикулоцитов среди мегалоцитов ниже, чем среди нормоцитов. Превращение мегалобласта в мегалоцит совершается через инволюцию (разрушение) ядра, в результате которой образуются тельца Жолли и кольца Кебота. В нормальных условиях эти тельца встречаются только у эмбриона и в крови новорожденного. Встречаются только в патологических условиях при пернициозной анемии.
Продуктивность эритропоэза в здоровом организме постоянно поддерживает оптимальный уровень содержания эритроцитов и гемоглобина в крови, компенсируя разрушение отживающих клеток.
Эффективный эритропоэз – постоянство циркулирующих гемоглобин-содержащих красных кровяных телец в норме является следствием точного равновесия между числом поступающих в периферическую кровь из костного мозга молодых эритроцитов и числом разрушающихся в селезенке старых эритроцитов в единицу времени.
Кроме своей основной функции - переноса кислорода при помощи гемоглобина, эритроциты принимают участие в осуществлении многих других физиологических функций. Благодаря содержащемуся в них гемоглобину эритроциты играют важную роль «буфера» в регуляции кислотно-основного равновесия. Около 30% буферных свойств крови, предохраняющих от развития ацидоза, приходится на долю эритроцитов.
Роль эритроцитов в водно-солевом обмене определяется их способностью к набуханию в венозной крови за счет тканевой жидкости и отбухания в артериальной крови и в легочных капиллярах за счет отдачи жидкости.
При патологии в периферической крови могут встречаться эритроциты костного мозга, которые не выявляются в крови здорового человека. Их появление свидетельствует о развитии компенсаторного усиления эритропоэза или о нарушении созревания клеток эритроидного ряда в костном мозге (регенеративные формы эритроцитов). К ним относятся: нормобласты, мегалобласты, эритроциты с остатками ядерной субстанции в виде телец Жолли и колец Кебота, полихроматофилъные эритроциты, ретикулоциты. Иногда при действии на организм различных повреждающих факторов происходит извращение эритропоэза и тогда в крови обнаруживается дегенеративные формы эритроцитов. К ним относятся: клетки с измененной величиной – анизоцитоз и формой — пойкилоцитоз, появление к крови эритроцитов с разным содержанием гемоглобина, т.е. гипохромных и гиперхромных эритроцитов – анизохромия, клетки с гемоглобиновой дегенерацией Эрлиха. Гемоглобиновая дегенерация Эрлиха – это неравномерное распределение гемоглобина в эритроцитах в результате его коагуляции. К дегенеративным формам эритроцитов относятся вакуолизированные эритроциты и эритроциты, окрашенные в темно-синий цвет вместо розового. Появление в крови таких темных эритроцитов называется дегенеративной полихромазией. К дегенеративным формам относятся и шизоциты, мелкие осколки эритроцитов, встречающиеся при хронической анемии.
Изменения в организме при эритроцитозе обусловлены увеличением вязкости крови. При выраженных эритроцитозах наблюдается покраснение лица и слизистых оболочек, переполнение кровью сосудов склер. Нарушение микроциркуляции является причиной головной боли, головокружения, нарушения зрения. В 20% случаев отмечено тромботическое поражение сосудов головного мозга, сердца, артерий и вен, сетчатки, печеночной и воротной вен, может развиться ДВС-синдром.
Анемия – состояние, характеризующееся уменьшением содержания эритроцитов или гемоглобина, или того и другого в единице объема крови. Причины анемии разнообразны.
Существует два типа нормальных гемоглобинов: гемоглобин А (HbA – гемоглобин взрослого) и HbF (фетальный гемоглобин). Появление в крови Hb с необычной структурой – называется Hb-нозом. Варианты гемоглобина отличаются друг от друга глобиновой частью молекул и различаются по своим физиологическим, физико-химическим свойствам.
Кроветворение сложный процесс пролиферации и дифференцировки клеток костного мозга, в результате которого из исходной полипотентной клетки образуются и выходят в периферическую кровь форменные элементы: эритроциты, тромбоциты и лейкоциты. Различают два вида лейкоцитарной ткани: миелоидную и лимфоидную. Лейкоциты разделяются на два больших класса: зернистые (гранулоциты) лейкоциты и незернистые (агранулоциты) лейкоциты. К зернистым лейкоцитам относятся: нейтрофильные, базофильные, эозинофильные лейкоциты.
Стимуляция миелопоэза осуществляется колоние-стимулирующими факторами (КСФ), основными из которых являются интерлейкины (ИЛ-1, ИЛ-3 и ИЛ-5, -6, фактор некроза опухолей - ФНО), гранулоцитарный колоние-стимулирующий фактор (Г-КСФ), моноцитарный колониестимулирующий фактор (М-КСФ) и гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ). В норме КСФ вырабатываются у взрослого человека клетками крови и соединительной ткани. При развитии патологических процессов образуются различные КСФ, которые поступают в кровь и стимулируют костный мозг к усилению выработки лейкоцитов и их выбросу в кровяное русло. Эта стимуляция специфична в отношении клеток определенного типа. Например, бактериальные инфекции приводят к увеличению нейтрофильных лейкоцитов, а заражение простейшими – к накоплению эозинофилов. Поэтому подсчет лейкоцитов разного типа (лейкоцитарная формула) имеет важное практическое значение.
В норме моноциты, лимфоциты вырабатывают факторы, подавляющие миелопоэз. К таким факторам (ингибиторам) относятся простагландин Е, лактоферрин. Подавление продукции этих факторов приводит к повышению активности КСФ. В норме продукция КСФ регулируется механизмом обратной связи. Увеличение числа образующихся клеток блокирует дальнейшую продукцию новых клеток.
Определение содержания в крови лейкоцитов и количественная оценка основных популяций клеток (формула крови или лейкограмма) осуществляется в практической медицине с 30-х годов XIX столетия, когда Шиллингом были описаны простые методы определения этих показателей с применением микроскопического исследования. Используется несколько способов подсчета количества лейкоцитов и определения лейкограммы, основанных на принципе распознавания образа клеток за счет различий их внешнего вида. В нашей стране наиболее распространен способ визуального определения клеток с помощью микроскопа. Суммарное содержание клеток определяют путем подсчета количества клеток в известном объеме крови, разбавленной 20-кратным объемом 3%-го водного раствора уксусной кислоты, разрушающей эритроциты. Техника подсчета клеток в точном объеме осуществляется при помощи камеры Горяева.
Лейкограмму определяют в мазке, который готовят из капли крови на предметном стекле и после фиксации в метиловом спирте окрашивают так, чтобы четко различались основные клеточные структуры (ядро, цитоплазма, гранулы), характеризующие клетки различных видов лейкоцитов Клетки всех популяций хорошо различаются при окрашивании смесями азура и эозина. Этот метод прост, удобен, надежен, но мало производителен, т.к. связан с микроскопированием.
В последние 50 лет появились и широко распространены высокопроизводительные автоматические приборы для подсчета не только количества лейкоцитов, но и формулы крови.
Поскольку клетки существуют и функционируют в общей системе крови лейкограмму целесообразно дополнять показателями, оценивающими свойства цельной крови. Одним из таких показателей является скорость оседания эритроцитов (СОЭ), отражающая реологические свойства крови (связанные с содержанием в ней белков). Для определения СОЭ кровь перемешивают с 0антикоагулянтом (цитрат натрия), помещают в мерный капилляр, выдерживают в течение часа и измеряют столб плазмы над осадком клеток в миллиметрах (норма 3-10 мм/ч у мужчин и 3-15 мм/ч у женщин).
Общее количество лейкоцитов в крови здорового взрослого человека в условиях покоя и натощак колеблется от 4,0 до 9,3×109/л.
При различных заболеваниях уровень их может или уменьшаться, или увеличиваться, а в ряде случаев в крови могут появляться патологически измененные формы лейкоцитов.
В норме в крови находится определенное количество не только зрелых клеток, но и их предшественников – незрелых клеток. Это в большей степени относится к нейтрофильным лейкоцитам, составляющих большую часть всех циркулирующих в крови лейкоцитов.
Нормальная лейкоцитарная формула крови взрослого человека
|
L ×109/л |
Гранулоциты, % |
Агранулоциты, % |
||||||
|
Нейтрофилы |
Эозинофилы |
Базофилы |
Моноциты |
Лимфоциты |
||||
|
Мц |
Ю |
П |
С |
|
|
|
|
|
|
4,5-9,0 |
0 |
0‑1 |
2‑5 |
50-67 |
1‑5 |
0‑1 |
3‑9 |
19‑37 |
К физиологическим лейкоцитозам относятся:
- пищеварительный лейкоцитоз, развивающийся через 2-3 часа после приема пищи; - лейкоцитоз беременных, развивающийся с 5-6 месяцев беременности;
- лейкоцитоз рожениц, возникающий на второй неделе после родов;
- лейкоцитоз новорожденных;
- эмоциональный, возникающий при психическом возбуждении, боли;
- миогенный лейкоцитоз, связанный с усилением мышечной работы. Физиологические лейкоцитозы обычно носят кратковременный характер, за исключением лейкоцитоза беременных и новорожденных, т.к. эти два вида лейкоцитоза обусловлены повышенной функцией миелоидного ростка костного мозга, а остальные лейкоцитозы – это перераспределительные лейкоцитозы, связанные с выходом в кровяное русло запаса зрелых лейкоцитов из органов депо.
К патологическим лейкоцитозам относят лейкоцитозы, возникающие при обширных травмах, развитии инфекций и воспаления, при действии токсических веществ как экзогенного, так и эндогенного характера, после кровопотерь, при распаде опухолей. Механизм возникновения патологических лейкоцитозов связан с повышением лейкопоэтической функции костного мозга. Только один вид лейкоцитоза «центрогенный», возникающий при шоковых состояниях, агонии, после операций имеет перераспределительный характер.
В зависимости от того, какой вид лейкоцитов увеличивается, различают нейтрофильный, эозинофильный, базофильный лейкоцитоз, лимфоцитоз и моноцитоз.
Лейкоцитозы могут быть обусловлены:
- увеличением скорости продукции лейкоцитов и выхода их из костного мозга в кровь;
- перераспределением между пулами в крови (маргинальным и циркулирующим);
- уменьшением объема циркулирующей крови.
Лейкоцитозы, при которых не увеличивается пролиферация лейкоцитов в костном мозге и не выходят молодые формы лейкоцитов в периферическую кровь называются перераспределительными. Они развиваются при переходе лейкоцитов из маргинального пула в циркулирующий пул при стрессе, после приема пищи, при мышечной работе, при обезвоживании.
Лейкоцитозы, при которых увеличивается пролиферация лейкоцитов в костном мозге и происходит выход незрелых форм лейкоцитов в периферическую кровь, это истинные лейкоцитозы. К ним относятся:
- воспалительные лейкоцитозы, которые возникают в результате образования активированными макрофагами и лимфоцитами колониестимулирующих факторов;
- лейкоцитозы беременных, обусловленные гормональными сдвигами;
- лейкоцитозы, развивающиеся при опухолях кроветворной ткани – лейкозах.
Нейтрофильный лейкоцитоз (нейтрофилия) – увеличение содержания нейтрофилов в гемограмме свыше 70%. Наблюдается при острых инфекциях, воспалительных процессах, инфаркте миокарда, после острых кровопотерь, укусах ядовитых насекомых и физиологическом лейкоцитозе. При нейтрофилии частой находкой является появление в крови значительного количества незрелых нейтрофилов. Увеличен0ие в крови молодых форм нейтрофилов свидетельствует о ядерном сдвиге влево, преобладание зрелых нейтрофилов особенно с большим количеством сегментов ядра (больше 3-4) на фоне исчезновения более молодых клеток – о ядерном сдвиге вправо.
Большое практическое значение имеет определение степени ядерного сдвига в лейкоцитарной формуле. Ядерный сдвиг (индекс) определяют по формуле:
![]() , где Яи – ядерный
индекс нейтрофилов,
, где Яи – ядерный
индекс нейтрофилов,
Мц – миелоциты,
Ю – юные нейтрофилы,
П – палочкоядерные нейтрофилы,
С – сегментоядерные нейтрофилы.
В норме ядерный индекс равен 0,06-0,1.
Клинические наблюдения показывают, что при многих воспалительных процессах формула меняется за счет увеличения молодых форм. Это сказывается на увеличении ядерного индекса до 0,5-1 и выше. Такое изменение лейкограммы называется сдвигом влево.
Сдвиг от 0,1 до 0,15 – слабый сдвиг влево,
от 0,15 до 0,3 – средний сдвиг,
выше 0,45 – резко выраженный сдвиг.
Ядерный индекс меньше 0,06 – ядерный сдвиг вправо.
Выделяют следующие разновидности ядерного сдвига влево.
Лейкоцитоз называется абсолютным, если он обусловлен повышением абсолютного количества лейкоцитов в крови в результате возросшей продукции клеток в костном мозге или увеличенного поступления лейкоцитов из костномозгового депо.
Относительный лейкоцитоз – это процентное увеличение отдельных форм лейкоцитов, которое наблюдается при перераспределении лейкоцитов во время шока, коллапса, эмоционального напряжения. Например, известно, что у студентов во время экзаменов увеличивается число лейкоцитов.
Повышение количества каждого из видов лейкоцитов имеет диагностическое и прогностическое значение, т.к. характерно для определенных патологических процессов.
Нейтрофильный лейкоцитоз (нейтрофилия) может протекать без ядерного сдвига или с гипорегенеративным, гиперрегенеративным дегенеративным сдвигом влево или со сдвигом вправо. Характерен для болезней дыхательных путей и лёгких, скарлатины в период разгара болезни, стафилококковых и стрептококковых инфекций, гонореи, лептоспироза. Асептическая нейтрофилия наблюдается при: кровопотере, уремии, токсикозе беременных, отравлении ядами некоторых змей, насекомых, медуз, алкоголизме и др.
Эозинофильный лейкоцитоз (эозинофилия) – увеличение содержания эозинофилов свыше 5% - развивается при поступлении в организм чужеродных белков и гистамина. Связан с антитоксической и фагоцитарной функциями этих клеток. Главным объектом фагоцитоза эозинофилов являются иммунные комплексы антиген-антитело. Описаны наследственные формы эозинофилии. Эозинофилия развивается при различных аллергических заболеваниях (бронхиальная астма, отек Квинке, крапивница и др.), при паразитарных заболеваниях (аскаридоз, лямблиоз и др.), некоторых кожных заболеваниях (псориаз, экзема, дерматиты), коллагенозах (системная красная волчанка, ревматизм, дерматомиозит), хроническом миелолейкозе, лимфогрануломатозе, эндокринопатиях (гипофизарная кахексия, микседема), ряде инфекционных заболеваний (скарлатина, сифилис, туберкулез), при приеме лекарственных препаратов (антибиотики, сульфаниамиды др.).
Базофильный лейкоцитоз (базофилия) – редкая форма лейкоцитоза, встречается при хроническом миелолейкозе, гемолитических анемиях, гемофилии, при вакцинации и введении в организм чужеродного белка.
Для хронического миелолейкоза характерно не только увеличение базофилов, но и эозинофилов, при этом говорят о базофильно-эозинофильной ассоциации клеток.
Увеличение содержания моноцитов свыше 11% называется моноцитозом, чаще всего является показателем развития иммунных процессов, характерных для ряда инфекций (оспа, корь, краснуха, дифтерия, бруцеллез, сифилис, токсоплазмоз). Значительное увеличение моноцитов наблюдаются при моноцитарном лейкозе.
Лимфоцитоз – увеличение содержания лимфоцитов выше 44%. Физиологический лимфоцитоз наблюдается на 4-5 день после рождения. Лимфоциты преобладают в крови над нейтрофилами – «первый перекрест». В возрасте 4-5 лет происходит выравнивание относительного содержания лимфоцитов и нейтрофилов – «второй перекрест». Физиологический относительный лимфоцитоз может сохраняться до 8-10 лет. В физиологических условиях наблюдается после физических нагрузок и у вегетарианцев. В патологических условиях лимфоцитоз развивается при ряде инфекционных заболеваний (брюшной тиф, малярия, бруцелез, туберкулез, сифилис), при алиментарной дистрофии, некоторых эндокринных расстройствах (микседема, акромегалия, евнухоидизм).
Патологические формы лейкоцитов подразделяются на регенеративные, которые обнаруживаются в норме только в костном мозге, и дегенеративные (деструктивно измененные) формы.
Дегенеративные изменения лейкоцитов проявляются в виде: анизоцитоза (изменение величины), т.е. появления гигантских нейтрофилов или микроформ лимфоцитов, нейтрофилов; наличия вакуолей в ядре или цитоплазме – признак жировой дегенерации клетки, наиболее характерен для абсцессов, тяжелых форм сепсиса, лучевой болезни; появления токсогенной зернистости, обусловленной коагуляцией белков под влиянием инфекционного или токсического агента; исчезновения обычной зернистости; наличия включений типа телец Князькова-Деле (базофильно окрашенные комочки цитоплазмы); пикноза (сморщивания) ядра или его распада (кариорексиса); гиперсегментации ядер нейтрофилов или гипосегментации; гипохроматоза (потеря способности нормально окрашиваться), при этом ядро может сохранять четкие контуры (хроматинолиз), либо не имеет контуров (кариолиз); появления голых ядер лимфоцитов; теней Боткина-Гумпрехта; цитолиза; дегрануляции клеток чаще всего базофилов.
Лейкопения – уменьшение количества лейкоцитов в периферической крови ниже 4,0´109/л. Развиваются только при патологических состояниях. Особенно тяжело протекают при поражении костного мозга – лейкозах, лучевой болезни. При этом нарушается функциональная активность лейкоцитов, специфическая и неспецифическая реактивность, развиваются иммунодефицитные состояния, интеркуррентные заболевания инфекционного характера.
Три основных механизма лежат в основе развития лейкопении:
- снижение выработки лейкоцитов и их выхода из костного мозга в периферическую кровь;
- повышенное их разрушение;
- перераспределение лейкоцитов – выход из кровотока и депонирование в тканях или микроциркуляторном русле.
Агранулоцитоз – наиболее тяжелая форма лейкопении (общее содержание лейкоцитов ниже 1000 в 1 мкл). При содержании нейтрофильных лейкоцитов ниже 500 в 1 мкл резко возрастает риск смертельного исхода.
Эозинопения наблюдается при острых инфекционных заболеваниях, септических и стрессовых состояниях. Выраженная эозинопения наблюдается при вирусных заболеваниях.
Лимфоцитопения характерна для красной волчанки, распространенного туберкулеза лимфатических узлов, острой лучевой болезни, лимфогрануломатоза.
Моноцитопения наблюдается при острых инфекционных заболеваниях, при тяжелых септических процессах, при пернициозной анемии.
Лейкопении приводят к снижению противоинфекционной и противоопухолевой резистентности.
Неспецифическая реактивность и иммунитет
Основное назначение лейкоцитов – участие в защитных реакциях организма против чужеродных агентов, способных нанести ему вред. Различают неспецифическую реактивность организма и иммунитет. Неспецифическая реактивность направлена на уничтожение любого чужеродного агента. К ней относятся: фагоцитоз и пиноцитоз, система комплемента, естественная цитотоксичость, интерфероны, лизоцим, β-лизины.
Патогенные микробы проникают в организм через кожу, слизистые оболочки, лимфу, кровь и другие ткани. Для большинства микробов эти «входные ворота» как бы «закрыты».
Защитная деятельность тканей, препятствующих проникновению микробов в организм обусловлена разными механизмами:
- механическим удалением микробов с кожи и слизистых;
- уничтожением микробов с помощью естественных жидкостей организма (слезы, пот, пищеварительные соки, отделяемое влагалища) или патологическими жидкостями, например, воспалительной жидкостью – экссудатом;
- фиксацией микробов в тканях и уничтожение их фагоцитами;
- уничтожение микробов с помощью специфических антител;
- выделение микробов и их ядов из организма.
Большинство из перечисленных механизмов являются неспецифическими факторами защиты и представляют собой как бы первую линию обороны.
К факторам неспецифической защиты относятся:
- фагоцитоз – поглощение инородных частиц (микробов или измененных собственных клеток организма) лейкоцитами;
- система комплемента;
- интерферон;
- непроницаемость покровов (кожа, слизистые);
- бактерицидные субстанции тканей (лизоцим, пропердин, кислая среда);
- гидролитические ферменты;
- естественная цитотоксичость.
Комплемент – ферментная система, состоящая более, чем из 20 белков
В результате активации системы комплемента образуются: мембрано-атакующий комплекс (С5,6,7,8,9), который лизирует (растворяет) клетки; анафилотоксины С3а и С5а, которые вызывают: дегрануляцию базофилов крови и тканей; расширение сосудов, повышение проницаемости сосудистой стенки, хемотаксис лейкоцитов; опсонизирующий фактор С3в, соединяющийся с поверхностью микроорганизма, что облегчает фагоцитоз.
К специфическим факторам относятся:
- иммунокомпетентные клетки;
- антитела;
- гиперчувствительность немедленного и замедленного типов;
- иммунологическая память;
- иммунологическая толерантность.
Лейкоциты выполняют свои основные функции в тканях. Лейкоцитарная инфильтрация складывается из 3-х этапов
Краевое стояние лейкоцитов, при котором лейкоциты выходят из осевого кровотока и катятся по эндотелию, постепенно прикрепляясь к нему.
Диапедез или переход лейкоцитов через стенку сосуда. При этом нейтрофилы и моноциты «протискиваются» через щели между эндотелиальными клетками амебовидным способом, выпуская псевдоподии, а лимфоциты могут проникать прямо через цитоплазму клеток сосудистой стенки, не повреждая их. Это явление называется эмпериполез.
фагоцитоз – одно из самых блестящих открытий XIX века. И.И. Мечников описал фагоцитоз в 1883 г. как общебиологическое явление в жизнедеятельности одноклеточных и многоклеточных организмов, состоящее в поглощении клетками других клеток и твердых частиц.
Главная функция лейкоцитов заключается в том, чтобы поглощать, убивать и переваривать микроорганизмы, различные чужеродные частицы, а также собственные нежизнеспособные клетки. Процесс распознавания, поглощения и переваривания называется фагоцитозом.
И.И. Мечников был первым, кто понял значение фагоцитоза как важного механизма невосприимчивости к инфекционным заболеваниям. Именно И.И. Мечников ввел термин «фагоцитоз», что в переводе с греческого означает пожирание клеток. Фагоцит – пожиратель клеток. Фагоциты разделяются на микрофаги (нейтрофилы) и макрофаги (моноциты).
Способностью к фагоцитозу обладают нейтрофилы, моноциты, макрофаги и эозинофилы. Эти клетки называются профессиональными или облигатными (обязательными) фагоцитами.
У одноклеточных организмов фагоцитоз служит для пищеварения, у высокоорганизованных организмов эта функция приобрела защитный характер и выполняется фагоцитами.
Микрофаги (нейтрофилы) фагоцитируют микроорганизмы.
Макрофаги отличаются от лимфоцитов, но также играют важную роль в иммунном ответе, и как антиген-обрабатывающие клетки при возникновении ответа, и как фагоциты в виде исполнительного звена. В крови они названны моноцитами; в тканях гистиоцитами или тканевыми макрофагами. Все макрофаги возникают из предшественников моноцитов в костном мозге. Макрофаги найдены во всех тканях организма, а также в лимфатических узлах, где они распологаются как диффузно, так и фиксированно в субкапсулярном пространстве и в синусах мозгового слоя. Тканевые макрофаги также обнаруживаются в синусах красной пульпы селезенки. В печени макрофаги известны как клетки Купфера, в легких как альвеолярные макрофаги, а в мозговой ткани как микроглия. В периферической крови и костном мозге они выявляются в виде моноцитов и их предшественников. Дендритические ретикулярные клетки в фолликулах лимфатических узлов и ретикулярные клетки в паракортикальной зоне - специализированные клетки «обработки» антигенов для B- и T-лимфоцитов соответственно. Функции макрофагов включают в себя фагоцитоз, обработку антигенов и взаимодействие с цитокинами.
Макрофаги (моноциты, гистиоциты) поглощают микробы и более крупные частицы, в том числе клетки и их оболочки.
Различают четыре стадии фагоцитоза:
1. Хемотаксис (приближение).
2. Аттракция (прилипание).
3. Поглощение.
4. Умерщвление и переваривание.
Первая стадия - хемотаксис – направленное движение лейкоцитов по градиенту концентрации какого-либо распознаваемого ими вещества.
Последовательность эмиграции лейкоцитов связана с неодновременным появлением молекул адгезии и хемоаттрактантов, специфичных для разных лейкоцитов. Выходя из сосудов, лейкоциты проявляют положительный хемотаксис, то есть движутся к носителю хемоаттрактанта, что является уже первой стадией фагоцитоза.
К числу специфических хемоаттрактантов действующих на определенные типы лейкоцитов относятся хемокины, которые секретируются клетками, участвующими в развитии воспалительного процесса, например, ил-8 является хемокином для нейтрофилов, монокин – хемокин для моноцитов, лимфотактин – хемоаттрактант для лимфоцитов и натуральных киллеров, эотаксин – для эозинофилов.
Фагоцитирующие клетки имеют поверхностные рецепторы хемоаттрактантов. хемоаттрактанты могут быть экзо- и эндогенными, специфическими для определенного вида лейкоцитов или универсальными. Эндогенные хемоаттрактанты называются хемокинами.
Свойствами хемоаттрактантов обладают:
- липопротеиды, содержащиеся в клеточной оболочке бактерий;
- активированные компоненты комплемента С3а и С5а;
- лейкотриен В4 - вещество, вырабатываемое лейкоцитами;
- продукты повреждения и метаболизма клеток;
- некоторые медиаторы посредники: нейтрофильные катионные белки, ИЛ-1; кахексии, С-реактивный белок;
- иммунные комплексы и иммуноглобулины типа М и G.
Под влиянием этих веществ лейкоциты активируются и начинают двигаться к центру воспалительного очага. Это направленное движение лейкоцитов называется хемотаксисом.
Наряду с хемотаксисом различают хемокинез – ненаправленное увеличение локомоторной активности клеток под влиянием медиаторов. Например, гистамин, действуя на Н1-рецепторы нейтрофилов и эозинофилов, активирует их подвижность, но не обязательно в сторону нарастающего градиента своей концентрации.
Активация лейкоцитов начинается с взаимодействия хемоаттрактанта с рецепторами, расположенными на мембране лейкоцитов. От рецептора сигнал поступает внутрь клетки. Это приводит к появлению псевдоподий (выпячивание цитоплазмы) с помощью которых лейкоциты осуществляют движение. Кроме того, активируются внутрилейкоцитарные ферменты, которые способствуют выработке медиаторов, управляющих ходом развития воспаления (лейкотриены, простагландины и др.).
Этот механизм хемотаксиса очень чувствителен – фагоцит «улавливает» разницу в 0,1% концентрации хемоаттрактанта на одном из полюсов клетки. Разница в концентрации хемоаттрактанта на одном полюсе клетки приводит к развитию феномена «кеппинга», т.е. скопления большого количества рецепторов на том участке клетки, где значительная их часть занята хемоаттрактантом. Этот участок становится ведущим. Перемещение лейкоцитов процесс сложный и обеспечивается структурами цитоскелета (микрофиламентами и микротрубочками). Взаимодействие структурных элементов клетки и рецепторов достигается с участием ионов кальция. Само движение осуществляется с участием кальций-чувствительных (кальмодулин) и сократительных (актин, миозин) белков. Кальмодулин способствует сборке миозиновых молекул, это дает возможность миозину в комплексе с актином осуществлять сокращение. При сокращении лейкоцит подтягивается к псевдоподии и перемещается по направлению к очагу воспаления.
Неодинаковое количество различных хемоаттрактантных рецепторов на нейтрофилах и макрофагах, наряду с распределением и последовательностью экспрессии молекул клеточной адгезии, определяет стадийность эмиграции лейкоцитов.
Для борьбы с фагоцитозом некоторые микробы выделяют особые вещества репелленты, которые вызывают отрицательный хемотаксис фагоцитов, и токсины, которые блокируют двигательную активность лейкоцитов.
Вторая стадия - прилипание (аттракция) фагоцитов к проникшим в организм микроорганизмам осуществляется при участии опсонинов – сывороточных факторов, которые попадают в ткани из крови. К ним относятся С-реактивный белок, компонент комплемента - С3b, иммуноглобулины G, фибронектин и др. Опсонины соединяются с поверхностью клетки микроорганизма, а фагоциты имеют рецепторы к С-РБ, С3b, IgG, что и облегчает фагоцитоз. Фагоциты образуют тонкие цитоплазматические выпячивания, выбрасываемые по направлению к объекту фагоцитоза и с их помощью осуществляется прилипание. Контакт и прилипание лейкоцитов к микроорганизмам сопровождается резким повышением метаболической активности лейкоцитов («метаболический взрыв»), повышением потребления кислорода. В результате образуются активные метаболиты кислорода.
В ходе поглощения (3-я стадия) фагоцит образует псевдоподии, которые окружают объект фагоцитоза, прилипая к его покрытой опсонинами поверхности. Когда мембрана псевдоподия покроет всю поверхность объекта фагоцитоза, он оказывается внутри «мешка», образованного мембраной фагоцитирующей клетки. Этот «мешок» называется фагосомой. Разрушение поглощенных частиц происходит внутри фагосомы.
Четвертая стадия – умерщвление и переваривание. В лизосомах содержатся ферменты, обеспечивающие разрушение практически всех веществ, содержащихся в клетках, в том числе микробных. Но для того, чтобы ферменты могли переваривать поглощенные микробы, последние должны быть сначала убиты. Для этого в лейкоцитах есть два бактерицидных (убивающих) механизма: зависящий от кислорода и независящий от кислорода.
Зависящий от кислорода бактерицидный фактор связан с образованием активных метаболитов кислорода. Продукция этих веществ начинается после контакта фагоцита с опсонизированными бактериями. Именно в это время фагоциты начинают активно поглощать кислород, что называют термином респираторный взрыв. Процесс этот сложный, в ходе которого образуются очень активные метаболиты кислорода; гидроксильный радикал ОН, супероксидный анион О2- и другие. Проникающие внутрь фаголизосомы активные бактерицидные радикалы «убивают» микробов. Система образования бактерицидных метаболитов кислорода действует во всех профессиональных фагоцитах. В нейтрофилах вместе с ней действует еще одна мощная бактерицидная система – система миелопероксидазы, которой нет у моноцитов и макрофагов.
Миелопероксидаза – фермент, содержащийся в гранулах нейтрофилов. Бактерицидное действие заключается в том, что в присутствии перекиси водорода и йода миелопероксидаза катализирует реакцию Н2О2 с хлором, в результате чего образуется гипохлорит ОСl-, обладающий мощным бактерицидным действием.
Независящий от кислорода бактерицидный механизм связан с поступлением внутрь фагосомы бактерицидных веществ, которые содержатся во внутриклеточных гранулах фагоцитов. К числу бактерицидных веществ, содержащихся в гранулах, относятся: катионные белки, лизоцим, лактоферрин и другие. Важным бактерицидным фактором, действующим в активированных макрофагах, является оксид азота (NO).
Не все живые микроорганизмы гибнут внутри фагоцита. Например, возбудитель туберкулеза – палочка Коха остается живой внутри фагоцита. Более того, она оказывается «отгороженной» мембраной и цитоплазмой фагоцитов, поэтому она менее доступна для действия других бактерицидных воздействий (комплемент, антибиотики) или даже изолирована от них. Такой фагоцитоз называется незавершенным.
Лизосома приближается к фагосоме, их мембраны сливаются, образуя единую вакуоль, в которой находится поглощенная частица и лизосомальные ферменты. Эта вакуоль называется фаголизосомой. В фаголизосоме устанавливается оптимальная для переваривания среда с рН равным около 5.
В тех случаях, когда фагоцит не может поглотить атакуемый объект, например, если размеры последнего значительно превышают размер самого фагоцита, или если объектом фагоцитоза являются фиксированные на базальной мембране комплексы антиген-антитело, то наступает фрустированный фагоцитоз, сводящийся к тому, что активированные фагоциты «выстреливают» содержимое своих гранул во внеклеточное пространство. При этом содержимое гранул и активные метаболиты кислорода действуют не только на объект атаки, но и на ткани организма хозяина. Повреждение тканей хозяина возможно также и при гибели лейкоцитов во время фагоцитоза. Гибель нейтрофилов при воспалении связана не столько с «кознями» микробов, сколько с тем, что они не выдерживают собственного мощного окислительного удара, наносимого по флогогенным агентам системой продукции активных кислородных радикалов.
Гормонально-гуморальная регуляция процесса фагоцитоза
I. Активаторы процесса фагоцитоза: 1) опсонины; 2) тироксин; 3) половые гормоны; 4) цГМФ;
5) ацетилхолин и холинергические препараты. II. Факторы, тормозящие процесс фагоцитоза: 1) лейкотоксины; 2) антифагины; 3) цАМФ; 4) глюкокортикоиды.
В настоящее время фагоцитоз рассматривается как процесс, используемый при элиминации (удалении) собственных погибших клеток и как фактор повреждения тканей, т.е. фагоцитоз наряду с саногенным, оздоровительным, оказывает ещё и патогенное действие.
Несмотря на то, что уже более ста лет известно, что фагоциты играют важную роль в защите организма от инфекции, лишь недавно, около 25 лет назад, стало ясно, что аномалия фагоцитоза предрасполагает к инфекции. Доказано, что такое заболевание детей как хронический грануломатоз, характеризующейся тяжелой рецидивирующей пиогенной (гнойной) инфекцией, развивается вследствие нарушения бактерицидного действия фагоцитов. Наследственный дефект миелопероксидазы приводит к тому, что нейтрофилы утрачивают способность убивать микроорганизмы, в результате чего они продолжают свою жизнедеятельность внутри фагоцитов, как, например, при синдроме Чедиака-Хигаси. Поэтому в клинике все чаще и чаще прибегают к определению фагоцитарной активности лейкоцитов.
Нейтрофильные лейкоциты постоянно выходят в ткани, поэтому их называют клетками «первой линии защиты» или «отрядом быстрого реагирования». Это фагоциты одноразового действия, которые обязательно гибнут при фагоцитозе, выделяя бактерицидные и цитостатические факторы и медиаторы, в том числе и привлекающие макрофагов.
Нейтрофилы эффективно защищают человека от многих бактериальных и грибковых инфекций. Вне сосудов нейтрофилы могут жить не более 48 часов, а моноциты могут жить вне сосудов несколько суток; кроме того, стимулы, поддерживающие миграцию моноцитов, действуют дольше, чем стимулы, поддерживающие эмиграцию нейтрофилов.
В тканях моноциты превращаются в активные подвижные макрофаги, в том числе гистиоциты соединительной ткани, защищающие организм от проникших бактерий с помощью фагоцитоза. На более поздних стадиях развития воспаления макрофаги участвуют в процессах очищения очага от поврежденных нежизнеспособных клеток собственного организма, в том числе лейкоцитов, то есть выполняют роль «мусорщиков», что очень важно для последующего заживления.
Макрофаги участвуют в иммунном ответе хозяина в качестве клеток презентирующих (представляющих) антиген. В очаге воспаления они фагоцитируют антигены, доставляют их в соответствующие (региональные) лимфатические узлы, где в измененном виде представляют лимфоцитам.
Гистиоцит – большой обжора
Все поглощает без разбора
За аппетит достойный саг
Его прозвали Макрофаг.
И этот термин очень меток
Ведь он – Гаргантюа средь клеток.
(А.Г. Кнорре «Гистоазбука»)
Макрофаги играют важную роль в заживлении тканей, так как секретируют факторы роста для фибробластов и других мезенхимальных клеток, продуцируют факторы роста для сосудов. Наконец, активированные макрофаги продуцируют такие цитокины, как ИЛ-1, ИЛ-6, ФНОα, которые вызывают ряд системных защитных реакций, называемых «реакциями острой фазы».
Итак, макрофаги выполняют следующие функции:
- защитную фагоцитарную (поглощают и убивают микроорганизмы);
- очищающую – фагоцитируя разрушенные клетки тканей в очаге воспаления;
- антигенпрезентирующую - представляют антиген лимфоцитам;
- участвуют в заживлении поврежденных тканей, выделяя факторы роста для фибробластов;
- продуцируют интерлейкины, необходимые для осуществления системных защитных реакций и регуляции гемопоэза.
Эозинофилы накапливаются в тканях при воспалении, вызванном гельминтами (глистами), простейшими и при аллергических воспалительных реакциях, вызываемых IgE (ринит, атопическая бронхиальная астма). Накопление эозинофилов в тканях обусловлено их миграцией под влиянием таких хемоаттрактантов как эотоксин, лейкотриен В4, С5а – фрагмент комплемента. В очаге воспаления эозинофилы «атакуют» паразитов, размеры которых значительно больше самого эозинофила, используя механизм дегрануляции, то есть выброса своих биологически активных веществ, которые являются токсичными для гельминтов.
Однако биологически активные вещества эозинофилов могут оказывать токсическое действие и на клетки хозяина, что играет значительную роль при заболеваниях, сопровождающихся эозинофилией (увеличением числа эозинофилов) и, прежде всего, в патогенезе атопических заболеваний легких.
Иммунологическая реактивность
Иммунитет – это способ специфической защиты организма от всех веществ, несущих признаки чужеродной генетической информацией.
Специфичность иммунного ответа зависит от способности иммунной системы произвести почти неограниченное число антител и в такой же степени разнообразный ассортимент T-лимфоцитов, несущих специфические рецепторы к антигенам на своей поверхности. Антиген вызывает ответ специфических вили T-лимфоцитов, которые являются запрограммированными на реакцию против данного антигена (то есть, лимфоцит несет рецепторы, специфичные для данного антигена). Функцию рецептора выполняет иммуноглобулин на B-клетке и иммуноглобулиноподобная молекула на T-клетках. При встрече с антигеном определенный лимфоцит (B или T) выборочно размножается, формируя клон сенсибилизированных клеток исполнительного звена, которые обеспечивают высокоспецифичный ответ против этого антигена: из B-клеток образуются плазматические клетки, которые в свою очередь производят иммуноглобулины; из T клеток - цитотоксические T-лимфоциты. Этот специфичный ответ обычно имеет защитный эффект (иммунитет); однако иногда возникают неблагоприятные реакции, которые повреждают ткани (гиперчувствительность).
При попадании в организм человека или теплокровных животных чужеродные агенты могут формировать три типа основанных специфических ответных реакций: иммунитет, аллергию, иммунологическую толерантность.
По происхождению различают видовой и приобретенный иммунитет.
Видовой иммунитет является наследственным признаком данного вида животных. По прочности или стойкости видовой иммунитет разделяют на абсолютный и относительный.
Абсолютный – это такой иммунитет, который определяется с момента рождения и является таким прочным, что никакие воздействия внешней среды не могут его ослабить. Относительный иммунитет менее прочен и в значительной степени зависит от влияния внешней среды. Приобретенный иммунитет разделяют на естественно приобретенный и искусственно приобретенный. Каждый из них по способу возникновения разделяется на активный и пассивный.
Естественно приобретенный активный иммунитет развивается после перенесения соответствующего инфекционного заболевания.
Естественно приобретенный пассивный иммунитет называют еще врожденным, или плацентарным. Он обусловлен переходом защитных антител из крови матери через плаценту в кровь плода. Защитные антитела вырабатываются в организме матери, а плод получает их готовыми. Таким путем новорожденные дети получают иммунитет к кори, скарлатине, дифтерии и другим инфекциям. Через 1-2 года полученные от матери антитела разрушаются и частично выводятся из организма ребенка. В эти сроки восприимчивость детей к указанным инфекциям резко повышается.
Искусственный иммунитет воспроизводят в целях предупреждения заразных болезней. Активным искусственным иммунитетом называют иммунитет, который достигается введением здоровым людям, ослабленных патогенных микробов, ослабленных токсинов (анатоксинов) или вирусов. Такая активная иммунизация впервые была воспроизведена Дженнером путем прививок коровьей оспы детям. Эта процедура была названа вакцинацией, а прививочный препарат – вакциной (лат. vacca – корова). Пассивный искусственный иммунитет воспроизводится путем введения человеку сыворотки, содержащей антитела против микробов и их токсинов. Особенно эффективны антитоксические сыворотки против дифтерии, столбняка, газовой гангрены. Получают такие сыворотки путем иммунизации лошадей соответствующими токсинами.
Антитоксический иммунитет направлен на нейтрализацию микробных ядов. Этот вид иммунитета проявляется при таких инфекциях как дифтерия, столбняк, газовая гангрена, ботулизм. Антибактериальный иммунитет направлен на уничтожение самих микробных тел.
Антибактериальный иммунитет проявляется в ряде защитных реакций, главными из которых являются выработка антител и фагоцитоз. Антитела вызывают растворение или склеивание (агглютинацию) бактерий, или способствуют их фагоцитозу.
В механизмах противовирусного иммунитета имеет значение:
- выработка противовирусных антител;
- фагоцитоз вирусных частичек;
- образование в клетках лимфоидного ряда особого белка – интерферона, который подавляет размножение вирусов.
Иммунологическую функцию выполняет специализированная система клеток, тканей и органов, которую называют иммунной системой.
Иммунная система
Иммунная система – это совокупность всех лимфоидных органов и скоплений лимфоидных клеток тела. Центральной клеткой иммунной системы является лимфоцит. Лимфоидная система - это морфологический синоним иммунной системы. Иммунная система имеет три особенности: она генерализована (разбросана) по всему телу; ее клетки постоянно рециркулируют по всему телу через кровоток и лимфоток; она обладает уникальной (единственной в своем роде) особенностью вырабатывать строго специфические молекулы антител в отношении каждого антигена.
Иммунная система состоит из центральных органов: вилочковая железа (тимус), костный мозг, сумка Фабриция (у птиц) и периферических органов (селезенка, лимфатические узлы, лимфоидная ткань пищеварительной системы, миндалины, клетки Лангерганса кожи). Кроме того, она располагает подвижными иммуноцитами – лимфоцитами, переносимыми с током крови и лимфы.
Главной функцией иммунной системы является поддержание антигенного гомеостаза в организме. Иммунная система обеспечивает:
- распознавание чужеродных агентов (антигенов);
- связывание и удаление их из организма;
- запоминание, обеспечивающее ускоренную реакцию организма при повторной встрече с тем же чужеродным агентом.
Таким образом, иммунная система выполняет защитную функцию.
Антигены – это вещества (чаще всего белки или полисахариды), генетически чужеродные для конкретного организма, вызывающие в организме иммунный ответ, IgG, то есть специфическую реакцию, направленную на удаление антигена из организма.
Антигенными свойствами обладают микробы и вирусы, различные яды (токсины) животного, растительного или микробного происхождения, опухолевые клетки, которые приобретают черты чужеродности вследствие мутации.
Иммунная система обеспечивает жизненно важное свойство организма – иммунологическую реактивность, которая представляет собой способность организма отвечать на действие антигена клеточными и гуморальными реакциями, специфичными по отношению к антигену. Эта способность обусловлена двумя видами иммуноцитов: Т-лимфоцитами и В-лимфоцитами. Различают несколько подвидов (субпопуляций) Т-лимфоцитов функционально способных к иммунологическому взаимодействию с антигеном. Это Т-киллеры (убийцы) или Т-цитотоксические клетки, разрушающие клетки с антигеном; Т-хелперы (помощники), помогающие другим Т- и -лимфоцитам реагировать на антиген; Т-супрессоры – лимфоциты, тормозящие реакцию других лимфоцитов на антиген.
Т-лимфоциты реагируют с антигеном непосредственно и осуществляют клеточные реакции в организме.
В-лимфоциты под действием антигена превращаются в плазматические клетки, которые вырабатывают иммуноглобулины, то есть отвечают за гуморальные иммунные реакции. У человека образуется пять классов иммуноглобулинов: IgG, IgM, IgD, IgЕ, IgA.
Основную массу сывороточных иммуноглобулинов (70-80%) составляют IgG; IgA – 10-15%; IgM – 5-10%; иммуноглобулинов Е и D очень мало – около 0,2%. Через плаценту проходят только материнские иммуноглобулины G, поэтому в крови новорожденных определяется только этот тип иммуноглобулинов.
Иммуноглобулины – это молекулы, предназначенные для распознавания и связывания антигенов. Они существуют в двух формах – связанной с мембранами B-лимфоцитов и в свободной растворимой форме. Когда иммуноглобулин связан с мембраной В-клеток, он выполняет роль рецептора, распознающего антигены, а если он растворим и циркулирует в крови, то выполняет функцию антитела.
Белки суперсемейства иммуноглобулинов участвуют в адгезии клеток крови. Появляются после активации эндотелия цитокинами – ИЛ-1; ФНО и g-интерфероном и обеспечивают физиологическую миграцию лейкоцитов в различные органы (выраженная миграция наблюдается в тимусе и очень низкая в головном мозге).
Реакции антиген-антитело
Реакции специфического взаимодействия сывороточных антител с антигенами, против которых они направлены, проявляются в виде нескольких основных феноменов:
Феномен агглютинации заключается в том, что антигенные частицы, находящиеся во взвеси, под влиянием антитела склеиваются между собой и выпадают в осадок.
Феномен преципитации – эффект укрупнения растворимых антигенов под влиянием антитела.
Феномен лизиса (растворения) клеток. Для проявления этого феномена кроме антитела необходим комплемент.
Феномен опсонизации заключается в том, что антитела усиливают фагоцитарную активность нейтрофилов и макрофагов в отношении тех антигенов, против которых они образованы.
Эти реакции могут быть защитно-физиологическими, например, вызвать охранительное торможение в коре головного мозга или усилить фагоцитарную реакцию микрофагов и способствовать выделению токсинов почками.
Иммунологическая толерантность
Под иммунологической толерантностью понимают отсутствие иммунной реакции на конкретный антиген, то есть «терпимость» организма в отношении этого антигена. Ярким примером иммунологической толерантности является отсутствие иммунных реакций на собственные антигены организма. Потеря толерантности к собственным антигенам приводит к развитию аутоиммунных заболеваний, а потеря толерантности к чужеродным антигенам приводит к развитию повышенной чувствительности – сенсибилизации.
Иммунологическая толерантность - специфическое подавление иммунного ответа, вызванное предварительным введением антигена. Иммунологическая толерантность как форма иммунного ответа специфична. Толерантность может проявляться в подавлении синтеза антител и гиперчувствительности замедленного типа (специфического гуморального и клеточного ответа) или отдельных видов и типов иммунного ответа. Толерантность может быть полной (нет иммунного ответа) или частичной (существенное снижение ответа).
Если на введение антигена организм отвечает подавлением только отдельных компонентов иммунного ответа, то это - иммунологическое отклонение (расщепленная толерантность). Наиболее часто выявляется специфическая ареактивность Т-клеток (обычно Т-хелперов) при сохранении функциональной активности В-клеток.
Естественная иммунологическая толерантность - иммунологическая ареактивность к собственным антигенам (аутоиммунная толерантность) возникает в эмбриональном периоде. Она предотвращает выработку антител и Т-лимфоцитов, способных разрушать собственные ткани.
Приобретенная иммунологическая толерантность - отсутствие специфической иммунной реакции к чужеродному антигену.
Иммунологическая толерантность представляет особую форму иммунного ответа, характеризующуюся запретом, налагаемым Т- и В-супрессорами на образование клеток-эффекторов против данного, в том числе собственного, антигена.
Основой формирования иммунологической толерантности является удаление лимфоцитов, специфических к соответствующим антигенам. В основе индуцированной иммунологической толерантности лежат различные механизмы, среди которых принято выделять центральные и периферические.
Центральные механизмы связаны с непосредственным воздействием на иммунокомпетентные клетки. Основные механизмы:
- элиминация антигеном иммунокомпетентных клеток в тимусе и костном мозге (Т- и В- клеток соответственно);
- повышение активности супрессорных Т- и В-клеток, недостаточность контрсупрессоров;
- блокада эффекторных клеток;
- дефектность презентации антигенов, дисбаланс процессов пролиферации и дифференциации, кооперации клеток в иммунном ответе.
Периферические механизмы связаны с перегрузкой (истощением) иммунной системы антигеном, пассивным введением высокоаффинных антител, действием антиидиотипических антител, блокадой рецепторов антигеном, комплексом “антиген-антитела”, антиидиопатическими антителами.
Исторически иммунологическую толерантность рассматривают как защиту против аутоиммунных заболеваний.
Интерлейкины
Интерлейкины (ИЛ) - группа растворимых белковых молекул (разновидность цитокинов), опосредующих активацию и взаимодействие иммунокомпетентных клеток в процессе иммунного ответа, а также регулирующих процессы миело-, эритропоэза. Большинство ИЛ является эндогенными пирогенами. Интерлейкины — биологически активные вещества, секретируемые стволовыми кроветворными клетками, макрофагами, лимфоцитами; обладают иммунорегуляторными и медиаторными свойствами: отдельные интерлейкины активируют макрофаги, лимфоциты, стимулируют митоз, усиливают пролиферацию и рост Т- и В-лимфоцитов, повышают синтез интерферонов и секрецию лимфокинов. Известны интерлейкины, которые продуцируются макрофагами, вступившими в контакт с чужеродными антигенами или микроорганизмами, и инициируют мобилизацию иммунной системы; другие интерлейкины стимулируют пролиферацию и дифференцировку иммунных клеток и поддерживают воспалительную реакцию; третьи обладают противовоспалительными свойствами и способствуют прекращению иммунной реакции, после того как она достигла своей цели. Таким образом, интерлейкины – это факторы межклеточного взаимодействия в иммунном ответе, являются медиаторами иммунитета.
В настоящее время выделено более 20 ИЛ. Наиболее изучены следующие.
Интерлейкин‑1 (ИЛ‑1) — пептид, синтезируется в макрофагах, В-лимфоцитах, эндотелиальных клетках, фибробластах; играет важную роль в инициации иммунного ответа — стимулирует продукцию ИЛ‑2 Т-хелперами, оказывает влияние на созревание В-лимфоцитов, усиливает функции нейтрофилов; обладает выраженным воспалительным и пирогенным свойством; является, по-видимому, одним из важнейших медиаторов, осуществляющих связь между иммунной, нервной и эндокринной системами.
Интерлейкин‑2 (ИЛ‑2, фактор роста Т-лимфоцитов) — пептид, синтезирующийся Т-лимфоцитами (Т-хелперами); необходим для пролиферации Т-хелперов, Т-супрессоров, Т-киллеров.
Интерлейкин‑3 (ИЛ‑3) — пептид, вырабатывается в Т-лимфоцитах и клетках стромы костного мозга; поддерживает размножение почти всех классов ранних клеток-предшественниц гемопоэза, воздействуя на стволовые кроветворные клетки, полипотентную предшественницу миелопоэза, стимулирует созревание эритроцитов, гранулоцитов, моноцитов, тромбоцитов.
Интерлейкин‑4 (ИЛ‑4) — пептид, синтезирующийся Т-хелперами; стимулирует пролиферацию В-лимфоцитов, Т-лимфоцитов и макрофагов, способствует синтезу иммуноглобулинов IgМ, IgG, IgА, IgЕ, снижает противоопухолевую активность макрофагов.
Интерлейкин‑5 (ИЛ‑5, фактор дифференцировки эозинофилов) — пептид, синтезирующийся Т-хелперами; является фактором дифференцировки В-лимфоцитов в антителопродуцирующие клетки, усиливает функциональную активность эозинофилов.
Интерлейкин‑6 (ИЛ‑6) — пептид, продуцируемый макрофагами, фибробластами и опухолевыми клетками; стимулирует синтез иммуноглобулинов и миелоидную дифференцировку; продукция ИЛ‑6 увеличивается при ревматоидном артрите, болезни Педжета, множественной миеломе, карциноме почек и яичников.
Интерлейкин‑7 (ИЛ‑7) — пептид, продуцируемый клетками стромы красного костного мозга; вызывает пролиферацию Т- и В-лимфоцитов, воздействуя на их клетки-предшественницы.
Интерлейкин‑8 (ИЛ‑8) — пептид, синтезирующийся макрофагами, нейтрофилами, фибробластами, Т-лимфоцитами и другими клетками; медиатор острой фазы воспаления, вызывает миграцию нейтрофилов в очаг воспаления.
Интерлейкин‑9 (ИЛ‑9, фактор роста Т-лимфоцитов) — пептид, стимулирующий пролиферацию Т-лимфоцитов, мощный фактор риска развития бронхиальной астмы.
Интерлейкин‑10 (ИЛ‑10) — пептид, продуцируемый преимущественно моноцитами/макрофагами, Т-хелперами и В-лимфоцитами; стимулирует пролиферацию и дифференцировку В-лимфоцитов, подавляет синтез ИЛ‑2 и g-интерферона, мощный ингибитор иммунных и воспалительных реакций.
Интерлейкин‑11 (ИЛ‑11) — пептид, продуцируемый клетками стромы красного костного мозга, эндотелиальными клетками, макрофагами, предшественниками жировых клеток; он увеличивает в плазме концентрацию белков острой фазы воспаления.
Интерлейкин‑12 (ИЛ‑12) — полипептид, синтезирующийся макрофагами; стимулирует рост и дифференцировку Т-киллеров, увеличивает функциональную активность Т-хелперов, угнетает синтез IgЕ.
Иммунокомпетентные клетки
К клеткам иммунной системы относят лимфоциты, макрофаги и другие антиген-представляющие клетки (А-клетки, от англ. accessory- вспомогательный), а также так называемую третью популяцию клеток (т.е. клеток, не имеющих основных поверхностных маркеров Т- и В-лимфоцитов, А-клеток).
По функциональным свойствам все иммунокомпетентные клетки разделяют на эффекторные и регуляторные. Взаимодействие клеток в иммунном ответе осуществляется с помощью гуморальных медиаторов - цитокинов. Основные клетки иммунной системы- Т- и В-лимфоциты.
Лимфоциты.
В организме лимфоциты постоянно рециркулируют между зонами скопления лимфоидной ткани. Расположение лимфоцитов в лимфоидных органах и их миграция по кровеносному и лимфатическому руслу строго упорядочены и связаны с функциями различных субпопуляций.
Лимфоциты имеют общую морфологическую характеристику, однако их функции, поверхностные CD (от claster differenciation) маркеры, индивидуальное (клональное) происхождение, различны.
По наличию поверхностных CD маркеров лимфоциты разделяют на функционально различные популяции и субпопуляции, прежде всего на Т- (тимусзависимые, прошедшие первичную дифференцировку в тимусе) лимфоциты и В - (bursa-зависимые, прошедшие созревание в сумке Фабрициуса у птиц или его аналогах у млекопитающих) лимфоциты.
Т- лимфоциты.
Локализация. Обычно локализуются в так называемых Т-зависимых зонах периферических лимфоидных органов (периартикулярно в белой пульпе селезенки и паракортикальных зонах лимфоузлов).
Функции. Т-лимфоциты распознают процессированный и представленный на поверхности антиген-представляющих А-клеток антиген. Они отвечают за клеточный иммунитет, иммунные реакции клеточного типа. Отдельные субпопуляции помогают В-лимфоцитам реагировать на Т-зависимые антигены выработкой антител.
Происхождение и созревание. Родоначальницей всех клеток крови, в том числе лимфоцитов, является единая стволовая клетка костного мозга. Она генерирует два типа клеток-предшественников - лимфоидную стволовую клетку и предшественника клеток красной крови, от которой происходят и клетки- предшественники лейкоцитов и макрофагов.
Образование и созревание иммунокомпетентных клеток осуществляется в центральных органах иммунитета (для Т-лимфоцитов - в тимусе). Клетки- предшественники Т-лимфоцитов попадают в тимус, где пре-Т-клетки (тимоциты) созревают, пролиферируют и проходят дифференцировку на отдельные субклассы в результате взаимодействия с эпителиальными и дендритными клетками стромы и воздействия гормоноподобных полипептидных факторов, секретируемых эпителиальными клетками тимуса (альфа1-тимозин, тимопоэтин, тимулин и др.).
При дифференцировке Т-лимфоциты приобретают определенный набор мембранных CD-маркеров. Т-клетки разделяют на субпопуляции в соответствии с их функцией и профилем CD-маркеров.
Т-лимфоциты распознают антигены с помощью двух типов мембранных гликопротеинов- Т-клеточных рецепторов (семейство Ig-подобных молекул) и CD3, нековалентно связанных между собой. Их рецепторы, в отличие от антител и рецепторов В-лимфоцитов, не распознают свободно циркулирующие антигены. Они распознают пептидные фрагменты, представляемые им А-клетками через комплекс чужеродных веществ с соответствующим белком главной системы гистосовместимости 1 и 2 класса.
Выделяют три основные группы Т-лимфоцитов - помощники (активаторы), эффекторы, регуляторы.
Первая группа - помощники (активаторы), в состав которых входят Т-хелперы1, Т-хелперы2, индукторы Т-хелперов, индукторы Т-супрессоров.
1. Т-хелперы1 несут рецепторы CD4 (как и Т-хелперы2) и CD44, отвечают за созревание Т-цитотоксических лимфоцитов (Т-киллеров), активируют Т-хелперы2 и цитотоксическую функцию макрофагов, секретируют ИЛ-2, ИЛ-3 и другие цитокины.
2. Т-хелперы2 имеют общий для хелперов CD4 и специфический CD28 рецепторы, обеспечивают пролиферацию и дифференцировку В-лимфоцитов в антителопродуцирующие (плазматические) клетки, синтез антител, тормозят функцию Т-хелперов1, секретируют ИЛ-4, ИЛ-5 и ИЛ-6.
3. Индукторы Т-хелперов несут CD29, отвечают за экспрессию антигенов HLA класса 2 на макрофагах и других А-клетках.
4. Индукторы Т-супрессоров несут CD45 специфический рецептор, отвечают за секрецию ИЛ-1 макрофагами, активацию дифференцировки предшественников Т- супрессоров.
Вторая группа - Т-эффекторы. В нее входит только одна субпопуляция.
5. Т-цитотоксические лимфоциты (Т-киллеры). Имеют специфический рецептор CD8, лизируют клетки- мишени, несущие чужеродные антигены или измененные аутоантигены (трансплантант, опухоль, вирус и др.). ЦТЛ распознают чужеродный эпитоп вирусного или опухолевого антигена в комплексе с молекулой класса 1 HLA в плазматической мембране клетки-мишени.
Третья группа - Т-клетки-регуляторы. Представлена двумя основными субпопуляциями.
6. Т-супрессоры имеют важное значение в регуляции иммунитета, обеспечивая подавление функций Т-хелперов 1 и 2, В-лимфоцитов. Имеют рецепторы CD11, CD8. Группа функционально разнородна. Их активация происходит в результате непосредственной стимуляции антигеном без существенного участия главной системы гистосовместимости.
7. Т-контрсупрессоры. Не имеют CD4, CD8, имеют рецептор к особому лейкину. Способствуют подавлению функций Т-супрессоров, вырабатывают резистентность Т-хелперов к эффекту Т-супрессоров.
В-лимфоциты.
Существует несколько подтипов В-лимфоцитов. Основная функция В-клеток - эффекторное участие в гуморальных иммунных реакциях, дифференциация в результате антигенной стимуляции в плазматические клетки, продуцирующие антитела.
Образование В-клеток у плода происходит в печени, в дальнейшем - в костном мозге. Процесс созревания В-клеток осуществляется в две стадии - антиген-независимую и антиген-зависимую.
Антиген-независимая фаза. В-лимфоцит в процессе созревания проходит стадию пре-В-лимфоцита - активно пролиферирующей клетки, имеющей цитоплазменные H-цепи типа C-мю (т.е. IgM). Следующая стадия - незрелый В- лимфоцит характеризуется появлением мембранного (рецепторного) IgM на поверхности. Конечная стадия антигеннезависимой дифференцировки- образование зрелого В-лимфоцита, который может иметь два мембранных рецептора с одинаковой антигенной специфичностью (изотипа) - IgM и IgD. Зрелые В-лимфоциты покидают костный мозг и заселяют селезенку, лимфоузлы и другие скопления лимфоидной ткани, где их развитие задерживается до встречи со “своим” антигеном, т.е. до осуществления антиген-зависимой дифференцировки.
Антиген-зависимая дифференцировка включает активацию, пролиферацию и дифференцировку В-клеток в плазматические клетки и В-клетки памяти. Активация осуществляется различными путями, что зависит от свойств антигенов и участия других клеток (макрофагов, Т-хелперов). Большинство антигенов, индуцирующих синтез антител, для индукции иммунного ответа требуют участия Т-клеток - тимусзависимые антигены. Тимуснезависимые антигены (ЛПС, высокомолекулярные синтетические полимеры) способны стимулировать синтез антител без помощи Т- лимфоцитов.
В-лимфоцит с помощью своих иммуноглобулиновых рецепторов распознает и связывает антиген. Одновременно с В-клеткой антиген по представлению макрофага распознается Т-хелпером (Т-хелпером 2), который активируется и начинает синтезировать факторы роста и дифференцировки. Активированный этими факторами В-лимфоцит претерпевает ряд делений и одновременно дифференцируется в плазматические клетки, продуцирующие антитела.
Активация В-лимфоцитов может осуществляться:
- Т-зависимым антигеном при участии белков МНС класса 2 Т-хелпера;
- Т-независимым антигеном, имеющим в составе митогенные компоненты;
- поликлональным активатором (ЛПС);
- анти-мю иммуноглобулинами;
- Т-независимым антигеном, не имеющим митогенного компонента.
Кооперация клеток в иммунном ответе
В формировании иммунного ответа включаются все звенья иммунной системы- системы макрофагов, Т- и В-лимфоцитов, комплемента, интерферонов и главная система гистосовместимости.
В кратком виде можно выделить следующие этапы.
1. Поглощение и процессинг антигена макрофагом.
2. Представление процессированного антигена макрофагом с помощью белка главной системы гистосовместимости класса 2 Т-хелперам.
3. Узнавание антигена Т-хелперами и их активация.
4. Узнавание антигена и активация В-лимфоцитов.
5. Дифференциация В-лимфоцитов в плазматические клетки, синтез антител.
6. Взаимодействие антител с антигеном, активация систем комплемента и макрофагов, интерферонов.
7. Представление при участии белков МНС класса 1 чужеродных антигенов Т-киллерам, разрушение инфицированных чужеродными антигенами клеток Т-киллерами.
8. Индукция Т- и В-клеток иммунной памяти, способных специфически распознавать антиген и участвовать во вторичном иммунном ответе (антигенстимулированные лимфоциты).
Клетки иммунной памяти. Поддержание долгоживущих и метаболически малоактивных клеток памяти, рециркулирующих в организме, является основой длительного сохранения приобретенного иммунитета. Состояние иммунной памяти обусловлено не только длительностью жизни Т- и В-клеток памяти, но и их антигенной стимуляцией. Длительное сохранение антигенов в организме обеспечивается дендритными клетками (депо антигенов), сохраняющими их на своей поверхности.
Дендритные клетки - популяции отросчатых клеток лимфоидной ткани костномозгового (моноцитарного) генеза, представляющая антигенные пептиды Т-лимфоцитам и сохраняющая антигены на своей поверхности. К ним относятся фолликулярные отросчатые клетки лимфоузлов и селезенки, клетки Лангерханса кожи и дыхательных путей, М-клетки лимфатических фолликулов пищеварительного тракта, дендритные эпителиальные клетки тимуса.
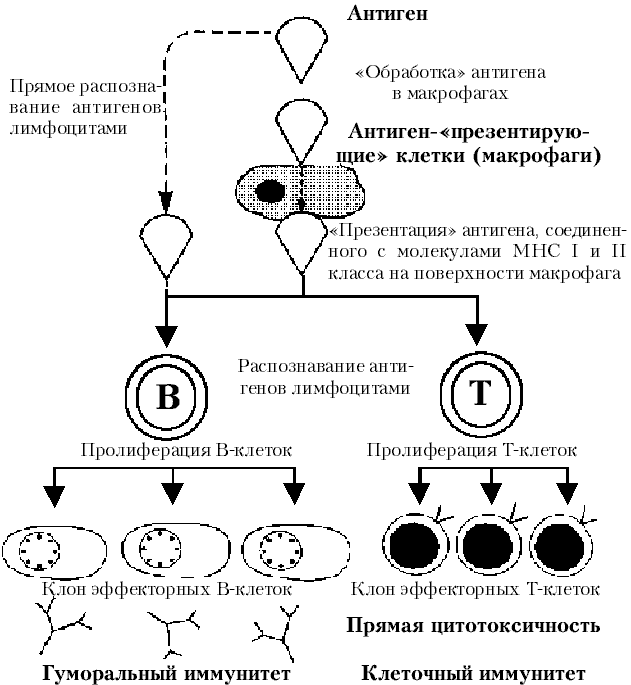
CD антигены. Кластерная дифференциация поверхностных молекул (антигенов) клеток, прежде всего лейкоцитов, шагает далеко вперед. К настоящему времени CD антигены- не абстрактные маркеры, а функционально значимые для клетки рецепторы, домены и детерминанты, в том числе исходно не являющиеся специфическими для лейкоцитов.
Важнейшими дифференцировочными антигенами Т-лимфоцитов человека являются следующие.
1. CD2 - антиген, характерный для Т-лимфоцитов, тимоцитов, NK-клеток. Он идентичен рецептору эритроцитов барана и обеспечивает образование розеток с ними (методика определения Т-клеток).
2. CD3 - необходимы для функционирования любых Т-клеточных рецепторов (ТКР). Молекулы CD3 имеют все субклассы Т-лимфоцитов. Взаимодействие ТКР- CD3 (она состоит из 5 субъединиц) с представляющей антиген молекулой МНС класса 1 или 2 определяет характер и реализацию иммунного ответа.
3. CD4. Эти рецепторы имеют Т-хелперы 1 и 2 и Т-индукторы. Являются корецептором (местом связывания) детерминант белковых молекул МНС класса 2. Является специфическим рецептором для оболочечных белков вируса иммунодефицита человека ВИЧ-1 (gp120) и ВИЧ- 2.
4. CD8. Популяция CD8+Т-лимфоцитов включает цитотоксические и супрессорные клетки. При контакте с клеткой-мишенью CD8 выступает в роли корецептора для белков HLA класса 1.
Дифференцировочные рецепторы В-лимфоцитов.
На поверхности В-лимфоцитов может находиться до 150 тысяч рецепторов, среди которых описано более 40 типов с различными функциями. Среди них - рецепторы к Fc-компоненту иммуноглобулинов, к С3-компоненту комплемента, антигенспецифические Ig-рецепторы, рецепторы к различным факторам роста и дифференцировки.
Краткая характеристика методов оценки Т- и В-лимфоцитов.
Для выявления В-лимфоцитов используют метод розеткообразования с эритроцитами, обработанными антителами и комплементом (EAC-РОК), спонтанного розеткообразования с эритроцитами мыши, метод флюоресцирующих антител с моноклональными антителами (МКА) к рецепторам В-клеток (CD78, CD79a, b, мембранные Ig).
Для количественной оценки Т-лимфоцитов используют метод спонтанного розеткообразования с эритроцитами барана (Е-РОК), для выявления субпопуляций (например, Т-хелперов и Т-супрессоров) - иммунофлюоресцентный метод с моноклональными антителами (МКА) к CD-рецепторам, для определения Т-киллеров - тесты цитотоксичности.
Функциональную активность Т- и В-клеток можно оценить в реакции бласттрансформации лимфоцитов (РБТЛ) на различные Т- и В-митогены.
Сенсибилизированные Т-лимфоциты, участвующие в реакциях гиперчувствительности замедленного типа (ГЗТ) можно определить по выделению одного из цитокинов - MIF (миграцию ингибирующего фактора) в реакции торможения миграции лейкоцитов (лимфоцитов) - РТМЛ.
Одной из особенностей иммунокомпетентных клеток, особенно Т- лимфоцитов, является способность продуцировать большое количество растворимых веществ - цитокинов (интерлейкинов), осуществляющих регуляторные функции. Они обеспечивают согласованную работу всех систем и факторов иммунной системы, благодаря прямым и обратным связям между различными системами и субпопуляциями клеток обеспечивают устойчивую саморегуляцию иммунной системы. Их определение дает дополнительное представление о состоянии иммунной системы.
В целом гомеостаз организма обеспечивается согласованной работой (взаимодействием) иммунной, эндокринной и нервной систем.
Тромбоциты – это безъядерные клетки крови размером 3-5 мкм. Они происходят из стволовых клеток, и относятся к миелоидной ткани. Эти клетки принимают участие в процессах свертывания крови благодаря таким свойствам как:
- способность прилипать к поврежденной стенке сосуда (адгезия);
- соединяться друг с другом (агрегация);
- способность выделять медиаторы (феномен высвобождения), влияющие на свертываемость крови (тромбоксан А, фактор 2, способствующий превращению фибриногена в фибрин, фактор 3 – способствующий образованию тромбокиназы).
Нарушение каждого из этих свойств может приводить к изменению свертывания крови.
Тромбоцитоз – увеличение количества тромбоцитов в периферической крови (N ‑ 180-320´109/л). Образование тромбоцитов регулируется тромбопоэтином, вырабатываемым клетками почек и печени.
Различают первичный и вторичный тромбоцитоз.
Первичный тромбоцитоз является результатом неопластической пролиферации на уровне клеток предшественников. Вторичный сопутствует патологическим состояниям Тромбоцитоз может быть обусловлен действием лекарств, сгущением крови (диарея, рвота, интенсивное потение). Критериями, отличающими первичный тромбоцитоз от вторичного, являются количество тромбоцитов и их внешний вид.
Клинически тромбоцитоз обычно не проявляется и является лабораторной находкой. Однако у 1/3 пациентов с первичным тромбоцитозом отмечаются сосудистые расстройства в виде головной боли и жгучей болезненности гиперемированной кожи ладоней и стоп, может нарушаться зрение, возможны тромботические осложнения.
Тромбоцитопения – уменьшение количества тромбоцитов в единице объема крови. Различают первичные и вторичные тромбоцитопении.
Причины, вызывающие тромбоцитопению, подразделяются на:
физические факторы:
- ионизирующее излучение;
- поглощение и разрушение тромбоцитов фагоцитами;
- у пациентов с искусственными клапанами сердца.
Химические факторы:
- лекарственные препараты (цитостатики, препараты золота, сульфаниламиды, ПАСК, гипотиозид и др.);
- вещества, используемые в быту (этанол, уксус и др.).
Биологические факторы:
- антитромбоцитарные антитела;
- вирусы;
- цитолитические факторы, образуемые лейкозными клетками.
Механизм развития тромбоцитопений связан с:
- подавлением тромбоцитопоэза;
- повышенным разрушением тромбоцитов;
- усиленным их потреблением.
Проявляется тромбоцитопения геморрагическим синдромом.
Тромбоцитопатии – состояния, характеризующиеся нарушением адгезивной, агрегационной, коагуляционной функций кровяных пластинок, признаками расстройства гемостаза (геморрагическими диатезами). Для тромбоцитопатий характерны длительно сохраняющиеся функциональные, биохимические и морфологические изменения в тромбоцитах.
Свёртывание крови
Свертывание крови – совокупность биофизических, биохимических процессов, обеспечивающих переход крови из жидкого состояние в твердое (агрегатное состояние) и защищает организм от кровопотери, обеспечивает постоянство объема циркулирующей крови.
Система свертывания крови – совокупность механизмов клеточного и ферментативного характера.
Функционирует в норме вместе с механизмами, которые препятствуют свертыванию крови - это противосвертывающая система. Свертывающая и противосвертывающая системы образуют единую систему – система регуляции агрегатного состояния крови.
Механизмы свертывания крови
Первые данные получены А.А. Шмидтом:
1. При свертывании крови образуются нити нерастворимого белка – фибрина. Они служат основой будущего кровяного плотного сгустка.
2. Образование фибрина является аутокаталитическим ферментативным процессом, и свертывание крови представляет собой ферментативную, биохимическую реакцию.
Показано, что в норме в циркулирующей крови фибрина почти нет, имеется его химический предшественник – фибриноген, который присутствует постоянно в плазме в растворенном состоянии в избирательных концентрациях; в случае повреждения сосудистой стенки происходит ферментативная реакция.
тромбин
Фибриноген---------------------------фибрин
Тромбин является ферментативным катализатором.
3. Шмидт А.А. показал, что в нормальной крови тромбина почти нет, но при активации свертывания он образуется из своего предшественника протромбина.
Протромбин---------------------------------тромбин.
Реакция ферментативная.
Один из учеников А.А. Шмидта - Моравитц установил, что принимают участие ионы кальция, растворенные в плазме; красные кровяные пластинки-тромбоциты. Переход протромбина в тромбин многоступенчатый аутокаталитический процесс, который осуществляется под влиянием протромбиназ (тромбопластин). Тромбопластины – это совокупность факторов, обеспечивающих переход протромбина в тромбин, множество ферментативных реакций приводит к образованию тромбопластина.
Современные представления о процессе свертывания
Свертывание крови – это многоступенчатый, ферментативный процесс, протекающий по типу каскада; активация осуществляется с помощью факторов, которые выбрасываются в кровь или околоклеточную жидкость при повреждении клеток и тканей.
Гемостаз – остановка кровотечения, направленная на поддержание массы циркулирующей крови; представляет собой совокупность физиологических и биохимических процессов; состоит из трех компонентов.
1. Сосудистый компонент.
Активная реакция сужения сосудов в участке повреждения, которое возникает вследствие сосудосуживающих биологически активных веществ. Обусловливает резкое ограничение кровотока: профилактика кровопотери.
2. Клеточный компонент.
Переход тромбоцитов в функционально активное состояние – подвижность, способность склеиваться друг с другом и прилипать в виде агрегатов к стенкам поврежденных сосудов. Структурная основа первичного пластинчатого тромба – хлопьевидное скопление тромбоцитов. Происходит заклеивание образующейся бреши, однако тромб мягкий и структурно непрочный, может удержать движение крови в микрососудах, в крупных сосудах не справится. Активация тромбоцитов и агрегация: тромбоциты выбрасывают в плазму крови ряд веществ, которые активируют третий компонент.
3. Плазматическое свертывание.
Под влиянием активаторов происходит образование трехмерной прочной сетки из нитей фибрина, которая удерживает кровь под большим давлением и является основным механизмом остановки кровотечения у человека.
По современным представлениям процесс не заканчивается на уровне фибрина, происходит растворение нитей фибрина.
4. Фибринолиз. Ликвидация красного кровяного сгустка. Тромб удаляется, так как выполнил функцию. Это ферментативный процесс. Фибринолитическая система очищает кровь от тромба.
Характеристика факторов свертывания крови
1. Плазменные: постоянно содержатся в крови;
2. Клеточные:
- тромбоцитарные, пластинчатые;
- эритроцитарные;
- лейкоцитарные;
- тканевые: выделяются в тканевую жидкость и кровь при повреждении клеточных мембран. Фосфолипиды – это осколки клеточных мембран, обладают ферментативной активностью и находятся у истоков запуска, содержатся в сосудистой стенке.
Плазменные факторы свертывания
I. Фибриноген.
Белок плазмы крови, находится в лимфе, тромбоцитах. Под действием тромбина превращается в фибрин. Количество в крови 2 – 4 г/л. Синтезируется в рибосомах и микросомах гепатоцитов. Период полураспада 3 дня. Ежедневно образуется от 1,5 до 5 г. фибриногена. Синтез фибриногена усиливается АКТГ, трийодтиронином, продуктами расщепления фибрина. Катаболизм фибриногена происходит в плазме, в клетках эндотелия сосудов, в макрофагах.
Кроме осуществления гемостаза биологическая роль фибрина заключается:
- защита раневых поверхностей от инфекций (фибриновый барьер);
- участие в регенерации соединительной ткани;
- участие в процессах воспаления.
II. Протромбин.
Гликопротеид плазмы, синтезируется в печени, зависит от витамина К. Период полураспада 60 часов. Содержание: 7 – 17 мг на 100 мл. Меньше всего у новорожденных. У детей грудного возраста 22% от количества взрослого, но это уже в 3 раза больше, чем необходимо для нормального свертывания крови.
В тромбин превращается под влиянием фактора Х (Стюарт-Прауэра), фактора V (акцелератор), ионов кальция, 3 тромбоцитарного фактора (тромбопластин).
III. Тромбопластин.
Тканевая тромбокиназа. Представляет собой фосфолипопротеид. Содержится в тканях. Катализатор превращения тромбина.
IV. Ионы кальция.
Участвуют на нескольких этапах свертывания крови:
- при вторичной агрегации тромбоцитов в сосудисто-тромбоцитарном механизме гемостаза;
- при активации VII фактора, IX фактора, VIII фактора, II фактора;
- в стабилизации фибрина.
V. Акцелератор. Ускоритель превращения протромбина в тромбин. Работает вместе с Х фактором, ионами кальция и третьим тромбоцитарным фактором. Синтез в печени при участии витамина К. При хранении крови быстро разрушается.
VI. Проконвертин.
Стабильный фактор, кофактор тромбопластин. Сывороточный ускоритель превращения протромбина в тромбин, необходимый компонент внешнего механизма гемостаза. Активируется при участии тканевого тромбопластина (III) и ионов кальция. При хранении стабилен. Биосинтез происходит в печени при участии витамина К. Период полураспада 2 – 9 часов. Его еще называют антифибринолизином и фактором Коллера.
VIII. Антигемофильный глобулин А.
Гликопротеид. В консервированной крови быстро разрушается. Синтез происходит в печени, лейкоцитах, селезенке. Активирует фактор Х. Работает вместе с IX фактором, ионами кальция, 3 тромбоцитарным фактором, которыми и активируется.
IX. Антигемофильный глобулин В или фактор Кристмаса.
При консервировании стабилен. Период полураспада 24 часа. Синтез происходит в печени при участии витамина К. Активирует VIII фактор. Работает вместе с 3 тромбоцитарным фактором, калликреином (XIV).
X. Фактор Стюарта – Прауэра.
Активирует перехода протромбина в тромбин, синтезируется в печени. При хранении крови стабилен.
Активируется:
- при внешнем механизме гемостаза VII, III факторами;
- при внутреннем механизме свертывания VIII, IX, IV факторами.
XI. Плазменный предшественник тромбопластина (ППТ).
Фактор Розенталя. Активирует фактор IX (антигемофильный глобулин В) вместе с коллагеном, ионами кальция, 3 тромбоцитарным и XIV факторами.
Активируется XII фактором, коллагеном, 3 тромбоцитарным и XV фактором.
XII. Фактор контакта или фактор Хагемана.
Активируется при контакте с чужеродной поверхностью, катехоламинами, протеазами и коллагеном. Вместе с кининогеном (XV), 3 тромбоцитарным фактором активирует XI фактор.
XIII. Фибринстабилизирующий фактор (фибриназа).
Содержится в плазме, в клетках крови и тканях. Вместе с ионами кальция участвует в стабилизации фибрина.
Активируется тромбином и ионами кальция. При дефиците – медленное заживление ран, нарушение процессов регенерации.
XIV. Фактор Флетчера.
Плазменный прекалликреин, активирует IX фактор вместе с XI фактором, коллагеном и ионами кальция.
XV. Фактор Виллебранда, Фитцджеральда.
Высокомолекулярный кининоген. Вместе с XII фактором, коллагеном, 3 тромбоцитарным фактором активирует XI плазменный фактор.
Тромбоцитарные факторы
Фактор 1 – очень похож на V фактор плазмы – акцелерин, но менее активен.
Фактор 2 – белок, синтезируемый в тромбоцитах. Участвует в образовании нерастворимого фибрина.
Фактор 3 – тромбопластин.
Фактор 4 – антигепариновый фактор, нейтрализует активность гепарина плазмы.
Фактор 11 – фактор агрегации тромбоцитов. Аналогичную задачу выполняет тромбоксан. Ингибитор агрегации – простациклин из эндотелия сосудов.
Принципиальные положения в свертывании крови
1. Существуют специальные системы, поддерживающие жидкое состояние крови, до тех пор, пока не возникает необходимость в местном образовании тромба. При нормальном течении процесса кровь в остальной части системы кровообращения остается жидкой и образовавшийся для гемостаза тромб не растворяется фибринолитической системой.
2. Для образования тромба необходимо 3 участника:
- сосудистая стенка;
- форменные элементы крови;
- плазма с факторами свертывания.
3. Внутри сосудов идет непрерывный процесс образования и растворения фибрина, необходимого для выстилки внутри всего сосудистого русла, камер сердца, клапанов и т.д.
4. Большое количество факторов свертывания крови, наличие нескольких механизмов свертывания, а также каскадный тип ферментативного превращения необходим для надежного регулирования, как жидкого состояния крови, так и быстрого ее свертывания.
5. В свертывании крови большую роль играют электрокинетические явления. Заряды препятствуют склеиванию эритроцитов и тромбоцитов между собой и с сосудистой стенкой.
6. Самосохраняющаяся функция крови обеспечивается 3 системами:
- свертывающая – образует фибрин;
- антикоагулянтная – препятствует образованию тромба;
- фибринолитическая.
7. Известны 2 механизма свертывания крови, имеющие различные назначения:
- сосудисто-тромбоцитарный гемостаз (первичный);
- ферментативно-коагуляционный (вторичный).
Причем оба процесса происходят не последовательно, а фактически одновременно. Кроме того, коагуляционный (вторичный) механизм свертывания крови подразделяется на:
1) внешний – запускается при поступлении из тканей в кровь тромбопластина через несколько секунд. Под влиянием внешнего механизма гемостаза образуется небольшое количество тромбина, которого хватает только для стимуляции агрегации тромбоцитов, освобождения тромбоцитарных факторов и активации проконвертина (VII).
2) внутренний – запускается за счет ферментных факторов крови. Активация внутреннего механизма обеспечивает массивную трансформацию X фактора и соответственно переход протромбина в тромбин. Запуск осуществляется в течение нескольких минут.
Противосвертывающая (антикоагулянтная) система крови
Противосвертывающая система крови – это совокупность веществ, которые препятствуют свертыванию. Существуют 2 противосвертывающие системы:
Первая противосвертывающая система:
- естественные антикоагулянты, обеспечивают нейтрализацию небольшого избытка протромбина на местном уровне, без привлечения других систем организма;
- клетки (макрофаги), способные поглощать факторы свертывания.
Вторая противосвертывающая система:
- включается через рецепторные окончания избытком тромбина в крови;
- рефлекторно повышается выделение естественных антикоагулянтов (гепарин) и активаторов фибринолиза.
Мнение профессора Кудряшова поддерживают немногие, чаще говорят о 2 группах антикоагулянтных факторов.
Постоянные антикоагулянты.
1. Антитромбин III – альфа-2-глобулин. Является самым мощным антикоагулянтом, обеспечивает три четверти противосвертывающей активности плазмы. В присутствии гепарина активность антитромбина III значительно повышается. Механизм действия: блокада тромбина.
2. Гепарин или антитромбин II. Активирует антитромбин III. Синтез происходит в печени, образует комплексы с фибриногеном, плазмином, адреналином. Синтезируется также базофилами и тучными клетками. Снижает адгезию и агрегацию тромбоцитов.
Образующиеся антикоагулянты.
1. Фибрин – антитромбин I, адсорбирует тромбин. При лизисе фибрина освобождается тромбин.
2. Пептиды А и В – отколовшиеся от фибриногена в момент его превращения в фибрин.
3. Продукты расщепления фибрина (антитромбин VI) – тормозят эффекты тромбоцитов.
4. Простагландин Е1.
5. Простациклин тормозит адгезию и агрегацию тромбоцитов.
6. Антитромбин IV (макроглобулин).
7. Комплекс факторов XI, XII, IX – тормозят активность фактора XII.
Фибринолитическая система
Носит ферментативный характер, имеются свои проактиваторы, активаторы, ингибиторы. Основной фермент фибринолитической системы – фибринолизин – сериновая протеаза, вызывающая расщепление пептидных связей в белковых субстратах. Основная функция фибринолиза – лизис фибрина, фибриногена, а также расщепление V, VIII и XII факторов. Кроме того, фибринолизин попутно расщепляет глюкагон, соматотропный гормон (гормон роста), гамма-глобулины. Фибринолизин в виде неактивного предшественника плазминогена находится в плазме, плаценте, матке. Активация плазминогена происходит 2 путями:
1. Внутренний путь: активатор – активный XII фактор, он также активирует и кининовую систему.
2. Внешний путь:
- урокиназа – синтез и хранение в эндотелиоцитах почечных сосудов;
- фибринолизин;
- трипсин;
- химотрипсин;
- комплекс трипсина и гепарина (тромболитин);
- ферменты микроорганизмов – стафиллокиназа и стрептокиназа.
Активация фибринолиза происходит при эмоциональном возбуждении, травме, гипоксии, гиподинамии, физической нагрузке.
Ингибиторы фибринолиза (антиплазмины).
Альфа-2-антиплазмин образует комплекс с фибрином.
Альфа-2-макроглобулин или антитромбин IV.
Антитромбин III.
Альфа-антитрипсин.
Наличие большого числа ингибиторов фибринолиза следует расценивать как форму защиты белков крови от расщепления плазмином.
Особенности свёртывания крови у детей
Кровь плода до 4-5 месяцев не свертывается из-за отсутствия фибриногена. Фибриноген появляется в плазме на 4-5 месяце внутриутробного развития и достигает нормы взрослого на 2-4 день после рождения. Другие факторы свертывания – аналогичная закономерность.
Однако, время свертывания крови у детей, в том числе и у новорожденных, мало отличается от времени свертывания крови взрослого. Вероятно, дело не в абсолютном количестве факторов свертывания, а в соотношении тех или иных концентраций. Кроме того, концентрация ряда факторов свертывания (протромбина) у взрослых и детей превышает необходимую величину для полноценного свертывания крови.
Образовавшийся в процессе свертывания фибрин подвергается спонтанному асептическому растворению (фибринолизу) протеолитическим ферментом плазмином, который содержится в плазме в виде профермента плазминогена. Важную роль в осуществлении фибринолиза играют лейкоциты, которые под влиянием активированного комплемента скапливаются в сгустке крови и освобождают активаторы плазминогена, переводя его в плазмин. Кроме того, лейкоциты фагоцитируют продукты распада фибрина и выделяют протеазы, способные разрушать фибрин и без участия плазмина.
Недостаточное образование фибрина, неполноценность тромбоцитарного звена, избыточная активность плазмина, неполноценность эндотелиальных клеток сосудистой стенки приводят к развитию феномена кровоточивости. Наоборот, избыточное образование фибрина, неполноценность антикоагулянтов и слабость фибринолитического звена становятся причиной избыточного внутрисосудистого свертывания. Иногда наблюдается сочетание тромботических и геморрагических проявлений.
При нарушении функционирования системы гемокоагуляции различают следующие синдромы:
- геморрагический;
- тромботический;
- тромбогеморрагический или синдром диссеминированного внутри-сосудистого свертывания (ДВС-синдром).
Тромботические синдромы – патологические состояния, характеризующиеся внутрисосудистым или внутрисердечным образованием тромбов, связанных со стенкой сосуда и, в той или иной степени, суживающих или полностью закрывающих просвет сосуда.
Причинами тромбообразования являются:
- нарушение целости сосудистой стенки;
- замедление тока крови;
- повышенная склонность крови к свертыванию.
Тяжесть расстройств определяется степенью закрытия просвета сосуда.
Полная обтурация артериального сосуда вызывает развитие инфаркта.
Основной причиной образования артериальных тромбов является атеросклероз сосудов. Большая роль в формировании венозных тромбов принадлежит врожденной предрасположенности к их образованию (тромбофилии). Для венозных тромбов характерна способность отрываться и превращаться в эмболы, распространяющиеся с током крови в сторону сердца и далее от него.
Группы крови
Группы крови – нормальные иммуногенетические признаки крови, позволяющие объединить людей в определенные группы по сходству антигенов крови. Знания о группах крови лежат в основе учения о переливании, трансплантации органов и тканей, в судебно-медицинской экспертизе.
Антигены – вещества, поступающие в организм парентеральным путем и вызывающие специфическую иммунологическую реакцию, которая проявляется в выработке специфических антител. Антитела – белки глобулиновой фракции сыворотки крови, которые образуются в ответ на введение антигена и специфически взаимодействующие с антигенами, вызвавшими их образование. Существует более 250 изоантигенов, находящихся в генетической связи. Большое значение в клинике имеют: 1. Система АВО. 2. Резус. 3. Лютеран. 4. Келл Челлано. 5. Диего. 6. Даффи.
Система АВО
Начало систематическому исследованию групп крови было положено открытием в 1901 г. Ландштейнером групп крови системы АВО.
В этой системе эритроциты человека разделены по принципу наличия у них трех различных антигенных свойств: А, В и АВ (А+В). Антигенные свойства «О» не существует; в крайнем случае, можно говорить о свойстве Н, однако специфические антитела анти - Н имеют весьма малое клиническое значение. Таким образом, группа крови человека определяется антигенными свойствами эритроцитов.
В крови новорожденного, как правило, нет антител системы АВО. В течение первого года жизни у ребенка образуются антитела к тем антигенам, которых нет в его собственных эритроцитах (изоантигены, анти-А, анти-В). После этого сыворотка, например, группы О, содержит антитела анти-А и анти-В, а сыворотка группы АВ не содержит этих антител.
В настоящее время установлено, что в кишечнике присутствуют бактерии, несущие те же антигенные детерминанты, что и эритроциты: так называемые гетерофильные антигены. Большая часть антител системы АВО относится к типу иммуноглобулинов класса М. Обладая 10 участками связывания антигенов, они представляют собой полные антитела, способные вызывать агглютинацию эритроцитов.
|
Группы крови |
Антигены |
Антитела |
I |
O (H) |
Анти-А (α); Анти-В (β) |
|
II |
A |
Анти-В (β) |
|
III |
B |
Анти-А (α) |
|
IV |
AB |
- - |
Наследование групп крови
В диплоидном наборе хромосом каждого человека содержатся 2 из трех аллельных генов – А, В и О(Н), кодирующих свойства элементов крови.
|
Группа крови (фенотип) |
Генотип |
Агглютиногены(на эритроцитах) |
Агглютинины (в плазме) |
|
0 |
00 |
Н (практически не эффективен) |
Анти-А |
|
А |
ОА или АА |
А |
Анти-В |
|
В |
ОВ или ВВ |
В |
Анти-В |
|
АВ |
АВ |
А и В |
Анти-А |
Показано, что свойства А и В являются доминантными, поэтому группа крови 0 фенотипически экспрессирована только у гомозигот. Поскольку генотип АО и ВО может давать соответственно фенотип А и В, у родителей с одной из этих групп крови вполне может быть ребенок с группой крови 0. Аллели А и В находятся в отношениях кодоминантности: при наличии обоих этих генов каждый из них экспрессируется, не взаимодействуя друг с другом.
Зная эти принципы наследования, можно получить некоторую информацию о родителях, исходя из группы крови ребенка. В судебно-медицинской практике принято считать, что мужчина с группой АВ не может быть отцом ребенка с группой крови 0. Чем больше учитывается групповых факторов, тем с большей степенью надежности может быть исключено отцовство (в настоящее время можно достичь вероятности 99%).
Группа крови А подразделяется на подгруппы А1 и А2. Основное различие между этими подгруппами заключается в том, что при смешивании с сывороткой анти-А эритроциты А1 агглютинируют быстрее и в большей степени, чем А2. На эритроцитах группы А2 имеется больше Н-структур, чем на эритроцитах А1. Примерно 80% лиц с группой крови А принадлежат к подгруппе А1, остальные 20% - к подгруппе А2. Практического значения для переливания крови это подразделение не имеет, так как трансфузионные реакции между подгруппами А1 и А2 выражены слабо и встречаются редко.
Географическое распределение групп крови
Более 40% жителей Центральной Европы имеют группу крови А, примерно 40% - группу 0; 10% или более – группу В и около 6% - группу АВ. У 90% коренных жителей Америки отмечена группа 0. Более 20% населения Центральной Азии имеют группу крови В. Исходя из данных о наличии и соотношении различных групп крови в тех или иных районах земного шара, антропологи могут делать выводы о происхождении и смешении народов.
Система Резус (Rh)
Взаимодействие эритроцитов с антирезусной сывороткой обусловлено наличием в разных участках мембраны нескольких антигенов (неполные антигены). Важнейшие из них - С, D, Е, с, е. Наиболее выражены антигенные свойства у антигена D. Для простоты кровь, содержащую D-эритроциты, называют резус-положительной (Rh+ или Rh); а кровь без таких эритроцитов – резус-отрицательной (Rh– или rh); 85% европейцев имеют кровь Rh+; 15% - Rh–. Фенотипу Rh+ может соответствовать генотип DD или Dd; а фенотипу Rh – только генотип dd.
Одно из различий между системами резус и АВО, имеющее важное практическое значение, заключается в том, что агглютинины системы АВО всегда содержатся в крови человека уже после первых месяцев жизни, тогда как Rh – агглютинины появляются только после сенсибилизации: контакта резус-отрицательного индивида с резус-антигенами. Следовательно, при первом переливании резус-несовметимой крови явной реакции обычно не возникает. Реакции антиген-антитело появляются только при повторном переливании такой крови. Другое различие между двумя системами состоит в том, что большинство резус-агглютининов представляет собой неполные антитела иммуноглобулинов класса G, размеры которых в отличие от размеров полных агглютининов системы АВО достаточно малы, чтобы они могли проникать через плацентарный барьер.
Резус-несовместимость и беременность. При беременности из крови резус-положительного плода в кровь резус-отрицательной матери могут проникать небольшие количества эритроцитов. Это приводит к выработке агглютининов против Rh+ - эритроцитов. Обычно лишь во время родов в кровь матери попадает большое количество (10-15 мл) эритроцитов плода. Поскольку титр антител возрастает в крови матери относительно медленно (в течение нескольких месяцев), при первой беременности осложнений обычно не возникает. Однако при второй беременности резус-отрицательной женщины резус-положительным плодом титр антител у нее в крови может достигать столь высокого уровня, что в результате проникновения агглютининов через плаценту эритроциты плода начинают разрушаться. Это приводит к серьезным нарушениям жизнедеятельности плода и даже к внутриутробной смерти (эритробластоз плода). Образование антител в организме резус-отрицательной женщины можно ограничить или полностью подавить путем так называемой анти-D-профилактики. Если непосредственно после родов (в том числе преждевременных) женщине ввести анти-D-глобулин, то резус-положительные эритроциты, проникшие в ее кровь, разрушатся и тем самым будет ликвидирован фактор, вызывающий выработку антител иммунной системой. Реакции антиген-антитело могут возникать и при несовместимости матери и плода по другим групповым признакам (в частности, АВО), однако такие реакции обычно бывают слабо выраженными.
Переливание крови
Правила переливания крови:
1. Переливание изогруппной крови.
2. Определение групповой принадлежности по системе АВО.
3. Определение резус-принадлежности крови.
4. Определение индивидуальной совместимости крови.
5. Проведение биологической пробы.
Определение групповой принадлежности крови по системе АВО.
1. Метод стандартных сывороток – используются стандартные сыворотки первой, второй и третьей групп крови, которые содержат антитела соответствующей группы; следовательно, в исследуемой крови определяем антигены.
2. Метод стандартных эритроцитов – используются стандартные эритроциты второй и третьей групп, которые содержат соответствующие антигены (А, В); следовательно, в исследуемой крови определяют антитела.
3. Метод цоликлонов – используются цоликлоны анти-А (альфа) и анти-В (бета), это моноклональные антитела, в крови определяем антигены.
Определение резус-принадлежности крови.
1. Метод антирезусных сывороток – используется антирезусная сыворотка, которую наслаивают по стенке пробирки, следом каплю крови, пробирку покачивают несколько минут, затем добавляют каплю физиологического раствора для исключения ложной агглютинации. Если агглютинация есть – резус положительный; при отсутствии агглютинации – резус отрицательный.
2. Метод цоликлонов – цоликлон анти-D-супер.
Определение индивидуальной совместимости крови
1. Кровь донора смешивают с сывороткой реципиента. При наличии агглютинации кровь несовместима; при отсутствии – совместима.
2. Кровь реципиента смешивают с сывороткой донора. Оценка результатов аналогична.
Проведение биологической пробы.
Первые 45 мл крови переливают дробно: через 3 минуты по 15 мл и наблюдают за состоянием больного. Явления несовместимости: чувство жара во всем теле, бледность кожных покровов, малый и частый пульс, снижение артериального давления; боли в животе, голове, пояснице; моча красно-коричневого цвета: «мясных помоев».
Классификация кровезамещающих растворов
1. Гемодинамические:
а) препараты на основе декстрана:
- полиглюкин;
- реополиглюкин.
б) препараты желатина:
- желатиноль.
2. Дезинтоксикационные:
- гемодез;
- полидез.
3. Препараты для парентерального питания:
а) белковые гидролизаты:
- гидролизат казеина;
- гидролизин;
- аминопептид
б) смеси аминокислот:
- аминокровин;
- мориамин.
4. Регуляторы водно-солевого и кислотно-щелочного состояния:
а) солевые растворы:
- Изотонический раствор хлорида натрия (физиологический раствор);
- раствор Рингера-Локка;
- лактасол.
б) осмодиуретики:
- маннитол;
- сорбитол.
- Кровезаменители с функцией переноса кислорода.
- Эмульсии фторуглеродов;
- Растворы гемоглобина
5. Кровезаменители комплексного действия.
- растворы гемодинамического и дезинтоксикационного действия;
- растворы гемодинамического и гемопоэтического действия;
- растворы гемодинамического и реологического действия.
МЕТОДЫ ОЦЕНКИ ГЕМОСТАЗА
Методика подсчета тромбоцитов (метод Фонио). Определяют количество тромбоцитов на 1000 эритроцитов в мазках периферической крови (заранее приготовленных). Зная абсолютное число эритроцитов в 1 мм3 крови, вычисляют количество кровяных пластинок в 1 мм3 крови.
Для предупреждения аггрегации тромбоцитов на место укола наносят каплю 14 % раствора сульфата магния. Капля крови смешивается с магнезией. Из смеси делают мазок и красят по Романовскому – Гимза. Определяют количество тромбоцитов на 1000 эритроцитов.
Определение времени рекальцификации плазмы по Хауэллу. В стабилизированной крови ионы кальция связываются стабилизатором (оксалат натрия), и кровь лишается способности свертываться. При прибавлении раствора CaCl2 в крови вновь появляются свободные ионы кальция, что возвращает ей способность к коагуляции.
В пробирку наливают 0,1 мл 0,025 М раствора CaCl2 и 0,1 мл физиологического раствора. После чего пробирки помещают в водяную баню на 60 секунд при 37 оС. Через 60 секунд в пробирки добавляют 0,1 мл испытуемой плазмы и с этого момента замечают время образования сгустка.
Определение активности факторов протромбинового комплекса. Определяется время образования сгустка в плазме при добавлении к ней избытка тромбопластина и оптимального количества кальция. В этих условиях время свертывания плазмы характеризует активность протромбина, ускорителей его превращения и факторов протромбинового комплекса.
В пробирку вводят 0,1 мл суспензии тромбопластина, 0,1 мл 0,025 М раствора CaCl2, нагревают на водяной бане при 37о и через 10 секунд прибавляют 0,1 мл испытуемой плазмы. Отмечают время свертывания плазмы с момента ее добавления.
Тромботест. В слабый раствор CaCl2 (0,3%) объемом 3 мл добавляют 0,1 мл испытуемой плазмы. Осторожно смешивают и ставят в термостат при 37о. Через 30 минут читают результаты. Определяют степень свертываемости. Разливают семь степеней: 1 степень – слабая опалесценции, 2 степень – появление взвешенных частиц, 3 степень – хлопья фирина, 4 степень – нити фибрина, 5 степень – сетка из нитей фибрина, 6 степень – мешочек из сетки фибрина, 7 степень – плотный большой мешок (сетчатый или волокнистый).
МЕТОДЫ ИССЛЕДОВАНИЯ ПЕРВИЧНОГО ТРОМБОЦИТАРНО-
СОСУДИСТОГО ГЕМОСТАЗА
1. Оценка сосудистого компонента гемостаза.
Проба на резистентность капилляров.
Принцип метода (проба щипка). Кожу под ключицей собирают в складку и делают щипок. У здорового человека никаких изменений не наблюдается ни сразу после щипка, ни спустя 24 часа. Но если резистентность капилляров нарушена, на месте щипка образуются петехии или кровоподтек, особенно отчетливо видимые через 24 часа.
Проба жгута. На предплечье очерчивают круг приблизительно 5 см в диаметре. Тщательно осматривают кожу в круге на наличие петехий. Затем на плечо накладывают манжету тонометра и создают давление 80 мм. рт. ст. Давление поддерживают строго на одном уровне в течение 5 минут. В очерченной области подсчитывают все появившиеся петехии, включая имевшиеся ранее. У здоровых людей петехии либо не появляются, либо их бывает не более 10. При нарушении сосудистого компонента гемостаза отмечается повышенное количество петехий, и их диаметр превышает 1 мм.
2. Оценка тромбоцитарного компонента гемостаза.
Определение количества тромбоцитов в крови.
Из пальца берут 0,02 мл. крови и приливают в пробирку с 1,98 мл. 1% раствора оксалата аммония с небольшим количеством бриллиантового голубого. Тщательно перемешивают, при этом эритроциты разрушаются, а тромбоциты и лейкоциты сохраняются. Взвесь выдерживают в течение 20-30 минут для осаждения тромбоцитов, а затем помещают в камеру Горяева. Тромбоциты подсчитывают в 25 больших квадратах. Среднее арифметическое из 2 параллельных определений умножают на 1000 (на 1 мкл.). Пределы колебаний числа тромбоцитов в норме составляют от 150 х 10 до 450 х 10/ л.
Микрометод определения агрегации тромбоцитов в цельной крови.
Принцип метода основан на том, что после введения тром6оцитагрегирующего агента в цельную кровь тромбоциты склеиваются, и в результате уменьшается количество свободных тромбоцитов. По их количеству, выраженному в % к исходному уровню можно судить об агрегационной способности тромбоцитов. В норме агрегационная способность тромбоцитов составляет от 30 до 40 %.
Определение адгезивной активности тромбоцитов.
Адгезивную активность тромбоцитов оценивают по их способности задерживаться на фильтре, кетгуте, нарезанном кусочками. Адгезию оценивают как отношение между количеством тромбоцитов в цельной крови и фильтрате, выраженное в процентах. В норме адгезивная способность тромбоцитов составляет от 30 до 40%.
Длительность кровотечения по методу Дуке.
Скарификатором прокалывают мякоть ногтевой фаланги и через каждые 30 секунд фильтровальной бумагой, осторожно снимают выступающие капли крови. У здоровых людей остановка кровотечения происходит через 1 -3 минуты. Метод позволяет интегрально оценить состояние томбоцитарно - сосудистого гемостаза. Удлинение времени кровотечения по Дуке свидетельствует о недостаточности тромбоцитарно- сосудистого гемостаза.
МЕТОДЫ ОЦЕНКИ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
1. Оценка первой фазы коагуляционного гемостаза.
Время свертывания крови по Ли-Уайту.
В пробирку набирают 1мл венозной крови и при появлении первых капель крови включают секундомер. Через каждые 30 секунд пробирку наклоняют и смотрят, растекается ли кровь по стенкам пробирки. Момент свертывания крови фиксируют по секундомеру и записывают. Затем стеклянной палочкой осторожно отделяют сгусток от стенок пробирки. Если действительно наступило свертывание крови, сгусток будет скользитъ по стенкам пробирки. Тогда останавливают секундомер и записывают окончательное время, которое считают временем свертывания крови.
У здоровых людей время свертывания крови в несиликонированной пробирке составляет 5 -7 минут при температуре 37 градусов, а в силиконированной 15-20 минут.
Определение времени рекальцификации плазмы.
Принцип метода заключается в определении времени, необходимого на свертывание декальцинированной плазмы после добавления к ней оптимального количества хлористого кальция.
В пробирку, установленную на водяной бане при температуре 37 градусов, наливают 0,2 мл. 0,28 % раствора хлористого кальция и 0,1 мл физиологического раствора. Через 60 секунд в пробирку добавляют 0,1мл исследуемой плазмы и включают секундомер. Плазма здорового человека свертывается в течение 60 -120 секунд. Укорочение времени свидетельствует о повышении, а удлинение о замедлении времени свертывания крови.
Определение каолин-кефалинового времени (АПТВ).
Каолин - белая глина, является активатором свертывания крови.
Кефалин- заменитель тромбоцитарного фактора 3.
АПТВ является модифицированным временем рекальцификации плазмы, включающим предварительную активацию XI и XII факторов каолином и тем самым обеспечивает максимальный каталитический эффект фосфолипидов.
В пробирку, нагретую до 37 градусов на водяной бане, помещают 0,1 мл реагента АПТВ и проводят инкубацию в течение 3 минут. Затем прибавляют 0,1 мл. плазмы и смесь инкубируют в течение 2 минут. После чего добавляют 0,1 мл подогретого до 37 градусов 0,28 % хлористого кальция и засекают время. Нормальное значение АПТВ составляет 30-40 секунд. Удлинение АПТВ более чем на 8 секунд считается патологическим и свидетельствует о замедлении свертывания крови.
2. Определение второй фазы коагуляционного гемостаза.
Определение протомбинового времени.
Принцип метода заключается в том, что при избытке тромбопластина, оптимальном содержании кальция и фибриногена в плазме, время образования сгустка зависит от активности факторов протромбинового комплекса (IV, V, VII, Х). На этом основании в реакционную смесь вводят тканевой тромбопластин и хлористый кальций. Источником факторов протромбинового комплекса является сама плазма. Если в ней занижена активность одного или нескольких факторов протромбинового комплекса, время свертывания будет увеличено по сравнению с нормой, если их активность повышена, то время свертывания будет уменьшено.
Методика: в пробирку с 0,1 мл цитратной плазмы добавляют 0,1 мл тромбопластека, и смесь инкубируют при температуре 37 градусов в течение 1 минуты. Затем в нее добавляют 0,1 мл 0,2.8 % хлористого кальция и засекают время. В норме тромбиновое время составляет от 13 до 15 секунд.
Протромбиновый_индекс плазмы.
Протромбиновый индекс плазмы рассчитывают по формуле: ПИП=А/В*100,
где А - протромбиновое время плазмы здорового человека.
В - протромбиновое время исследуемой плазмы.
В норме ПИП здорового человека составляет 80-110 %.
ПИП здорового человека определяют каждый раз перед работой с тромбопластином новой серии.
3. Оценка третьей фазы свертывания крови.
Определение концентрации фибриногена.
Принцип метода: при избытке тромбина время образования фибринового сгустка зависит от концентрации фибриногена.
К 0,2 мл разведенной в соотношении 1: 9 цитратной плазмы прибавляют 0,2 мл раствора тромбина и одновременно включают секундомер. Отмечая время появления нитей фибрина. Концентрацию фибриногена определяют по специальной калибровочной кривой. Норма фибриногена у здорового человека составляет 1,5-4,5 г/л.
Определенне концентрации фибриногена весовым (унифицированным) методом.
Принцип метода заключается в том, что полученный сгусток фибрина быстро высушивают и взвешивают. Норма - 1,5-4,5 г/л.
4. Оценка четвертой фазы свертывания крови - ретракции кровяного сгустка.
Сгусток помещают на промокательную бумагу и измеряют его диаметр, спустя 15-20 минут вновь измеряют диаметр сгустка. Рассчитывают индекс ретракции по формуле:
А/В*100
где: А - диаметр сгустка в исходном фоне.
В - диаметр сгустка спустя 15-20 минут.
Индекс ретракции кровяного сгустка отражает объем сыворотки, отжимающейся из сгустка при ретракции нитей фибрина. В норме индекс ретракции составляет 75-80 %. Снижение индекса ретракции свидетельствует о недостаточности 6-го фактора тромбоцитов (ретрактозима).
ОПРЕДЕЛЕНИЕ АКТИВНОСТИ АНТИКОАГУЛЯНТОВ
Определение тромбинового времени (Антитромбиновая активность).
Принцип метода основан на способности антитромбина плазмы, инактивировать добавленный к ней стандартный раствор тромбина.
В пробирку, находящуюся на водяной бане при температуре +37°, приливают 0.1 мл физиологического раствора, 0,1 мл плазмы и прогревают 15 сек. Затем добавляют 0,1 мл стандартного раствора тромбина, который свертывает плазму здорового человека за 14-16 сек. и отмечают время появления сгустка. Ставят несколько параллельных проб и вычисляют среднее арифметическое. Увеличение тромбинового времени может быть связано с недостатком фибриногена, функциональной неполноценностью молекул фибриногена, с высокой антитромбиновой активностью продуктов деградации фибрина, высокой активностью гепарина.
Определение времени свободного гепарина с протаминсульфатом.
Принцип основан на определении уменьшения тромбинового времени после добавления к плазме протаминсульфата, связывающего гепарин.
В пробирку вносят 0,1 мл плазмы и 0,05 мл протаминсульфата, через 30 секунд добавляют 0,1мл тромбина и включают секундомер. Результат выражают в разнице между тромбиновым временем и временем с добавлением протаминсульфата. В норме оно составляет 7,7 - 10 секунд.
Определение плазмина, плазминогена и суммарной фибринолитической активности производят на основании степени гидролиза фибрина до, и после активации плазмы крови урокиназой или стрептокиназой. По фибринолитической активности до активации определяют содержание плазмина, а по разнице, активированной и неактивированной плазмы содержание плазминогена. Степень гидролиза определяют по интенсивности окраски фильтрата проб, при длине волны 440 нм. Расчет показателей осуществляется по специальным формулам. В норме показатель плазмина составляет 88 -112%, плазминогена - 82-118%, суммарная фибринолитическая активность -62-118%.
Алгоритм разбора гемостазиограмм.
1. По показателям время кровотечения по Дуке, время свертывания крови по Ли-Уайту, времени рекальцификации плазмы и АПТВ определить в целом наличие склонности к гипо- или гиперкоагуляции.
2. Оценить состояние тромбоцитарно - сосудистого гемостаза по количеству тромбоцитов их способности к адгезии и агрегации, пробе жгута (щипка), пробе Дуке.
3. Оценить состояние коагуляционного гемостаза.
а) первой фазы: время свертывания по Ли-Уайту, время рекальцификации плазмы, АПТВ.
4. Оценить состояние второй фазы по протромбиновому индексу.
5. Оценить состояние коагулянтов третьей фазы по концентрации фибриногена.
6. Оценить активность четвертой фазы по степени ретракции кровяного сгустка.
7. Оценить активность антикоагулянтов по тромбиновому времени, времени с протаминсульфатом и активности плазминоген - плазминовой системы.
Сделать заключение о возможной этиологии и патогенезе имеющихся нарушений со стороны системы гемостаза.
МЕТОДИКИ ЛАБОРАТОРНЯХ РАБОТ, ВЫПОЛНЯЕМЫХ СТУДЕНТАМИ НА ПРАКТИЧЕСКИХ ЗАНЯТИЯХ
Содержание практической работы № 1 и порядок ее выполнения
Цель работы: овладеть методикой взятия крови для общего анализа
Методика: Кисть левой руки исследуемого кладут на стол ладонью вверх. Концевую фалангу IV пальца протирают спиртом и эфиром. Затем, удерживая между большим и указательным пальцами IV палец пациента, берут другой рукой стерильный скарификатор одноразового использования и быстрым движением делают прокол мякоти концевой фаланги. Кровь из ранки должна вытекать без надавливания. Первую каплю снимают ватой, вторую каплю берут для исследования. После этого на ранку накладывают ватный тампон, смоченный настойкой йода или спирта. Зарисовывают скарификатор.
Содержание практической работы № 2 и порядок ее выполнения
Цель работы: овладеть методикой подсчета эритроцитов и определить их количество; изучить основные функции эритроцитов.
Методика: Для работы необходимы смеситель и счетная камера. Смеситель представляет собой капилляр с ампулообразным расширением. В ампуле имеется стеклянная бусинка для размешивания крови. На капилляре нанесены метки 0,5 и 1,0. Над ампулой имеется метка 101. На короткий отросток смесителя надевается резиновая трубка со стеклянным наконечником.
Счетная камера представляет собой толстое стекло, в средней части которого имеется 4 поперечных желоба. Между ними находятся 3 узкие площадки. Средняя площадка ниже боковых на 0,1 мм и разделена пополам продольным желобком, по обе стороны которого на стекло нанесены сетки Горяева. Сетка Горяева состоит из 225 больших квадратов, 25 из них разделены поперечными и продольными линиями на 16 маленьких. Сторона маленького квадрата равняется 1/20 мм, площадь – 1/400 мм2.
Перед взятием крови на счетную камеру накладывают шлифованное покровное стекло и большими пальцами плотно притирают его к боковым стеклянным пластинкам до появления ньютоновских колец. После прокола пальца первую каплю крови снимают ватным тампоном. Во вторую каплю крови погружают кончик смесителя для эритроцитов, который держат горизонтально. Берут в рот стеклянный наконечник, соединенный резиновой трубкой с коротким отростком ампулы, и осторожно насасывают кровь в капилляр смесителя до метки 0,5, не допуская попадания пузырьков воздуха. Затем погружают кончик смесителя в 1-3 % раствор поваренной соли и насасывают его до метки 101, разбавляя при этом кровь в 200 раз. Смеситель кладут на стол. Затем, зажав концы смесителя между I и III пальцами, встряхивают его. После тщательного перемешивания крови, выпустив предварительно две-три капли, наносят каплю разведенной крови на среднюю пластинку счетной камеры у края покровного стекла. В силу капиллярности жидкость заполнит камеру. Затем камеру ставят на предметный столик микроскопа и, если форменные элементы расположены равномерно над сеткой Горяева, приступают к их подсчету.
Подсчитывают число эритроцитов в пяти больших квадратах, что составляет 80 маленьких, расположенных по диагонали. При этом во время подсчета найденное число эритроцитов заносят последовательно в маленькие квадраты, изображенные в разделе «Полученные результаты». Во избежание двукратного подсчета клеток, лежащих на границе малых квадратов, руководствуются правилом Егорова: относящимися к данному квадратику считаются эритроциты, лежащие как внутри квадратика, так и на его левой и верхней границах. Эритроциты, лежащие на правой и нижней границах, в данном квадратике не считаются. Подсчитав общую сумму эритроцитов в пяти больших квадратах, вычисляют количество эритроцитов в 1 мм3 по следующей формуле:
Х = А х 4000 х 200
80
где Х – искомое количество эритроцитов в 1 мм3 крови, А – число эритроцитов в 5 больших (80 маленьких) квадратах, 200 – степень разведения крови, 4000 – фактор пересчета для определения количества эритроцитов в 1 мм3. На рисунках обозначают малый и большой квадраты, указывают размеры сторон и площади малого квадрата, обозначают слой крови в счетной камере и указывают уровень наполнения смесителя кровью. Сравнивают полученный результат с нормой и делают вывод.
Содержание практической работы № 3 и порядок ее выполнения
Цель работы: овладеть методикой определения количества гемоглобина по Сали, определить его количество у человека; изучить основные свойства и значение гемоглобина
Методика: . В градуированную пробирку гемометра Сали наливают децинормальный раствор соляной кислоты до нижней метки шкалы (2 г%). Прокалывают палец. В специальный капилляр берут 20 мм3 крови и, обтерев его кончик ваткой, выдувают кровь на дно пробирки так, чтобы верхний слой соляной кислоты оставался прозрачным. Не вынимая капилляра, промывают его соляной кислотой, находящейся над кровью. Смешивают кровь с раствором соляной кислоты путем встряхивания пробирки и ставят ее на 5 минут в корпус гемометра (за это время успевает образоваться солянокислый гематин темно-коричневого цвета).
Затем в пробирку добавляют по каплям дистиллированную воду до тех пор, пока цвет раствора в градуированной пробирке не будет совершенно одинаков с цветом стандартного раствора в боковых пробирках (добавляя воду, раствор перемешивают стеклянной палочкой). Цифра на шкале пробирки на уровне мениска полученного раствора указывает содержание Hb в г%. На рисунке закрашивают пробирки со стандартным раствором, на градуированной пробирке указывают концентрацию найденного количества гемоглобина, а на капилляре – объем крови, необходимый для исследования. Сравнивают полученный результат с нормой и делают вывод.
Содержание практической работы № 4 и порядок ее выполнения
Цель работы: овладеть методикой расчета цветового показателя; выяснить значение цветового показателя для клиники.
Методика: Определив количество эритроцитов в 1 мм3 крови и количество гемоглобина в 100 мл крови, рассчитывают цветовой показатель по следующей формуле:
кол-во гемоглобина: 16,7 (НКГ)
кол-во эритроцитов 5000000 (НКЭ)
НКГ – нормальное количество гемоглобина
НКЭ – нормальное количество эритроцитов
Сравнивают полученный результат с нормой и делают вывод.
Отчет о проделанной работе студентов выносится в тетрадь, оформляют вывод. Преподаватель проверяет и подписывает выполненную работу, проводит выборочный контроль знаний.
Содержание практической работы № 5 и порядок ее выполнения
Цель работы: овладеть методикой подсчета лейкоцитов и определить их количество
Методика: Описанным в работе № 2 методом набирают кровь в смеситель для лейкоцитов, объем ампулы в котором в 10 раз меньше, чем в смесителе для эритроцитов. Затем разбавляют ее в 20 раз 5% раствором уксусной кислоты, подкрашенной метиленовой синью. Притирают покровное стекло к счетной камере и заполняют ее разбавленной кровью из смесителя.
Подсчет лейкоцитов ведут при малом увеличении микроскопа в 100 больших квадратах, что составляет 1600 малых квадратиков. При этом найденное число лейкоцитов в каждом большом квадрате заносят в соответствующие квадраты специальной сетки, изображенной в разделе «Полученные результаты». Подсчитывают число лейкоцитов в 100 больших квадратах. Количество лейкоцитов в 1 мм3 рассчитывают по формуле:
Х = в х 4000 х 20,
1600
Где: Х – число лейкоцитов в 1 мм3 крови, В – число лейкоцитов в 100 больших (1600 малых) квадратах, 20 – степень разведения крови, 4000 – фактор пересчета для определения количества лейкоцитов в 1 мм3. Сравнивают полученные результаты с должными величинами и делают вывод.
Содержание практической работы № 6 и порядок ее выполнения
Цель работы: овладеть методикой определения резус-фактора, уяснить принцип подразделения крови человека на резус-положительную и резус-отрицательную.
Методика: На дно центрифужной пробирки наносят специальной пипеткой одну каплю стандартного реагента антирезуса и одну каплю исследуемой крови. Содержимое пробирки перемешивают встряхиванием и затем, медленно поворачивая, наклоняют пробирку почти до горизонтали таким образом, чтобы содержимое растекалось по стенкам пробирки. Вращение пробирки следует производить до появления результата, но не менее трех минут. Оценка результатов производится визуально. Если на стенках пробирки видна равномерно окрашенная взвесью эритроцитов жидкость, кровь является резус-отрицательной. Появление четко различимых агрегатов эритроцитов на фоне просветленной жидкости указывает на резус-положительную принадлежность исследуемой крови. Для исключения неспецифической агглютинации эритроцитов в пробирку следует добавить 2 мл физиологического раствора и перемешать, не взбалтывая, путем 2 - 3-кратного перевертывания пробирки.
Содержание практической работы № 7 и порядок ее выполнения
Цель работы: изучить суспензионную устойчивость крови, разобрать механизм оседания эритроцитов и его значение для клиники, овладеть методикой определения скорости оседания эритроцитов.
Методика: Для определения скорости оседания эритроцитов применяется прибор Панченкова, состоящий из штатива, в котором зажимаются в вертикальном положении специальные капилляры. На капиллярах имеется шкала в мм, состоящая из 100 делений, и две метки: «К» (кровь) на уровне нуля и «Р» (реактив) на уровне 50 мм. Капилляр промывают 5% раствором цитрата натрия. Затем набирают раствор цитрата натрия до метки «Р» и выдувают его на часовое стекло. Вслед за этим делают прокол пальца и в тот же капилляр двукратно набирают кровь до метки «К». Обе порции крови выпускают на часовое стекло и смешивают с раствором цитрата.
Полученную смесь крови с цитратом в отношении 4:1 набирают в капилляр до нулевой отметки и ставят его в штатив, отмечая время. По прошествии часа измеряют по шкале капилляра высоту образовавшегося столбика плазмы. Высота столба плазмы в мм, образовавшегося за 1 час в результате оседания эритроцитов, является мерой СОЭ. При работе следует иметь в виду, что для успешного взятия крови прокол пальца должен быть довольно глубоким, капилляр следует держать слегка наклонно, погрузив его кончик в каплю крови, при этих условиях кровь сама заполнит капилляр. Зарисовывают капилляр прибора Панченкова, показав величину скорости оседания эритроцитов в опыте. Сравнивают полученный результат с нормой и делают вывод
Содержание практической работы № 8 и порядок ее выполнения
Цель работы: овладеть методикой определения групп крови; усвоить принцип подразделения крови людей на группы.
Методика: Чистое предметное стекло помещают на белую бумагу и наносят (не смешивая) по капле стандартных сывороток I, II, III групп, содержащих соответственно агглютинины: a, b; b и a. Затем прокалывают палец и уголком второго предметного стекла переносят небольшое количество выступившей крови в каплю сыворотки I группы, другим чистым углом такое же количество крови переносят в сыворотку II группы и третьим чистым углом переносят кровь в сыворотку III группы. Каждый раз кровь тщательно смешивают с каплей сыворотки. За реакцией агглютинации наблюдают в течение 5 минут, периодически покачивая предметное стекло. При отсутствии агглютинации капля остается равномерно окрашенной. При агглютинации капля состоит из комочков красного цвета, разделенных прозрачной смесью плазмы и стандартной сыворотки. Для исключения «холодовой агглютинации» к капле сыворотки с кровью добавляют каплю физиологического раствора комнатной температуры. Группа крови устанавливается в зависимости от агглютинации.
1. При отсутствии агглютинации со всеми 3 сыворотками кровь принадлежит к 0 (I) гр.
2. При агглютинации с сыворотками I и III групп кровь принадлежит к А (II) группе.
3. При агглютинации с сыворотками I и II групп кровь принадлежит к В (III) группе.
4. При агглютинации с сыворотками I, II, III групп кровь принадлежит к АВ (IV) группе.
Зарисовывают предметное стекло с полученными результатами, описывают их и делают вывод.
Содержание практической работы № 9 и порядок ее выполнения
Цель работы: освоить методику определения времени свертывания крови; изучить механизм процесса свертывания крови.
Методика: Определение времени свертывания крови производится в аппарате Базарона, представляющем водный термостат с двумя камерами: нижняя (водная) и верхняя (воздушная) с отверстиями для термометров. Снимают крышку аппарата и в водную камеру вливают 150 мл горячей воды (около 60о, а в воздушную - 15 мл теплой воды). Когда термометр воздушной камеры покажет температуру 37°, делают прокол кожи пальца и испытуемый наносит каплю крови из пальца на середину вогнутой поверхности парафинированного часового стекла, находящегося в воздушной камере. Аппарат закрывают крышкой. Каждую минуту открывают крышку и проводят через каплю очищенный от жира конский волос. Отмечают момент прилипания комочков фибрина к поверхности волоса (начало свертывания) и прилипание всей капли к волосу (конец свертывания). Полученные результаты сравнивают с нормой и делают вывод.
Преподаватель проверяет и подписывает выполненную работу, проводит выборочный контроль знаний.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.