МДК 0202. Лекция. ККЛС 7 группы периодической системы Д.И. Менделеева

Контроль качества неорганических лекарственных средств элементов
VII
группы периодической системы Д.И. Менделеева
ПМ 02 «ИЗГОТОВЛЕНИЕ ЛЕКАРСТВЕННЫХ ФОРМ И
ПРОВЕДЕНИЕ ОБЯЗАТЕЛЬНЫХ ВИДОВ
 ВНУТРИАПТЕЧНОГО КОНТРОЛЯ» МДК 02.02.
«КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ» СПЕЦИАЛЬНОСТЬ 33.02.01 «ФАРМАЦИЯ»
ВНУТРИАПТЕЧНОГО КОНТРОЛЯ» МДК 02.02.
«КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ» СПЕЦИАЛЬНОСТЬ 33.02.01 «ФАРМАЦИЯ»
ПРЕПОДАВАТЕЛЬ: Бессонова С.В.
Барнаул, 2024
 План:
План:
1.Общая характеристика элементов VII группы 2.Кислота хлористоводородная
8,3%
3.Натрия хлорид, калия хлорид 4.Натрия бромид, калия бромид.
Общая характеристика
• Галогены – F, Cl, Br, I – элементы главной подгруппы 7 группы периодической системы
• Все галогены обладают очень резким запахом.
• Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек.
• 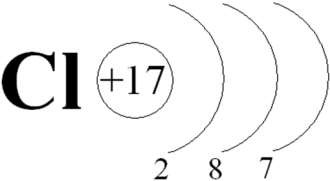 Атомы галогенов имеют на внешнем
электронном слое 7 электронов, до устойчивого состояния им не хватает одного
электрона, поэтому галогены стремятся приобрести его, переходя в более
устойчивое состояние галогенид – ионов.
Атомы галогенов имеют на внешнем
электронном слое 7 электронов, до устойчивого состояния им не хватает одного
электрона, поэтому галогены стремятся приобрести его, переходя в более
устойчивое состояние галогенид – ионов.
История открытия галогенов

 |
 |

 |
Кислота хлористоводородная
Acidum hydrochloricum
Кислота хлористоводородная разведённая
Acidum hydrochloricum dilutum
 M.m. = 36,46 г/
M.m. = 36,46 г/
моль
Бесцветная прозрачная жидкость с характерным запахом. Смешивается во всех соотношениях с водой и спиртом.
Кислота хлористоводородная разведенная содержит хлороводород в пределах - 8,2-8,4 %, плотность ее равна 1,040 - 1,041 г / см3.

Определение
подлинности
1.Взаимодействие катиона водорода с индикатором
“Метилоранж”. Появляется розовое окрашивание
2. Реакция на хлорид-ион с Нитратом серебра:
|
Осадок Хлорида серебра растворим в растворе аммиака |
AgNO3
+
HCl ![]() AgCl↓ +
HNO3
AgCl↓ +
HNO3
белыйосадок
AgCl↓
+
2NH4OH
![]() [Ag(NH3)2]Cl
+ 2H2O
[Ag(NH3)2]Cl
+ 2H2O
3. Реакция на хлорид-ион с Диоксидом марганца при нагревании:
t°
MnO2
+
4HCl ![]() MnCl2
+
Cl2↑
+
2H2O
MnCl2
+
Cl2↑
+
2H2O
запах
Выделяется свободный Хлор, который обнаруживается по запаху
 Количественное
определение
Количественное
определение
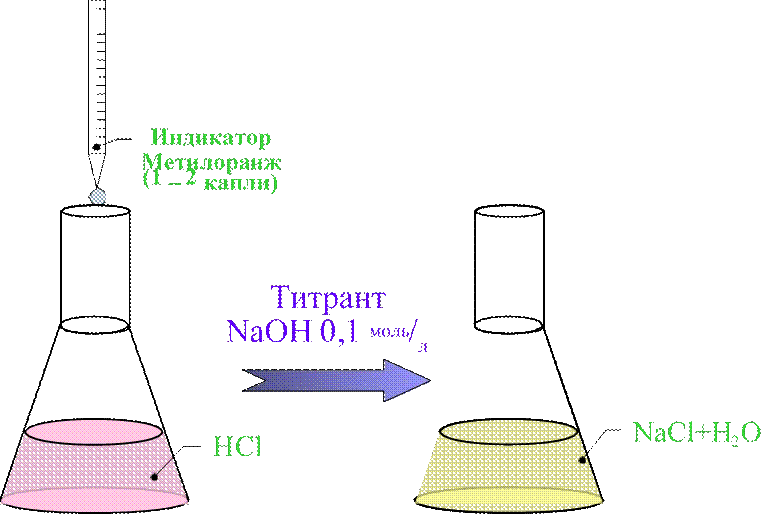
•метод кислотно-основного титрования в водных средах;
•титрант NaOH 0,1 моль/л;
•индикатор Метилоранж;
•титрование ведут от розовой до жёлтой окраски.
HCl
+ NaOH ![]() NaCl + H2O fэ=1
NaCl + H2O fэ=1
Формула для расчёта массовой доли:
|
% T KП Tx/ y 100 V
m |
 Количественноеопределение
Количественноеопределение

Применение
Кислота хлороводородная (хлористоводородная) – единственная минеральная кислота, которая постоянно присутствует в свободном виде в желудочном соке человека.
Она способствует превращению фермента желудочного сока пепсиногена в активный фермент - пепсин, а также уничтожает проникающие в желудок патогенные и гнилостные бактерии.
В медицине находит применение кислота хлористоводородная разведённая.
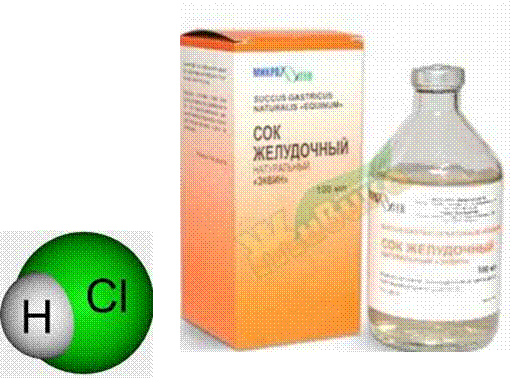 Применяют
её внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при пониженной
кислотности желудочного сока. Часто её назначают совместно с препаратами
железа, так как она способствует улучшению их всасывания.
Применяют
её внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при пониженной
кислотности желудочного сока. Часто её назначают совместно с препаратами
железа, так как она способствует улучшению их всасывания.
Хранение.
Кислота хлористоводородная, предназначенная для медицинских целей, должна храниться в склянках с притертыми пробками при комнатной температуре.
Нельзя хранить кислоту в очень теплых помещениях, так как в этом случае может выделяться газообразный HCl, который нарушит укупорку склянки.
Натрия хлорид
 Natrii
chloridum
Natrii
chloridum
M.m. = 58,44
г/моль
 Описание
Описание
Белый кристаллический порошок солёного вкуса; растворим в воде, трудно в спирте.
Водные растворы нейтральной реакции.

Определение подлинности
I. Реакция на катион Na+
 1.Сухая
реакция (Фармакопейная). Соль натрия, внесённая в бесцветное пламя спиртовки,
окрашивает пламя в жёлтый цвет.
1.Сухая
реакция (Фармакопейная). Соль натрия, внесённая в бесцветное пламя спиртовки,
окрашивает пламя в жёлтый цвет.
2.С раствором Цинкуранилацетата в уксусно-кислой среде Na+ образует жёлтый мелкокристаллический осадок. Реакция микрокристаллоскопическая – под микроскопом видны кристаллы в виде восьмиугольников (Фармакопейная).
NaCl + Zn(UO2)3(CH3COO)8 + CH3COOH + 9H2O
![]()
Na[Zn(UO2)3(CH3COO)9]·9H2O↓ + HCl
![]()
Определение подлинности
I. Реакция на катион Na+
3. С раствором Гексагидрооксостибеат (V) калия (не фармакопейная).
Условия: достаточно концентрированные растворы; холод; трение.
NaCl
KSbOH6
![]() NaSbOH6
KCl
NaSbOH6
KCl
белый аморфный осадок
. С раствором Пикриновой кислоты.
OH ONa

 O2NNO2 O2NNO2
O2NNO2 O2NNO2
+Na+ ![]() +H
+H
NO2 NO2
Пикриноваякислота Игольчатые кристаллы
Определение подлинности
II. Реакция на анион Cl─
5. Реакция осаждения c раствором Нитрата серебра.
NaClAgNO3 ![]() AgCl
NaNO3
AgCl
NaNO3
белый осадок
Осадок растворим в растворе аммиака.
AgCl
2NH3 ![]() AgNH3
2
Cl
AgNH3
2
Cl
![]() Количественноеопределение I.
Количественноеопределение I.
•Метод аргентометрии (Мора);
•Среда нейтральная;
•Титрант AgNO3 0,1 моль/л;
•Индикатор K2CrO4 5%;
•Титрование ведут от жёлтой до буровато-жёлтой окраски осадка
.
NaClAgNO3 ![]() AgCl
NaNO3
AgCl
NaNO3
титрант белыйосадок Реакция в точке эквивалентности:
2AgNO3K2CrO4
![]() Ag2CrO4
2KNO3
Ag2CrO4
2KNO3
буровато-жёлтый осадок
Формулы для расчёта:
|
C M
1000 |
|
% T KП Tx/ y 100 V
m |
f =1
э
Количественноеопределение
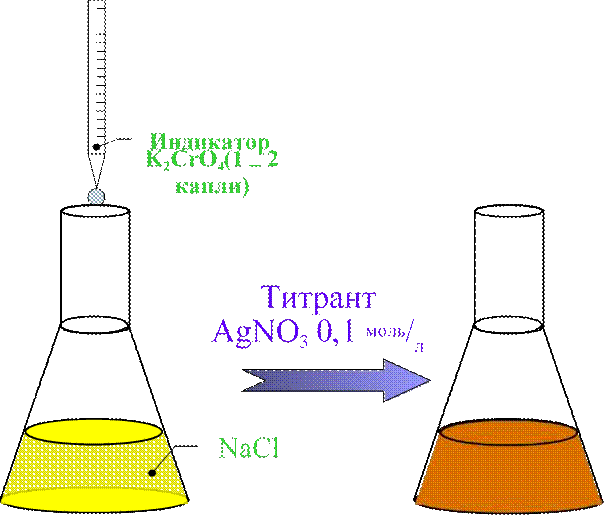
Жёлтый Буровато-жёлтый
Количественное определение
![]() II. •Метод
меркуриметрии;
II. •Метод
меркуриметрии;
•Среда азотнокислая;
•Индикатор дифенилкарбазон;
•Титрант Hg(NO3)2 0,1 моль/л;
•Титрование ведут до сине-фиолетового окрашивания.
2NaCl
HgNO3
2
![]() HgCl2
2NaNO3
HgCl2
2NaNO3
титрант
Формулы для расчёта:
|
C M
1000 |
|
% T KП Tx/ y 100 V
m |
fэ=1
Количественное определение
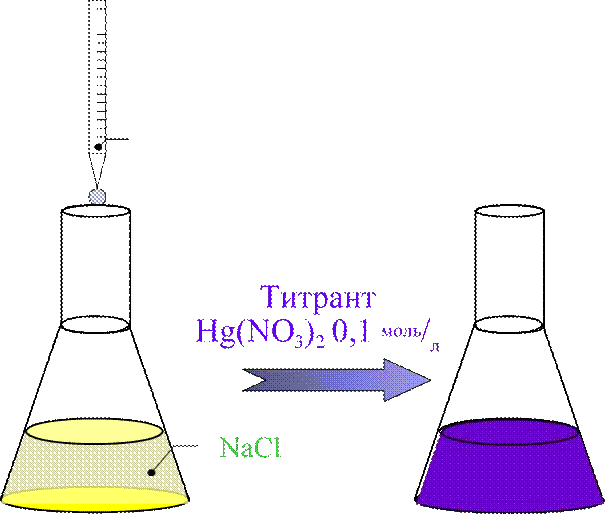 Индикатор Дифенилкарбазон
Индикатор Дифенилкарбазон
(1 – 2 капли)
Жёлтый Сине-фиолетовый
Применение
1. Наружно для ванн, обтираний, полосканий при заболеваниях верхних дыхательных путей.
2. Изотонический раствор NaCl (0,9%) вводят внутривенно для поддержания осмотического давления крови.
3. На изотоническом растворе готовят раствор Фурацилина, кислоту Аминокапроновую и используют для изотонирования глазных капель.
Каля хлорид Kalii chloridum
 M.m. =
74,56г/моль
M.m. =
74,56г/моль
Описание
Белый кристаллический порошок или бесцветные кристаллы без запаха, солёного вкуса.
Растворим в 3 ч. холодной воды, нерастворим в спирте.
Водные растворы нейтральной реакции.
Определение подлиности
I. Реакция на катион K+
1. Сухая реакция (Фармакопейная). Соль калия, внесённая в бесцветное пламя спиртовки, окрашивает пламя в фиолетовый цвет.С раствором Винной кислоты в присутствии раствора
2. Ацетата натрия образуется белый кристаллический осадок, растворимый в минеральных кислотах и нерастворимый в уксусной кислоте.
Условия: охлаждение; механическое трение.
![]()
![]() HOCHCOOH HOCHCOOK
HOCHCOOH HOCHCOOK
KCl
![]() HCl
HCl
HOCH COOH HOCH COOH
HCl
CH3COONa
![]() NaClCH3COOH
NaClCH3COOH
Вместо раствора Винной кислоты и Ацетата натрия можно использовать раствор Гидротартрата натрия:
NaHC4H4O6
KCl
![]() KHC4H4O6
NaCl
KHC4H4O6
NaCl
Определение подлинности
3.С раствором свежприготовленного
Гексанитрокобальтата (III) натрия образуется жёлтый осадок:
2KCl
Na3Co(NO2
)6
![]() K2NaCo(NO2)62NaCl
K2NaCo(NO2)62NaCl
II. Реакция на анион Cl─
4. Реакция осаждения c раствором Нитрата серебра:
KClAgNO3 ![]() AgCl
KNO3
AgCl
KNO3
белыйосадок
Осадок растворим в растворе аммиака:
AgCl
2NH3 ![]() AgNH3
2Cl
AgNH3
2Cl
Количественноеопределение
I. Метод аргентометрии (Мора);
•Среда нейтральная;
•Титрант AgNO3 0,1 моль/л;
•Индикатор K2CrO4 5%;
•Титрование ведут от жёлтой до буровато-жёлтой окраски осадка
KClAgNO3 ![]() AgCl
KNO3
AgCl
KNO3
титрант белыйосадок Реакция в точке эквивалентности:
2AgNO3K2CrO4
![]() Ag2CrO4
2KNO3
Ag2CrO4
2KNO3
буровато-жёлтый осадок
Формулы для расчёта:
|
C M
1000 |
|
% T KП Tx/ y 100 V
m |
f =1
э
Количественноеопределение
II. •Метод меркуриметрии;
•Среда азотнокислая;
•Индикатор дифенилкарбазон;
•Титрант Hg(NO3)2 0,1 моль/л;
•Титрование ведут до сине-фиолетового окрашивания.
2KCl
HgNO3
2
![]() HgCl2
2KNO3
HgCl2
2KNO3
титрант
Формулы для расчёта:
|
C M
1000 |
|
% T KП Tx/ y 100 V
m |
fэ=1
Применение
1. При нарушении сердечного ритма (аритмии). Назначают в порошках, микстурах.
2. В аптеках готовят раствор для инъекций 4%.
Хранение
В хорошо укупоренной таре, так как слегка гигроскопичен.
Натрия бромид, калия бромид.
Натрия бромид
Natrii bromidum
NaBr M.м.=102,9
Описание.
Белый кристаллический порошок беззапаха, соленого вкуса. Гигроскопичен. Растворим в 1,5 частях воды и в 10 частях спирта.
Водные растворы нейтральной реакции.
Реакции подлинности.
1.Катион Натрия
1. С Цинкуранилацетатом в уксуснокислой среде – жёлтый кристаллический осадок.
NaBr+Zn(UO2)3(CH3COO)8+CH3COOH +
9H2O→NaZn(UO2)3(CH3COO)9∙9H2O + HBr
2. С гексагидроксостибиат (5) калия, механическое воздействие, холод, образуется белый осадок.
NaBr+ K[Sb(OH)6] →KB r+ Na[Sb(OH)6 ]↓
1.3. Микрокристаллоскопическая реакция с пикриновой кислотой.
С6H2(NO2)3OH + NaBr → С6H2(NO2)3ONa + HBr
1.4 Сухая реакция. Окрашивание пламени в желтый цвет.
Реакции подлинности
2. Бромид ион.
1. Раствором серебра нитрата образуется бледно-желтый осадок, труднорастворимый в растворе аммиака.
NaBr + AgNO3 → AgBr↓ + NaNO3
2.2 С окислителем раствором хлорамина в присутствии хлороформа, хлороформный слой окрашивается в оранжевый цвет.
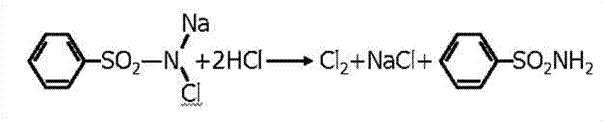
2NaBr + CI2 → Br2 + 2NaCI
Количественное определение.
1. Метод Мора.
Среда нейтральная, индикатор Калия хромат, титрант стандартный раствор серебра нитрата. Титрование ведут до появления буровато-желтого окрашивания осадка.
NaBr + AgNO3 → AgBr ↓ + NaNO3
2AgNO3 + K2CrO4 → Ag2CrO4 ↓ + 2KNO3
F=1
2. Метод меркуриметрии. Среда азотнокислая, индикатор дифенилкарбазон, титрант 0,1 моль/л Hg(NO3)2. Титрование ведут до появления сине-фиолетового окрашивания.
2NaBr + Hg(NO3)2 → HgBr2 + 2NaNO3
F=1
Применение.
Обладает успокаивающим действием. Назначают в микстурах при неврозах.
Хранение.
В хорошо укупоренной таре, в защищенном от света месте.
Калия бромид
Kalii bromidum KBr M.м. = 119,0
Описание
Бесцветные, блестящие кристаллы или мелкокристаллический порошок без запаха.
Растворим в 1,7 частях воды, мало в спирте.
Реакции подлинности
1.Катион калия
1. Сухая реакция. Окрашивание пламени в фиолетовый цвет.
2. Со свежеприготовленным раствором гексанитрокобальтат (3) натрия.
Na3[ Co(NO2)6] + 2KBr → K2Na[Co(NO2)6] ↓ + 2NaBr
1.2 С раствором гидротартрата натрия, холод, механическое воздействие - белый осадок, растворимый в растворах минеральных кислот и не растворимый в уксусной кислоте.
NaHC4H4O6 + KBr → KHC4H4O6↓+ NaBr
2.На бромид ион (см. натрия бромид).
Количественное определение
1. Метод Мора (см. натрия бромид)
2. Метод меркуриметрии (см. натрия бромид)
3.Метод Фольгарда (обратное титрование)
Среда азотнокислая
Индикатор - железоаммониевые квасцы.
KBr + AgNO3 → AgBr↓ + KNO3
AgNO3 + NH4SCN → AgSCN + NH4NO3
FeNH4(SO4)2 +3NH4SCN → Fe(SCN)3 + 2( NH4)2SO4 F=1
Применение.
Обладает успокаивающим действием. Назначают в микстурах при неврозах.
Хранение.
В хорошо укупоренной таре, в защищенном от света месте.
Контрольные вопросы для закрепления:
1.Чем различаются фармакопейный и внутриаптечный анализы?
2.Перечислите виды внутриаптечного контроля. Как их можно подразделить?
3.Какую роль играют ионы калия и натрия в организме человека?
4.Можно ли применять натрия хлорид вместо калия хлорида? Почему?
5.В каких лекарственных формах применяется натрия хлорид?
6.Какие химические свойства характерны для элементов 7 группы основной подгруппы периодической системы Д.И.Менделеева?
7.Какими химическими реакциями устанавливают подлинность препаратов галогенидов щелочных металлов? Напишите уравнения реакций.
8.Наличие каких примесей устанавливают в препаратах галогенидов щелочных металлов?
9.Какие методы используют для количественного определения препаратов галогенидов щелочных металлов? Напишите уравнение реакции.
10.Какие испытания, кроме фармакопейных, могут быть использованы для идентификации катионов и анионов, входящий в состав молекул лекарственных препаратов данной группы?
11.Какими методами, кроме фармакопейных, можно провести определение количественного содержания этих препаратов? Напишите уравнения реакций.
12.Какие разновидности аргентометрического метода количественного анализа можно использовать для определения галогенидов щелочных металлов?
13.Каковы достоинства и недостатки каждого варианта?
1. Какие лекарственные формы галогенидов щелочных металлов включены в ГФ?
2. Назовите состав изотонического раствора натрия хлорида.
3. Растворы для инъекций и инфузий подвергаются полному химическому контролю.
4. Перечислите параметры, по которым проверяются растворы до стерилизации и после стерилизации.
6. Как получают хлористоводородную кислоту?
7. Почему хлористоводородная кислота, иногда имеет желтоватый оттенок?
8. Каким видам внутриаптечного контроля подвергается соляная кислота (для внутреннего употребления)?
9. Как применяется бромид натрия?
10. Почему бромид калия нельзя вводить внутривенно?
11. Какими преимуществами обладает рефрактометрия?
12. При длительном применении бромидов возможны побочные эффекты («бромизм»): насморк, кашель, конъюнктивит, общая вялость, ослабление памяти, кожная сыпь. Назовите препарат, являющийся
© ООО «Знанио»
С вами с 2009 года.
![]()

