
Методическая разработка урока «Сера и ее соединения»
Цель: Дать общую характеристику серы. Охарактеризовать её в свете трёх форм существования этого химического элемента: в форме атомов, простых и некоторых сложных соединений серы. Химические свойства серы как простого вещества рассмотреть в свете окислительно -восстановительных реакций.
Оборудование и реактивы. Руды и минералы: красный, бурый и магнитный железняки, колчедан, цинковая обманка, глауберова соль, гипс, алебастр, натрий, железо (порошок), цинк (гранулы), алюминий (порошок), тоненькая медная проволока, соляная кислота, перманганат калия. Пробирки, стаканчик, стекло часовое, колба с обратным холодильником, лупа, фарфоровые тигли, прибор для получения газов
Используемый приём: метод кластеров (блоков).
Ход урока.
1.Организационный момент.
2.Фронтальный опрос.
Вспомнить общие названия известных подгрупп химических элементов и объяснить их этимологию:
*благородные газы
*щелочные и *щёлочноземельные металлы
*халькогены и его первый представитель – кислород *галогены
3. Сообщение темы урока.
Используемый приём: метод кластеров.
Общее название элементов 6 группы главной подгруппы – «халькогены» ( в переводе с греческого обозначает «рождающие руды»)
Стадия вызова
-Демонстрация коллекции «Коллекции руд», которые используют в металлургии и уже изучали в разделе «Металлы».
Руды представляют собой соединения родоначальника подгруппы – кислорода.
Вторым представителем «халькогенов» является – сера.
-Чтение текста учебника химии п. № , стр.
Стадия осмысления.
Задание. Используя прочитанный материал, составить краткий конспект – схему: «Сера и её соединения»
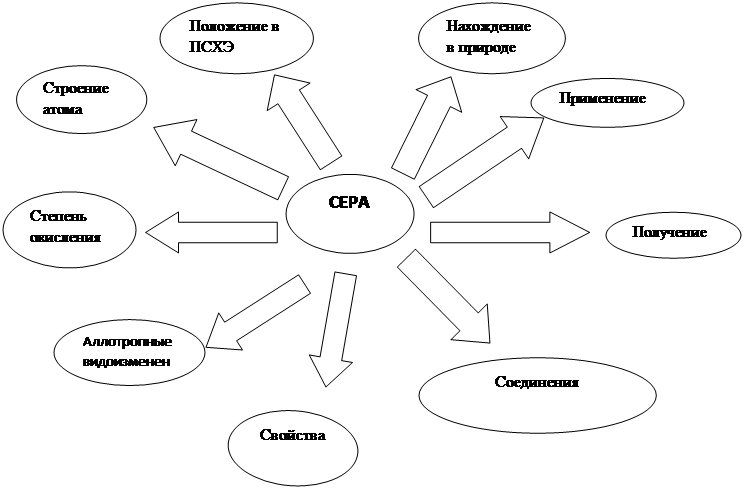
Стадия рефлексии
На основании прочитанного текста, составленной общей схемы продолжите работу над расшифровкой отдельных кластеров (более конкретизированный подход к рассмотрению и расшифровке блоков). Разноуровневые задания.
Работа в парах:
1.Общая характеристика элемента «серы»:
*Халькоген , *элемент, простое вещество, сера-элемент сложного вещества.
2. Положение серы в ПСХЭ:
* порядковый номер-
*№ периода -
*большой или малый -
*№ ряда -
*чётный или нечётный -
*№ группы -
*главная или побочная -
3.Строение атома серы:
*заряд ядра -
* число протонов-
*число нейтронов
*общее число электронов
*число энергетических уровней
*число электронов на внешнем уровне
+схема строения атома-
4. Аллотропные модификации серы, их физические свойства.
5.Нахождение в природе:
*в свободном виде;
*в виде соединений
6.Химические свойства:
Задание. Составить уравнения реакций, характеризующих химические свойства серы, указав восстановителем или окислителем в конкретном случае является сера.
*Взаимодействует с металлами:
2Na + S = Na2 S; (при взаимодействии с металлами проявляет С.О. =-2, является окислителем)
*Взаимодействует с водородом:
Н2 + S = Н2S ; (при взаимодействии с водородом проявляет С.О.=-2, является окислителем)
*Взаимодействует с кислородом:
S + O2 = SO2 ; (при взаимодействии с кислородом проявляет С.О.=-4, является восстановителем)
7.Соединения серы:
*на основе водорода: сероводород – Н2S, сероводородная кислота –H2S и ее соли – сульфиды.
Составить формулы солей: сульфидов натрия, кальция и алюминия.
*кислородные соединения:
|
Оксиды - кислотные |
Гидроксиды - кислоты |
Соли |
|
Оксид серы (IY)- SO2- кислотный Сернистый газ |
Сернистая кислота - H2SO3 |
Сульфиты |
|
Оксид серы (YI)- SO3 –кислотный Серный ангидрид |
Серная кислота – H2SO4 |
Сульфаты |
Выступления учащихся.
Демонстрация опытов:
1. Получение пластической серы
2. Взаимодействие серы с железом (4 г серы и 7г железа)
3. Взаимодействие серы с цинком (в массовом соотношении 2:1
Задание на дом. Параграф №
Составить уравнения реакций взаимодействия серы с металлами: железом и цинком, формулы сульфитов и сульфатов натрия, кальция и алюминия и заполнить 3-ю колонку таблицы.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.