
Государственное автономное профессиональное
образовательное учреждение самарской области
«Новокуйбышевский нефтехимический техникум»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по выполнению лабораторных/ практических работ
Дисциплина ОП.02 Органическая химия
Профиль профессионального образования Естественно- научный
Программы подготовки специалистов среднего звена
18.02.012 Технология аналитического контроля химических соединений
г. о. Новокуйбышевск, 2020 г
|
РАССМОТРЕНО предметной (цикловой) комиссией Протокол № ____ от __________________201___ г. _______________М.В. Коряковская |
УТВЕРЖДАЮ Заместитель директора по НМР ______________ О.Д. Щелкова |
Разработчик:
ГАПОУ СО «ННХТ» преподаватель_____________ В.А. Афонина
(место работы) (занимаемая должность) (И.О.Фамилия
Внутренняя экспертиза
Зам. дир. по УР ГАПОУ СО «ННХТ» Семисаженова В.Б
Содержание
1. Пояснительная записка
2. Внутренний распорядок и безопасные методы работы в лаборатории.
3. Основные сведения об оборудовании и методах, используемых при проведении органических синтезов разделении и очистке веществ.
4. Практические/лабораторные работы
Практическое занятие № 1. Обобщить знания об элементном составе органических веществ. Определение углерода, водорода и галогена.
Практическое занятие № 2. Установить формулы органических веществ по продуктам реакции
Практическое занятие № 3. Составить структурные формулы изомеров углеводородов и их названий.
Практическое занятие № 4. Описать характерные химические свойства уравнениями реакций.
Лабораторная работа № 1. Получение метана и исследование его химических свойств.
Практическое занятие № 5. Рассчитать выход продукта реакции и количества затраченного вещества.
Лабораторная работа № 2. Получение этилена и исследование его свойств.
Лабораторная работа № 3. Получение ацетилена и исследование его свойств.
Практическое занятие № 6. Составить структурные формулы и закрепить знания номенклатуры и химических свойств.
Практическое занятие № 7. Составить цепочки, химических превращений и написать уравнения реакций взаимного перехода алканов, алкадиенов, алкенов, алкинов.
Практическое занятие № 8. Решить расчётные задачи.
Лабораторная работа № 4. Изучение свойств бензола, толуола и нафталина.
Практическое занятие № 9. Составить уравнения реакций примеров ориентации при электрофильном замещении в бензольном ядре.
Практическое занятие № 10. Составить и решить цепочку химических превращений.
Лабораторная работа № 5. Получение галогенопроизводных и изучение их свойств.
Практическое занятие № 11. Составить реакции нуклеофильного замещения.
Практическое занятие № 12. Написать уравнения реакций цепочек превращения галогенопроизводных.
Практическое занятие № 13. Составить схемы синтезов и решить расчетные задачи.
Лабораторная работа № 6. Исследование физических и химических свойств одноатомных и многоатомных спиртов
Лабораторная работа № 7. Исследование свойств фенолов.
Практическое занятие № 14. Составить цепочки превращений спиртов, закрепить знания номенклатуры, способов получения спиртов.
Практическое занятие № 15. Составить схему синтеза и решить расчётные задачи.
Лабораторная работа № 8. Исследование альдегидов и кетонов.
Практическое занятие № 16. Составить структурные формулы альдегидов и кетонов, закрепить знания номенклатуры.
Практическое занятие № 17. Составить структурные формулы изомеров гомологического ряда альдегидов.
Практическое занятие № 18. Установить структурные формулы альдегидов и кетонов по продуктам реакции.
Лабораторная работа № 9. Исследование свойств карбоновых кислот, сложных эфиров.
Практическое занятие № 19. Составить структурные формулы одноосновных карбоновых кислот и их производных. Составить цепочки химических превращений.
Практическое занятие № 20. Написать уравнения реакций свойств одноосновных карбоновых кислот и их производных
Лабораторная работа № 10. Изучение свойств аминов.
Практическое занятие № 21. Составить и решить цепочки химических превращений.
Лабораторная работа № 11. Изучение свойств углеводов.
5. Информационные источники
Приложение 1 - Оформление лабораторной работы
Пояснительная записка
Методические указания (рекомендации) составлены в соответствии с рабочей программой дисциплины «Органическая химия» для специальностей 18.02.12 Технология аналитического контроля химических соединений ГАПОУ СО «ННХТ».
Целью лабораторного практикума является экспериментальное
ознакомление с основными классами органических соединений и методами
эксперимента, усвоение правил техники безопасной работы в химической
лаборатории.
Перед тем как приступить к выполнению лабораторной работы, сле-
дует внимательно изучить методику выполнения опытов и обратить особое
внимание на вопросы техники безопасности.
Описание лабораторной работы ведется в процессе ее выполнения
или сразу же после окончания. В отчете должно быть записано уравнение
происходящей реакции с указанием условий проведения, описан прибор,
обязательно отражено, происходило ли в ходе реакции появление или ис-
чезновение окраски или осадка, выделение газа, самопроизвольное повы-
шение температуры и т. д., как контролировалось течение реакции, как оп-
ределялся ее конец.
После каждой лабораторной работы предлагаются контрольные вопросы и задачи,
которые студенту необходимо выполнить в письменном
виде
Практические работы по дисциплине «Органическая химия» предназначены для закрепления теоретических знаний студентов и приобретения практических навыков в решении различных ситуационных задач, которые могут быть использованы в будущей практической деятельности:
- обобщение, систематизацию, углубление, закрепление, развитие и детализацию полученных теоретических знаний по конкретным темам учебной дисциплины;
- формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
- формирование и развитие умений: наблюдать, сравнивать, сопоставлять, анализировать, делать выводы и обобщения, самостоятельно вести исследования, пользоваться различными приемами измерений, оформлять результаты в виде таблиц, схем, графиков;
- приобретение навыков работы с различными приборами, аппаратурой, установками и другими техническими средствами для проведения опытов;
Результатом освоения программы дисциплины: органическая химия явля-ется овладение профессиональными (ПК ) компетенциями.
В результате их выполнения, обучающийся должен:
уметь:
-составлять и изображать структурные полные и сокращенные формулы органических веществ и соединений;
-определять свойства органических соединений для выбора методов синтеза углеводородов при разработке технологических процессов;
-описывать механизм химических реакций получения органических соединений;
-составлять качественные химические реакции, характерные для определения различных углеводородных соединений;
-прогнозировать свойства органических соединений в зависимости от строения молекул;
-определять по качественным реакциям органические вещества и проводить качественный и количественный расчёты состава веществ;
-решать задачи и упражнения по генетической связи между классами органических соединений;
-применять безопасные приемы при работе с органическими реактивами и химическими приборами;
-проводить реакции с органическими веществами в лабораторных условиях;
-проводить химический анализ органических веществ и оценивать его результаты.
знать:
--влияние строения молекул на химические свойства органических веществ;
-влияние функциональных групп на свойства органических веществ;
-изомерию как источник многообразия органических соединений;
-методы получения высокомолекулярных соединений;
-особенности строения органических веществ, их молекулярное строение, валентное состояние атома углерода;
-особенности строения органических веществ, содержащих в составе молекул атомы серы, азота, галогенов, металлов;
-особенности строения органических соединений с большой молекулярной массой;
-природные источники, способы получения и области применения органических соединений;
-теоретические основы строения органических веществ, номенклатуру и классификацию органических соединений;
-типы связей в молекулах органических веществ.
обладать общими компетенциями
ОК 01. Выбирать способы решения задач профессиональной деятельности, применительно к различным контекстам.
ОК 02. Осуществлять поиск, анализ и интерпретацию информации, необходимой для выполнения задач профессиональной деятельности.
ОК 03. Планировать и реализовывать собственное профессиональное и личностное развитие.
ОК 04. Работать в коллективе и команде, эффективно взаимодействовать с коллегами, руководством, клиентами.
ОК 05. Осуществлять устную и письменную коммуникацию на государственном языке с учетом особенностей социального и культурного контекста.
ОК 06. Проявлять гражданско-патриотическую позицию, демонстрировать осознанное поведение на основе традиционных общечеловеческих ценностей.
ОК 07. Содействовать сохранению окружающей среды, ресурсосбережению, эффективно действовать в чрезвычайных ситуациях.
ОК 10. Пользоваться профессиональной документацией на государственном и иностранном языке
обладать профессиональными компетенциями:
ПК 1.3. Подготавливать реагенты, материалы и растворы, необходимые для анализа.
ПК 1.4 Работать с химическими веществами и оборудованием с соблюдением отраслевых норм и экологической безопасности.
ПК 2.2. Проводить качественный и количественный анализ неорганических и органических веществ химическими и физико-химическими методами.
Методические указания (рекомендации) дают возможность студентам изучить методы и пути обеспечения безопасных условий труда на производстве, эксплуатации технологического оборудования, научиться работать с различной литературой и методическими пособиями.
2. Внутренний распорядок и безопасные методы работы в лаборатории
1. Общие требования безопасности
1.1. Рационально строить свою работу.
1.2. Все работы вести точно и аккуратно.
1.3. Соблюдать все меры предосторожности при работе с ядовитыми, взрывоопасными и огнеопасными веществами.
1.4. Не загромождать свое рабочее место ненужными предметами.
1.5. Немедленно убирать с пола осколки разбитой посуды, пролитые жидкости или жиры.
1.6. Осторожно обращаться с легко-воспламеняющими, горячими и взрывоопасными веществами. При случайных проливах огнеопасных жидкостей необходимо выключить нагревательные приборы, спиртовки, место пролива жидкости засыпать песком или собрать тряпкой, затем тряпки и песок удалить, а место, где была пролита жидкость, хорошо промыть водой.
1.7. Нельзя хранить на рабочем месте, какие – либо вещества неизвестного происхождения.
1.8. Нельзя хранить и применять пищу на рабочем месте.
1.9. К работе в лаборатории органической химии допускаются
лишь студенты, проведшие инструктаж по технике безопасности.
Инструктаж проводится преподавателем на первой вводном заня-
тии.
Во время работы в лаборатории студенты обязаны неукосни-
тельно выполнять правила техники безопасности. Студент, нару-
шивший правила, немедленно отстраняется от лабораторных заня-
тий и допускается к работе лишь после повторного инструктажа.
2. Требования безопасности перед началом работы
2.1. В лаборатории разрешено находится в белом халате и медицинской шапочке, во второй обуви
2.2. Дежурные студенты принимают химическую лабораторию у предыдущей группы.
2.3. Внимательно прочитать инструкцию к выполнению данной работы и продумать последовательность операций.
2.4. Предварительно подробно ознакомиться с проведением химического опыта и хорошо понять химизм процессов, которые предстоит изучить на практике.
2.2. Тщательно проверить, имеется ли все необходимое для проведения данной работы.
3. Требования безопасности во время работы
3.1. При работе с реактивами необходимо: реактивы закрывать пробкой или крышками. Если на склянке или банке нет этикетки, нельзя применять реактив.
3.2. Нельзя выливать или засыпать реактив обратно в склянку.
3.3. Применять реактивы следует в той концентрации и том количестве, которое указано в методическом указании.
3.4. Нельзя работать с грязной посудой.
3.5. Нельзя пробовать вещества на вкус.
3.6. Нюхать вещества, можно направляя к себе движением руки струю газа или пара, держа отверстие сосуда с веществом на некотором расстоянии от лица.
3.7. С сильно пахнущими веществами следует работать в вытяжном шкафу.
3.8. При растворении кислот наливают кислоту в воду, а не наоборот.
3.9. Не наклоняться над сосудом с кипящей жидкостью.
3.10. Нагревать жидкость в пробирке следует с верхних слоев, постепенно прогревая всю пробирку. Пробирку следует держать так, чтобы отверстие было направлено в сторону от себя и соседей, вдоль рабочего стола.
3.12. Нельзя путать крышки от склянок с разными веществами - это загрязняет реактивы.
3.13. Зажигать спиртовку следует спичками, ни в коем случае зажигалками или другой горящей спиртовкой. Нельзя перемещать горящую спиртовку.
3.14 Получив задание на
работу, необходимо ознакомиться с ха-
рактеристиками веществ, используемых в синтезе, правилами тех-
ники безопасности при работе с ними и составить обстоятельный
план работы.
3.15 Студент может приступать к выполнению работы
только с разрешения преподавателя после утверждения им плана
работы и (если возникает необходимость) проведенных расчетов.
3.16 Производить в лаборатории, какие бы то ни было действия, не
связанные с выполнением практикума, запрещается.
3.17 Перед началом каждой операции необходимо тщательно
осмотреть аппаратуру, посуду, убедиться в их исправности, пра-
вильности сборки установки и соответствии взятых реактивов с
веществами, указанными в описании синтеза.
3.18 При проведении работ при повышенной температуре необхо-
димо собирать прибор так, чтобы можно было быстро и безопасно
убрать нагревательный прибор и охладить нагретую поверхность.
3.19 Оставлять без присмотра работающую установку категориче-
ски запрещается. Закончив работу, нужно обязательно убрать свое
рабочее место, тщательно вымыть посуду и сдать рабочее место
дежурному студенту или лаборанту. Оставлять полупродукты и ре-
акционные смеси до следующего занятия можно только в посуде с
четкой этикеткой с указанием фамилии исполнителя, группы, даты
и названия содержимого.
3.20 В целях обеспечения безопасности работы необходимо также
быть внимательным к соседу, работающему рядом, знать – с каки-
ми веществами он работает и какие операции выполняет.
3.21 Во время работы в лаборатории необходимо соблюдать чисто-
ту и порядок, не загромождать рабочее место посудой, бумагой и
реактивами. Категорически запрещается бросать бумагу, битое
стекло и другие твердые вещества в раковины, а также сливать в
раковины органические вещества, концентрированные растворы
кислот и щелочей: для этого в лаборатории имеются специальные
емкости.
3.22 Обо всех замеченных неисправностях электропроводки, при-
боров необходимо немедленно сообщать преподавателю.
3.23 Находясь в лаборатории, необходимо бережно и аккуратно
относиться к
имуществу лаборатории, приборам, посуде. Не допускать попада-
ния химических веществ на рабочий стол и пол. Если все-таки ве-
щество пролито или рассыпано, необходимо немедленно сообщить
об этом преподавателю и под его контролем собрать вещество и
провести соответствующую обработку испорченной поверхности.
4. Требования безопасности в аварийных ситуациях
4.1. Перед проведением очередного занятия в лаборатории преподаватель должен повторить указания о мерах предосторожности, которые необходимо соблюдать при использовании в данных опытах тех или иных реактивов.
4.2. При ранении стеклом нужно убедиться, что в ранке не осталось стекла, быстро протереть ранку ваткой, смоченной спиртом, смазать йодом и забинтовать.
4.3. При термических ожогах на обожженное место следует приложить бинт, смоченной холодной водой и обратиться в медицинский пункт колледжа.
4.4. В случае ожога лица, рук кислотой или щелочью немедленно обмыть пораженное место большим количеством воды, При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды и обратиться в медицинский пункт колледжа.
4.5. При необходимости пострадавшего после оказания первой помощи доставить в поликлинику.
5. Требования безопасности по окончанию работы
5.1. После окончания работы привести в порядок рабочее место, вымыть посуду, которая использовалась в химическом анализе, и сдать его лаборанту, дежурному или преподавателю. Посуда должна быть чисто вымыта и ополоснута дистиллированной водой.
5.2. Нельзя выливать в раковину отходы реактивов, вредные, пахучие вещества, для этого имеются специальные банки «Слив реактивов».
5.3 Уходящий из лаборатории
последним обязан проверить: вы-
ключены ли вода, электроприборы и вытяжная вентиляция во всей
лаборатории.
3. Основные сведения об оборудовании и методах, используемых при проведении органических синтезов разделении и очистке веществ.
2.1Химическая
посуда
В лаборатории органической химии большинство химических
реакций и операций по разделению и очистке веществ проводится в
стеклянных приборах и посуде. Наиболее часто используют следу-
ющую стеклянную посуду (см. рис. 1):
Стаканы (1) применяют как вспомогательную посуду при ра-
боте только с водными растворами. Нагрев или проведение процес-
сов, сопровождающихся разогреванием, можно проводить только в
тонкостенных стеклянных или фарфоровых стаканах.
Конические колбы (2) (колбы Эрленмейера) – используют при
работе с органическими растворами.
Колбы плоскодонные (3)
при-
меняют обычно для хранения химических веществ и растворов.
Помните: колбы плоскодонные и конические нельзя применять для
работы в вакууме!
Колбы для отсасывания (4) (колбы Бунзена) – изготавливают
толстостенными и применяют только для фильтрования растворов
под вакуумом водоструйного насоса.
Конические воронки (5а) применяют для заливания жидко-
стей в узкие отверстия. Для фильтрования в органической лабора-
тории не используются!
Воронки Бюхнера (56) применяют с бумажным фильтром для
отделения твердых веществ от жидкостей фильтрованием в вакуу-
ме.
Фильтры Шотта (5в) стеклянные цилиндрические воронки
с впаянными пористыми пластинами. Используют для фильтрова-
ния сильнокислых растворов.
Капельные воронки (6) служат для постепенного прибавления
жидкости в процессе реакции. Делительные воронки (7) служат для
разделения несмешивающихся жидкостей и для экстракции.
Колбы круглодонные (8) применяют для нагревания веществ
при повышенной температуре и работ под вакуумом.
Двух-, трех - и четырехгорлые колбы (9) применяют при
проведении операций и синтезов, в том числе и при нагревании,
когда необходимо одновременно производить перемешивание, из-
мерение температуры реакционной массы, постепенное прибавле-
ние каких-либо веществ в ходе реакции и т.п.
Перегонные колбы Вюрца (10) применяют для перегонки
жидкостей при атмосферном давлении. Перегонные колбы Кляйзе-
на (11) применяют для перегонки жидкостей в вакууме. Перегон-
ные колбы с дефлегматором (12) применяют для более эффектив-
ного разделения жидкостей с близкими температурами кипения
(дефлегматор работает на основе принципа ректификации).
Прямой холодильник (холодильник Либиха) (13) применяют
для перегонки низкокипящих жидкостей (т. кип. ниже 150° С).
Воздушный холодильник (14) – используют при перегонки
высококипящих жидкостей (т. кип. выше 150° С).
Обратный шариковый холодильник (15) используют при ки-
пячении, длительном нагревании всех жидкостей, а также при лю-
бом нагревании низкокипящих жидкостей (т.кип. ниже 150° С).
Хлоркальциевые трубки (16) применяют с влагопоглощаю-
щим (обычно прокаленный хлористый кальций) наполнителем для
предотвращения взаимодействия содержимого колбы с атмосфер-
ной влагой.
Алонжи (17) применяют для соединения наклонного холо-
дильника с приемником.
Пауки (18) применяют при фракционной вакуумной перегон-
ке жидкостей.
Форштоссы (двурогие, трехрогие) (19) применяют для уве-
личения числа вводов в реакционную колбу.
Насадки Вюрца (20), Кляйзена (21), дефлегматоры (22),
присоединенные к круглодонным колбам (8), позволяют использо-
вать последние в качестве колб Вюрца (10), Кляйзена (11) или колб
для фракционной перегонки (12).
Помните: многие отсутствующие виды посуды при некоторой
изобретательности могут быть заменены несложными конструкци-
ями из имеющейся посуды.
17
2.2. Основные правила сборки приборов из стеклянной посуды и работы с
ними
Соединение стеклянных деталей осуществляется при помощи
резиновых пробок, резиновых шлангов, а также с помощью шлифов
(при наличии посуды со шлифами). Детали установки монтируют
на штативах и стендах с помощью лапок, зажимов, колец.
Соединение деталей всегда должно быть плотным и исклю-
чающим подтекание жидкостей или газов (при работе в вакууме) в
местах соединений.
Резиновые пробки и шланги разрушаются под действием
сильных кислот и галогенов, набухают при контакте с органиче-
скими растворителями. Кроме того, органические вещества извле-
кают из пробок растворимые соединения и загрязняются ими. По
возможности необходимо производить соединение таким образом,
чтобы исключить непосредственный контакт жидкостей с местом
соединения. При соединении на пробках конец входящей в пробку
детали должен выступать из пробки на 20-25 мм (рис. 2), тогда сте-
кающая жидкость не будет касаться пробки. (В отдельных случаях
пробку может заменить короткий отрезок гладкой резиновой труб-
ки соответствующего диаметра).
Наиболее удобна в работе стеклянная посуда с нормальными
(конусными) шлифами (конусные шлифы подразделяются по мак-
симальному диаметру, чаще всего используются шлифы с макси-
мальным диаметром 14.5, 19 и 29 мм) (рис. 3). Детали с различаю-
щимися по диаметру шлифами соединяют с помощью переходов
(рис. 4). Кроме того, бывают плоские, цилиндрические и шаровые
шлифы.
При использовании шлифов необходимо помнить о том, что
сильнощелочные растворы быстро разъедают стекло, особенно раз-
витую поверхность шлифа, и шлифованные соединения "заедает".
Для разъединения такого
соединения нужно осторожно постучать
по диаметру шлифа, смочить шлиф растворителем и осторожно по-
пытаться, раскачивая керн шлифа, разъединить его.
При соединении с помочью пробок вначале вставляют трубку
в отверстие пробки вращательными движениями, предварительно
смазав внутреннюю часть пробки и трубку глицерином, а затем
вставляют пробку с трубкой в отверстие другой детали, также при-
меняя вращательные движения. Вставляя трубку в пробку или
шланг, необходимо держать ее пальцами как можно ближе к тому
месту, которое вставляется, иначе можно сломать трубку и пора-
нить руки. Гораздо легче надевается шланг, предварительно вы-
держанный некоторое время в толуоле или кипящей воде.
При сборке прибора на пробках для работы в вакууме пробку
смазывают в центральной части небольшим количеством вазелина
или вакуумной смазки, вращением добиваясь образования сплош-
ного кольца смазки по месту соединения пробки с внутренней по-
верхностью отверстия.
При работе при атмосферном давлении с соединениями на
пробках нельзя употреблять смазку, т. к. пробка будет выскальзы-
вать из отверстия. Перед сборкой приборов на шлифах, как при ра-
боте в вакууме, так и при атмосферном давлении, шлифы необхо-
димо смазывать. Небольшое количество смазки наносят узким
кольцом на центральную часть керна, и, соединив керн с муфтой,
20 легким вращением равномерно распределяют смазку до образова-
ния прозрачного кольца.
Сборка прибора и крепление его деталей всегда необходимо
начинать с "головы", то есть с колбы, в которую первоначально за-
гружают вещество. Во всех случаях высота крепления колбы долж-
на быть такой, чтобы в ходе операции (синтез, перегонка и т. п.)
под колбу можно было свободно поставить и убрать плитку (баню),
а также изменить расстояние между колбой и плиткой.
Все приборы, за исключением приборов для перегонки, необ-
ходимо крепить на одном штативе.
Между металлической поверхностью лапок, зажимов, колец и
стеклянными деталями всегда должны быть резиновые или кожа-
ные прокладки.
Колбу крепят лапкой или зажимом за верхнюю часть горла.
При горизонтальном или наклонном креплении деталей (холодиль-
ников и т. п.) неподвижная часть зажима лапки помещается обяза-
тельно снизу, закрепляемая деталь должна на ней лежать без
напряжений. Чтобы избежать поломки стеклянной детали при за-
креплении, необходимо вначале рукой зажать лапку (зажим) и за-
крутить барашек на зажиме до упора (без усилия!). Каждая деталь
прибора должна быть закреплена, нельзя крепить детали просто
надеванием на пробку (шлиф).
2.3. Некоторые общие требования к приборам и правила работы с ними
Перед сборкой прибора проверьте целостность используемой
стеклянной посуды. Запрещается пользоваться посудой с отбитыми
краями, трещинами и т. п.
Перед сборкой прибора, а также после его сборки, подумайте,
позволяет ли конструкция прибора, расположение деталей осу-
ществлять все необходимые в ходе работы операции (прибавление
реактивов, измерение и регулирование температуры реакционной
массы, смену приемников и т.п.).
Загружать вещество в прибор разрешается только после его
полной сборки.
Во всех случаях нельзя заполнять колбы более чем на 2/3 их
объема. При работе при атмосферном давлении любой прибор обя-
зательно должен иметь сообщение с атмосферой.
Холодильник подключают таким образом, чтобы перемеще-
ние воды в рубашке было противоположно направлению движения
конденсируемой жидкости.
Разборку прибора производят в порядке, противоположном
сборке.
Шланги, которые не удается легко снять при разборке прибо-
ра, лучше срезать, так как при снятии прилипшего к стеклу шланга
можно сломать стекло и поранить руки.
Особое внимание следует обратить на мытьё химической по-
суды. Стеклянную посуду целесообразнее мыть сразу же после ис-
пользования, иначе со временем осадки и налеты реакционной мас-
сы стареют, и их отмывание становится весьма затруднительно.
Растворители для мытья следует подбирать соответственно типу загрязнений:
кислые осадки отмывают разбавленными растворами
соды или щелочи, основные – разбавленными минеральными кис-
лотами. Особенно эффективны хромовая смесь и спиртовый рас-
твор гидроксида калия. В некоторых случаях оправдано использо-
вание органических растворителей. Твердые остатки, прочно при-
ставшие к стенкам, можно удалить щеткой (ершом). После мытья
посуду ополаскивают водой (по хорошо промытой стеклянной по-
верхности вода стекает сплошной пленкой) или, для ускорения
процесса сушки, ацетоном (под тягой, вдали от нагревательных
приборов!). В последнем случае для полного высушивания доста-
точно продуть посуду воздухом из резиновой груши.
Мелкую посуду сушат в сушильном шкафу при 100 – 110° С, а
крупную – просто на воздухе.
4. Практические занятия /лабораторные работы
Практическое занятие № 1
Обобщить знания об элементном составе органических веществ.
Определение углерода, водорода и галогена.
Цель работы: закрепить умения составлять формулы органических веществ по массовым долям элементного состава.
При выводе формул нужно различать простейшую и истинную формулы.
Простейшая формула показывает соотношение числа атомов каждого элемента.
Истинная формула показывает точный количественный состав. Например, простейшая формула бензола СН, она показывает, что на один атом углерода в молекуле бензола приходится один атом водорода. Истинная формула бензола, показывающая точный количественный состав молекулы – С6Н6. Чтобы установить истинную формулу, нужно знать истинную молекулярную (молярную) массу, она в целое число раз больше массы, найденной по простейшей формуле. На это число нужно умножить индексы в простейшей формуле, чтобы получить истинную формулу. Если в условии задачи нет данных для нахождения истинной молярной массы, а найденная простейшая формула явно не соответствует истинной, то полученные индексы нужно увеличить в два раза. Например, получилась простейшая формула С3Н7, значит истинная будет С6Н14
При всём многообразии задач на вывод формул можно выделить несколько основных типов. Рассмотрим алгоритмы решений этих задач наиболее простыми способами.
I. Вывод формул веществ по массовым долям элементов.
Написать формулу вещества, обозначив индексы через x, y, z.
· Если неизвестна массовая доля одного из элементов, то её находят, отняв от
100 % известные массовые доли.
· Найти соотношение индексов, для этого массовую долю каждого элемента (лучше в %) разделить на его атомную массу (округлить до тысячных долей)
x : y: z = ω1 / Ar1 : ω2 / Ar2 : ω3 / Ar3
· Полученные числа привести к целым. Для этого разделить их на наименьшее из полученных чисел. При необходимости (если опять получилось дробное число) после этого домножить до целого числа на 2, 3, 4 … .
· Получится простейшая формула. Для большинства неорганических веществ она совпадает с истинной, для органических, наоборот, не совпадает.
Задача № 1.
Массовая доля углерода в углеводороде равна 83,72 %. Найти молекулярную формулу углеводорода.
Дано: Решение:
ω(С) = 83,72 % 1. Напишем формулу - СхНу
2. Найдём массовую долю водорода:
М.Ф. = ? ω(Н) = 100 % - 83,72 % = 16,28 %
3. Найдём соотношение индексов:
х : у = 83,72 / 12 : 16,28 / 1 = 6,977 : 16,28 = 1 : 2,333 = 3 : 7
4. Простейшая формула – С3Н7, но она не соответствует истинной.
Выход – увеличить индексы в 2 раза С6Н14.
Ответ: С6Н14.
Задача № 2.
Определить формулу вторичного амина, массовые доли углерода, водорода и азота, в котором составляют 61; 15,3 и 23,7 % соответственно.
Ответ: CH3 – NH – C2H5.
Задача № 3.
Массовая доля углерода в диеновом углеводороде составляет 88,89 %. Найти молекулярную формулу диена.
Ответ: С4Н6.
II. Вывод формул веществ по массовым долям элементов и данным для нахождения истинной молярной массы (плотности, массе и объёму газа или относительной плотности).
1. Найти истинную молярную массу:
если известна плотность:
d = m / V = M / Vm M = d ∙ Vm = d г/л ∙ 22,4 л/моль
· если известна масса и объём газа, молярную массу можно найти двумя способами:
- через плотность d = m / V, M = D ∙ Vm;
- через количество вещества: = V / Vm, M = m / .
если известна относительная плотность первого газа по другому:
D21 = M1 / M2 M1 = D2 ∙ M2
M = DH2 ∙ 2 M = DO2 ∙ 32
M = Dвозд. ∙ 29 M = DN2 ∙ 28 и т.д.
2. Найти простейшую формулу вещества (см. предыдущий алгоритм) и его молярную массу.
3. Сравнить истинную молярную массу вещества с простейшей и увеличить индексы в нужное число раз.
Задача № 1.
Найти формулу углеводорода, в котором содержится 14,29 % водорода, а его относительная плотность по азоту равна 2.
Дано:
ω(Н) = 14,29 % Решение:
D(N2) = 2 1. Найдём истинную молярную массу СхНу :
М = DN2 ∙ 28 = 2 ∙ 28 = 56 г/моль.
М.Ф. = ? 2. Найдём массовую долю углерода:
ω(С) = 100 % - 14,29 % = 85,71 %.
3. Найдём простейшую формулу вещества и его молярную массу:
х : у = 85,7 / 12 : 14,29 / 1 = 7,142 : 14,29 = 1 : 2 СН2
М(СН2) = 12 + 1 ∙ 2 = 14 г/моль
4. Сравним молярные массы:
М(СхНу) / М(СН2) = 56 / 14 = 4 истинная формула – С4Н8.
Ответ: С4Н8.
Задача № 2.
Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить формулу вещества.
Ответ: C7H12.
Задача № 3.
Определить молекулярную формулу амина, массовые доли углерода, азота и водорода в котором составляют 38,7; 45,15 и 16,15 % соответственно. Относительная плотность его паров по воздуху равна 1,069.
Ответ: CH3NH2.
Задача № 4.
Определите формулу углеводорода, массовая доля водорода в котором составляет 14,3 %. Относительная плотность этого вещества по водороду равна 21.
Ответ: С3Н6.
Задача № 5.
Относительная плотность паров углеводорода по воздуху равна 3,31, а массовая доля водорода в нём равна 12,5 %. Определите молекулярную формулу углеводорода.
Ответ: С7Н12.
Практическое занятие № 2
Установить формулы органических веществ по продуктам реакции
Цель: Уметь анализировать состав и устанавливать формулы органических веществ по продуктам реакции.
1. Проанализировать состав продуктов сгорания и сделать вывод о качественном составе сгоревшего вещества:
Н2О Н, СО2 С, SO2 S, P2O5 P, Na2CO3 Na, C; HCl H, Cl
Наличие кислорода в веществе требует проверки. Обозначить индексы в формуле через x, y, z. Например: Сх Ну Оz (?).
2. Найти количества веществ продуктов сгорания по формулам:
n= m / M и n= V / Vm
3. Найти количества элементов, содержавшихся в сгоревшем веществе.
Например:
(С) = (СО2), (Н) = 2 ∙ (Н2О), (Na) = 2 ∙ (Na2CO3), (C) = (Na2CO3) и т.д.
4. Если сгорело вещество неизвестного состава, то обязательно нужно проверить, содержался ли в нём кислород. Например: Cx, Hy, Oz (?),
m(O) = m в – ва – (m(C) + m(H)
Предварительно нужно найти: m(C) = (C) ∙ 12 г / моль, m(H) = (H) ∙ 1 г / моль
Если кислород содержался, найти его количество: (О) = m(O) / 16 г / моль
5. Найти соотношения индексов по соотношению количеств элементов. Например:
x : y : z = (С) : (Н) : (О)
Числа привести к целым, разделив их наименьшее.
6. Если известны данные для нахождения истинной молярной массы вещества, найти её по формулам: M = ∙ Vm, M1 = D2 ∙ M2
7. Написать простейшую формулу и найти её молярную массу. Сравнить истинную молярную массу с простейшей и увеличить индексы в нужное число раз.
Задача № 1. При сгорании 7,2 г вещества образовалось 9,9 г углекислого газа и 8,1 г воды. Плотность паров этого вещества по водороду равна 16. Определите молекулярную формулу вещества.
Дано: Решение:
m в – ва = 7,2 г 1. Напишем формулу Cx Hy Oz (?).
m (CO2) = 9,9 г 2. Найдём количества веществ:
m (H2O) = 8,1 г (СО2) = m / М = 9,9 г / 44г/моль = 0,225моль
DH2 = 16 (Н2О) = m / M = 8,1 г / 18г/моль = 0.45моль
М.Ф. = ? 3. Найдём количества элементов:
(С) = (СО2) = 0,225моль
(Н) = 2 ∙ (Н2О) = 2 ∙ 0,45 = 0,9моль
4. Найдём массы:
m(C) = 12г/моль ∙ 0,225моль = 2,7 г
m(H) = 1г/моль ∙ 0,9моль = 0,9 г
m(O) = 7,2 г – (2,7 + 0,9) = 3,6 г
Найдём количество элемента кислорода:
(О) = 3,6 г / 16г/моль = 0,225моль
5. Найдём соотношение индексов:
x : y : z = 0,225 : 0,9 : 0,225 = 1 : 4 : 1
Простейшая формула - СН3ОН:
М(СН3ОН) = 32г/моль
6. Найдём истинную молярную массу:
Мист. = DH2 ∙ 2 = 16 ∙ 2 = 32г/моль
7. Сравним: Мист. / Мпрост. = 32г/моль / 32г/моль = 1
Молекулярная формула – СН3ОН.
Ответ: СН3ОН.
Задача № 2. При сгорании газа, не содержащего кислород, выделилось 2,24 л углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Определить формулу сгоревшего вещества.
Дано:
V(CO2) = 2,24 л Решение:
m(H2O) = 1,8 г 1. Написать формулу сгоревшего вещества: CxHyClz
m(HCl) = 3,65 2. Найти количества веществ:
М.Ф. = ? (CO2) = V / Vm = 2,24л / 22,4л/моль =0,1моль
(Н2О) = m / M = 1,8г / 18г/моль = 0,1моль
(HCl) = m / M = 3,65г / 36,5г/моль = 0.1моль
3. Найти количества элементов:
(С) = (СО2) = 0,1моль
(Н) = 2 ∙ (Н2О) + (НСl) = 2 ∙ 0,1 + 0,1 = 0,3 моль
(Сl) = (HCl) = 0,1моль
4. Найти соотношение индексов:
х : y : z = 0,1 : 0,3 : 0,1 = 1 : 3 : 1
5. Простейшая формула: CH3Cl.
Ответ: CH3Cl.
Задача № 3. При сгорании вторичного амина симметричного строения выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота. Установите молекулярную формулу этого амина.
Ответ: (C2H5)2NH.
Задача № 4. При полном сгорании органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1.8 г воды и 4 г фтороводорода. Установите молекулярную формулу сгоревшего соединения.
Ответ: C2H4F2.
Задача № 5. При сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0.224 л азота (объёмы газов измерены при н. у.). Плотность вещества по водороду 15,50. Установите его молекулярную формулу.
Ответ: СН3NH2.
Практическое занятие № 3
Составить структурные формулы изомеров углеводородов и их названий.
Цель: Научиться составлять структурные формулы изомеров алканов
Изомерия – явление существования соединений, одинаковых по составу, но разных по строению и свойствам. Различают структурную и пространственную изомерию.
Причиной структурной изомерии является различный порядок соединения атомов в молекулах. Она включает:
~ изомерию, определяемую характером углеродного скелета
СН3 – СН2 – СН2 – СН3 СН3 – СН – СН3
|
н-бутан СН3 2-метилпропан
Задание № 1
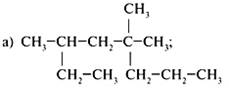
Для 2,2,3-триметилпентана составить формулы двух гомологов и двух изомеров.
Решение:
1. Составить формулу исходного вещества, используя задание 2 алгоритма 1:
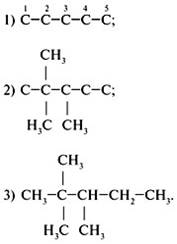
2. Составить формулы г о м о л о г о в, сохраняя строение (разветвление 2,2,3-триметил-). Для этого уменьшить главную цепь на группу СН2 (гомологическая разность) – пример а или увеличить главную цепь на СН2 – пример б:
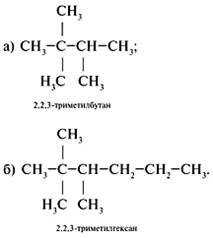
3. Составляя формулы и з о м е р о в, изменить строение, сохраняя состав исходного углеводорода (C8H18), примеры в, г:
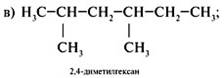
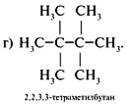
Задания для самостоятельного решения
Задание 1. Какие из приведенных ниже формул отвечают предельным углеводородам: С4Н8, С8Н:8, С6Н6, С3Н8, С20Н42, С11Н22?
Задание 2. Напишите структурные формулы следующих алканов: а)
2,3-диметилпентан; б) З-метил-3-этилпентан; в) 2,3,4-триметил-З-изопропил-
гексан; г) 2,2,4,6-тетраметилгептан; д) 2-метил-3,3-диэтилоктан.
Задание 3. Назовите предельные углеводороды:
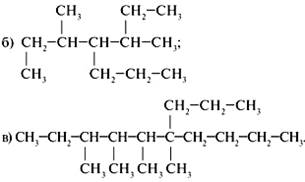
Задание 4. Составьте структурную формулу 2,4,5,5-тетраметил-3-этилоктана. Укажите все первичные, вторичные, третичные и четвертичные углеродные атомы. Составьте для этого вещества два гомолога и два изомера, назовите их.
Задание 5.
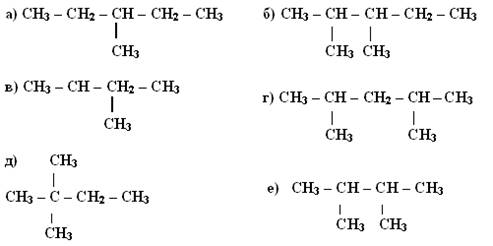
Задания повышенного уровня сложности:
Задание 1. Напишите формулу 2,5-диметил-3,4-диэтилгексана. Приведите формулу его изомера, в молекуле которого содержатся три третичных атома углерода.
Задание 2. В молекуле алкана имеются только первичные и третичные атомы углерода. Первичных атомов в два раза больше, чем третичных. Напишите формулу такого алкана.
Практическое занятие № 4
Описать характерные химические свойства уравнениями реакций
Цели занятия:
1. Воспитательные
- воспитание готовности к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
2.Развивающие
- активизация познавательной деятельности студентов
-развитие способности к постановке задачи, формулирование гипотез, анализ и синтез, сравнение, обобщение, систематизация, выявление причинно-следственных связей, поиск аналогов, формулирование выводов общению
3. Образовательные
-определение принадлежности веществ к гомологическому ряду алканов, составление структурных формул изомеров алканов, составление уравнений реакций, характеризующих химические свойства алканов и способы их получения;
- формирование навыков выполнения расчетов по уравнениям реакций;
1.Первый представитель ряда алканов называется:
а) бутан; б) пропан; в) октан; г) метан.
2. Общая формула алканов:
а) СnH2n; б) СnH2n+2; в) СnH2n–2; г) СnHn.
3. Атомы углерода в алканах находятся в состоянии:
а) sр-гибридизации;
б) sр2-гибридизации;
в) sр3-гибридизации;
г) в негибридном состоянии.
4. Валентный угол в алканах равен:
а) 109°28'; б) 180°; в) 90°; г) 270°.
5. Молекула метана имеет строение:
а) октаэдрическое; б) плоскостное; в) тетраэдрическое; г) гексагональное.
6. Каждый последующий представитель гомологического ряда органических соединений отличается от предыдущего на гомологическую разность, равную:
а) СН; б) СН3; в) СН4; г) СН2.
7. Изомеры гексана: 2-метилпентан, 3-метилпентан, 2-этилбутан,
2,2 диметилбутан, 2-метил-2-этилпропан. Написать структурные формулы.
I. Реакции замещения (разрыв связей C–H):
- Галогенирование, с образованием галогеналканов. Реакция протекает под действием кванта света (механизм реакции замещения).
- Нитрование – замещение атома водорода нитрогруппой –NO2.
а) нитрование азотной кислотой в газовой фазе при температуре 400о-500о:
CH4 + HO–NO2 → CH3NO2 + H2O (нитрометан)
При этих условиях алканы с большим числом углеродных атомов образуют смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С–С:
C2H6 + HO–NO2 → C2H5NO2 (нитроэтан) + CH3NO2 (нитрометан)
CH3CH2CH3 + HO–NO2 → CH3NO2 (9%) + C2H5NO2 (26%) + C3H7NO2 (1-нитропропан 32%) + C3H7NO2 (2-нитропропан 33%)
б) нитрование разбавленной HNO3 при температуре 140о и при повышенном или нормальном давлении (реакция М.И.Коновалова) – образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного, труднее у вторичного, наиболее трудно – у первичного атома углерода.
- Сульфирование– замещение атома водорода сульфогруппой –SO3H с образованием алкансульфокислот. Сульфирование происходит при действии очень концентрированной кислоты при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атома углерода.
II. Реакции окисления. При обычных условиях алканы устойчивы к действию окислителей (KMnO4, K2Cr2O7).
- Окисление кислородом воздуха при высоких температурах (горение):
а) полное окисление до диоксида углерода и воды;
б) неполное окисление (недостаток кислорода) – с образованием СО или С и воды.
- Окисление кислородом воздуха при невысоких температурах в присутствии катализаторов (неполное каталитическое окисление). В результате могут образовываться альдегиды, кетоны, спирты, карбоновые кислоты. Например, при окислении метана, в зависимости от природы катализатора и условии проведения реакции, могут образовываться:
2CH4 + O2 → 2CH3OH (метанол)
CH4 + O2 → H2C=O (метаналь) + H2O
2CH4 + 3O2 → 2HCOOH (метановая кислота) + 2H2О
III. Термические превращения алканов:
- Крекинг – это разрыв связей С–С в молекулах алканов в длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода. Осуществляется при температуре 450о-700о.
- Дегидрирование – отщепление водорода; происходит в результате разрыва связей С–Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется этин (температура ниже 1000о, а при нагревании до 1200о он разлагается на простые вещества – углерод и водород). При дегидрировании других алканов образуются алкены (смесь алкенов).
- Дегидроциклизация– ароматизация, дегидрирование с образованием ароматических соединений, например, из гептана – метилбензол.
- Изомеризация– превращение химического соединения в его изомер, например, бутан → изобутан (при температуре 100о, AlCl3).
Лабораторная работа № 1
Получение метана и исследование его химических свойств
Цель: отработать
методику получения метана и изучить его свойства.
Реактивы и материалы: натриевая соль этановой кислоты обезвоженная
(ацетат натрия) – CH3COONa; смесь гидроксидов натрия (NaOH) и
кальция (Са(ОН)2) – натронная известь сухая; насыщенный раствор Вr2 (бромная
вода); перманганат калия KMnO4, 1Н; жидкие алканы: гептан С7Н16 и
гексан С6Н14; раствор брома (Вr2) в бензоле (С6Н6);
гидроксид аммония (NH4OH), 25% раствор; лакмусовая синяя или
универсальная индикаторная бумага; серная кислота H2SO4.
Оборудование: газоотводная трубка, штатив с пробирками, физический штатив, спиртовка, стеклянная
палочка, вытяжной шкаф, держатели.
ТБ: опыты
проводят в вытяжном шкафу!
Опыт №1 Получение метана и его горение
В сухую пробирку, снабжённую пробкой с
газоотводной трубкой, помещают смесь из обезвоженной натриевой соли этановой
кислоты и натронной извести (1:2, высота слоя 6-10 мм). Затем укрепляют пробирку
горизонтально и нагревают смесь в пламени горелки.
Поджигают выделяющийся газообразный метан у
конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем.
При нагревании натриевой соли уксусной кислоты с
натронной известью происходит расщепление соли с образованием метана.
Опыт №2 Отношение метана к бромной воде и
перманганату калия
Во вторую пробирку помещают 5 капель раствора
перманганата калия, а в третью пробирку 3-5 капель бромной воды. Не
прекращая нагревания смеси в первой пробирке, вводят поочерёдно конец
газоотводной трубки во вторую и третью пробирки. Обесцвечивания растворов
перманганата калия и бромной воды не происходит. В обычных условиях алканы
устойчивы к действию окислителей. Реакции замещения у них идут в довольно жёстких
условиях, к реакциям присоединения не способны.
Опыт №3 Бромирование предельных УВД
В сухую пробирку помещают 4 капли смеси жидких
алканов и добавляют 1-2 капли раствора брома. Содержимое пробирки перемешивают
на холоду. Окраска брома при этом не исчезает. Нагревают содержимое пробирки до
исчезновения окраски. В отверстие пробирки вносят стеклянную палочку, смоченную
раствором гидроксида аммония, при этом появляется белый дымок бромида аммония
NH4Br. Пинцетом вносят в пробирку синюю лакмусовую бумагу, смоченную
водой (бумага краснеет).
Реакция бромирования жидких алканов,
сопровождается выделением бромоводорода и проходит значительно медленнее
бромирования газообразных алканов. Бромирование ускоряется при вводе
катализаторов (например, железных опилок). Легче всего галогенируются УВД с
третичным атомом углерода в молекуле, труднее всего замещается водород при
первичном атоме углерода.
Опыт №4 Действие концентрированной серной
кислоты на алканы
В пробирку помещают 2 капли жидкого алкана и 2
капли серной кислоты. Содержимое пробирки энергично перемешивают в течение 1-2
минут, охлаждая пробирку холодной водой. В условиях опыта алканы с серной
кислотой не реагируют.
При небольшом нагревании дымящая серная кислота
образует с алканами, содержащими третичный атом углерода, сульфокислоты. При
высоких температурах серная кислота действует как окислитель.
Практическое занятие № 5
Рассчитать выход продукта реакции и количества затраченного вещества
Цели занятия:
1. Воспитательные
- воспитание готовности к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
2.Развивающие
- активизация познавательной деятельности студентов
-развитие способности к постановке задачи, формулирование гипотез, анализ и синтез, сравнение, обобщение, систематизация, выявление причинно-следственных связей, поиск аналогов, формулирование выводов общению
3. Образовательные
-определение принадлежности веществ к гомологическому ряду,
составление уравнений реакций, характеризующих химические свойства ;
- формирование навыков выполнения расчетов по уравнениям реакций;
Выход продукта реакции никогда не совпадает с теоретически рассчитанным из-за потерь в производстве вследствие разных причин: побочных процессов, неэффективных соударений реагирующих молекул и т.п. Массовую (объёмную, мольную) долю выхода продукта реакции определяют как отношение массы (объема, количества), практически полученной в результате реакции, к массе (объёму, количеству), теоретически рассчитанной.
Задача. Бензол количеством вещества 0,5 моль прореагировал с избытком брома (в присутствии катализатора). При этом получили бромбензол массой 70 г. Определите массовую долю выхода бромбензола.

Задача. При дегидрировании смеси циклогексана и циклогексена в бензол выделился водород массой, достаточной для полного восстановления 36,9 г нитробензола в анилин. Найти %-ный (по массе) состав исходной смеси, если известно, что такая же масса этой смеси может обесцветить 480 г 10%-ного раствора брома в CCl4.

1. Определим m(Br2) в растворе СCl4:
m(Br2) = m(раствора) • ω(Br2) = 480 г • 0,1 = 48 г
2. Из углеводородов исходной смеси с Br2 реагирует только циклогексен С6Н10, являющийся ненасыщенным соединением.
По уравнению этой реакции рассчитаем массу С6Н10.
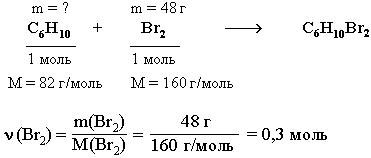
ν(С6Н10) = ν(Br2) = 0,3 моль
m(C6Н10) = ν(С6Н10) • M(С6Н10) = 0,3 моль • 82 г/моль = 24,6 г
3. Определим количество вещества Н2, использованного на восстановление нитробензола:
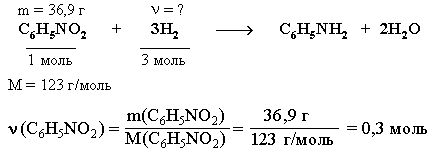
ν(Н2) = 3ν(С6Н5NO2) = 0,9 моль
4. Массу циклогексана рассчитаем из уравнений реакций дегидрирования углеводородов.
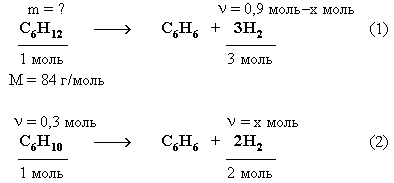
Из уравнения (2) следует, что x = ν(H2) = 0,6 моль.
Тогда количество водорода, выделившегося в реакции (1) равно:
ν(Н2) = 0,9 моль – 0,6 моль = 0,3 моль.
![]()
m(C6H12) = ν(C6H12) • M(C6H12) = 0,1 моль • 84 г/моль = 8,4 г
5. Определим массу исходной смеси углеводоров:
m(смеси) = m(C6H12) + m(C6H10) = 8,4 г + 24,6 г = 33,0 г
6. Рассчитаем массовые доли углеводородов в исходной смеси:
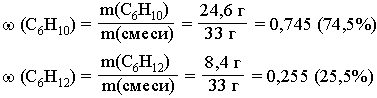
Ответ: ω(С6Н10) = 0,745 (74,5%); ω(С6Н12) = 0,255 (25,5%)
Если реакция проводится в растворе, то при расчете массы, объёма и количества исходных веществ или продуктов реакции необходимо учитывать их концентрацию.
Задача. Сколько грамм бромной воды с массовой долей брома 3,2% потребуется для реакции с 10 л (н.у.) смеси этана и этилена, в которой объемная доля этилена равна 28%?

Лабораторная
работа №2
Получение этена (этилена) и изучение его
свойств.
Цель: отработать
методику получение этена (этилена) реакцией дегидратации этанола и проведение
качественных реакций.
Реактивы и материалы: этанол С2Н5ОН, 96% водный
раствор; серная кислота H2SO4; песок Si02,
сухой; насыщенный раствор брома (бромная вода); водный раствор перманганата
калия КMnО4 О,1Н.
Оборудование: штатив с пробирками, вытяжной шкаф,
фильтровальная бумага, пробки с газоотводными трубками, спиртовка или сухое
горючее, пробиркодержатели.
ТБ: опыты
проводят в вытяжном шкафу!
Опыт №1 Получение этена и его горение
В сухую пробирку помещают несколько крупинок
песка, 2 капли этанола и 4 капли серной кислоты. Закрывают пробирку пробкой с
газоотводной трубкой и осторожно нагревают смесь на пламени спиртовки.
Выделяющийся газ поджигают у конца газоотводной трубки - он горит светящимся
пламенем.
Концентрированная серная кислота является
окислителем. При нагревании смеси этанола с концентрированной серной кислотой
образуется, кроме этилена и следов диэтилового эфира (С2Н5)20,
ряд продуктов окисления органических соединений, например, диоксид углерода СО2,
уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом
восстанавливается до диоксида серы (сернистого ангидрида).
Если реакцию вести в присутствии песка, сульфата
алюминия (катализаторы, ускоряющие дегидратацию этанола), почернения смеси
не происходит,
следовательно, диоксида серы не образуется.
Дегидратация спиртов является общим способом получения
непредельных УВД.
Опыт №2 Отношение этилена к окислителям
Не прекращая нагревания пробирки со смесью
этанола и серной кислоты, опускают конец газоотводной трубки в пробирку с 1
каплей раствора перманганата калия и 4 каплями воды. Раствор быстро обесцвечивается.
При этом этен окисляется в двухатомный спирт.
Опыт № 3 Присоединение к этену брома
Не прекращая нагревания пробирки со смесью
спирта и серной кислоты, опускают конец газоотводной трубки в пробирку с 5
каплями бромной воды. Бромная вода быстро обесцвечивается вследствие
присоединения атомов брома по месту разрыва двойной связи.
Для алкенов характерны реакции присоединения по
месту разрыва двойной связи. Реакция обесцвечивания водного раствора брома
служит качественной реакцией на двойную связь.
Лабораторная
работа №3
Получение этина (ацетилена) и изучение его
свойств.
Цель: отработать методику получения этина
(ацетилена) и изучить его свойства.
Реактивы: карбид кальция СаС2; этин С2Н2;
насыщенный раствор Вг2 (бромная вода); перманганат калия KMnO4 0,1Н;
нитрат серебра, AgN03, 0,2Н; гидроксид аммония NH4OH,
концентрированный водный раствор; хлорид меди, СuCl2.
Оборудование: газоотводная трубка, штатив с пробирками,
вытяжной шкаф, фильтровальная бумага, пробиркодержатели.
Опыт№1 Получение этина (ацетилена) и его
горение
Работу с этином необходимо вести в вытяжном
шкафу, т. к. не очищенный этин, полученный из карбида кальция, содержит
вредные, неприятно пахнущие примеси. В пробирку помещают маленький кусочек
карбида кальция, добавляют 2 капли воды и закрывают пробирку пробкой с
газоотводной трубкой. В пробирке бурно выделяется газообразный этин.
Реакция экзотермична, этин содержит значительные
количества аммиака, фосфина и других примесей и поэтому имеет характерный
запах. Примеси можно удалить промыванием ацетилена водным раствором бихромата
калия, подкисленного серной кислотой.
Подожгите этин у конца газоотводной трубки.
Опыт №2 Присоединение к этину брома
В пробирку с карбидом кальция добавляют ещё 2
капли воды и зарывают её пробкой с газоотводной трубкой, конец которой опускают
в пробирку с бромной водой.
Опыт №3 Отношение этина к окислителям
В пробирку помещают 1 каплю перманганата калия и
5 - 7 капель воды. В пробирку с карбидом кальция добавляют еще 2 капли воды
и закрывают пробкой с газоотводной трубкой, конец которой опускают в приготовленный раствор
перманганата калия. Розовый раствор обесцвечивается: происходит окисление
ацетилена по месту разрыва тройной связи с образованием промежуточного продукта
окисления - щавелевой кислоты, которая окисляется дальше до оксида углерода.
Опыт № 4 Образование карбида (ацетиленида)
серебра
В пробирку внося 2 капли раствора нитрата
серебра и прибавляют 1 каплю раствора аммиака - образуется осадок гидроксида
серебра. При добавлении ещё 1-3 капель раствора аммиака, осадок AgOH
легко растворяется с образованием аммиачного раствора оксида серебра.
Через аммиачный раствор оксида серебра
пропускаем ацетилен. В пробирке образуется светло-жёлтый осадок ацетиленида
серебра, который затем становится серым.
Опыт №5 Образование карбида (ацетиленида)
меди
В отверстие пробирки (опыт №1) вводя полоску
фильтровальной бумаги, смоченной аммиачным раствором хлорида меди, содержащим
комплексный аммиакат состава [Cu(NH3)2]Cl. Появляется
красно-бурое окрашивание вследствие образования ацетиленида меди.
В водных растворах ацетилениды устойчивы. В
сухом состоянии при нагревании или ударе они взрываются с большой силой.
Практическое занятие № 6
Составить структурные формулы и закрепить знания номенклатуры и химических свойств.
Цель: закрепление полученных теоретических знаний о строении органических соединений- алкинов, развитие практических навыков составления структурных формул органических соединений, умение давать им названия.
Планируемый результат обучения:
обучающийся должен уметь:
- называть: изученные вещества по тривиальной или международной номенклатуре;
- определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений;
- проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Обучающийся должен знать/понимать:
- важнейшие химические понятия: углеродный скелет, функциональная группа;
- основные теории химии: строения органических соединений.
Оборудование и материалы: таблицы, схемы, раздаточный материал, шаростержневые модели.
Теоретическая часть
Алкины (иначе ацетиленовые углеводороды) - углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Тривиальное название сохранилось для первого представителя ацетилена СН СН. По рациональной номенклатуре рассматриваются как производные ацетилена, в молекулах которых атомы водорода замещены на алкильные группы.
Например: СН3- С С-СН2-СН3
метилэтилацетилен
Для наименования алкинов по систематической номенклатуре к названию основы добавляют суффикс – ин.
1. Выбирают самую длинную цепь углеродных атомов, содержащую тройную связь.
2. Нумеруют углеродные атомы главной цепи с того конца, к которому ближе тройная связь.
3. С помощью локантов и умножающих приставок в алфавитном порядке перечисляют все заместители.
4. По числу углеродных атомов называют главную цепь, добавляя суффикс – ин.
5. С помощью локанта через дефис в суффиксе указывают углеродный атом главной цепи, от которого отходит тройная связь.
Практическая часть
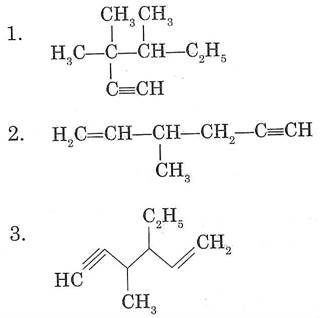
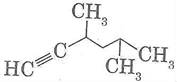
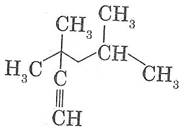
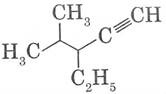
Задание № 1.
Назовите алкины по систематической номенклатуре:
4.
5.
6.
 7.
7.
Задание № 2. Как называются следующие углеводороды по систематической и рациональной номенклатурам:
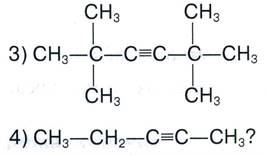
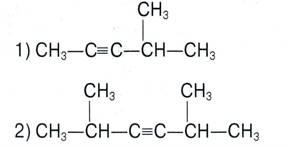
Задание № 3. Напишите все возможные формулы изомеров углеводорода состава С5Н8, относящегося к классу алкинов и дайте им названия.
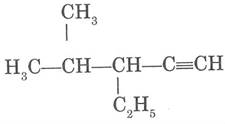
Задание № 4. Назовите согласно систематической номенклатуре следующее соединение:
НС CH3
CH2Br
1. 4-бром-3-метилбутин-1;
2. 1-бром-2-метилбутен-3;
3. 4-бром-3-метилпропин;
Практическое занятие № 7
Составить цепочки, химических превращений и описать уравнения реакций взаимного перехода алканов, алкадиенов, алкенов, алкинов Цель:
• знать понятие алкенов, алкинов, их общую формулу; гомологический ряд и виды изомерии; свойства и получение;
• уметь называть алкены и алкины по систематической номенклатуре; составлять структурные формулы по названию; производить расчеты по химическим уравнениям реакций; составлять генетические ряды превращений между алкенами и алкинами.
Контрольные вопросы.
• Какие углеводороды называются непредельными?
• Что такое алкены, алкины? Их общая формула.
• Охарактеризуйте природу двойной связи непредельных углеводородов.
• Какие виды изомерии характерны для алкенов и алкинов?
Рекомендации к выполнению работы.
• Названия алкенов образуются из названий соответствующих алканов с заменой окончания -ан на -ен, а алкинов - с заменой окончания -ан на -ин.
• Нумерацию углеродной цепи начинают с того конца, который ближе к двойной или тройной связи:
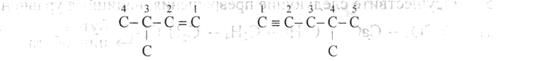
3 Положение кратной связи (двойной и тройной) (с номерами 1 и 2) указываем меньшим номером атома, участвующего в образовании двойной или тройной связи, следовательно, алкен будет называться: З-метилбутен-1, а алкин -4-метилпентин-1.
Выполнение работы.
• Напишите структурные формулы следующих соединений:
а) 2 - метилбутен - 2;
б) 2, 3, 4 - триметилпентен - 1;
в) 2, 3 - диметилбутен - 2;
г) 3,6- диметилоктен - 1;
д) 3,3- диметилбутин - 1;
е) 4-этилгексин-2;
ж) 2 - метилоктин - 3;
з) 3-хлор - З-метилгептин-1.
• Назовите следующие углеводороды по систематической номенклатуре:
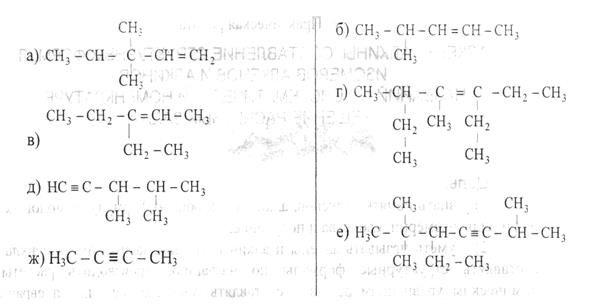
• Напишите структурные формулы всех изомеров алкенов и алкинов состава С5Н8, назовите их по систематической номенклатуре.
• Решите следующие задачи.
• При пропускании этилена через раствор бромной воды вес склянки увеличился на 14 г. Какой объем этилена поглотится бромной водой? Какая масса бромистого этилена образовалась при этом?
• Какой объем ацетилена можно получить при взаимодействии 51,2 кг карбида кальция с водой, если выход ацетилена составляет 84 % по сравнению с теоретическим?
• Какой объем выделится углекислого газа при сжигании 50 л пропилена (н.у.)?
Примечание: молярный объем любого газа при н.у. равен 22,4 л, который используется в решении задачи. (ViM0JIbra3a= 22,4 л/моль).
5 Осуществите следующие превращения, напишите уравнения реакций:
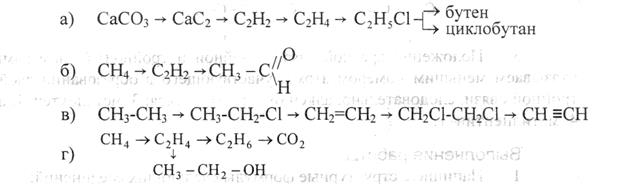
Практическое занятие № 8
Решить расчётные задачи
Определение химической формулы вещества по продуктам его сгорания
Это традиционный тип задач по органической химии, родившийся еще в прошлом веке из повседневной экспериментальной практики химика-аналитика. Давайте рассмотрим методику решения таких задач.
Задача. При сгорании органического вещества массой 4,8 г образовалось 3,36 л CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества.
Решение. Продукты
сгорания вещества состоят из трех элементов: углерода, водорода, кислорода. При
этом очевидно, что в состав этого соединения входил весь углерод, содержащийся
в CO2, и весь водород, перешедший в воду. А вот кислород мог
присоединиться во время горения из воздуха, а мог и частично содержаться в
самом веществе. Для определения простейшей формулы соединения нам необходимо
знать его элементный состав. Найдем количество продуктов реакции (в моль):
n(CO2)
= V(CO2) / VM = 3,36 л :
22,4 л/моль = 0,15 моль
n(H2O)
= m(H2O) / M(H2O) = 5,4 г : 18
г/моль = 0,3 моль
Следовательно, в состав исходного соединения
входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H)
= 2n(H2O), так как в одной молекуле воды содержатся два атома
водорода. Вычислим их массы по формуле:
m = n х M
m(H)
= 0,6 моль х 1 г/моль = 0,6 г
m(С)
= 0,15 моль х 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного
вещества:
m(O)
= 4,8 - (0,6 + 1,8) = 2,4 г
Найдем число моль атомов кислорода:
n(O)
= m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного
органического соединения пропорционально их мольным долям:
n(CO2)
: n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
самую маленькую из этих величин (0,15) принимаем
за 1, а остальные делим на нее.
Итак, простейшая формула исходного вещества CH4O.
Однако по условию задачи требуется определить молекулярную формулу, которая в
общем виде такова: (CH4O)х. Найдем значение x.
Для этого сравним молярные массы исходного вещества и его простейшей формулы:
x = M(CH4O)х / M(CH4O)
Зная относительную плотность исходного вещества
по водороду, найдем молярную массу вещества:
M(CH4O)х = M(H2)
х D(H2) = 2 г/моль х 16 = 32 г/моль
x =
32 г/моль / 32 г/моль = 1
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x =
32; 32 x = 32; x = 1
Ответ. Формула исходного органического вещества CH4O.
2. Теория и реальность (задачи на выход продукта)
Схемы расчетов по химическим уравнениям основываются
на законе сохранения массы веществ и справедливы, если в реакцию вступают
абсолютно чистые вещества и их взаимодействие протекает без потерь. Однако на
практике продуктов реакции всегда образуется меньше, чем должно было получиться
в соответствии с расчетами. Поэтому одна из важнейших характеристик
химико-технологического процесса - практический выход продукта реакции h:
h =
{mпракт (Vпракт; nпракт)
: mтеор (Vтеор; nтеор)}
х 100%,
где mпракт (Vпракт; nпракт)
- масса, объем или количество вещества-продукта, получившегося практически,
а mтеор(Vтеор; nтеор)
- масса, объем или количество вещества-продукта, рассчитанное теоретически (по
уравнению реакции).
Задача. В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола.
Решение.
3C2H2 (650 оС, активированный уголь) = C6H6
n(C2H2)
= V(C2H2)/ VM =
120 л : 22,4 л/моль = 5,35 моль
n(C6H6)теор =
1/3 х n(C2H2) = 1/3 х 5,35 моль = 1,785 моль
n(C6H6)практ = m(C6H6)/ M(C6H6)
= 60 г : 78 г/моль = 0,77 моль
h =
(nпракт : nтеор) х 100% = (0,77 :
1,785) х 100% = 43%
Ответ. 43%.
3. Реакции, в которых один из реагентов взят в избытке
Задача. Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность d = 0,8 г/мл).
Решение. В
условии задачи даны количества обоих реагентов - это верный признак того, что
какой-нибудь из них находится в избытке. Найдем массу этанола, введенного в
реакцию:
m(раствора)
= V х d = 100 мл х 0,8 г/мл = 80 г
m(C2H5OH)
= {m(раствора) х w%} : 100% = 80 г х 0,96 = 76,8 г
(1) 2C2H5OH + 2Na = 2C2H5ONa + H2
на 2 моль этанола -- 2 моль натрия -- 1 моль водорода
Найдем заданное количество этанола в моль:
n(C2H5OH)
= m(C2H5OH) / M(C2H5OH)
= 76,84 г : 46 г/моль = 1,67 моль
Поскольку заданное количество натрия составляло
2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного
водорода будет определяться количеством этанола:
n1(H2) = 1/2 n(C2H5OH)
= 1/2 х 1,67 моль = 0,835 моль
V1(H2) = n1(H2)
х VM = 0,835 моль х 22,4 л/моль = 18,7 л
Но это еще не окончательный ответ. Будьте
внимательны!
Вода, содержащаяся в растворе спирта, тоже
реагирует с натрием с выделением водорода.
Найдем массу воды:
m(H2O)
= {m(раствора) х w%} : 100% = 80 г х 0,04 = 3,2 г
n(H2O)
= m(H2O)/M(H2O) = 3,2 г : 18 г/моль =
= 0,178 моль
(2) 2H2O + 2Na = 2NaOH + H2
на 2 моль воды -- 2 моль натрия -- 1 моль водорода
Количество натрия, оставшееся неизрасходованным
после реакции с этанолом, составит:
n(Na,
остаток) = 2 моль - 1,67 моль = 0,33 моль
Таким образом, и по сравнению с заданным
количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода,
выделившегося по реакции (2):
n2(H2) = 1/2 n(H2O)
= 1/2 х 0,178 моль = 0,089 моль
V2(H2) = n2(H2)
х VM = 0,089 моль х 22,4 л/моль = 1,99 л
Общий объем водорода:
V(H2)
= V1(H2) + V2(H2)
= 18,7 л+ 1,99 л = 20,69 л
Ответ: V(H2) = 20,69 л
4. Реакции, протекающие в газовой фазе
При проведении расчетов по уравнениям таких
реакций необходимо помнить, что количественные соотношения реагирующих веществ
имеют одну особенность, вытекающую из закона Авогадро, а именно:
Для реакций, протекающих между газообразными
веществами, отношение объемов реагирующих веществ и продуктов реакции равно
отношению соответствующих коэффициентов уравнения реакции.
Задача. Какой объем воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена?
Решение.
(1) CH4 + 2O2 = CO2 + 2H2O
на 1 моль CH4 -- 2 моль 2O2
(2) 2C2H2 + 5O2 = 4CO2 + 2H2O
на 2 моль 2C2H2 -- 5 моль 2O2
Объем кислорода, который пойдет на сжигание
заданного объема метана V1(O2) и
ацетилена V2(O2), составит:
V1(O2) = 2V(CH4)
= 2 х 5 = 10 л
V2(O2) = 5/2 V(C2H2)
= 5/2 х 15 = 37,5 л
V(O2) = V1(O2)
+ V2(O2) = 10 л + 37,5 л = 47,5 л
Отсюда рассчитаем объем воздуха на сжигание
(содержание кислорода в воздухе принимаем равным 21% по объему):
V(воздуха)
= V(O2) : 0,21 = 47,5 л : 0,21 = 226 л
Ответ. V(воздуха) = 226 л
Лабораторная работа № 4
Исследование физических свойств бензола, толуола, нафталина и их способности к окислению..
Цель:
• Изучить свойства бензола, толуола, стирола, отношение их к воде, органическим растворителям и окислителям.
• Развивать умения составлять уравнения реакций, объяснять взаимное влияние атомов в молекуле толуола.
Реактивы и оборудование: бензол, толуол, стирол, вода, этиловый спирт, четырех хлористый углерод, раствор перманганата калия, бромная вода, железные опилки, конц. Серная и азотная кислоты, 10% раствор серной кислоты, штатив с пробирками, газоотводная трубка, водяная баня, фильтрованная бумага, лакмусовая бумажка.
Подготовка к работе
• Какие углеводороды называются ароматическими и почему?
• Напишите структурные формулы бензола, толуола, стирола. Почему при изображении структурной формулы бензола не следует указывать двойные связи?
• Какие реакции характерны для ароматических углеводородов?
• Почему реакции замещения протекают быстрее у аренов, чем реакции присоединения?
Выполнение работы
Опыт 1. Растворимость бензола.
Налейте в одну пробирку 1-2 мл. воды, а в другую - 1-2 мл. этилового спирта. В обе пробирки добавьте равное количество бензола. Встряхните пробирки. Запишите наблюдения.
Опыт 2. Горение бензола и толуола.
Смочите один кусочек фильтровальной бумаги бензолом, а второй кусочек - толуолом, взяв каждый из них тигельными щипцами, подожгите в вытяжном шкафу. Затем сожгите кусочек бумаги без бензола. Запищите наблюдения и объясните, какой из углеводородов горит более коптящим пламенем?
Напишите уравнения реакций горения бензола и толуола.
Опыт 3. Окисление бензола, толуола и стирола.
В три пробирки налейте по 1 мл. раствора перманганата калия и 10% - ной серной кислоты. Затем в одну пробирку 0,5 мл. бензола, в другую - 0,5 мл. толуола, в третью - 0,5 мл. стирола. Сильно встряхивайте первую и вторую пробирки, предварительно закрыв их пробками, в течение нескольких минут.
Изменяется ли цвет раствора К Mn О4 в каждой пробирке? Запишите наблюдения.
Напишите уравнения реакций окисления толуола и стирола.
Опыт 4. Бромирование бензола и толуола.
• В две пробирки налейте по 0,5 мл. бензола и толуола, добавьте по 1 мл. бромной воды в каждую из них. Энергично встряхните пробирку с бензолом. Запишите наблюдение явления в каждой пробирке.
• В пробирку налейте 1-2 мл. бензола, прилейте 1-2 мл. брома в четыреххлористом углероде и добавьте на кончике ножа немного железных опилок(в качестве катализатора). Нагреть смесь на водяной бане до начала кипения! Внесите влажную лакмусовую бумажку..
Что наблюдаете? Запишите соответствующие уравнения реакций.
Опыт следует проводить в вытяжном шкафу.
Признаками реакции бромирования является исчезновение окраски брома и выделение дымящегося на воздухе бромистого водорода.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 5. Нитрование бензола.
В широкую сухую пробирку налейте 2 мл. концентрированной серной кислоты и 1 мл. конц. азотной кислоты, охладите полученную смесь, прилейте к ней 1 мл. бензола в три приема, хорошо перемешивая смесь после каждого прибавления (пробирку закрыть пробкой с обратным холодильником). Если смесь разогревается, то ее нужно охладить водой. Пробирку со смесью встряхивайте в течение 3 минут, после чего полученную смесь вылейте в стаканчик с водой.
Что наблюдаете?
Внимание: опыт проводить в вытяжном шкафу, т.к. работа с концентрированными кислотами требует осторожности.
Составьте уравнение реакции нитрования бензола.
Задания для самостоятельных выводов
• В каких растворителях растворяются ароматические углеводороды?
• Почему бензол горит более коптящим пламенем чем толуол?
• Почему толуол окисляется и вступает с бромной водой в реакцию быстрее, чем бензол?
• Почему раствор перманганата калия обесцвечивается стиролом?
Упражнения
• Напишите уравнения реакций получения бензойной кислоты (двумя способами), исходя из бензола и используя для этого все необходимые вещества.
• В лаборатории из 78 г. бензола при реакции нитрования получено 105 г. нитробензола. Сколько процентов составляет выход продукта от теоретического?
Опыт 6. Влияние катализатора на ход бромирования ароматических углеводородов
Реактивы: толуол, алюминий (в виде проволоки или полоски), железо (в виде опилок), йод (кристаллический)
Опыт следует проводить в вытяжном шкафу.
А. В сухой пробирке смешивают 2-3 мл исследуемого углеводорода с равным объемом раствора брома и делят смесь на четыре части, примерно одинаковые по объему. К трем порциям добавляют катализаторы: в первую - несколько кристалликов йода, во вторую - алюминия и в третью - маленькую щепотку железных опилок. В четвертую порцию катализатор не добавляют.
Смеси, содержащие толуол, оставляют при комнатной температуре, часто взбалтывая.
Наблюдая различия в быстроте и интенсивности выделения бромистого водорода, отмечают, как влияют различные катализаторы на ход бромирования.
Б. Для обнаружения влияния катализатора не только на скорость, но и на направление бромирования толуола, смеси нагревают без катализатора и с катализатором - железом до начала кипения. Энергичное бромирование наблюдается в обоих случаях. Затем обе пробирки охлаждают и погружают в каждую из них конец полоски фильтровальной бумаги, свернутой жгутом так, чтобы жидкость смочила бумагу. Вынув обе бумажки, слегка подсушивают их над электроплиткой или просто на воздухе и время от времени определяют запах смоченной части бумаги (осторожно!). Бромистый водород и растворитель улетучиваются очень быстро, затем испаряется и взятый в избытке толуол. После этого можно установить резкое различие запаха обеих бумажек.
После окончания опыта все пробирки ополаскивают в вытяжном шкафу теплым раствором щелочи.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 7. Влияние света на ход бромирования ароматических углеводородов
Реактивы: бензол, толуол, раствор брома.
Оборудование: 2 пробирки, пипетка, держатель для пробирок
Ход выполнения работы:
В каждую пробирку помещают одинаковый объем одного из углеводородов. Высота столба жидкости должна составлять 7-8 см. Затем на каждую пробирку надевают кусок непрозрачной резиновой трубки или кольцо из полоски черной бумаги (закрепленной мягкой проволокой) так, чтобы часть столба жидкости (не менее 3-4 см) была закрыта от прямого света.
В каждую пробирку приливают по 5-10 капель раствора брома, встряхивают их и оставляют либо на рассеянном дневном свете, либо при освещении электрической лампочкой на расстоянии 2-3 см; освещенность всех пробирок должна быть примерно одинаковой. По часам отмечают время начала опыта. Через 1-10 мин (в зависимости от толщины стенок пробирок и интенсивности освещения) видимая часть раствора обесцвечивается сначала в одной из пробирок, затем - в другой. Записав время, потребовавшееся для обесцвечивания жидкости в каждой пробирке, сразу же открывают затемненную часть слоя данной жидкости и отмечают, исчезла ли окраска брома и в этой части.
У отверстия пробирок, в которых наблюдается обесцвечивание, выделяется дымящий на воздухе газ, иногда в жидкости заметны пузырьки. Испытывают на бумажках, какой запах имеют продукты реакции в обесцветившихся растворах сразу после испарения более летучих веществ.
В одной из пробирок жидкость остается окрашенной бромом очень длительное время.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 8. Сульфирование ароматических углеводородов
Реактивы: толуол, ксилол
Оборудование: 2 пробирки, пипетка, держатель для пробирок
Ход выполнения работы:
В пробирки помещают по 0,5-1 мл каждого из углеводородов и добавляют 4 мл конц. серной кислоты, затем пробирки нагревают на водяной бане до 80С при частом и сильном встряхивании.
Углеводороды при встряхивании образуют с кислотой эмульсию (тем легче, чем дольше идет процесс) и постепенно растворяются. Отмечают различие во времени, которое требуется для полного растворения исследуемых углеводородов при одинаковом режиме нагревания и встряхивания.
Когда растворение закончится, все пробирки охлаждают в стакане с холодной водой, затем содержимое каждой пробирки выливают в колбочку или стаканчик с 10-15 мл холодной воды и отмечают, выделяется ли исходный углеводород или продукт реакции.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 9. Взаимодействие ароматических углеводородов с концентрированной азотной кислотой
Реактивы: толуол, бензол, нафталин.
Оборудование: 3 пробирки, пипетка, держатель для пробирок
Ход выполнения работы:
Опыт следует проводить в вытяжном шкафу. Работают параллельно с двумя веществами.
В две пробирки помещают по 1 мл конц. азотной кислоты, добавляют в них соответственно 5-6 капель одного из углеводородов и сильно встряхивают. Жидкости в пробирках образуют нестойкую, быстро расслаивающую эмульсию. Продолжая часто встряхивать, нагревают смеси почти до кипения. Отмечают различие хода процесса в разных пробирках.
После 1-2 мин нагревания со встряхиванием пробирки приливают в каждую по 4-5 мл холодной воды. Отмечают характерный запах продуктов реакции. В двух пробирках продукты реакции выделяются в виде тяжелого окрашенного масла.
Результаты наблюдений заносят в тетрадь для лабораторных работ.
Контрольные вопросы
1. Какие реакции характерны для аренов?
2. Напишите структурные формулы всех изомеров бутилбензола и назови-
те их.
3. Смесь каких углеводородов получится при алкилировании толуола про-
пиленом в присутствии AICI3?
4. Получите с помощью реакции Вюрца - Фиттига n-этилтолуол.
5. В каком валентном состоянии находится атом углерода в молекуле бен-
зола? Представьте схематически пространственную конфигурацию бензо-
ла.
6. Какие углеводороды получатся, если подвергнуть дегидроциклизации 2-
метилгексан, н-гептан, н-октан?
7. Напишите структурные формулы углеводородов состава С7Н8 и С8Н10,
которые при окислении образуют бензойную кислоту.
8. Напишите схемы получения бензола из следующих исходных веществ:
а) ацетилена; б)циклогексана; в) бензойной кислоты.
Практическое занятие № 9
Составить уравнения реакций примеров ориентации при электрофильном замещении в бензольном ядре.
Цель закрепить знания механизма электрофильного замещения ароматических углеводородов.
• Какие углеводороды называются аренами?
• Охарактеризуйте особенности строения молекулы бензола.
• Назовите важнейшие способы получения аренов, приведите соответствующие уравнения реакций.
• На примере бензола охарактеризуйте важнейшие химические свойства аренов. Объясните, почему для бензола более характерны реакции замещения. Объясните, почему в обычных условиях бензол устойчив к действию окислителей.
• В чем отличия в химических свойствах гомологов бензола от свойств самого бензола. Объясните, чем обусловлены эти отличия.
• Составьте формулы следующих веществ: бромбензол; 1,3 - диметилбензол; 1,3 - диметил 4 - хлорбензол; пропилбензол; 1,3 - динитробензол.
• Составьте уравнения реакций взаимодействия:
Бензола с хлором (в присутствии катализатора);
Бензола с водородом;
Метилбензола с водородом;
Метилбензола с хлором (при освещении);
Этилбензола с азотной кислотой
Бензола с хлорэтаном (в присутствии хлорида алюминия)
Этилбензола с хлорметаном (в присутствии хлорида алюминия).
8. Сколько изомерных гомологов бензола может отвечать формуле С9Н12? Напишите структурные формулы всех изомеров и назовите их.
Практическое занятие № 10
Составить и решить цепочку химических превращений
Цели:
• рассмотреть генетическую связь между типами углеводородов и классами органических соединений;
• обобщить и систематизировать знания учащихся об углеводородах и их производных на основе сравнительной характеристики их свойств;
• развивать логическое мышление, опираясь на химию углеводородов и их производных; формировать навык самообразования учащихся.
Ход урока
Органическая химия – наука о жизненно-важных веществах. Углеводороды имеют большое значение для современных отраслей промышленности, техники, повседневной жизни людей. Эти вещества, как в индивидуальном состоянии, так и в виде природных смесей (газ, нефть, уголь), служат сырьем для производства десятка тысяч более сложных органических соединений, несут в наши дома тепло и свет.
В нашей жизни органические вещества занимают очень большое место. На сегодняшний день их насчитывается более 20 миллионов. Без них из обихода исчезли бы многие привычные вещи: изделия из пластмасс и резины, средства бытовой химии, косметика. Каждый день синтезируются все новые и новые вещества. Знать все обо всем невозможно. Но можно понять основные закономерности, которые применяются в превращении органических веществ.
Большое значение имеют разработки наших русских ученых – Н.Д.Зелинского, В.В.Марковникова, Б.А.Казанского, М.Г.Кучерова.

1. Какие классы углеводородов вы знаете, называйте сразу с общей формулой?
Таблица «Классификация веществ»
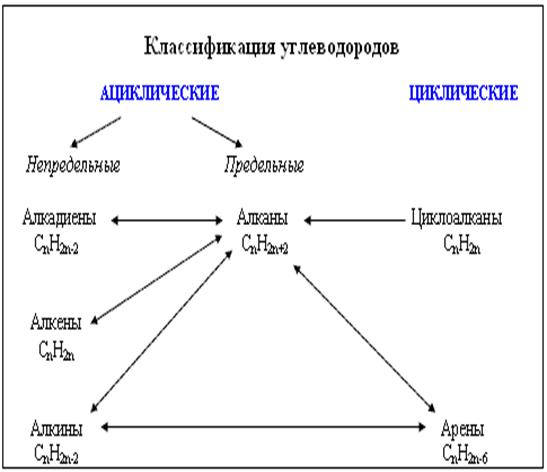
Ответить на вопросы:
1.Чем отличаются по составу углеводороды разных типов?
Ответ: Числом атомов водорода
2. Какие реакции следует провести, чтобы из одного типа
углеводородов получить другой?
Ответ: Реакции гидрирования или
дегидрирования. Так можно осуществить большинство переходов, однако, этот
способ получения углеводородов не является универсальным. Стрелками в
схеме указаны углеводороды, которые непосредственно можно превратить друг в
друга одной реакцией.
Выполнение: Схематически это выглядит так:
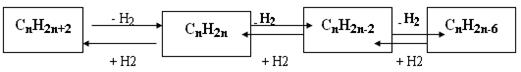
Задание 1: для закрепления изученного материала осуществите несколько цепочек превращения. Определите тип каждой реакции:
• Для иллюстрации сказанного предлагается осуществить несколько схем превращений
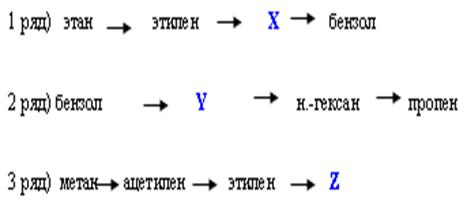
Ответ: 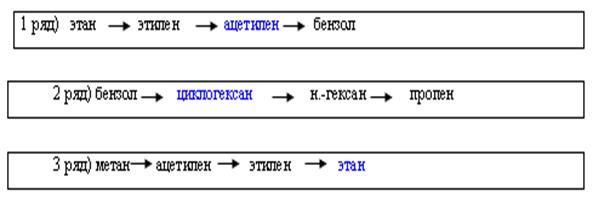
3. Составьте уравнения реакций к схемам:
метан ![]() этан
этан ![]() этен
этен ![]() этин
этин ![]() бензол
бензол ![]() хлорбензол
хлорбензол
бензол ![]() метилбензол
метилбензол ![]() 2,4,6 -
тринитротолуол
2,4,6 -
тринитротолуол
Лабораторная работа № 5
Получение галогенопроизводных и изучение их свойств
Цель работы: изучение способов получения и химических свойств галогенопроизводных углеводородов.
Реактивы и оборудование: 2н. NaOH; H2SO4 конц.; 0,2н. AgNO3; I2 в растворе KI; хлорбензол; этанол; NaCl(тв.); хлоральгидрат (крист).
штатив с пробирками; держатель для пробирок; предметные стекла; спиртовка, микроскоп.
Опыт 1 Получение хлорэтана из этанола
Насыпают в пробирку мелкие кристаллы хлорида натрия на высоту около 3 мм и добавляют 3-4 капли этилового спирта., чтобы вся соль была смочена спиртом. Затем добавляют 3-4 капли серной кислоты и нагревают над пламенем спиртовки не допуская слишком быстрого выделения хлористого водорода. Для контроля за ходом образования хлорэтана подносят отверстие пробирки к пламени спиртовки и поджигают (хлорэтан горит с образованием характерного колечка зеленого цвета). После первоначального нагревания, как только будет замечено хотя бы слабое зеленое колечко хлорэтана нагрев прекращают. Необходимо написать уравнения реакций.
Примечание. Не следует без нужды нагревать пробирку, так как при реакции выделяются значительное количество хлористого водорода. По этой причине не следует пытаться определить запах хлорэтана.
Опыт 2 Получение хлороформа из хлоральгидрата
В пробирку помещают 3-4 кристалла хлоральгидрата, добавляют 6-8 капель 2н. NaOH и слегка подогревают жидкость, помутневшую уже при комнатной температуре. Что при этом происходит? Следует обратить внимание на запах образующейся жидкости, сравнивая его с запахом хлороформа из склянки. Необходимо написать уравнения реакций.
Опыт 3 Получение иодоформа из этанола
В пробирку помещают 2 капли этанола, 3 капли раствора иода в иодистом калии и 3 капли 2н. NaOH. При слабом нагревании, (иногда даже от тепла рук) появляется белая муть с характерным очень стойким запахом иодоформа. При растворении мути надо к теплому раствору добавляют еще 3-5 капель раствора иода. Подождать 2-3 минуты до формирования кристаллов. Затем при помощи пипетки берут со дна пробирки 2 капли жидкости с кристаллами иодоформа, переносят их на предметное стекло под микроскоп и зарисовывают в журнале форму полученных кристаллов. Написать уравнения реакций.
Примечание. Нагревают смесь иода со спиртом и щелочью до кипения, но не кипятят , так как образующийся иодоформ будет разлагаться.
Практическое занятие № 11
Составить реакции нуклеофильного замещения
Цель: закрепить пройденный материал.
Реакции нуклеофильного замещения (sn) в алкилгалогенидах
В реакциях нуклеофильного замещения галогенопроизводные выполняют роль реагента, алкилирующего нуклеофильную частицу. В зависимости от того, несет ли нуклеофильная частица заряд или нет, схемы такого алкилирования могут выглядеть по-разному, например:
В первом случае при взаимодействии этилхлорида с водным раствором едкого натра (щелочном гидролизе этилхлорида) произошло этилирование гидроксид-аниона. Атом кислорода в нуклеофильной частице в процессе реакции выступил донором неподеленной пары электронов и потерял заряд. Во втором случае при взаимодействиитрет-бутилбромида с водой (нейтральный гидролиз) произошло алкилирование воды как нуклеофила. Теперь уже нейтральный атом кислорода выступил в качестве донора неподеленной пары электронов и приобрел положительный заряд.
Описанный выше гидролиз галогенопроизводных является одним из примеров многочисленных реакций нуклеофильного замещения. В результате гидролиза галогенопроизводных образуются спирты, а в результате реакций с другими нуклеофилами – большое число разнообразных функциональных производных углеводородов. Ниже приведены лишь некоторые другие примеры реакций нуклеофильного замещения:
• алкилирование алкоголятов – синтез простых эфиров по Вильямсону
бензилхлорид метилат натрия бензилметиловый эфир
• алкилирование карбоксилат-анионов (солей карбоновых кислот) – синтез сложных эфиров
аллилиодид ацетат калия аллилацетат
• замещение атома галогена на галоген (реакция Финкельштейна)
•
алкилирование аммиака или аминов
иодид метиламмония
анилин бромид изопропилфениламмония
• алкилирование нитрит-аниона – синтез нитросоединений
нитроэтан
• алкилирование цианид-аниона – синтез нитрилов карбоновых кислот
4-хлор-1-бутен нитрил 4-пентеновой кислоты
• алкилирование ацетиленидов
метилацетиленид натрия 2-гексин
Нуклеофильное замещение в алкилгалогенидах может происходить по двум альтернативным механизмам:
• с последовательными процессами разрыва связи углерод-галоген и образования новой связи с нуклеофилом (мономолекулярное нуклеофильное замещение, или SN1)
• с одновременным (синхронным) разрывом связи углерод-галоген и образованием новой связи с нуклеофилом (бимолекулярное нуклеофильное замещение, или SN2).
2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
Этот механизм представляет собой последовательность двух стадий, отличающихся константами скорости. На первой стадии субстрат медленно подвергается гетеролизу полярной связи углерод-галоген с образованием карбокатиона и галогенид-аниона.
На второй стадии образовавшийся карбокатион очень быстровзаимодействует с нуклеофилом с образованием ковалентной связи по донорно-акцепторному механизму: карбокатион предоставляет вакантную орбиталь, а нуклеофил – заполненную орбиталь.
Так как первая стадия протекает значительно медленнее, чем вторая, скорость реакции замещения определяется скоростью первой стадии, которая зависит только от концентрации галогенопроизводного как единственного участника этой стадии. Такой процесс нуклеофильного замещения являетсямономолекулярным, поэтому его обозначают SN1.
По механизму SN1 реагируют галогенопроизводные, которые при ионизации образуют устойчивыекарбокатионы. Поэтому среди насыщенных галогенопроизводных этот механизм характерен, прежде всего, для третичных галогенидов, поскольку третичные карбокатионы являются более устойчивыми, чем вторичные или первичные. Так, например, следующие карбокатионы можно расположить в ряд по убыванию их устойчивости:
Если атом галогена соединен с асимметрическим атомом углерода хиральной молекулы, то мономолекулярное нуклеофильное замещение приводит к рацемизации по данному асимметрическому атому, поскольку образующийся карбокатион как плоская в области заряженного атома углерода частица может присоединить нуклеофил с одинаковой вероятностью с обеих сторон от этой плоскости с образованием двух энантиомеров.
Например, при щелочном гидролизе (S)-2,3-диметил-3-хлорпентана образуется смесь равных количеств энантиомерных спиртов, т.е. рацемический спирт.
Кроме третичных галогенопроизводных, по механизму SN1 могут реагировать также аллил- и бензилгалогениды, которые образуют стабилизированные за счет сопряжения карбокатионы.
аллил-катион
бензил-катион
Поскольку на стадии, лимитирующей скорость реакции, образуются катион и анион, то для протекания реакции по механизму SN1 лучше всего подходят растворители, обладающие возможностью стабилизировать и катионы, и анионы. Такими свойствами обладают так называемые полярные протонные растворители, способные хорошо сольватировать катионы и образовывать водородные связи с анионами. К полярным протонным растворителям относятся, например, вода, муравьиная кислота, а также водно-спиртовые и водно-кислотные смеси.
Практическое занятие № 12
Написать уравнения реакций цепочек превращения галогенопроизводных.
Цепочки превращений
|
№1.С помощью каких реакций можно осуществить превращения по схеме: СН4 → СН3Br → С2Н6 → С2Н5Cl → С2Н5ОН → → СН3 СОН → СН3СООН → СН3СООС2Н5 Решение. 1. Для введения атома галогена в молекулу углеводорода можно воспользоваться реакцией радикального хлорирования: hv СН4 + Br2 → CH3Br + HBr 2. Один из вариантов, приводящих от галогенпроизводного к предельному углеводороду с большим числом углеродных атомов, реакция с металлическим натрием (реакия Вюрца) 2 CH3Br + 2 Na → H3C – CH3 + 2 NaBr свет 3. C2H6 + Br2 → CH3CH2Br + HBr 1. Для превращения галогенпроизводного в спирт необходимо заменить атом галогена в молекуле на гидроксильную группу, что можно сделать, осуществив реакцию нуклеофильного замещения (гидролиз в щелочной среде): С2Н5Cl + KOH → C2H5OH + KCl 5. Для того чтобы превратить спирт в альдегид (см. свойства спиртов или получение карбонильных соединений), нужно увеличить степень окисления атома углерода при функциональной группе, т.е. подействовать мягким (не разрушающих молекулу) окислителем: t C2H5OH + CuO → CH3 – CHO + Cu + H2O 6. Дальнейшее окисление (см. свойства карбонильных соединений или способы получения карбоновых кислот) приведет к преобразованию альдегидной группы в карбоксильную:
CH3 – CHO +2Cu(OН)2 → CH3 – COOH + Cu2O+2H2O 7. Реакции карбоновых кислот со спиртами приводят к образованию сложных эфиров: H+ CH3 – COOH + HO – CH2 – CH3 → CH3 – COO – CH2 – CH3 + H2O №2. С помощью каких реакций можно осуществить превращения по схеме: СН3СООNa→CH3 – CH3→CH2=CH2→ CH2Br– CH2Br → CH≡CH→KOOC – COOK Решение. 1. Для получения этана из ацетата натрия воспользуемся синтезом Кольбе: электролизом водного раствора соли карбоновой кислоты (см. способы получения алканов): эл-з 2. 2СН3СООNa + 2Н2О → CH3 – CH3+Н2O +2NaHCO3 2. Для превращения этана в этен осуществим реакцию дегидрирования: t,Ni CH3 – CH3 → CH2=CH2 + Н2 3. Для получения дигалогеналкана из алкена воспользуемся реакцией бромирования: CH2=CH2 +Br2→ CH2Br– CH2Br 4. Для получения этина из дибромэтана необходимо осуществить реакцию дегидрогалогенирования, для этого используют спиртовый раствор КОН: CH2Br– CH2Br +2 КОНспирт. р-р→ CH≡CH +2 КВr +2Н2О 5. Этин обесцвечивает водный раствор KMnO4: 3CH≡CH +8KMnO4→3KOOC – COOK +8MnO2 +2КОН +2Н2О Введение в молекулу четырех атомов кислорода соответствует потере 8 электронов, поэтому перед MnO2 cтавим коэффициент 8. Mn меняет степень окисления от +7 до +4, что соответствует приобретению 3- х электронов, поэтому перед органическим веществом ставим коэффициент 3. Обратите внимание на уравнения реакций 1 и 5: синтез Кольбе и окисление алкинов водным раствором перманганата калия. Примечание: В кислой среде перманганат-ион восстанавливается до Mn2+, а этин окисляется до щавелевой кислоты: 5CH≡CH +8KMnO4 +12H2SO4 →5HOOC – COOH +8MnSO4 +4К2SO4 +12Н2О |
Практическое занятие № 13
Составить схемы синтезов и решить расчетные задачи.
Напишите формулы всех изомеров С3H7I и C4H9Cl. Назовите их по номенклатуре IUPAC и по радикально-функциональной номенклатуре.
2. Назовите следующие галогенопроизводные по заместительной номенклатуре, укажите какие из них относятся к первичным, вторичным, третичным алкилгалогенидам:
3. Написать схемы синтеза 1-бромбутана, 2-бромбутана и 1,2-дибромбутана из бутена-1.
4. Получите 2-бромбутан из соответствующих: спирта, алкена, акана, алкина.
5. Получить хлористый изобутил тремя способами. Написать для него реакции со следующими реагентами: NaCN; NH2CH3; NaOH (H2O); Mg (абс. эфир), затем ацетон; NaOH (спирт). Привести механизм реакции гидролиза.
6. Написать схему последовательных превращений: пропанол + SOCl2 ® A + Mg (абс. эфир)® Б + вода ® В
7. Как влияет природа галогена на реакционную способность алкилгалогенидов. Что такое тефлон, на каких особенностях строения основано его применение?
8. Из каких, алкилиодидов с наилучшим выходом можно получить 2-метилбутен-2,
пентен-1, дивинил? Приведите уравнения реакций.
9. Напишите схемы промышленного получения дихлорметана, хлороформа, четырёххлористого углерода, йодоформа, хлоропрена. Где используются эти вещества?
10. Какими качественными реакциями можно различить: 1) хлористый бензил и хлористый аллил; 2) бромбензол и бензилбромид; 3) 1-хлоргексан и н-гексан?
Лабораторная работа № 6
Исследование физических и химических свойств одноатомных и многоатомных спиртов.
Цель:
1. Изучить свойства спиртов в
зависимости от их состава, качественную реакцию на
многоатомные спирты.
2. Развивать умения составлять
уравнения реакций, сравнивать, анализировать.
Реактивы и оборудование: этиловый спирт, бутиловый,
амиловый спирты, глицерин,
натрий, фенолфталеин, вода, 10% - ный раствор гидроксида натрия, 1 -2% раствор сульфата меди, штатив с пробирками.
Подготовка к работе
Контрольные вопросы
• Какие вещества называются спиртами?
• Чем определяется атомность спиртов? Приведите формулы этилового, бутилового, амилового спиртов и глицерина.
• Как изменяются физические свойства гомологов одноатомных спиртов с увеличением их состава?
• Назовите важнейшие свойства спиртов.
Опыт 1. Растворимость спиртов в воде, горение спиртов
Реактивы и оборудование: спирты (этиловый, пропиловый, бутиловый, амиловый или изоамиловый); фарфоровые чашки, лучинки, пробирки.
Ход выполнения работы:
А. В четыре пробирки наливают по 2 мл воды и в каждую добавляют по 0,5 мл этилового, пропилового, бутилового, амилового (или изоамилового) спиртов соответственно. Пробирки хорошо встряхивают. Отмечают, что этиловый и пропиловый спирты прекрасно растворяются в воде, бутиловый спирт растворяется плохо, а при растворении амилового спирта образуется эмульсия, которая быстро расслаивается. При этом амиловый (изоамиловый) спирт, подобно маслу, всплывает на поверхность воды. Отсюда и возникло название «сивушное масло», под которым понимают смесь высокомолекулярных одноатомных спиртов, в том числе и изоамилового. Высшие спирты могут образовываться при спиртовом брожении, поэтому при разбавлении водой плохо очищенного от сивушного масла этилового спирта происходит помутнение раствора.
Объясните, почему выше перечаленные спирты по-разному растворяются в воде.
Б. В три фарфоровые чашки наливают по 1 мл этилового, бутилового и амилового спиртов. Спирты поджигают лучиной и наблюдают характер горения. Высокомолекулярные спирты горят более коптящим и ярким пламенем.
Напишите уравнения реакций горения указанных спиртов и рассчитайте в них содержание углерода (в масс. %).
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 2. Обнаружение воды в спирте и обезвоживание спирта
Реактивы и оборудование: этиловый спирт (ректификат), сульфат меди CuSO45Н2О (в порошке); пробирки, пипетки.
Ход выполнения работы:
В фарфоровой чашке или тигле нагревают на пламени горелки 1,5–2 г CuSO45Н2О, перемешивая соль медной проволочкой, до полного исчезновения голубой окраски соли и прекращения выделения паров воды. Дают остыть полученному белому порошку, пересыпают его в сухую пробирку и добавляют 2–3 мл этилового спирта. При встряхивании и слабом нагревании содержимого пробирки белый порошок быстро окрашивается в голубой цвет.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 3. Образование и гидролиз алкоголята
Реактивы и оборудование: этиловый спирт (обезвоженный, из опыта 1), натрий металлический; пробирки, скальпель, пинцет, фильтровальная бумага, проволока, лучины.
Ход выполнения работы:
Полученный в опыте 1 обезвоженный этиловый спирт осторожно сливают с осадка в сухую пробирку и погружают в него кусочек чистого (свежеотрезанного, очищенного и отжатого от керосина) металлического натрия размером с горошину. Охлаждая пробирку в стакане с водой, предотвращают разогревание смеси и выкипание спирта. Когда газ станет выделяться спокойно, подносят к отверстию пробирки горящую лучину. Выделяющийся водород образует с воздухом смесь, вспыхивающую с характерным резким звуком.
Жидкость постепенно густеет, натрий покрывается слоем твердого алкоголята, и реакция замедляется настолько, что для её ускорения требуется слегка нагревать пробирку. Если выделение водорода почти прекратится, а натрий полностью не растворится, подогревают смесь до разжижения, удаляют из него оставшийся кусочек натрия при помощи изогнутой проволочки и помещают его в банку для остатков натрия.
2ROH + 2Na 2RONa + H2
Полученный концентрированный раствор алкоголята при охлаждении закристаллизовывается.
Добавляют в ту же пробирку 5–6 мл воды и испытывают фенолфталеином реакцию полученного раствора.
RONa + H2O ROH + NaOH
Опыт 4. Качественные реакции на спирты
Реактивы и оборудование: спирты (этиловый, изопропиловый, третичный бутиловый, бензиловый, аллиловый), реактив Лукаса (16 г безводного хлорида цинка в 10 мл концентрированной соляной кислоты), реактив Дениже (5 г оксида ртути (II) в 100 мл воды и 20 мл концентрированной серной кислоты); стаканы на 100/150 мл, пипетки, пробирки.
Ход выполнения работы:
А. Проба Лукаса (обнаружение первичного, вторичного и третичного спиртов). В сухой пробирке к 0,5 мл реактива Лукаса прибавьте 3–4 капли исследуемого спирта, энергично встряхните и оставьте в стакане с водой при 30°С на 1–2 мин. В пробирке с первичным спиртом раствор остаётся прозрачным, в пробирке с вторичным спиртом происходит помутнение жидкости, а если спирт третичный — на дне образуется масляный слой алкилгалогенида (различная подвижность гидроксигруппы в спиртах). Сделайте выводы.
Примечание. Различить третичные и вторичные спирты можно пробой с концентрированной соляной кислотой без хлорида цинка. В этих условиях третичные спирты реагируют в течение 3–5 минут, вторичные не реагируют.
Б. Проба Дениже (обнаружение третичных спиртов). 3 мл реактива Дениже кипятят в течение 1–3 мин. с 1 мл исследуемого вещества. Третичные спирты образуют осадок жёлтого или красного цвета, в то время как первичные или вторичные спирты если и образуют осадок, то белого цвета.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 5. Окисление этилового спирта
Реактивы и оборудование: этиловый спирт, бихромат калия (5%-ный водный раствор), перманганат калия (2н водный раствор), разбавленная и концентрированная серная кислота; пробирки.
Ход выполнения работы:
А. Окисление хромовой смесью. Смешивают в пробирке 2 мл раствора бихромата калия, 1 мл разбавленной серной кислоты и 0,5 мл этилового спирта и осторожно нагревают смесь. Течение реакции окисления обнаруживается по изменению окраски раствора, а образование ацетальдегида — по его характерному запаху.
В. Окисление перманганатом калия. Поместите в пробирку 2 капли этилового спирта, 2 капли раствора перманганата калия и 3 капли концентрированной серной кислоты. Слегка нагрейте пробирку слабым пламенем горелки. Начинается обесцвечивание розового раствора, и выпадают бурые хлопья оксида марганца (IV). При избытке серной кислоты образуется бесцветный раствор. Ощущается запах уксусного альдегида. Напишите уравнение реакции.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 6. Комплексообразование многоатомных спиртов
Реактивы и оборудование: глицерин, этиловый спирт, этиленгликоль, сульфат меди (3%-ный водный раствор), гидроксид натрия (2н водный раствор), соляная кислота (разбавленная 1:5); пипетки, пробирки.
Ход выполнения работы:
Поместите в пробирку 3 капли раствора сульфата меди, 3 капли раствора щёлочи и взболтайте. Появляется голубой студенистый осадок гидроксида меда (II), который при нагревании до кипения разлагается, выделяя черный осадок оксида меди (II).
Повторите опыт, но перед кипячением гидроксида меди (П) добавьте в пробирку 2–3 капли многоатомного спирта. При взбалтывании осадок растворяется и появляется тёмно-синее окрашивание образовавшегося глицерата меди.
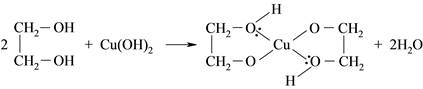
При кипячении глицерат меди не разлагается и окраска не изменяется. Гликоляты устойчивы в щелочной среде, но разлагаются на исходные соединения (соли меди и гликоли) в кислой среде.
Результаты наблюдений заносят в тетрадь для лабораторных работ.
Контрольные вопросы
1. Какие органические соединения называются спиртами?
2. По названию спиртов составьте их структурные формулы:
а) 2,3-диметил-1-бутанол;
б) трет-бутилкарбинол;
в) 2-метил-1,3-пропандиол;
г) 2,2-диметил-3-этил-3-гексанол.
3. Напишите структурные формулы двух изомеров и двух гомологов 2,3-
диметилбутанола-1. Назовите их.
4. Почему среди предельных одноатомных спиртов нет газов?
5. Почему растворимость предельных одноатомных спиртов с увеличением
молекулярной массы уменьшается?
6. Как можно превратить углеводород в метанол и метанол в этанол? На-
пишите уравнения реакций.
7. Как из оксида кальция и других неорганических реагентов синтезиро-
вать этанол?
8. Из метана, используя реакции Кучерова и Вюрца, получите 2-пентанол.
9. Составьте уравнения реакций, с помощью которых можно осуществить
цепочку превращений. При необходимости укажите условия протекания
реакций.
Пропанол-1 пропен пропанол-2 пропанон-2.
Лабораторная работа № 7
Исследование свойств фенолов
Цель:
1. Изучить свойства фенола на
основе строения молекулы и взаимного влияния
функциональной группы атомов друг на друга.
2. Развивать умения сравнивать, составлять уравнения реакций,
анализировать.
Реактивы и оборудование: фенол, вода, гидроксид
натрия, 10% - ный раствор серной
кислоты, бромная вода, хлорид железа (III), штатив с пробирками, спиртовка, спички.
Подготовка к работе
Контрольные вопросы
• Какие вещества относятся к фенолам, а какие - к ароматическим спиртам?
• Изобразите структурные формулы представителей, принадлежащих: а) к фенолам; б) к ароматическим спиртам.
• Составьте электронную формулу фенола и объясните, почему атом водорода в гидроксильной группе более подвижен, чем в молекулах одноатомных спиртов.
•
В результате каких опытов можно убедиться, что в молекуле фенола
функциональные группы атомов взаимно влияют друг на друга?
Требования техники безопасности.
Фенол (карболовая кислота) – токсичное вещество. При попадании
через рот или кожу происходит быстрое всасывание. Смертельная доза при
приеме внутрь – 2 г. При попадании на кожу вызывает жжение и ожоги.
Выполнение данной лабораторной работы требует особой осторожности.
Работа проводится в вытяжном шкафу. Категорически запрещается брать
вещества руками, нюхать склянки с реактивами.
Реактивы и посуда. Водный раствор фенола, раствор серной кисло-
ты, раствор хлорида железа (III), раствор карбоната натрия, раствор пер-
манганата калия, бромная вода, штатив с пробирками.
Опыт 1. Растворимость фенола в воде
Поместите в пробирку 1 мл жидкого фенола, добавьте 1 мл воды и
взболтайте. Получится мутная жидкость – эмульсия фенола, которая труд-
но растворяется в воде. При стоянии такая эмульсия постепенно расслаи-
вается, причем внизу будет раствор воды в феноле или жидкий фенол, а
вверху – раствор фенола в воде. Прибавляя по каплям воду, каждый раз 17
встряхивайте пробирку, пока не получится прозрачный раствор фенола в
воде. Помните о токсичности фенола.
Результаты
наблюдений заносят в тетрадь для лабораторных работ
Опыт 2. Образование трибромфенола
Поместите в пробирку 1 мл бромной воды и добавьте 0,5 мл прозрач-
ного раствора фенола в воде. Немедленно произойдет обесцвечивание
бромной воды и выделение белого осадка трибромфенола.
Эта реакция используется как качественная на фенол.
Результаты
наблюдений заносят в тетрадь для лабораторных работ
Опыт 3. Цветные реакции на фенолы
В пробирку поместите 1 мл прозрачной фенольной воды, полученной
в предыдущем опыте, и добавьте 0,5 мл 0,1 н. раствор хлорида железа(III),
появится фиолетовое окрашивание. Это характерная реакция на фенолы,
так как все фенолы дают с хлоридом железа(III) различно окрашенные
комплексы.
Еще более чувствительной реакцией на фенол является цветная ин-
дофеноловая проба.
В пробирку поместите 1 мл прозрачной фенольной воды, добавьте к
ней 1,5 мл 2 н. гидроксида аммония и затем 1,5 мл насыщенного раствора
бромной воды. Через несколько секунд появится постепенно усиливаю-
щееся синее окрашивание. Это окрашивание обусловлено образованием
красящего вещества – индофенола.
Результаты
наблюдений заносят в тетрадь для лабораторных работ
Контрольные вопросы
1. По названиям веществ составьте их структурные формулы:
а) 4-метил-2-фенилфенол;
б) 3-винил-5-этилфенол;
в) 2-изобутил-5-нитрофенол.
2. Почему одноатомный спирт – этанол – летучая жидкость, а одноатом-
ный фенол – твердое вещество?
3. Из углерода через бензол, используя реакцию Вюрца – Фиттига, получи-
те гомолог бензола и далее гомолог фенола.
4. Из метана, через ацетилен, получите бензол, а далее фенол, с которым
приведите реакции, протекающие по типу присоединения.
5. Напишите схемы синтеза из бензола соединений:
а) м-бромфенола;
б) 2,4,6-тринитрофенола.
6. Приведите уравнения двух качественных реакций на фенол.
7. Почему при галогенировании фенола сразу легко получается трибром-
фенол, а из бензола – только монопроизводное?
Практическое занятие № 14
Составить цепочки превращений спиртов, закрепление знаний номенклатуры, способов получения спиртов
Цель:
• Закрепить знания о способах получения спиртов.
• Уметь устанавливать структурные формулы исходных спиртов по продуктам реакций.
Способы получения предельных одноатомных спиртов
Спирты могут быть получены синтетическими способами:
1) каталитической гидратацией алкенов
2) гидролизом галогенопроизводных алканов
3) взаимодействием галогенопроизводных алканов с водным раствором щелочи
4) восстановлением альдегидов или кетонов
Особенности химических свойств предельных одноатомных спиртов
Свойства спиртов определяются их функциональной группой.
Все свойства предельных одноатомных спиртов можно подразделить на 4 группы:
1) реакции замещения водорода в гидроксильной группе
2) реакции замещения гидроксильной группы
3) реакции окисления
4) реакции отщепления
1. К реакциям замещения водорода в –ОН группе относятся:
а) взаимодействие со щелочными металлами, так как спирты проявляют слабо-кислые свойства.
Пример:
Алкоголят натрия
б) взаимодействие с органическими и неорганическими кислотами при нагревании – реакция этерификации
2. К реакциям замещения гидроксильной группы относятся:
а) взаимодействие с галогеноводородами
б) взаимодействие с галогенидами фосфора (например, с пентахлоридом фосфора).
3. Реакции окисления
4. К реакциям отщепления относятся:
а) каталитическое дегидрирование – отщепление водорода.
Первичные спирты дают альдегиды, вторичные спирты – кетоны.
б) дегидратация – отщепление воды.
В присутствии водоотнимающих средств (катализаторов H2SO4, H3PO4 и др.) происходит внутримолекулярная дегидратация, идущая с образованием алкена.
![]()
В более жестких условиях спирты претерпевают межмолекулярный процесс дегидратации, идущий с образованием простого эфира.
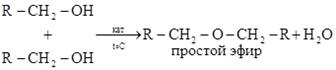
• Приведите схему получения карбонильных соединений по реакции Кучерова из следующих
веществ: I) ацетилена, 2) этилацетилена, 3) диметилацетилена.
• Приведите схему получения пропионового альдегида:
1) из соответствующего спирта; 2) из дигалогенпроизводного.
• Напишите структурную формулу вещества состава C5II10O, если известно, что оно реагирует с гидроксиламином и бисульфитом натрия, и дает реакцию серебряного зеркала, окислясь при этом в изовалериановую кислоту.
• Определите строение кетона общей формулы С5Н120, который при окислении дает уксусную, пропионовую и масляную кислоты.
Самостоятельно
I вариант
1) Дегидрированием, каких спиртов можно получить:
а) 3-метил-бутаналь; б) З-метил-бутанон-2.
2) Напишите структурные формулы изомеров состава
С4Н80
Назовите их по рациональной и систематической номенклатурой.
II вариант
• Какие карбонильные соединения можно получить при каталитической гидратации а) метилпропилацетилена, б) диэтилацетилена.
• Напишите структурные формулы изомерных кетонов состава С6Н|гО. Назовите их по рациональной и международной номенклатуре.
Практическое занятие № 15
Составить схему синтеза и решить расчётные задачи
Цель: закрепить пройденный материал.
1. ацетат калия → этан → X → этанол → диэтиловый эфир
2.CaC2→ этин → этаналь![]() X1
X1![]() X2
X2![]() X3
X3
3.Al4C3![]() X1
X1![]() X2
X2![]() этаналь
этаналь ![]() X3
X3![]() X1
X1
4. CaC2→этин→этаналь![]() X1
X1![]() X2
X2![]() X3
X3
5. CaC2 ![]() X1
X1 ![]() X2→ H3C–COOH
X2→ H3C–COOH ![]() X3→ (CH3)2–C=O
X3→ (CH3)2–C=O
6. HC![]() CH
CH![]() X1
X1![]() CH3COOH
CH3COOH![]() X2
X2![]() X3
X3![]() уксусная кислота
уксусная кислота
7.Метилат калия![]() → бромметан
→ бромметан![]() Х2
Х2![]() Х3
Х3![]() этанальХ4
этанальХ4
8. Ацетальдегид → ацетат калия → этановая кислота → этилацетат → ацетат кальция → ацетон
9. CH3CHO ![]() Х1
Х1![]() Х2→ этилен → CH3CHO
Х2→ этилен → CH3CHO ![]() X3
X3
10. CH3COOH→ X1![]() С2H6
С2H6 ![]() X2
X2![]() X3
X3![]() X4
X4
11. C2H5OH![]() X1
X1![]() X2
X2![]() X3
X3![]() этин
этин ![]() C2H4O
C2H4O
12. CH2BrCH2CH2Br![]() X1
X1![]() X2→ пропен
X2→ пропен![]() X3→ 1,2- дибромпропан
X3→ 1,2- дибромпропан
13. CH4![]() X1→ C6H6
X1→ C6H6![]() X2
X2![]() X3
X3![]() X4
X4
14. карбид алюминия ![]() Х1
Х1![]() Х2
Х2![]() бензол
бензол ![]() X3
X3![]() X4
X4
15. 1-хлорпропан ![]() Х1
Х1![]() X2
X2![]() X3
X3![]() X2→ изопропилбензол
X2→ изопропилбензол
16. этен![]() X1
X1![]() X2
X2![]() X3→толуол
X3→толуол![]() X4
X4
17. C2H4→ C2H4Cl2![]() X1
X1![]() X2
X2![]() X3
X3![]() C6H5CООН
C6H5CООН
18. CH3CH2CH2OH→ X1![]() C6H14
C6H14![]() X2
X2![]() C6H5СН3→ C6H5CООН
C6H5СН3→ C6H5CООН
19. С2Н2![]() Х1→ C6H5С2Н5
Х1→ C6H5С2Н5![]() X2
X2![]() X3
X3![]() X4
X4
20. ацетилен![]() бензол
бензол![]() этилбензол
этилбензол ![]() X1
X1![]() X2
X2![]() полистирол
полистирол
21. C6H6→C6H5CH3→ C6H5CООН→ C6H5CООCH3→CH3OH→(CH3)2O (укажите условия проведения реакций).
22.
![]()
23. C2H2→X1→X2→C6H5CH3→NO2–C6H4–CH3 ![]() X3
X3
24. CH3-CH2-CH(CH3)-CH3![]() X1
X1![]() X2
X2![]() X1
X1![]() X3CO2
X3CO2
25. CH4→ HCHO![]() X1
X1![]() X2
X2![]() X1
X1![]() X3
X3
26. пропилацетат![]() X1→ CH4
X1→ CH4![]() X2
X2![]() винилацетат
винилацетат![]() X3
X3
27. CH3-CH2-CHO ![]() X1
X1![]() X2
X2![]() X3
X3![]() X4
X4![]() X5
X5
28. Ацетат калия ![]() X1
X1 ![]() X2
X2 ![]() X3
X3 ![]() X4
X4 ![]() X5
X5
29. этанол ![]() Х1
Х1![]() Х2
Х2![]() Ag2C2
Ag2C2![]() X2
X2![]() X3
X3
30. C6H6→C6H5-CH(CH3)2![]() X1
X1![]() X2
X2![]() X3
X3![]() X4
X4
Лабораторная работа № 8
Исследование альдегидов и кетонов
Цель:
• Научить студентов получению альдегида в лаборатории и изучить свойства альдегидов на примере метаналя или формалина.
• Развивать умения составлять уравнения реакций, характеризующие свойства альдегидов, сравнивать, анализировать.
Реактивы и оборудование: этиловый спирт, медная проволока, аммиачный раствор оксида серебра, растворы сульфата меди и гидроксида натрия, штатив с пробирками, спиртовка, держатель для пробирок, водяная баня, формалин.
Подготовка к работе
Контрольные вопросы:
• Какие соединения относятся к альдегидам? Приведите их общую формулу.
• Изобразите структурные формулы первых трёх членов гомологического ряда альдегидов и дайте им название по рациональной и систематической номенклатуре.
• Какие химические реакции характерны для альдегидов?
Выполнение работы
Опыт 1. Окисление спирта в альдегид.
В пробирку налейте 0,5 - 1 мл. этилового спирта и погрузите в него раскаленную в пламене спиртовки спираль из медной проволоки. Опыт повторите несколько раз и запишите наблюдения.
Напишите уравнения реакций:
А) прокаливание меди;
Б) окисление этилового спирта оксидом меди (2) ( в структурной форме ). Назовите полученные вещества.
Опыт 2. Окисление метаналя аммиачным раствором оксида серебра.
В чистую пробирку поместить 6 капель аммиачного раствора оксида серебра, прибавьте 2-3 капли раствора формалина. Взболтайте и осторожно нагрейте смесь в стакане с кипящей водой. Что наблюдаете? Напишите уравнения реакций.
Опыт 3. Окисление метаналя гидроксидом меди (2 ).
В пробирку налейте 4 капли раствора гидроксида натрия и 2 капли раствора сульфата меди. К выпавшему осадку прибавьте 3-4 капли формалина, взболтайте и смесь нагрейте на водяной бане. Запишите наблюдения и уравнения реакций.
Результаты наблюдений заносят в тетрадь для лабораторных работ.
Задания для самостоятельных выводов
1. Какие вещества образуются при действии этанола на медную проволочку?
• Что образуется при окислении альдегидов? Как можно отличить альдегиды от других органических веществ?
• Почему при взаимодействии альдегидов с гидроксидом меди (2 ) появляется желтый, а потом красный осадок?
Упражнения
• Осуществить превращения
сн4 н - с:°-> снзон ^снзС1^с2Нб^С2Н5он->снз - с;'°
Напишите уравнения реакций.
• При окислении формальдегида выделилось 2,7 г. серебра. Вычислите массу образовавшейся при этом муравьиной кислоты.
Контрольные вопросы
1. Какие органические соединения называются альдегидами и кетонами?
2. Составьте формулу метилизопропилуксусного альдегида.
3. Выведите формулы всех изомерных альдегидов и кетонов состава
С4Н8О. Назовите их.
4. Составьте структурные формулы альдегидов и кетонов по их названиям:
а) диэтилкетон; б) 3,3-диметил-5-гексаналь; в) 2-метил-2-бутаналь;
г) 2,2,6-триметил-4-гептанон.
5. Основываясь на строении функциональной группы, поясните, почему
для альдегидов и кетонов характерны реакции присоединения?
6. Как определить, в какой из пробирок находится этилбутилкетон и мета-
наль. Напишите уравнения реакций.
7. Напишите уравнения реакций гидратации следующих соединений:
а) диметилацетилена; б) метилацетилена; в) 1-бутина.
Назовите полученные соединения.
8. Напишите уравнение реакции гидрирования 2,2-диметилбутанола.
9. Синтезируйте 3-гексанон, исходя из этена. Напишите уравнения реак-
ций.
Практическое занятие № 16
Составить структурные формулы изомеров гомологического ряда альдегидов .
Цель занятия:
сформировать знание о строении, номенклатуре, изомерии, методы добывания и химические свойства альдегидов и кетонов.
1. Напишите структурные формулы всех изомерных альдегидов и кетонов состава С4Н8ОБ и назовите их по систематической, заместительной и рациональной номенклатуре.
2. Напишите структурные формулы таких соединений: а) уксусный альдегид; б) изомасляний альдегид; в) пропанон; г) изопропилпропилкетон; д) 2-метоксибутаналь; е) 3, метоксиоктандион-2,6; есть) ацетил-ацетон; же) янтарный альдегид; з) метилбутеналь-2.
Практическое занятие № 17
Составить структурные формулы изомеров альдегидов и кетонов по продуктам реакций.
Цель урока:
1. Охарактеризовать состав, строение, классификацию, физические и химические свойства, получение и применение альдегидов.
2. Устанавливать взаимосвязь между изученными классами органических соединений. Знать качественные реакции на альдегиды.
Химические свойства альдегидов:
1. Реакции присоединения:
А) реакция гидрирования
Б) реакция присоединения NaHSO3
2. Реакции окисления:
А) реакция серебряного зеркала
Б) реакция светофор
3. Реакция поликонденсации
4. Реакция полимеризации
Качественная реакция на карбоксильную группу - реакция окисления альдегидов гидроксидом меди (ІІ) - светофор.
НСОН + 2Cu(OH)2 = HCOOH +Cu2O +2H2O
“Реакция серебряного зеркала”
Вы можете представить себе жизнь без зеркала? Проснуться утром – и не увидеть своего отражения? Кажется, ерунда, мелочь. А ведь какой душевный дискомфорт! Недаром сказочных персонажей в качестве наказания лишали отражения. Что такое зеркало? В чем его сила? Откуда оно появилось? Как его изготавливают?
Как мы уже знаем, первыми настоящими зеркалами служили отполированные до блеска металлические пластинки из меди, золота, серебра. Однако такие зеркала имели большой недостаток – на воздухе быстро темнели и тускнели. Какой же выход нашли из этой ситуации? Многочисленные опыты показали, что блестящий металлический слой можно нанести и на стекло. Так, в I в. н.э. начали изготавливать стеклянные зеркала – стеклянные пластинки, соединенные со свинцовыми или оловянными пластинами. Делалось это так: мыли спиртом стекло, очищали его тальком и затем к поверхности плотно прижимали оловянный лист. Сверху наливали ртуть и, дав ей постоять, сливали избыток. Образовавшийся слой амальгамы заклеивали или закрашивали. Такие зеркала оказались намного долговечнее металлических, поэтому ремесленные мастерские перешли на выпуск стеклянных зеркал, отражающая поверхность которых была сделана из амальгамы олова (раствор олова Sn в ртути Hg). Но, поскольку пары ртути очень ядовиты, производство ртутных зеркал было весьма вредным, да и сами зеркала содержали ртуть. Было опасно держать ртутные зеркала в жилых помещениях.
Поэтому ученые продолжали искать замену для ртути. Ее нашли французский химик Франсуа Птижан и великий немецкий ученый Юстус Либих. Либих предложил изготавливать стеклянные зеркала с серебряным покрытием. Разработанный им метод состоял из следующих операций. Сначала к водному раствору нитрата серебра AgNO3 добавляли водный раствор гидроксида калия KОН, что приводило к осаждению черно-коричневого осадка оксида серебра Ag2O.
2AgNO3 + 2KOH = Ag2O + 2KNO3 + H2O.
Осадок отфильтровывали и перемешивали с водным раствором аммиака NH3.
Ag2O + 4NH3 + H2O = 2[Ag (NH3)2] (OH).)
Оксид серебра растворялся в аммиачной воде с образованием комплексного соединения (аммиаката, или аммина) – гидроксида диамминсеребра(I). Затем в полученный прозрачный раствор погружали лист стекла, одна из поверхностей которого была тщательно обезжирена, и добавляли формальдегид НСНО.
2[Ag (NH3)2](OH) + HCHO = 2Ag + HCOONH4 + 3NH3 + H2O.)
Формальдегид восстанавливал серебро, которое осаждалось на очищенной поверхности стекла, покрывая его блестящим зеркальным налетом.
Задачи для самостоятельного решения:
1. Какие карбонильные соединения получатся при окислении а) изопропанола, б) 2,4-диметилпентанола-1, в) тетраметиленгликоля, г) 2,4-пентадиола.
2. Из соответствующих дигалогенпроизводных получите: а) 4,4-диметилпентаналь, б) метилбутанон.
3. Предложите схему превращения бутаналя в бутанон.
4. Напишите реакции альдольной и кротоновой конденсации для следую
щих альдегидов: а) метилпропаналя, б) 2 -метилбутаналя
Способ получения ацетона:
В пробирку поместили чуть-чуть порошка ацетата натрия и закрыли пробкой с газоотводной трубкой. Пробирку укрепили на штативе. Конец газоотводной трубки опустили в пробирку с водой. Пробирку с ацетатом натрия нагрели. Наблюдаем выделение пузырьков газа в пробирке с водой и чувствуется специфический запах ацетона. После прекращения реакции в первую пробирку добавляем одну каплю концентрированной соляной кислоты. Наблюдаем выделение пузырьков углекислого газа.
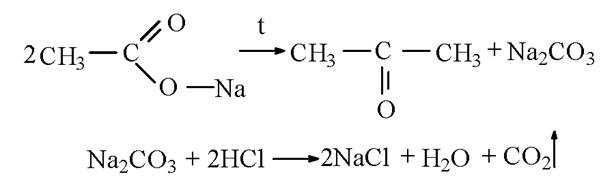
Методы получения кетонов
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:
2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:
3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:
Химическое поведение кетонов определяется четырьмя факторами. Во-первых, положительный заряд карбонильного углерода обусловливает его восприимчивость к нуклеофильной атаке. При этом основность карбонильного кислородного атома создает возможность дополнительного увеличения положительного заряда на карбонильном углероде за счет протонирования первого кислотами
Благодаря этому карбонильный углерод может успешно атаковаться даже слабыми нуклеофилами. Подобная активация молекул карбонильных соединений реализуется в кислотном катализе реакций нуклеофильного присоединения по карбонильной группе.
Во-вторых, слабость p -связи в карбонильной группе обусловливает стехиометрический результат нуклеофильных реакций этих соединений: уходящей группой при нуклеофильной атаке является карбонильный атом кислорода, который сохраняет свою s -связь с карбонильным углеродным атомом.
В-третьих, электроноакцепторный характер карбонильной группы за счет –I и –M–эффектов обусловливает кислотность водородных атомов при соседних с ней углеродных атомов, что проявляется в способности последних отщеплять протон под действием сильных оснований
Можно видеть, что обоснованием кислотности водородных атомов при a -углеродном атоме является стабилизация образующегося карбаниона за счет –I и –М–эффектов карбонильной группы.
Подвижность атомов водорода при a –углеродном атоме является предпосылкой для замещения этих атомов другими заместителями или группами, что находит свое выражение в реакциях a –галогенирования и конденсации.
В-четвертых, промежуточная степень окисления карбонильных групп +2 в кетонах) обусловливает их способность к реакциям окисления и восстановления.
Химические свойства кетонов
1. Получение оксима ацетона
Реактивы: ацетон, гидроксиламин солянокислый, карбонат натрия (безводный в порошке). В широкую пробирку наливают 7 мл воды и растворяют в ней 2 г солянокислого гидроксиламина и 1,5 г безводной соды, при этом выде- ляется оксид углерода (IV). Полученный раствор хорошо охлаждают (лучше в ледяной воде) и при встряхивании добавляют к нему 1,5 мл ацетона. Наблюдается разогревание и новое обильное выделение пу- зырьков оксида углерода (IV). Одновременно из раствора выделяются мелкие белые кристаллы оксима ацетона, имеющие слабый своеобраз- ный запах. При сильном охлаждении реакционной смеси растворимость оксима снижается и выход его увеличивается.
2. Иодоформная проба (проба Либена) на карбонильные соединения
[NH3OH]+ Cl- + Na2CO3 2 NH2OH + 2 NaCl + H2O + CO2 (CH3)2C=O + NH2OH (CH3)2C=N-OH + H2O Реактивы: ацетон, йод (кристаллический или в растворе), 10 %-й раствор едкого натра. К 1–2 мл разбавленного водного раствора исследуемого веще- ства добавляют до исчезновения окраски немного растертого в поро- шок йода или 1 мл раствора йода и затем несколько капель раствора 21 щелочи. Немедленно и без нагревания образуется желтый осадок йо- доформа с характерным запахом. CHI3 + CH3COONa NaOH I3C-CO-CH3 –
3. Открытие ацетона пробой Легаля
Реактивы: ацетон, 10 %-й раствор нитропруссида натрия (свежеприготовленный), 10 %-й раствор гидроксида натрия, уксусная кислота.
К 1 мл воды прибавляют 5–6 капель свежеприготовленного 10 %-го раствора нитропруссида натрия, 2–3 капли ацетона и 3–4 кап- ли 1 %-го раствора гидроксида натрия. Появляется темно-красное окрашивание, переходящее в оранжевое. При добавлении по каплям ледяной уксусной кислоты раствор
Практическое занятие № 18
Установить структурные формулы альдегидов и кетонов по продуктам реакции
Цель: закрепление полученных теоретических знаний о строении органических соединений: алкадиенов и кетонов, и развитие практических навыков составления структурных формул органических соединений и умения давать им названия.
Планируемый результат обучения:
обучающийся должен уметь:
- называть: изученные вещества по тривиальной или международной номенклатуре;
- определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений;
- проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Обучающийся должен знать/понимать:
- важнейшие химические понятия: углеродный скелет, функциональная группа;
- основные теории химии: строения органических соединений.
Оборудование и материалы: таблицы, схемы, раздаточный материал, шаростержневые модели.
Теоретическая часть
Альдегиды (от лат. alcohol dehydrogenatus - спирт, лишённый водорода)- класс органических соединений, содержащих альдегидную группу (-CHO).
В названии альдегидов используют тривиальные названия соответствующих кислот: муравьиный, уксусный, масляный и т.д. Правила названия альдегидов по систематической номенклатуре:
1. Выбирают самую длинную цепь углеродных атомов, содержащую альдегидную группу.
2. Нумеруют углеродную цепь, начиная с альдегидной группы. При наличии кратной связи первый номер получает углерод альдегидной группы.
3. В алфавитном порядке перечисляют все заместители с указанием их положения в цепи.
4. По числу углеродных атомов главной цепи называют альдегид, прибавляя к основе суффикс - аль.
Кетоны - органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. По рациональной номенклатуре к названию алкильных групп прибавляют слово «кетон»: метилэтилкетон.
Правила названия по систематической номенклатуре:
1. Выбирают самую длинную цепь углеродных атомов, содержащую карбонильную группу.
2. Нумеруют углеродную цепь с того конца, к которому ближе карбонильная группа.
3. В алфавитном порядке в префиксе перечисляют все заместители с указанием их положения в цепи.
4. По числу углеродных атомов главной цепи называют кетон, добавляя суффикс – он и, указывая через дефис номер атома углерода, при котором находится кетогруппа.
Практическая
часть Задание 1. Напишите название альдегидов по систематической номенклату![]()
![]() ре
ре
Задание 2. Как называются по систематической
номенклатуре следующие ![]() альдегиды:
альдегиды:
задание 3. Какую структурную формулу будет иметь:
Задание 4. Какое название указанного ниже
альдегида правильное бутанальили бутаналь-1?![]()
Задание 5. Напишите название кетонов по систематической номенклатуре:
![]()
![]()
Лабораторная работа № 9
Исследование свойств карбоновых кислот, сложных эфиров. Цель: 1.Изучить свойства карбоновых кислот на примере уксусной.
• Развивать умения составлять уравнения реакций в ионной форме;
• Развивать умения сравнивать и анализировать.
Реактивы: Уксусная кислота, вода, лакмус, магний, оксид меди (II), гидроксид натрия, карбонат натрия.
Подготовка к работе.
Контрольные вопросы.
• Какие соединения относятся к карбоновым кислотам? Приведите общую формулу карбоновых кислот.
• С какими веществами взаимодействуют неорганические кислоты?
• С какими веществами взаимодействуют карбоновые кислоты?
• Как окрашивается лакмус в уксусной кислоте? Объясните, почему?
Опыт №1 Действие индикаторов на раствор уксусной кислоты.
Налейте в пробирку 2-3 мл уксусной кислоты и 2 мл воды. Как растворяется кислота в воде? К полученному раствору добавьте 2-3 капли лакмуса. Какое окрашивание наблюдается? Напишите уравнения диссоциации уксусной кислоты.
Опыт №2 Взаимодействие уксусной кислоты с металлами
Налейте в пробирку 2-3 мл уксусной кислоты и поместите в нее немного магния. Что наблюдается? Подожгите выделившейся газ. Составьте уравнения реакции взаимодействия уксусной кислоты с магнием в молекулярном, ионном и сокращенном ионном виде.
Опыт №3 Взаимодействие уксусной кислоты с оксидами
Насыпьте в чистую пробирку немного оксида меди (II) и прилейте уксусной кислоты. Нагрейте пробирку. Каков цвет раствора? Составьте уравнения реакции.
Опыт №4 Взаимодействие уксусной кислоты с основаниями.
Налейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. Как изменится окраска? Почему? Составьте уравнения реакции в молекулярном, ионном и сокращенном ионном виде.
Опыт №5 Взаимодействие уксусной кислоты с солями летучих кислот.
Насыпьте в пробирку 1-2 грамма карбоната натрия. Прилейте 2-3 мл уксусной кислоты. Что
происходит? Составьте уравнение реакции, в молекулярном, ионном виде.
Опыт № 6 Растворимость в воде карбоновых кислот и их солей
Несколько капель или кристалликов (0,05-0,1 г) каждой из исследуемых кислот взбалтывают с 1-2 мл воды в пробирке; если кислота не растворяется при обычной температуре, смесь нагревают. Для всех параллельных проб следует брать примерно одинаковые количества кислоты и воды.
Охладив нагретые смеси, отмечают, выделяются ли снова кристаллы кислоты, растворившейся лишь при нагревании.
Полученные водные растворы кислот используют для проведения опытов 2, 4, 5.
Пробы, содержащие осадок малорастворимой кислоты, взбалтывают, затем часть суспензии отливают в другие пробирки и добавляют по 2-3 капли разбавленного раствора щелочи; при встряхивании кристаллы кислоты растворяются.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Задания для самостоятельных выводов.
• Какие свойства уксусной кислоты сходны со свойствами минеральных кислот?
• Какие вещества образуются при взаимодействии уксусной кислоты с основаниями?
Контрольные вопросы
1. Какие органические вещества называются карбоновыми кислотами?
2. По названиям кислот приведите их структурные формулы:
а) диметилэтилуксусная кислота;
б) 3-метил-4-этил-бутановая кислота;
в) этанкарбоновая кислота;
г) винилпропилуксусная кислота.
3. Почему среди карбоновых кислот нет газообразных веществ? Ответ
обоснуйте.
4. Напишите реакции, отличающие щавелевую кислоту от других органи-
ческих кислот.
5. Из метана получите пропановую кислоту. При этом используйте реак-
ции Вюрца, Кучерова, металлирования.
6. Из алкена получите диметилуксусную кислоту одной реакцией.
7. Получите пропановую кислоту, используя ацетилен, проведя только две
реакции.
8. Почему из всех карбоновых кислот только муравьиную можно приме-
нять в качестве восстановителя?
9. Сравните силу кислот:
а) этановая, пропановая, бутановая кислота;
б) масляная, изомасляная кислота.
Практическое занятие № 19
Составить структурные формулы одноосновных карбоновых кислот и их производных. Составить цепочки химических превращений
Цель занятия:
сформировать знание о строении, номенклатуре, изомерии, классификацию, методы добывания, химические свойства и практическое значение моно- и дикарбонових кислот и их функциональных производных.
1. Напишите
структурные формулы соединений: 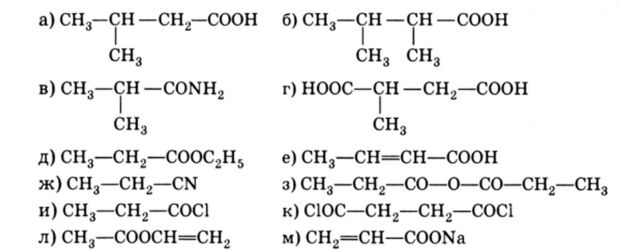
2. Напишите структурные формулы следующих соединений: а) изомасляная кислота; б) изовалериановая кислота;
в) 3,3-диметилбутановая кислота; г) 2,4-диметилпентановая кислота; д) диметилэтилуксусная кислота; е) метилизопропил- уксусная кислота; ж) изокапроновая кислота; з) (3-этилакрило- вая кислота; и) 2,3-диметилбутандионовая кислота; к) глута- ровая кислота; л) метиловый эфир изомасляной кислоты; м) этилформиат; н) бромангидрид а-бромпропионовой кислоты; о) акрилонитрил; п) бутирилхлорид; р) янтарный ангидрид; с) оксалат кальция.
3. Назовите кислоты, которые получатся при окислении:
а) изобутилового спирта; б) 3-метилгептаналя; в) гексанона-2.
4. Из пропилового спирта получите масляную кислоту.
5. Напишите для изомасляной кислоты уравнения реакций образования ангидрида и хлорангидрида всеми возможными способами.
6. Из 1-хлорпропана получите пропионовую кислоту. Напишите уравнение реакции ее с тионилхлоридом.
Практическое занятие № 20
Написать уравнения реакций свойств одноосновных карбоновых кислот и их производных
Цели: закрепить полученные знания о строении карбоксильных соединений, взаимном влиянии атомов в молекуле, реакционной способности, механизмах протекания химических реакций карбоновых кислот;
развивать представления о функциональных производных карбоновых кислот.
Ход работы
1. Приведите структурные формулы соединений:
1.1. пропандиовая кислота
1.2. 2-гидроксипропановая кислота
1.3. пропионилхлорид
1.4. бутилат кальция
1.5. ангидрид пропионовой кислоты
1.6. формамид
1.7. фениловый эфир пропионовой кислоты
1.8. n-хлорбензойная кислота
2. Допишите уравнения реакций:
2.1. ![]()
2.2. 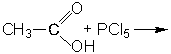
2.3. 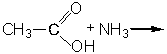
2.4. 
2.5. 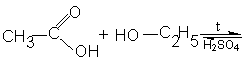
2.6. 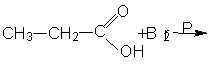
2.7. 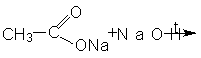
2.8. 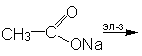
3. Какие вещества получатся при гидролизе следующих соединений:
|
3.1. этилформиат |
3.4. уксусный ангидрид |
|
3.2. изоамилацетат |
3.5. фтористый формил |
|
3.3. пропионитрил |
3.6. бутириламид |
4. Какие свойства отличают муравьиную кислоту от других карбоновых кислот? Приведите уравнения реакций.
5. Определите массу эфира, образовавшегося при взаимодействии 150 г 60%-го раствора уксусной кислоты с 150 мл 96%-го раствора этанола (плотность 0,8 г/мл). Известно, что 0,09 массовых долей эфира улетучилось при отгонке.
Дополнительные задания
1. На каком рисунке верно показано распределение электронной плотности в молекуле карбоновой кислоты:
|
1.1. |
1.3. |
|
1.2. |
1.4. |
2. Допишите уравнения реакций:
2.1. ![]()
2.2. ![]()
2.3. ![]()
2.4. ![]()
3. Расположите части схемы механизма реакции этерификации в правильной последовательности:
3.1. 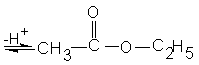
3.2. 
3.3. 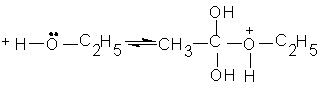
3.4. 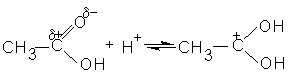 М
М
3.5. 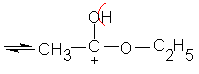
4. Приведите уравнения реакций, с помощью которых можно осуществить превращения:
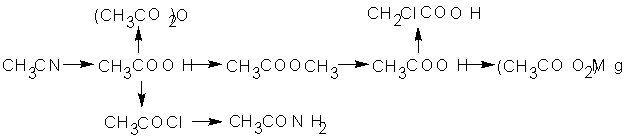
5. Для нейтрализации 2,08 г двухосновной карбоновой кислоты затрачено 40 мл 1 М раствора гидроксида натрия. Определите структуру карбоновой кислоты.
Лабораторная работа № 10
Изучение свойств аминов
Цель: Изучить свойства аминосоединений на примере анилина.
Опыт 1. Реакция с азотистой кислотой (на первичные жирные амины и аминокислоты)
Реактивы:: соли первичных алифатических аминов, аминокислоты (гликокол), соляная кислота (2н), нитрит натрия (5 %), мочевина.
Растворите около 0,1 г вещества в 6 каплях соляной кислоты при комнатной температуре, охладите до 5°С во льду и добавьте 5 капель раствора нитрита натрия. Происходит выделение пузырьков азота.
Напишите уравнение реакции.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 2. Обнаружение третичных аминов по реакции с лимонной кислотой и уксусным ангидридом
Реактивы: триэтиламин, лимонная кислота (2% раствор в уксусном ангидриде).
Каплю раствора лимонной кислоты смешайте с каплей триэтиламина и нагрейте смесь на кипящей водяной бане. Возникает пурпурно-красная окраска. Химизм процесса не установлен.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 3. Гидролиз ацетамида
Реактивы: ацетамид (кристал.), гидроксид натрия (2н).
Несколько кристаллов ацетамида поместите в пробирку, добавьте 10 капель 2 н NaОН и нагрейте. Резкий запах аммиака и посинение лакмусовой бумажки свидетельствуют о гидролизе ацетамида.
Напишите схему реакции гидролиза ацетамида и взаимодействия продукта гидролиза со щелочью.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 4. Разложение мочевины при гидролизе и при нагревании
Реактивы: мочевина (20% и кристал.), гидроксид бария (насыщ.), сульфат меди (0,2н), гидроксид натрия (2н), раствор белка.
А. К 3 каплям мочевины добавьте 6 капель прозрачной баритовой воды и смесь нагрейте. Наблюдается образование газа (обнаружить по запаху и по посинению лакмусовой бумажки) и карбоната бария, выпавшего в осадок.
Напишите уравнение реакции.
Б. 0,2-0,3 г мочевины нагревайте до тех пор, пока полученный плав не затвердеет. Охладив пробирку, добавьте в нее 5-6 капель воды и прокипятите. Слейте жидкость в другую пробирку и добавьте 2-3 капли 2н NaОН и 1 каплю СuSO4. Появляется розово-фиолетовое окрашивание комплексной медной соли биурета.
Напишите схему образования биурета.
В. К 3 каплям раствора белка добавьте равный объем 2н NaOН и 1 каплю СuSO4. Появляется розово-фиолетовое окрашивание комплексной соли биурета. Биуретовая реакция - одна из цветных реакций на белок и полипептиды.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 5. Конденсация мочевины с формальдегидом.
Реактивы: мочевина (кристал.), формалин (40%).
В сухую пробирку поместите 2-3 лопаточки мочевины так, чтобы высота слоя была 2-3 мм. Добавьте 3-4 капли 40% формалина, чтобы получился прозрачный раствор мочевины. Осторожно нагрейте над пламенем горелки. Реакция конденсации далее протекает экзотермически. Через несколько секунд содержимое пробирки мутнеет вследствие образования мочевино-формальдегидной смолы.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Опыт 6. Цветные реакции аминокислот
Реактивы: глицин (0,1%), ацетат натрия, сульфат меди, хлорид железа III (3%), нингидрин (0,1%).
А. К 3 каплям глицина добавьте кристаллик CuSO4 и кристаллик CH3COONa. Раствор становится густо-синим.
Б. К 2 каплям раствора глицина прилейте 1 каплю раствора FeCl3. Возникает красная окраска.
В слабокислых средах аминокислоты с солями меди и железа дают ярко окрашенные хелаты.
В. К 3 каплям глицина прибавьте 2 капли раствора нингидрина и взболтайте. Раствор окрашивается в фиолетовый цвет. При необходимости нагреть до кипения.
Некоторые аминокислоты могут давать желтую, красную или синюю окраску.
Результаты наблюдений заносят в тетрадь для лабораторных работ
Контрольные вопросы
1. Напишите структурные формулы и назовите все изомеры аминов состава С4Н11N.
2. Какие вещества получатся при восстановлении: а) нитрометана; б) нит-
ропропана; в) 2-нитробутана? Напишите уравнения реакций.
3. Напишите уравнения реакций взаимодействия с соляной кислотой сле-
дующих веществ: а) метиламина; б) диэтиламина; в) триметиламина. Назо-
вите полученные соединения.
4. Напишите структурные формулы аминокислот состава С4Н9О2N и назо-
вите полученные соединения.
5. Из α-хлорвалериановой кислоты синтезируйте α-аминовалериановую
кислоту. Напишите уравнения реакций.
6. Напишите структурные формулы следующих соединений: а) изопенти-
ламина; б) бутилметиламина; в) изобутилдиметиламина; г) диметилпенти-
ламина.
7. Получите изобутиламин, используя в качестве исходного вещества изо-
пропиловый спирт.
8. Получите любым способом аланин и напишите для него уравнение ре-
акции взаимодействия с азотистой кислотой и пятихлористым фосфором
Практическое занятие № 21
Составить и решить цепочки химических превращений
Цель:
Знать классификацию аминов, изомерию и номенклатуру предельных аминов,
строение аминов; физические и химические свойства предельных аминов, их
получение и применение; строение, свойства, способы получения и применения
анилина; генетическую связь аминов с другими классами органических соединений;
классификацию и номенклатуру гетероциклических соединений; строение, физические
и химические свойства пиррола и пиридина; примеры пуриновых и пиримидиновых
оснований, их значение.
Уметь: составлять формулы изомерных аминов и давать им названия;
составлять уравнения реакций, характеризующих химические свойства предельных
аминов и анилина, способы их получения; объяснять зависимость свойств аминов и
анилина от их строения; раскрывать взаимное влияние атомов на примере анилина.
Основные понятия: аминогруппа, амины, гетероциклы.
Контрольные вопросы:
1. Что такое амины?
2. Какие виды аминов известны?
3. Какие виды изомерии характерны для аминов?
4. Каковы физические свойства предельных аминов и анилина?
5. В чем сходство и отличие химических свойств: аммиака и предельных аминов,
предельных аминов и анилина?
6. Каковы области применения аминов?
7. Какие соединения называют гетероциклическими?
8. Каковы классификация и номенклатура гетероциклов?
9. Приведите примеры гетероциклов, которые:
а) являются основаниями;
б) не являются основаниями.
10. Какие химические свойства подтверждают ароматичность гетероциклов?
11. Обладает ли продукт гидрирования пиридина:
а) ароматическими свойствами;
б) свойствами основания? Почему?
12. Какое основание сильнее: пиррол или пирролидин? Почему?
13. Почему пиридин хорошо растворяется в воде, а пиррол плохо?
Задания для самоконтроля:
1. Составить формулы вторичных и третичных аминов состава С5Н13N,
назвать вещества.
2. У какого вещества сильнее выражены основные свойства:
а) метиламина или диметиламина;
б) аммиака или анилина;
в) этиламина или анилина?
Ответы обосновать.
3. Составить уравнения реакций и назвать продукты взаимодействия:
а) метиламина с водой;
б) метиламина с хлороводородом;
в) пропиламина с кислородом (горение);
г) анилина с хлороводородом;
д) нитроэтана с водородом (восстановление).
4. Осуществить превращения:

5. Найти массу триброманилина, образующегося при взаимодействии 18,6 г анилина
и 104 г брома.Ответ:66 г.
6. Определить формулу третичного амина, в котором массовые доли кислорода,
водорода и азота равны соответственно 65,75%, 15,07% и 19,18%. Назвать
амин.Ответ: Диметилэтиламин.
7. Из 4,4 м3 бензола с плотностью, равной 0,88 кг/л, получили анилин. Какова
его масса, если выход составляет 70%? Ответ: 3,23 т.
8. Сожгли 12,4 г первичного амина, а продукт горения пропустили через избыток
раствора щелочи. Газ, не прореагировавший со щелочью, имеет при нормальных
условиях объем 4,48 л. Определить амин. Ответ: Метиламин.
9. Имеется раствор фенола и анилина в бензоле. Массовая доля фенола в растворе
20%, анилина – 30%. Какую массу раствора брома в тетрахлорметане с массовой
долей брома, равной 8%, надо взять для бромирования 200 г исходного раствора?
Ответ: 6,425 кг.
Практическое занятие № 22
Закрепить знания на получение солей диазония получения красителей
Цель занятия:
изучить реакции получения солей диазония, азосочетания. Идентифицировать
первичную аминогруппу»
Студент должен уметь:
- писать уравнения реакций получения солей диазония;
- называть соли диазония;
- писать уравнения реакций азосочетания;
- идентифицировать первичную ароматическую аминогруппу.
Теоретическая часть
1. Диазосоединения: получение, свойства.
Диазосоединениями называются вещества, содержащие в молекуле группировку из двух
атомов азота, соединенную с одним углеводородным радикалом. Общая формула
диазосоединения R- N2X, где Х – анион сильной кислоты или ковалентносвязанная
группа, например, гидроксильная.
Ароматические соединения, в которых Х представляет собой анион сильной кислоты,
наприпер хлорид-ион, гидросульфат-ион, сульфат-ион, имеют солеобразующую
структуру
[ R и их называют солями диазония.
Название солей диазония просиходит по аналогии с названиями солей аммония:
Соли диазония получают, действуя азотистой кислотой HNO2 на первичный
ароматический амин в кислой среде. Получение соли диазония из амина называют
реакцией диазотирования.
На практике используют не саму азотистую кислоту, а ее соль и сильную
минеральную кислоты
Реакции с выделением азота.
1. Получение фенолов
При нагревании водных растворов солей диазония происходит бурное выделение
азота и образуются фенолы. В роли нуклеофила в этой реакции выступает молекула
воды:
2. Получение арилгалогенидов.
При добавлении к растворам солей диазония иодида калия образуются
соответствующие арилиодиды.
3. Получение углеводородов.
При действии на соли диазония такого восстановителя , как фосфорноватистокислый
натрий, происходит замещение диазогруппы на атом водорода.
2. Азосоединения.
Азосоединениями называются вещества, содержащие в молекуле азогруппу
-N= N-, связанную с двумя углеводородными радикалами.
Простейшим представителем ряда ароматических азосоединений является азобензол.
При составлении названий других соединений за основу берут азобензол.
Получение:
Азосоединения получаются в результате взаимодействия солей диазония с
производными бензола. Реакции, приводящие к образованию азосоединений
называются реакциями азосочетания.
Соли диазония реагируют с производными бензола, имеющими сильные
электронодорные заместители в бензолльной кольце – аминогруппу или
гидроксильную группу.
Азосочетание с ароматическими аминами проводят в нейтральной или слабокислой
среде.
Азосочетание с фенолами происходит аналогично реакции с ароматическими аминами,
но в слабощелочной среде. при подщелачивании раствора фенола происходит
образование феноксид-иона, что способствует повышению электронной плотности
бензольного кольца и, следовательно, облегчает реакцию электрофильного
замещения в нем.
II. Практическая часть
Опыт 1 Диазотирование анилина.
В пробирку поместите 1 каплю анилина и 6 капель 10% раствора хлороводородной
кислоты. Тщательно охладите полученный раствор водой со снегом или со льдом.
Добавьте в пробирку, периодически встряхивая, 6-8 капель 5% раствора нитрита
натрия и кусочек льда. Нанесите 1 каплю полученного раствора на йодкрахмальную
бумагу. появление устойчивой синей окраски йодкрахмальной бумаги
свидетельствует о завершении стадии образования бензолдаизонийхлорида.
Полученный раствор сохраните для опыта 2.
Вопросы:
1. Напишите схемы реакций, в которых принимает участие хлороводородная кислота.
Какая реакция приводит к образованию электрофильного реагента –
нитрозил-катиона?
2. Напишите схему диазотирования анилина. Какие реакции называются реакциями
диазотирования?
3. Почему появление синей окраски означает, что произошло образование
бензолдиазонийхлорида?
Опыт 2 Получение n – гидроксиазобензола.
Выполнение:
В пробирку поместите 3-4 капли жидкого фенола и 4-5 капель 10% раствора
гидроксида натрия до полного растворения фенола. прибавьте 1 каплю полученного
раствора к раствору бензолдиазонийхлорида, полученному в опыте 1. Появляется
оранжевая окраска.
Вопросы:
1. Напишите схему реакции взаимодействия бензолдиазонийхлорида с феноксидом
натрия. Объясните, почему реакция называется реакцией азосочетания?
2. К группе каких красителей относится n – гидроксиазобензол? Выделите в его
молекуле сопряженный элемент.
Лабораторная работа № 11
Изучение свойств углеводов
Цель: выработать умения анализировать и сравнивать свойства моно-, ди- и полисахаридов на основе проведения лабораторных опытов.
Контрольные вопросы:
1. Значение углеводов для жизнедеятельности живых организмов. Их функции.
2. Классификация углеводов.
3. Нахождение в природе представителей моно-, ди- и полисахаридов.
4. Сущность и значение биохимического процесса получения углеводов на Земле.
5. Химизм и сущность промышленного получения глюкозы, сахарозы, крахмала и целлюлозы.
6. С помощью каких химических методов можно доказать бифункциональность глюкозы?
7. Каковы особенности химических свойств восстанавливающих и невосстанавливающих дисахаридов?
8. Почему крахмал и целлюлоза, имея одну формулу, проявляют разные свойства?
9. Как на опыте доказать, что продуктом гидролиза крахмала и целлюлозы является глюкоза?
10. Каково применение углеводов в различных областях промышленности (в т.ч. и в пищевой)?
Опыт № 1. Обнаружение гидроксильных групп в углеводах.
В три пробирки наливают по 1,5 мл растворов : глюкозы, фруктозы, сахарозы. В каждую пробирку добавляют по 1 мл 10-% р-ра NaOH, а затем по каплям приливают 5-% р-р CuSO4. Образующийся вначале осадок Cu(OH)2 при встряхивании растворяется, получается ярко-синий раствор а лкоголятов меди.
Опыт № 2. Обнаружение альдегидной группы в моносахаридах.
а) Окисление гидроксидом меди (11) - реакция “ хамелеон”.
В две пробирки наливают по 2 мл р-ров глюкозы и фруктозы, добавляют 1 мл 10-% р-ра NaOH и по каплям (до появления голубого осадка Cu(OH)2 ) 5-% р-р CuSO4. Содержимое пробирок осторожно нагревают и наблюдают изменение голубой окраски осадка на красный. Объясните, почему реакция идет только с раствором глюкозы.
б) Окисление аммиачным раствором оксида серебра (реакция “серебряного зеркала”).
В две пробирки наливают по 1 мл растворов глюкозы и фруктозы, добавляют по 4-5 капель аммиачного раствора оксида серебра и осторожно нагревают. Объясните наблюдаемые явления.
Опыт № 3. Восстанавливающие свойства дисахаридов.
В три пробирки наливают по 1,5 мл растворов сахарозы, мальтозы и лактозы(или молока), добавляют по 1 мл 10-% р-ра NaOH и по каплям 5-% р-р CuSO4. Содержимое пробирок нагревают ( не допуская кипения ) и наблюдают проявления реакции “хамелеон”. Какие из предложенных дисахаридов проявляют восстанавливающие свойства?
Опыт № 4. Реакция Панова на кетогексозы.
В две пробирки наливают по 1 мл р-ров фруктозы и глюкозы, добавляют по 2 мл смеси этанола с конц. серной кислотой, а затем - 2-3 капли 5-% р-ра (спиртового) альфа-нафтола. Содержимое встряхивают и осторожно нагревают 3 мин. В какой пробирке появляется интенсивное фиолетовое окрашивание?
Опыт № 5. Гидролиз сахарозы.
В пробирку наливают 3 мл 1-% р-ра сахарозы и прибавляют 5 капель 1М р-ра скрной кислоты. Смесь нагревают 3-5 мин, охлаждают и делят на две части. Одну часть раствора нейтрализуют сухим гидрокарбонатом натрия до прекращения выделения углекислого газа, добавляют равный объем свежеприготовленного гидроксида меди (11) и повторно нагревают. Вторую половину гидролизата используют для обнаружения фруктозы реакцией Панова (см. опыт № 4). Сравнивают окраску растворов в двух пробирках. Какие продукты гидролиза сахарозы вами обнаружены проведенными реакциями?
Информационные источники
1. Грандберг, И. И. Практические работы и семинарские занятия по
органической химии. – М.: Высшая школа, 2015.
2. Гиттис, С. С. Практикум по органической химии / С. С. Гиттис,
И. И. Глаз, И. В. Иванов. – М.: Высшая школа, 2012.
3. Практикум по органической химии. Синтез и идентификация ор-
ганических соединений / под ред. О. Ф. Гинзбурга и И. И. Петрова.
– М.: Высшая школа, 2014.
4. Органикум. Практикум по органической химии: в 2 т. – М.: Мир,
2014.
5. Физер, Л. Реагенты для органического синтеза: в 7 т. / Л. Физер,
М. Физер. – М.: Мир, 2014.
6. Лернер, И. М. Указатель препаративных синтезов органических
соединений / И. М. Лернер, И. И. Берлин, Н. М. Слобачевская. – Л.:
Химия, 2012
7. Вейганд-Хильгетаг. Методы эксперимента в органической хи-
мии. – М.: Химия, 2013. – 944 с.
Приложение 1
Оформление лабораторной работы
Каждая практическая/лабораторная работа содержит
• Номер и наименование практической/лабораторной работы;
• Цель практической/лабораторной работы;
• Общие сведения;
• Порядок выполнения работы;
• Содержание отчета по практической работе;
• Выводы;
• Список использованных источников.
Критериями оценки выполнения практических занятий/лабораторных работ является соблюдение требований к выполнению работ.
Работа, выполненная в полном объеме, в соответствии с требованими , оценивается на «отлично»;
работа, выполненная в полном объеме с небольшими погрешностями – на «хорошо»;
работа, выполненная с принципиальными погрешностями – на «удовлетворительно»;
Оформление отчетов практических занятий /лабораторных работ производится в тетрадях для практических/лабораторных работ.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.