
Модели строения атома
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
 Первую
модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный
Нобелевской премии за открытие электрона). В конечном счёте она оказалась
неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных
исследований Резерфорда. Физики называли модель Томсона «пудинг с
изюмом».
Первую
модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный
Нобелевской премии за открытие электрона). В конечном счёте она оказалась
неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных
исследований Резерфорда. Физики называли модель Томсона «пудинг с
изюмом».
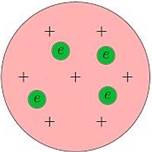
Согласно
Томсону атом представляет собой шар размером порядка ![]() см. По этому
шару некоторым образом распределён положительный заряд, а внутри шара, подобно
изюминкам, находятся электроны (рис. 1).
см. По этому
шару некоторым образом распределён положительный заряд, а внутри шара, подобно
изюминкам, находятся электроны (рис. 1).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны).
Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Планетарная модель атома
 Чтобы
отбросить α - частицу, положительный заряд атома должен создавать
куда более сильное электрическое поле, чем то, которое получается в модели
Томсона. А чтобы создать такое поле, положительный заряд должен быть
сосредоточен в области, гораздо меньшей размера атома.
Чтобы
отбросить α - частицу, положительный заряд атома должен создавать
куда более сильное электрическое поле, чем то, которое получается в модели
Томсона. А чтобы создать такое поле, положительный заряд должен быть
сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд q занимает область размером r, то вблизи заряда создаётся электрическое поле с потенциалом:
![]()
Зная
кинетическую энергию ![]() -частицы, можно найти величину тормозящего потенциала
-частицы, можно найти величину тормозящего потенциала ![]() , а затем и размер
, а затем и размер ![]() положительно заряженной
области.
положительно заряженной
области.
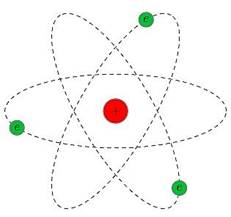
Рис. 2. Планетарная модель атома
Вычисления,
проведённые Резерфордом, дали следующий результат: ![]() см.
см.
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 2).
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в 1836 раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню (500 м). Тогда ядро окажется горошиной размером 5 мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Вот таким удивительным объектом оказался атом.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.