
КРАЕВОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«КЛЮЧЕВСКИЙ ЛИЦЕЙ ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ИМЕНИ АЛЕКСАНДРА ВАСИЛЬЕВИЧА ГУКОВА»
|
СОГЛАСОВАНО Заместитель директора по УПР КГБПОУ «Ключевский ЛПО имени А.В.Гукова » ___________________И.П. Кашич «_____»_______________2022г. |
УТВЕРЖДАЮ Директор КГБПОУ «Ключевский ЛПО имени А.В.Гукова » ___________________В.В. Репкин «____»_________________2022 г. |
ФОНД ОЦЕНОЧНЫХ СРЕДСТВ
ТЕКУЩЕЙ АТТЕСТАЦИИ
ПО ОБЩЕОБРАЗОВАТЕЛЬНОЙ УЧЕБНОЙ ДИСЦИПЛИНЕ
ОУД. 11. химия
Профиль профессионального образования: технический
Профессия СПО: 35.01.11 Мастер сельскохозяйственного производства
Уровень изучения: базовый
Форма обучения: очная
|
|
|
РАССМОТРЕНО на заседании методической комиссии Протокол от « » 2022 г. №___
|
Ключи 2022
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Фонд контрольно-оценочных средств по дисциплине Химия предназначен для осуществления текущего контроля знаний обучающихся.
1.2. В результате текущей аттестации по дисциплине осуществляется проверка предметных и метапредметных результатов обучения:
|
|
Результаты обучения (предметные, метапредметные) |
|
|
|
1 |
|
|
|
Предметные: |
|
|
П.1. |
- сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; |
|
|
П.2. |
- владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой; |
|
|
П.3. |
- владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
|
|
|
П.4. |
- сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям; |
|
|
П.5 |
− владение правилами техники безопасности при использовании химических веществ; |
|
|
П.6 |
- сформированность собственной позиции по отношению к химической информации, получаемой из разных источников. |
|
|
|
Метапредметные: |
|
|
М.1 |
- использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере; |
|
|
М.2 |
- использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере; |
|
2 ИСПОЛЬЗУЕМЫЕ ОЦЕНОЧНЫЕ СРЕДСТВА.
|
Наименование темы (раздела) |
Код контролируемых знаний, умений |
Текущий и рубежный контроль
|
|
|
Практические занятия |
Контрольные работы (тестирование) |
||
|
Введение |
|
|
|
|
1. Общая и неорганическая химия |
|
|
|
|
1.1 Основные понятия и законы |
|
|
|
|
1.2 Периодический закон и Периодическая система химических элементов Д. И. Менделеева и строение атома |
|
|
|
|
1.3 Строение вещества |
|
|
|
|
1.4 Вода. Растворы. Электролитическая диссоциация |
П.1, П.2, П.3, П.4, П.5, М.1 |
1 |
|
|
1.5 Классификация неорганических соединений и их свойства |
|
|
|
|
1.6 Химические реакции |
|
|
|
|
1.7 Металлы и неметаллы |
П.1, П.2, П.3, П.4, П.5, П.6, М.1, М.2 |
2,3 |
1 |
|
2. Органическая химия |
|
|
|
|
2.1 Основные понятия органической химии и теория строения органических соединений |
|
|
|
|
2.2 Углеводороды и их природные источники |
|
|
|
|
2.3 Кислородсодержащие органические соединения |
|
|
|
|
2.4 Азотсодержащие органические соединения. Полимеры |
П.1, П.2, П.3, П.4, П.5, П.6, М.1, М.2 |
4,5 |
2 |
3. ЛИТЕРАТУРА:
Основные источники:
1. Химия для профессий и специальностей технического и естественно-научного профилей : учебник для студ. учреждений сред. проф. образования / Ю. М. Ерохин, И. Б. Ковалева.-2-е изд., стер. – М. : Издательский центр «Академия», 2016. – 448с.
Дополнительные источники:
1. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М. Практикум: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
3. Сивоглазов В.И., Агафонова И.Б., Захарова Е.Т. Биология. Общая биология: базовый уровень, 10—11 класс. — М., 2014.
Мультимедийные пособия:
www.pvg.mk.ru (олимпиада «Покори Воробьевы горы»).
www.hemi.wallst.ru (Образовательный сайт для школьников «Химия»).
www.alhimikov.net (Образовательный сайт для школьников).
www.chem.msu.su (Электронная библиотека по химии).
www.enauki.ru (интернет-издание для учителей «Естественные науки»).
www.1september.ru (методическая газета «Первое сентября»).
www.hvsh.ru (журнал «Химия в школе»).
www.hij.ru (журнал «Химия и жизнь»).
www.chemistry-chemists.com (электронный журнал «Химики и химия»).
1. КОМПЛЕКТ ЗАДАНИЙ ТЕКУЩЕЙ АТТЕСТАЦИИ
Практическое занятие №1.
Тема: Приготовление раствора заданной концентрации
Цель работы: изучить практически методику приготовления раствора заданной концентрации
Оборудование и реактивы: химические колбы, стаканы, поваренная соль NaCl, вода, весы
Способы выражения состава раствора
Состав раствора принято выражать через безразмерные относительные величины - доли (массовую, объёмную молярную) и размерные величины- концентрации. Концентрация показывает отношение массы или количества растворенного вещества к объёму раствора.
Массовая доля - это отношение массы вещества к массе раствора:
W (B) = 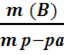 Массовая
доля выражается в долях единицы или в процентах
Массовая
доля выражается в долях единицы или в процентах
Решить задачу (пример). Найти массу вещества KOH и массу воды, необходимой для приготовления 250 г 10% раствора KOH
1 Находим массу вещества по формуле:
m(KOH) = m раствора ∙ W
m (KOH) = 250г ∙ 0,1
m (KOH) =25г .
m (H2O) = m р-ра – m в-ва
m (H2O) = 250-25= 225(г)
Ответ: m (KOH) =25г; m (H2O)= 225г
Задание 1 Приготовить 250 г 3% раствора поваренной соли NaCl. Для приготовления данного раствора произведите все необходимые расчеты
Задание 2 Решить задачу.
1 вариант. Рассчитать массовую долю вещества в растворе, если для приготовления 200 г раствора было взято 4г вещества.
2 вариант. Рассчитать массу воды, которую нужно взять для приготовления 150 г 6% раствора.
3 вариант. Рассчитать массу NaCl, которую нужно взять для приготовления 120 г 10% раствора.
Задание 3 Для засолки огурцов приготовили 6% раствор поваренной соли. Вычислите, какие массы соли и воды необходимо взять для приготовления 5 кг такого рассола
Задание 4 Подумайте и ответьте на вопрос: Где могут применяться знания и умения по теме практического занятия
Критерии оценки:
На «5»: Произведены правильно расчеты, приготовлен раствор заданной концентрации; решена задача в задании 2 и 3. Правильно записано условие задачи и нет замечаний по орфографическому режиму. Может быть 1-2 несущественных недочета в оформлении работы.
На «4»: Допущены 1-2 ошибки (при приготовлении раствора, либо при решении задачи). Либо работа выполнена правильно, но неаккуратно, с исправлениями.
На «3»: Выполнена правильно большая часть работы, либо допущены 3-4 ошибки в работе.
На «2»: Отсутствует половина задания, либо допущено более 4-х ошибок в выполнении работы.
На
«1»:
- Работа не выполнена, отсутствуют записи в тетради.
Практическое занятие №2
Тема:Получение, собирание и распознавание газов.
Цель работы: изучить способы получения, собирания и распознавания неорганических веществ
Реактивы и оборудование: штатив с пробирками, растворы солей, кислот и оснований, железный гвоздь, цинк, нагревательный прибор, держатель для пробирок, лучинка, стеклянная трубочка
Перед выполнением работы ознакомьтесь с правилами техники безопасности при работе в химической лаборатории. При выполнении опытов с химическими реактивами используйте спецодежду (халат). После выполнения опытов необходимо тщательно помыть руки
Лабораторный опыт 1. Получение водорода
В пробирку поместите две гранулы цинка и прилейте 1-2 мл соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Накройте пробирку с цинком пробиркой большего диаметра. Через 1-2 минуты поднимите большую пробирку вверх и, не переворачивая её, закрыв пальцем, поднесите к пламени спиртовки. Откройте пробирку. Что наблюдаете? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевернутую вверх дном пробирку?
Лабораторный опыт 2. Получение углекислого газа
В пробирку поместите кусочек мела и прилейте раствор соляной кислоты.
Что наблюдаете? Через 1-2 минуты внесите в пробирку горящую лучинку. Что наблюдаете? Напишите уравнение реакции.
В пробирку налейте 1-2 мл прозрачного раствора известковой воды. Через чистую стеклянную трубочку осторожно продувайте через раствор выдыхаемый вами воздух. Что наблюдаете? Напишите уравнение реакции.
Лабораторный опыт 3. Получение аммиака
В пробирку налейте 1-2 мл раствора хлорида аммония, а затем такой же объём раствора щелочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдаете? Напишите уравнение реакции.
Поднесите к отверстию пробирки индикаторную бумагу. Что наблюдаете? Осторожно понюхайте выделяющийся газ. Что ощущаете?
Критерии оценки
Отметка «5»: практическая часть работы выполнена верно, записаны уравнения реакций, расставлены при необходимости коэффициенты, записаны наблюдения и выводы
Отметка «4»: допущена1-2 неточности в записи уравнений, либо получены замечания при проведении работы. Выводы сформулированы неточно.
Отметка «3»: неполное выполнение задания; допущены отдельные существенные ошибки, исправленные с помощью преподавателя
Отметка «2»: проявлено незнание материала, допущены множественные ошибки.
Отметка «1»: работа не выполнена, отсутствуют записи в тетради.
Практическое занятие №3
Тема: Решение экспериментальных задач.
Цель работы: изучить способы распознавания неорганических веществ.
Оборудование: хлорид натрия, нитрат серебра, спиртовка, держатель, ложечка, спички, сульфат меди (II), гидроксид натрия, хлорид бария, номерные пробирки 1,2,3,4, соляная кислота, штатив с пробирками, палочка.
Примечание:
Алгоритм проведения работы:
1. Определите качественный состав хлорида натрия:
1. Вспомните, что является реактивом на хлорид анион и катион натрия.
2. Проведите качественные реакции на катион и анион, объясните происходящее.
2. Получите из предложенных веществ гидроксид меди (2):
1. Подумайте, какие реактивы вы возьмете для получения гидроксида меди (II) .
2. Проведите реакцию, объясните происходящее, какая реакция лежит в основе получения?
3. В предложенном образце обнаружить сульфат – анион:
1. Вспомните, что является реактивом на сульфат? Подумайте, какой реактив взять?
2. Проведите реакцию. Что происходит? Объясните происходящее.
4. Определите карбонат в пробирках 1, 2:
1. Вспомните, что является реактивом на карбонат? Подумайте, какой реактив взять?
2. Возьмите пробу из пробирок 1,2 и добавьте в пробирки реактив на карбонат. Что происходит? Объясните происходящее.
5. Распознать с помощью качественных реакций карбонат натрия и фосфат натрия в пробирках 3,4:
1. Вспомните, что является реактивом на карбонат и фосфат? Подумайте, какие реактивы взять?
2. Возьмите пробу из пробирок 3 и 4, добавьте в пробирки реактивы. Что происходит? Объясните происходящее.
Критерии оценки
Отметка «5»: практическая часть работы выполнена верно, записаны уравнения реакций, расставлены при необходимости коэффициенты, записаны наблюдения и выводы
Отметка «4»: допущена1-2 неточности в записи уравнений, либо получены замечания при проведении работы. Выводы сформулированы неточно.
Отметка «3»: неполное выполнение задания; допущены отдельные существенные ошибки, исправленные с помощью преподавателя
Отметка «2»: проявлено незнание материала, допущены множественные ошибки.
Отметка «1»: работа не выполнена, отсутствуют записи в тетради.
Контрольное тестирование №1 по разделу 1.
|
Вариант I Инструкция для обучающихся:
На выполнение теста отводится 45 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К заданиям №1 - 7 дано 4 ответа, из которых только один верный. Выберите верный, по Вашему мнению, ответ. Каждый правильный ответ оценивается в один балл. В заданиях №8 - №10 внимательно читайте условие. Правильные ответы оцениваются в 2 балла (задание считается не выполненным, если допущена 1 ошибка!). Желаем успехов! Критерии оценок: «5» - 13-12 баллов (92% - 100%) «4» - 11-10 баллов (85% - 77%) «3» - 9-7 баллов (69% -54%) «2» - 6 и менее баллов (46% и менее) «1» - 0 баллов 1.Электронная формула атома 1s2 2s2 2p63s2 3p4. Формулы водородного соединения и высшего оксида этого элемента: а) H2Sе и SеO2; б) NH3 и N2O5; в) H2S и SO2; г) СН4 и СО2.
2. Неметаллические свойства элементов в ряду J → Br → Cl → F: а) не изменяются; б) усиливаются; в) ослабевают; г) изменяются периодически.
3. В водном растворе электролитом может быть: а) CO2; б) CuSO4; в) Na2O; г) ответы неверные.
4. Кислотные свойства оксидов в ряду SiO2, P2O5, SO3, Cl2O7: а) возрастают; в) сначала возрастают, а затем убывают; б) убывают; г) сначала убывают, а затем возрастают.
5. Химическая связь в NH3 и BaCl2 соответственно: а) ионная и ковалентная полярная; б) ковалентная полярная и металлическая; в) ковалентная полярная и ионная; г) ковалентная неполярная и металлическая. 6. Электроотрицательность в ряду элементов As → P → N → O: а) уменьшается; в) не изменяется; б) увеличивается; г) не знаю.
7. Ионное уравнение 3Са2+ + 2РО43- → Са3(РО4)2↓ соответствует реакции между: а) Ca(OH)2 и К3РО4; в) NaOH и H3PO4 б) СаСl2 и NaH2PO4; г) Ca(OH)2 и H3PO4 8. Установи соответствие между веществом и видом химической связи, запишите набор из трёх цифр (из правой колонки) в соответствии с порядком букв абв (в левой колонке):
9. Атом хлора способен образовывать виды химической связи. Выбери три правильных ответа: а) ковалентную полярную; б) водородную; в) ионную; г) металлическую; д) ковалентную неполярную. 10. Установите соответствие между типами химической связи и их особенностями:
Эталоны ответов:
|
Вариант II Инструкция для обучающихся:
На выполнение теста отводится 45 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К заданиям №1 - 7 дано 4 ответа, из которых только один верный. Выберите верный, по Вашему мнению, ответ. Каждый правильный ответ оценивается в один балл. В заданиях №8 - №10 внимательно читайте условие. Правильные ответы оцениваются в 2 балла (задание считается не выполненным, если допущена 1 ошибка!). Желаем успехов! Критерии оценок: «5» - 13-12 баллов (92% - 100%) «4» - 11-10 баллов (85% - 77%) «3» - 9-7 баллов (69% -54%) «2» - 6 и менее баллов (46% и менее) «1» - 0 баллов 1.Электронная формула атома 1s2 2s2 2p63s2 3p3. Формулы водородного соединения и высшего оксида этого элемента: а) H2Sе и SеO2; б) NH3 и N2O5; в) H2S и SO2; г) РН3 и Р2О5.
2. Неметаллические свойства элементов в ряду С → N → О → F: а) не изменяются; б) усиливаются; в) ослабевают; г) изменяются периодически.
3. В водном растворе электролитом может быть: а) SO3; б) K2O; в); BaCl2 г) ответы неверные.
4. В периодах при движении слева направо кислотные свойства высших оксидов: а) возрастают; в) сначала возрастают, а затем убывают; б) убывают; г) сначала убывают, а затем возрастают.
5. Химическая связь в HCl и K2S соответственно: а) ионная и ковалентная полярная; б) ковалентная полярная и металлическая; в) ковалентная полярная и ионная; г) ковалентная неполярная и металлическая.
6. Электроотрицательность в ряду элементов F → Cl → Br → Se: а) уменьшается; в) не изменяется; б) увеличивается; г) не знаю.
7. Ионное уравнение Fe2+ + S2- → FeS↓ соответствует реакции между: а) FeSO4 и K2S; в) FeSO4 + H2; б) Fe(OH)2 + H2SO4; г) FeS + H2S. 8. Установи соответствие между веществом и видом химической связи, запишите набор из трёх цифр (из правой колонки) в соответствии с порядком букв абв (в левой колонке):
9. Атом серы способен образовывать виды химической связи. Выбери три правильных ответа: а) ковалентную полярную; б) водородную; в) ионную; г) металлическую; д) ковалентную неполярную. 10. Установите соответствие между типами химической связи и их особенностями:
Эталоны ответов:
|
Практическое занятие №4
Тема: Решение экспериментальных задач на идентификацию органических соединений.
|
Цель работы: изучить экспериментальные методы идентификации веществ. Реактивы: водный раствор гидроксида натрия (NaOH), серная кислота (H2SO4), водный раствор карбоната натрия (Na2CO3), водный раствор KMnO4 , бромная вода, водный раствор CuSO4 , аммиачный раствор оксида серебра, вода. Оборудование: штатив с чистыми пробирками, спиртовка, держатель для пробирки, стеклянная палочка, контрольные образцы вещества для идентификации. Примечание: 1. Вы должны, используя минимальное число реактивов определить содержимое в каждой пробирке. 2. Не забудьте взять пробу для распознавания соединений. Алгоритм проведения работы: 1 этап работы: В двух пробирках содержатся следующие вещества 1). Глюкоза, 2). Бензойная кислота. 1. Возьмите пробу из каждой пробирки. 2. Определите реактив, который вы возьмете для распознавания вещества в пробирке 1, 2. 2 этап работы: В двух пробирках содержатся следующие вещества 1). Глюкоза, 2). Глицерин. 1. Возьмите пробу из каждой пробирки. 2. Определите реактив, который вы возьмете для распознавания вещества в пробирке 1, 2. 3 этап работы: В двух пробирках содержатся следующие вещества 1). Глюкоза, 2). Сахароза. 1. Возьмите пробу из каждой пробирки. 2. Определите реактив, который вы возьмете для распознавания вещества в пробирке 1, 2. 4 этап работы: В двух пробирках содержатся следующие вещества 1). Формалин, 2). Этиловый спирт. 1. Возьмите пробу из каждой пробирки. 2. Определите реактив, который вы возьмете для распознавания вещества в пробирке 1, 2.
Заключение: 1. Обратите внимание на изменения, происходящие во всех этапах работы. 2. Составьте отчёт о работе в произвольной форме и сделайте общий вывод. Критерии оценивания: |
На «5»: работа выполнена полностью, записаны уравнения, наблюдения, сделаны выводы. записаны уравнения химических реакций, расставлены коэффициенты.
На «4»: В работе может быть допущено 1-2 ошибки, либо работа оформлена с нарушением орфографического режима.
На «3»: Допущено 3-4 ошибки, либо отсутствуют выводы.
На «2»: Допущено более 4-х ошибок, отсутствуют выводы.
Отметка «1»: работа не выполнена, отсутствуют записи в тетради.
Практическое занятие №5
Тема: Распознавание пластмасс и волокон.
|
I вариант Цель работы: изучить экспериментальные методы распознавания пластмасс и волокон. Оборудование: спиртовка, спички, тигельные щипцы, стеклянная палочка, пробирки, образцы пластмасс и волокон. Примечание:
Алгоритм проведения работы:
Распознайте в каждом номерном пакете волокна – капрон, хлопок, шерсть, ацетатное волокно, лавсан, по характерным свойствам.
Распознайте в каждом пакете пластмассу – полиэтилен, поливинилхлорид, полистирол, полиметилакрилат, по характерным свойствам.
|
II вариант Цель работы: изучить экспериментальные методы распознавания пластмасс и волокон. Оборудование: спиртовка, спички, тигельные щипцы, стеклянная палочка, пробирки, образцы пластмасс и волокон. Примечание:
Алгоритм проведения работы:
Распознайте в каждом номерном пакете волокна – капрон, хлопок, шерсть, ацетатное волокно, лавсан, по характерным свойствам.
Распознайте в каждом пакете пластмассу – полиэтилен, поливинилхлорид, полистирол, полиметилакрилат, по характерным свойствам.
|
На «5»: работа выполнена полностью, записаны наблюдения, сделаны выводы.
На «4»: В работе может быть допущено 1-2 ошибки, либо работа оформлена с нарушением орфографического режима.
На «3»: Допущено 3-4 ошибки, либо отсутствуют выводы.
На «2»: Допущено более 4-х ошибок, отсутствуют выводы.
Отметка «1»: работа не выполнена, отсутствуют записи в тетради.
Контрольное тестирование №2 по разделу 2.
|
Контрольное тестирование №2 по разделу 2. I вариант Инструкция для обучающихся:
На выполнение теста отводится 45 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К заданиям №1 - 7 дано 4 ответа, из которых только один верный. Выберите верный, по Вашему мнению, ответ. Каждый правильный ответ оценивается в один балл. В заданиях №8 - №10 внимательно читайте условие. Правильные ответы оцениваются в 2 балла (задание считается не выполненным, если допущена 1 ошибка!). Желаем успехов! Критерии оценок: «5» - 13-12 баллов (92% - 100%) «4» - 11-10 баллов (85% - 77%) «3» - 9-7 баллов (69% -54%) «2» - 6 и менее баллов (46% и менее) «1» - 0 баллов
1. Общая формула алкенов: а) СnН2n б) СnН2n + 2 в) СnН2n - 2 г) СnН2n – 6
2. Гомологом гексана является: а) С6Н14 б) С6Н6 в) С7Н16 г) С7Н14
3. Реакция взаимодействия этилена с водой называется: а) гидрирование б) дегидрирование в) гидратация г) гидролиз
4. Ряд одноатомных спиртов: а) С3Н7СОН, С4Н9СОН, С5Н11СОН б) С3Н7ОН, С4Н9ОН, С5Н11ОН; в) С3Н7СООН, С4Н9СООН, С5Н11СООН г) С2Н4, С2Н6, С2Н2.
5. Продукты взаимодействия этаналя и аммиачного раствора оксида серебра (I): а) СН3 - СООН + 2Аg б) СН3 - СООН + АgОН в) СН3 - СООН г) СН3СН2ОН
6. Карбоксильной называют группу: а) - ОН б) -СОН в) - NO2 г) – СООН
7. Верны ли следующие суждения о свойствах глюкозы? 1. Раствор глюкозы проводит электрический ток. 2. Для глюкозы характерны реакции брожения. а) верно только 1 в) оба суждения верны б) верно только 2 г) оба суждения неверны
8. Веществами Х и У в схеме превращений +Х +У С2Н6 → С2Н5CI → С2Н5ОН являются а) Х - НСI ; У - КОН б) Х - CI2 ; У - КОН (водн.р-р) в) Х - HCI ; У - Н2О г) Х – CI2 ; У – ВаCI2
9. Установите соответствие между формулой вещества и классом органических соединений, к которому оно принадлежит.
Ответ:
10. Установите соответствие между названием углевода и его молекулярной формулой:
Ответ
Эталоны ответов:
|
Контрольное тестирование №2 по разделу 2. II вариант Инструкция для обучающихся:
На выполнение теста отводится 45 минут. Задания рекомендуется выполнять по порядку, не пропуская ни одного, даже самого легкого. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям. К заданиям №1 - 7 дано 4 ответа, из которых только один верный. Выберите верный, по Вашему мнению, ответ. Каждый правильный ответ оценивается в один балл. В заданиях №8 - №10 внимательно читайте условие. Правильные ответы оцениваются в 2 балла (задание считается не выполненным, если допущена 1 ошибка!). Желаем успехов! Критерии оценок: «5» - 13-12 баллов (92% - 100%) «4» - 11-10 баллов (85% - 77%) «3» - 9-7 баллов (69% -54%) «2» - 6 и менее баллов (46% и менее) «1» - 0 баллов
1. Общая формула циклоалканов: а) СnН2n б) СnН2n + 2 в) СnН2n - 2 г) СnН2n – 6
2. Гомологом гептана является: а) С6Н14 б) С6Н6 в) С7Н16 г) С7Н14
3. Реакция, характерная для алкадиенов: а) присоединения б) замещения в) разложения г) обмена
4. Ряд карбоновых кислот: а) С3Н7СОН, С4Н9СОН, С5Н11СОН б) С3Н7ОН, С4Н9ОН, С5Н11ОН; в) С3Н7СООН, С4Н9СООН, С5Н11СООН г) С2Н4, С2Н6, С2Н2
5. Продукты взаимодействия ацетальдегида и аммиачного раствора оксида серебра(I): а) СН3СООН + 2Аg б) СН3СООН + АgОН в) СН3СООН г) СН3СН2ОН
6. Альдегидной группой является: а) - ОН б) - СОН в) - NO2 г) – СООН
7. Верны ли следующие суждения о распознавании волокон? 1. Шерстяное и шелковое волокна можно распознать по характеру горения. 2. Капрон и вискозное волокно можно распознать по характеру горения. а) верно только 1 в) оба суждения верны б) верно только 2 г) оба суждения неверны.
8. Веществами Х и У в схеме превращений +Х +У С2Н4 → С2Н5CI → С2Н5ОН являются а) Х - НСI ; У - КОН б) Х - CI2 ; У - КОН (водн.р-р) в) Х - HCI ; У - Н2О г) Х – CI2 ; У – ВаCI2
9. Установите соответствие между формулой вещества и классом органических соединений, к которому оно принадлежит.
Ответ:
10. Установите соответствие между названием вещества и его функциональной группой:
Ответ
Эталоны ответов:
|
Критерии оценивания практических занятий.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу
. Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4» :
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»: - работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию преподавателя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию преподавателя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
Отметка «1»:
- ставится тогда, когда ученик не знаком с учебным материалом.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.