
Деятельность системы органов кровообращения – сердца и сосудов – обеспечивает непрерывное движение крови в организме. Важнейшие законы гемодинамики, т.е. учения о движении крови в сосудистой системе, являются общими с законами гидродинамики, т.е. учения о движении жидкости. Согласно этим законам ток жидкости по сосудам определяется двумя силами: давлением, под которым движется жидкость, т.е. разностью давлений в начале и конце сосуда, и сопротивлением, которое испытывает текущая жидкость из-за своей вязкости и трения о стенки. Первая из этих сил способствует движению крови, вторая – гидравлическое сопротивление – препятствует ему. Отношение разности давлений к сопротивлению определяет объем жидкости, протекающей по сосудам. Сердце выполняет насосную функцию.
Функция сосудов заключается в том, чтобы регулировать объем периферического русла и приводить его в соответствие с объемом циркулирующей крови и обеспечивать достаточное кровоснабжение органов и тканей в зависимости от их потребностей. Эти функции обеспечиваются специфическими свойствами: эластичностью, сократимостью, тонусом, проницаемостью стенок сосудов.
В зависимости от того, какое свойство больше выражено, сосуды подразделяются на компенсирующие, резистивные, сосуды обмена и емкостные сосуды.
К компенсирующим сосудам относятся сосуды эластического типа – аорта и артерии. Благодаря высокой эластичности и особенностям строения эти сосуды преобразуют пульсирующее движение крови в равномерный кровоток.
Резистивные сосуды или сосуды сопротивления – артериолы и венулы, расположенные в пре и посткапиллярных областях сосудистого русла. У резистивных сосудов довольно толстая стенка, их мышечная структура всегда находится в определенном тонусе. Эти сосуды активно изменяют свой просвет под действием нейрогенных влияний, что обеспечивает соответствие просвета сосуда тому объему крови, который обеспечивает необходимый уровень кровоснабжения органов и тканей в соответствии их потребности. По выражению И.М. Сеченова артериолы – «краны кровеносной системы».
Сосуды обмена – это капилляры и венулы. Именно в этих сосудах, благодаря высокой проницаемости их стенок, происходит двусторонний обмен между кровью и тканями водой, газами, электролитами и питательными веществами.
Емкостные сосуды – венулы и вены. В них депонируются около 75-80% всей массы крови с целью ее распределения и возврата к сердцу. Тонус кровеносных сосудов и его адаптационные изменения имеют большое значение для приспособления кровообращения к меняющимся потребностям организма. Тонус сосудов в значительной степени определяется величиной артериального давления. Величина артериального давления зависит от минутного объема крови (количество крови, которое сердце нагнетает в сосуды за минуту) и общего периферического сопротивления (сосудистого тонуса).
САД пропорционально МОК и ОПС; МОК = СО х ЧСС
Минутный объем крови это систолический объем крови, умноженный на частоту сердечных сокращений. Систолический или ударный объем зависит от венозного возврата, который в свою очередь определяется объемом циркулирующей крови.
Основными факторами, определяющими уровень системного артериального давления, являются:
- сердечные факторы – систолический объем и частота сердечных сокращений;
- общее периферическое сопротивление;
- объем циркулирующей крови и венозный возврат крови к сердцу.
Величина артериального давления – АД – в значительной мере определяет адекватность кровоснабжения органов и тканей. Его значения, в свою очередь, зависят от количества крови, поступающей из сердца в аорту в минуту (сердечный выброс), и сопротивления, оказываемого кровотоку в артериальных сосудах. Большое значение на уровень АД оказывает общий объем циркулирующей крови.
Все факторы, имеющие отношение к регуляции АД, могут оказывать влияние на его уровень через изменения сопротивления току крови, сердечного выброса или объема крови.
В сложной системе регуляции кровообращения, а значит и уровня АД, можно выделить несколько звеньев, основными из которых являются: нервная система, гормоны, биологически активные вещества и почки. Многочисленные факторы регуляции АД в зависимости от конечного физиологического эффекта делятся на прессорные или повышающие АД и депрессорные, активация которых приводит к снижению АД.
Влияние нервной системы на регуляцию кровообращения представлено тремя звеньями: афферентным, центральным и эфферентным. Афферентное звено регуляции представлено рефлексогенными зонами сердечно-сосудистой системы. Наибольшее значение имеют рецепторы, локализованные в дуге аорты, синокаротидных зонах, в сердце и сосудах малого круга кровообращения. Воспринимая пульсовые колебания сосудистой стенки (механо- и барорецепторы) или изменения венозного давления и кровенаполнения правых отделов сердца эти рецепторы передают информацию в сердечнососудистый центр продолговатого мозга и выше расположенные отделы ЦНС, имеющие отношение к регуляции АД, включая нейроны гипоталамуса.
Эфферентное звено регуляции кровообращения представлено вазомоторными симпатическими нейронами. Аксоны этих нейронов являются холинергическими нервами. Повышение активности симпатической нервной системы сопровождается повышением секреции катехоламинов (адреналин и норадреналин). Адреналин вызывает снижение периферического сопротивления в коронарных и мозговых сосудах. Норадреналин вызывает выраженное увеличение общего периферического сопротивления и повышение системного артериального давления.
Центральная нервная система влияет на уровень АД не только посредством барорецепторных механизмов, но и посредством изменения скорости синтеза и освобождения многих гормонов и биологически активных веществ, имеющих отношение к регуляции АД.
Почечный механизм в регуляции системного кровотока и АД является наиболее важным. Почки являются основным органом, регулирующим постоянство содержания Na+ и воды в организме. Минимальные изменения содержания натрия и воды в организме сказываются на уровне АД. Изменения АД, в свою очередь, приводят к изменению скорости гломерулярной (клубочковой) фильтрации и реобсорбции натрия и воды с восстановлением водно-электролитного гомеостаза.
В зависимости от скорости развития и длительности адаптивных процессов все механизмы регуляции гемодинамики делят на три группы: кратковременного действия, промежуточного по времени действия, длительного действия.
К этим механизмам относятся:
1) баро- и хеморецепторные рефлексы,
2) рефлексы с рецепторов низкого давления предсердия и легочных вен,
3) реакция на ишемию ЦНС.
Важными зонами барорецепторов являются дуга аорты и каротидный синус (область разветвления сонной артерии на внутреннюю и наружную). При раздражении этих зон повышенным давлением происходит расширение резистивных сосудов, что приводит к уменьшению общего периферического сопротивления, а в емкостных сосудах происходит увеличение объема крови. И то и другое приводит к понижению системного артериального давления или за счет падения общего периферического давления, или путем уменьшения центрального венозного давления, венозного возврата, ударного объема и минутного объема крови.
Раздражителем для хеморецепторов этих зон (дуги аорты и каротидного синуса) является снижение напряжения кислорода и повышение напряжения углекислого газа или увеличение концентрации водородных ионов. Импульсы от хеморецепторов поступают в сердечно-сосудистый и дыхательный центры продолговатого мозга и вызывают рефлекторные реакции, изменяющие работу сердца и тонус сосудов, в результате артериальное давление повышается.
При раздражении рецепторов низкого давления предсердий и легочных вен увеличенным объемом циркулирующей крови происходит расширение периферических сосудов, особенно приносящих артериол почек, что приводит к увеличению емкости сосудистого русла и снижению артериального давления. Одновременно снижается выработка антидиуретического гормона в гипоталамусе, что вызывает увеличение диуреза и снижение объема циркулярной крови.
Реакция на ишемию центральной нервной системы возникает при: недостаточном кровоснабжении головного мозга, быстром падении артериального давления ниже 60 мм. рт. ст., снижении содержания кислорода в артериальной крови. Повышение содержания углекислого газа приводит к активации хеморецепторов продолговатого мозга. Происходит сужение сосудов, стимулируется сердечная деятельность и артериальное давление повышается.
Перечисленные механизмы включаются в первые секунды от момента изменения артериального давления и действуют в течение суток.
Регуляция системного артериального давления в этих случаях осуществляется за счет изменения емкости сосудистого русла и деятельности сердца.
К этим регуляторным механизмам относятся:
- механизм релаксации напряжения сосудов;
- изменение транскапиллярного обмена;
- ренин-ангиотензиновый механизм.
Повышению артериального давления препятствует механизм релаксации напряжения сосудов. Он заключается в постепенном возрастании растяжимости сосудов при увеличении внутрисосудистого давления. При уменьшении внутрисосудистого давления происходит обратный процесс, приводящий к повышению давления и носящий название обратной релаксации напряжения.
Изменения транскапиллярного обмена. Увеличение артериального или венозного давления сопровождается повышением давления в капиллярах, в результате чего увеличивается фильтрация жидкости в интерстициальное пространство, внутрисосудистый объем снижается. Это приводит к уменьшению давления. При уменьшении давления происходит обратный процесс.
Ренин-ангиотензиновый механизм. Протеолитический фермент ренин вырабатывается и хранится в почках. Поступая в кровь, этот фермент расщепляет ангиотензиноген (вырабатываемый в печени) и переводит его в ангиотензин I, под действием конвертаз плазмы ангиотензин I переходит в ангиотензин II. Эта реакция происходит в сосудах легких. В норме в активном состоянии ангиотензин II в крови находится 1-2 минуты.
Запуск этой реакции связан с величиной почечного кровотока. При снижении кровоснабжения почек выделение ренина увеличивается. Система ренин-ангиотензин реализует свое действие через клеточные рецепторы, которые опосредуют следующие физиологические эффекты этой системы: сужение сосудов и рост гладкомышечных клеток сосудов, повышение тонуса гладкомышечных клеток артериол, освобождение альдостерона, простациклинов, катехоламинов, вазопрессина, усиление реабсорбции натрия в канальцах почек, секрецию АКТГ и активацию гликогенолиза.
Ангиотензин II вызывает:
- генерализованный спазм резистивных сосудов, что приводит к увеличению общего периферического сопротивления, т.е. повышению постнагрузки миокарда,
- повышение чувствительности рецепторов к вазопрессину,
- активацию САС на разных уровнях,
- увеличение ОЦК (↓↓ выведения Н2О и натрия почками),
- снижение клубочковой фильтрации и повышение реабсорбции,
- стимуляцию синтеза вазопрессина,
- увеличение всасывания натрия и воды в кишечнике,
- повышение синтеза и секреции альдостерона.
Синтеза альдостерона усиливает реабсорбцию натрия и воды в почечных канальцах, что повышает объем циркулирующей крови и диастолическое наполнение полостей сердца, т.е. увеличение преднагрузки, активируя фактор роста способствует развитию гипертрофии миокарда, вызывает гипертрофию гладкомышечного слоя сосудов и снижает их эластичность. Сужение почечных сосудов под действием ангиотензина II и развитие в них соединительной ткани приводит к склерозу почек.
Чтобы ренин-ангиотензиновая система начала работать в полную силу требуется около 20 мин. далее система действует длительное время.
К этим механизмам относятся:
- почечно-объемный механизм;
- альдостероновый;
- вазопрессиновый.
Почечно-объемный механизм. Одним из наиболее важных факторов, определяющих величину системного артериального давления, является объем циркулирующей крови. Почки регулируют объем жидкости в организме не только путем изменения реабсорбции, но и за счет изменения скорости клубочковой фильтрации. При колебании давления от 75 до 160 мм.рт.ст. клубочковая фильтрация не изменяется. При повышении давления выше 160 мм.рт.ст. – скорость клубочковой фильтрации увеличивается, а значит возрастает выведение жидкости и натрия. Это приводит к:
- снижению объема внеклеточной жидкости и объема циркулирующей крови;
- снижению венозного возврата и сердечного выброса;
- снижению артериального давления до нормы.
При падении давления ниже 75 мм.рт.ст. происходят обратные процессы: почечная экскреция уменьшается, объем крови возрастает, венозный возврат и сердечный выброс увеличиваются и системное артериальное давление вновь повышается.
Альдостероновый механизм. Под действием альдостерона увеличивается канальцевая реабсорбция натрия, а значит и воды. Альдостерон повышает содержание в организме натрия и внеклеточной жидкости. Увеличение концентрации натрия приводит к усилению секреции антидиуретического гормона (вазопрессина), что сопровождается задержкой воды и увеличением объема циркулирующей крови. Задержка натрия повышает возбудимость гладких мышц сосудов к вазоконстракторным влияниям, усиливая прессорное действие ангиотензина II. Ангиотензин II стимулирует секрецию альдостерона. Повышенная продукция альдостерона приводит к артериальной гипертензии, а снижение – к артериальной гипостензии.
Вазопрессиновый механизм. Антидиуретический гормон играет особую роль в регуляции объема жидкости за счет реабсорбции воды. При повышении объема крови выделение вазопрессина снижается, что увеличивает выведение жидкости, при падении давления выброс вазопрессина увеличивается – выведение жидкости уменьшается, давление нормализуется.
Регуляторные механизмы длительного действия включаются через несколько часов после изменения величины системного артериального давления и функционируют длительное время.
Закрепление стойкой хронической гипертензии возможно только при участии механизмов длительного действия. Главным «обвиняемым» в таком закреплении в большинстве случаев являются почки.
Гуморальные факторы, влияющим на уровень системного артериального давления:
- почечные простагландины – расширяют почечные сосуды, повышают почечный кровоток, снижают ОПС, ингибируют эффекты АДГ, усиливают диурез и натрий-урез;
- калликреин-кининовая система – есиливают выработку простагландинов,
- предсердный натрийуретический пептид – снижает реабсорбцию воды и натрия, уменьшает синтез альдостерона и вазопрессина, расширяет сосуды, усиливают диурез и натрий-урез, снижают ОЦК и САД;
- эндотелий, зависимый релаксирующий фактор (оксид азота), которые обладают депрессорной активностью; он снижает содержание кальция, что → расслабляет гладкие миоциты сосудов → ↓ОПС и
↓САД.
- брадикинин, ацетилхолин - расслабляет гладкие миоциты сосудов → ↓ОПС и ↓САД,
- эндотелин, проявляющий прессорную активность.
Таким образом, величина артериального давления зависит от многих факторов, нарушение которых может приводить к изменению сосудистого тонуса.
Виды нарушений сосудистого тонуса
|
Гипертонические состояния |
|
|
![]()
![]()
![]()
![]()
|
Симптоматические гипертонии: - почечная, - эндокринная, - церебральная, - гипертония растормаживания, - регионарные гипертонии. |
|
Гипертони-ческая болезнь |
|
Острая: шок, коллапс, обморок |
|
Хроническая |
|
|
||||||
|
|
|
Симптоматические гипотонии: - токсико-инфекционные; - эндокринные; - послеродовые; - алиментарные. |
||||
|
|
|
|
||||
|
|
|
|
|
|
|
Гипотоническая болезнь |
Нарушения сосудистого тонуса.
Артериальная гипертензия – патологическое состояние, при котором САД превышает нормальный уровень.
По рекомендации ВОЗ за верхнюю границу нормы АД принято считать АД 140/90 мм.рт.ст. Превышение АД выше 160/95 мм.рт.ст. называется артериальной гипертензией. Снижение давления ниже 100/60 мм.рт.ст. называется гипотензией.
АГ дифференцируются:
1. По МОС (СО):
- гиперкинетические,
- эукинетические,
- гипокинетические.
2. По изменению ОПС:
- АГ со ↓ОПС,
- АГ с нормальным ОПС,
- АГ с ↑ОПС.
3. По ОЦК:
- гиперволемические,
- нормоволемические,
- гиповолемические.
4. По виду повышения САД:
- систолические,
- диастолические,
- смешанные.
5. По содержанию ренина в крови:
- гиперрениновые,
- норморениновые,
- гипорениновые.
6. По клиническому течению:
- доброкачественные,
- злокачественные.
Симптоматические вторичные гипертензии
Этот вид гипертензий является симптомом какого-либо основного заболевания и в ряде случаев определяет всю клиническую картину заболевания.
Выделяют два вида почечной гипертензии:
- реноваскулярная,
- ренопривная.
Почечная реноваскулярная гипертензия возникает при нефритах, кистах, инфарктах почек и сдавлении почечных артерий, т.е. во всех случаях ишемии паренхимы почек.
Ренин выделяется во всех случаях ишемии почек. Далее срабатывает промежуточный механизм регулирования артериального давления: ренин → ангиотензиноген → ангиотензин I → ангиотензин II → спазм сосудов, выравнивание давления. Если ишемии почек связана с кровопотерей, то эта реакция будет иметь компенсаторный характер. При ишемии почки, обусловленной сдавливанием почечной артерии, эти реакции приводят к еще большему спазму приносящих сосудов почки и дальнейшему повышению артериального давления. Это еще раз подчеркивает единство патогенных и защитных саногенетических механизмов в организме.
В основе патогенеза ренопривной гипертензии лежит угнетение синтеза и секреции почечных депрессорных факторов.
Эндокринные гипертензии. При гипертрофии задней доли гипофиза происходит сужение сосудов и длительный подъем артериального давления, т.к. в кровь поступает избыточное количество вазопрессина. Этот гормон вырабатывается нейросекреторными клетками гипоталамуса, а накапливается в задней доле гипофиза.
При патологии надпочечников также наблюдается подъем артериального давления. Это связано с тем, что в мозговом слое надпочечников вырабатывается адреналин, который обладает сильным сосудосуживающим действием, которое осуществляется тремя путями: непосредственным действием на гладкую мускулатуру сосудистой стенки, прямым возбуждением симпатических центров гипоталамуса, усилением секреции вазопрессина.
При гиперфункции коркового вещества надпочечников также повышается артериальное давление из-за гиперпродукции минералокортокоидов и глюкокортикоидов (альдостерон, кортикостерон, дезоксикортикостерон). При этом повышается реабсорбция натрия в почечных канальцах. Это приводит к гиперволемии и увеличению тканевого кровотока. Увеличенная концентрация минералокортокоидов повышает чувствительность сосудистой стенки к катехоламинам их прессорному действию при увеличении концентрации натрия в сосудистой стенке.
Церебральные гипертензии. Эти гипертонические состояния развиваются при травмах и сотрясениях головного мозга, энцефалитах. Основным механизмом развития таких гипертоний является повышение тонуса сосудодвигательного центра, обусловленного или ишемией головного мозга или повышением давления в желудочках мозга.
Сосудистая гипертензия «растормаживания» возникает в том случае, если нарушается импульсация, идущая к сосудодвигательному центру по синокаротидному и аортальному нервам от дуги аорты и синокаротидной зоны, которые в норме тормозят активность сосудодвигательного центра. Если нарушается проведение импульсов, то центр растормаживается и давление повышается.
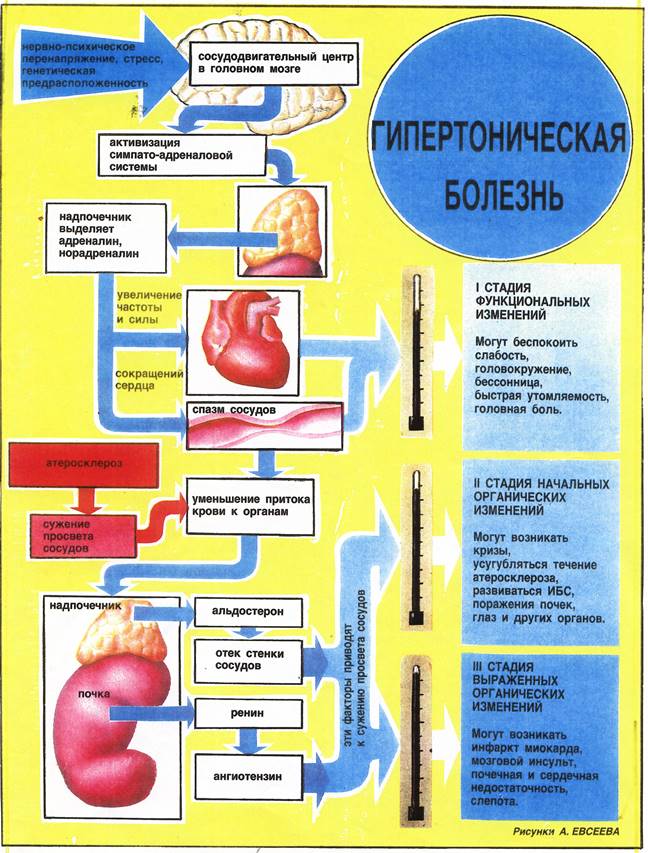
Гипертоническая болезнь или первичная (эссенциальная) гипертензия – полигенное мультифакторное заболевание с наследственной предрасположенностью, основным клиническим проявлением которого является стойкое хроническое повышение систолического и/или диастолического артериального давления. В основе патогенеза заболевания лежит высокая активность регуляторных прессорных механизмов длительного действия. На долю гипертонической болезни приходится до 95% случаев гипертензии. По течению, темпам развития, клинической картине различают доброкачественную и злокачественную формы первичной гипертензии. В большинстве случаев гипертоническая болезнь протекает стабильно и, если не осложняется инфарктом миокарда или инсультом, не представляет угрозу для жизни (доброкачественная форма). Однако, примерно в 5% случаев гипертоническая болезнь проявляется резким и выраженным подъемом системного артериального давления и без лечения заканчивается смертью (злокачественная гипертония).
Название эссенциальная означает, что до сих пор не установлен какой-либо один этиологический фактор этого заболевания.
Важное значение в патогенезе гипертензии имеет высшая нервная деятельность и ее перенапряжение под влиянием эмоциональных воздействий, особенно отрицательных эмоций, неотреагированных в двигательном акте. А.А Богомолец образно назвал гипертоническую болезнь так – это «болезнь осени жизни человека, которая лишает его возможности дожить до зимы». Г.Ф. Ланг назвал гипертоническую болезнь «болезнью неотреагированных эмоций» в результате чего возбуждается сосудодвигательный центр и повышается артериальное давление.
Факторы риска развития гипертонической болезни (ГБ):
- генетический фактор (ГБ часто имеет семейный характер);
- эмоциональный стресс, особенно длительное нервнопсихическое расстройство;
- диета с большим содержанием поваренной соли. Этот фактор сочетается с генетической предрасположенностью. Повышенное содержание в пище натрия сопровождается снижением в ней K+, Ca2+ и Mg2+, что играет определенную роль в патогенезе ГБ;
- гормональные факторы – усиление прессорных влияний гипоталамо-гипофизарной системы, избыток катехоламинов и активация ренин-ангиотензиновой системы;
- почечный фактор. При высокой активности ренин-ангиотензин-альдостероновой системы развивается вазоконстрикторная гипертензия, при низкой активности – гиперволемическая гипертензия;
- расовые факторы;
- тучность;
- курение и злоупотребление алкоголем;
- гиподинамия;
- профессиональные вредности (стрессовые профессии).
Этиология ГБ. Выделяют три основные причины ГБ:
- хроническое психоэмоциональное перенапряжение (Стресс);
- генетически обусловленный дефект почечного механизма регуляции артериального давления;
- наследственный дефект почечных насосов клеточных мембран, приводящий к нарушению обмена Ca2+ и Na+, что приводит к повышению рецепторов сосудов ко всем прссорным факторам.
Патогенез. В патогенезе ГБ выделяют два механизма повышения артериального давления – нейрогуморальный и гемодинамический.
Нейрогуморальные механизмы включают следующие факторы:
- симпатико-адреналовую систему, регулирующую содержание и активность катехоламинов;
- ренин-ангиотензин-альдостероновую систему;
- гормоны (АКТГ, кортизол, СТГ, АДГ и др.);
- прессорно-депрессорную системы (простагландиновая система и калликреин-кининовая).
Эти системы действуют на уровне сердца и сосудов, повышая тонус периферических артериол, и включают в патогенез ГБ вторую группу механизмов.
Гемодинамические механизмы. Эти механизмы повышают АД путем:
- задержки воды и Na+ в стенке сосудов;
- действия ангиотензина II;
- повышения уровня кальция в клетках;
- снижения депрессорных влияний.
В клинике гипертонической болезни выделяют три стадии.
Первая транзиторная стадия или стадия функциональных изменений.
Вторая стадия стойкого повышения артериального давления или стадия начальных органических изменений.
Третья стадия выраженных органических изменений.
Во вторую стадию формируются следующие порочные круги.
Почечный: спазм сосудов → ишемия почек → выброс ренина →спазм сосудов. Хеморецепторный: спазм сосудов → повышение чувствительности хеморецепторов к адреналину → малые дозы катехоламинов вызывают сильную реакцию → спазм сосудов. Эндокринный: спазм сосудов → ишемия передней доли гипофиза → гиперпродукция адренокортикотропного гормона → выброс минерало-кортикоидов (альдостерона) → спазм сосудов.
Барорецепторный: спазм сосудов → повышение артериального давления → торможение барорецепторов → гипертония растормаживания за счет отключения депрессорных механизмов → спазм сосудов.
Длительное стойкое повышение сосудистого тонуса приводит к атеросклеротическому повреждению сосудистой стенки, и гипертония переходит в III стадию органных изменений. Характерными особенностями этой стадии являются компенсаторная гипертрофия миокарда с последующим формированием сердечной недостаточности, развитием соединительной ткани в почках (синдром сморщенной почки) с закреплением почечного порочного круга на морфологическом уровне.
Формы гипертонической болезни
Мозговая форма. Кардиальная форма. Ренальная (почечная) форма.
Гипертоническая ретинопатия – поражение сосудов сетчатки глаз.
Наиболее серьезными осложнениями ГБ, нередко приводящими к смерти больного, являются:
- инфаркт миокарда – вследствие чрезмерной нагрузки на сердце быстро развивается коронарогенная форма сердечной недостаточности;
- инсульт головного мозга – высокое артериальное давление вызывает повреждение мозговых сосудов и кровоизлияния в мозг;
- хроническая почечная недостаточность – высокое артериальное давление вызывает кровоизлияния в почки и нарушение в них кровообращения, приводящие к деструкции ее ткани и нарушению функций (синдром первично сморщенной почки).
Принципы патогенетической терапии ГБ.
В транзиторную стадию применяют седативные препараты.
Во вторую стадию применяют препараты, снижающие сосудистый тонус и уменьшающие сердечный выброс.
В настоящее время для лечения ГБ применяют шесть основных групп препаратов: блокаторы медленных кальциевых каналов, диуретики, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, антагонисты ангиотензина II, α-адреноблокаторы. Лекарственную терапию проводят индивидуально по официальным рекомендациям. Немедикаментозная терапия показана всем больным.
Основные меры немедикаментозной терапии включают диету, снижение избыточной массы тела, достаточную физическую активность. Диета предусматривает ограничение потребления поваренной соли менее 6 г/сут., но не менее 1-2 г/сут. иначе может произойти компенсаторная активация ренин-ангиотензиновой системы; снижение в рационе доли углеводов и жиров; увеличение в рационе ионов калия; отказ от приема алкоголя.
Одно из непременных условий эффективности лечения заключается в разъяснении больному с ГБ особенностей течения болезни («Болезнь не излечивается, но АД эффективно снижается!»), длительности течения, вовлечения органов – мишеней, возможных осложнений при отсутствии контроля АД.
Эндотелий, его функция и дисфункция
Эндотелий представляет собой внутреннюю выстилку сосуда, отделяющую кровоток от более глубоких слоев сосуда, непрерывный монослой эпителиальных клеток, формирующих ткань, масса которой составляет 1,5-2,0 кг. Эндотелий непрерывно вырабатывает огромное количество важнейших биологически активных веществ, является, таким образом, гигантским паракринным органом, распределенным по всей площади человеческого организма. Эндотелий выполняет множество различных функций, в т.ч. барьерную (защитную), транспортную, синтетическую, эндокринную и др. Его главная роль состоит в поддержании гомеостаза путем регуляции равновесия противоположных процессов:
а) тонуса сосудов (вазодилатация или вазоконстрикция);
б) анатомического строения сосудов (синтез или ингибирование факторов пролиферации);
в) гемостаза (синтез и ингибирование факторов фибринолиза и агрегации тромбоцитов);
г) местного воспаления (выработка про- и противовоспалительных факторов).
Эндотелий выполняет ключевую функцию в регуляции тонуса и роста сосудов, процессов адгезии лейкоцитов и балансов профибринолитической и протромбогенной активности. Решающую роль при этом играет образующаяся в эндотелии окись азота (NO). Монооксид азота выполняет важную функцию в регуляции коронарного кровотока, а именно, расширяет или сужает просвет сосудов в соответствии с потребностью. Увеличение тока крови, например, при физической нагрузке, благодаря усилиям протекающей крови приводит к механическому раздражению эндотелия. Это механическое раздражение стимулирует синтез NO, который обуславливает релаксацию (расширение) мышц сосудов и таким образом действует сосудорасширяюще. При повреждении эндотелия равновесие нарушается в сторону вазоконстрикции. Это неравновесие между вазодилатацией и вазоконстрикцией характеризует состояние, которое называют эндотелиальной дисфункцией.
Под эндотелиальной дисфункцией понимают дисбаланс физиологических механизмов и биологических веществ, которые в норме обеспечивают гомеостаз и тонус сосудов.
Заболевания, связанные с эндотелиальной дисфункцией атеросклероз, гипертоническая болезнь, коронарная недостаточность, инфаркт миокарда, почечная недостаточность, посттрансплантационная болезнь реперфузии, диабет и инсулинорезистентность, эндокринные возрастные нарушения, не дыхательные легочные патологии (астма) и др., наследственные и приобретенные нарушения обмена (дислипидемия и др.).
Эндотелий интимы сосудов выполняет барьерную, секреторную, гемостатическую, вазотоническую функции, играет важную роль в процессах воспаления и ремоделирования сосудистой стенки.
Функции эндотелия Основные механизмы
Атромбогенность сосудистой стенки NO, t-PA, тромбомодулин и другие факторы
Тромбогенность сосудистой стенки Фактор Виллебранда, PAI-1, PAI-2 и другие факторы
Регуляция адгезии лейкоцитов Р-селектин, Е-селектин, ICAM-1, VCAM-1 и другие
молекулы адгезии
Регуляция тонуса сосудов Эндотелин, NO, PGI2 и другие факторы
Регуляция роста сосудов VEGF, FGFb и другие ростовые факторы
Нарушение функции эндотелия является одним из универсальных механизмов патогенеза многих заболеваний, в том числе и таких распространенных, как атеросклероз, гипертоническая болезнь, сахарный диабет и др. Задолго до клинических проявлений атеросклероза в интиме и субэндотелиальном слое артерий запускается сложный патогенетический механизм формирования атеромы. Дисфункция эндотелия имеет значение в развитии тромбоза, неоангиогенеза, ремоделирования сосудов, внутрисосудистой активации тромбоцитов и лейкоцитов и т.д. Преимущественное нарушение той или иной функции эндотелия зависит от локализации патологических процессов, преобладания тех или иных медиаторов воспаления, наличия гемодинамических сдвигов.
Результаты современных исследований позволяют считать, что эндотелиальная дисфункция – один из важнейших независимых факторов риска при диабете, атеросклерозе, гипертонии, сепсисе, росте числа злокачественных заболеваний.
Эндотелиальная дисфункция может быть определена как неадекватное (увеличенное или сниженное) образование в эндотелии различных биологически активных веществ. Одним из методов оценки выраженности эндотелиальной дисфункции является оценка содержания в крови этих веществ или исследование содержания в крови факторов, повреждающих эндотелий, уровень которых коррелирует с эндотелиальной дисфункцией. К таким факторам (медиаторам повреждения эндотелия) относятся: гиперхолестеринемия, гипергомоцистеинемия, цитокины (IL-1b, TNFα, IL-8 и др.).
По скорости образования в эндотелии различных факторов (что связано во многом и с их структурой), а также по преимущественному направлению секреции этих веществ (внутриклеточная или внеклеточная) можно разделить вещества эндотелиального происхождения на следующие группы:
Факторы, постоянно образующиеся в эндотелии и выделяющиеся из клеток в базолатеральном направлении или в кровь (NO, простациклин).
Факторы, накапливающиеся в эндотелии и выделяющиеся из него при стимуляции (фактор Виллебранда, Р-селектин, тканевой активатор плазминогена). Эти факторы могут попадать в кровь не только при стимуляции эндотелия, но и при его активации и повреждении.
Факторы, синтез которых в нормальных условиях практически не происходит, однако резко увеличивается при активации эндотелия (эндотелин-1, ICAM-1, VCAM-1, Е-селектин, PAI-1).
Факторы, синтезируемые и накапливающиеся в эндотелии (t-PA) либо являющиеся мембранными белками (рецепторами) эндотелия (тромбомодулин, рецептор протеина С).
Дисфункция эндотелия может быть самостоятельной причиной нарушения кровообращения в органе, поскольку нередко провоцирует ангиоспазм или тромбоз сосудов, что, в частности, наблюдается при некоторых формах ишемической болезни сердца. С другой стороны, нарушения регионарного кровообращения (ишемия, венозный застой) тоже могут приводить к дисфункции эндотелия.
Артериальные гипотензии
Нормальное распределение и передвижение крови зависит от тонуса, артерий, вен, деятельности сердца и регуляции центральной нервной системы. От тонуса вен зависит распределение и передвижение крови по венозной системе. Тонус вен является важным фактором, определяющим приток крови к сердцу, а значит и силу сердечных сокращений. На приток крови к сердцу влияет и присасывающее действие грудной клетки.
Артериальной гипотензией называют состояния, при которых давление падает ниже 90 мм.рт.ст., сопровождающееся появлением ряда патологических симптомов: слабость, потливость, головокружение, обморок.
Такое состояние может наблюдаться при уменьшении минутного объема крови и/или снижении общего периферического сопротивления.
Артериальная гипотензия может возникать в результате нарушений прессорных регуляторных механизмов, участвующих в поддержании уровня системного артериального давления.
Артериальная гипотензия может быть обусловлена понижением тонуса резистивных сосудов. Чаще всего гипотония возникает у лиц астенической конституции, характеризующейся понижением физического развития и питания, общей адинамией, быстрой утомляемостью, тахикардией, одышкой, головокружением, головной болью, обмороками, депрессией с периодическим повышением нервной возбудимости.
Выделяют артериальную гипотензию физиологическую (не сопровождается патологическими симптомами) и патологическую с характерным патологическим симптомокомплексом. По происхождению выделяют две формы гипотензии: первичную или эссенциальную и вторичную – симптоматическую. По характеру течения патологическая гипотония бывает острой и хронической.
По патогенезу различают три гемодинамические формы артериальной гипотензии: связанную с недостаточностью сократительной функции сердца; вызванную уменьшением количества циркулирующей крови; возникающую в результате понижения тонуса резистивных сосудов.
Эссенциальная гипотензия (гипотоническая болезнь) называется еще нейроциркуляторной (вегетососудистой) дистонией. Чаще возникает у молодых людей с астенической конституцией. Главным этиологическим и патогенетическим фактором первичной гипотензии является перенапряжение основных процессов коры больших полушарий с превалированием процесса торможения, распространяющегося на подкорковые вегетативные образования, в том числе на сосудодвигательный центр. В результате торможения этого центра ослабевает его влияние на сосуды, что является непосредственной причиной снижения тонуса резистивных сосудов и артериального давления.
Симптоматическая артериальная гипотензия (вторичная) является следствием ряда общих соматических заболеваний. Гипотензия сопутствует:
Эндокринным нарушениям: недостаточность секреции глюко- и минералокортикоидов, приводящая к уменьшению внеклеточной жидкости; первичная недостаточность надпочечников; гипотиреоз (недостаточность функции щитовидной железы); синдром несахарного диабета.
Сердечно-сосудистым заболеваниям: инфаркт миокарда; миокардит; стеноз устья аорты; митральный стеноз; крово- и плазмопотеря; обмороки сердечно-сосудистого происхождения.
Нейрогенным нарушениям: дессиминированный склероз; периферические и диабетические нейропатии; прием препаратов, обладающих гипотензивным эффектом.
Чаще всего наблюдается преходящая ортостатическая гипотензия, реже наблюдается развитие длительной гипотензии.
Ортостатическая гипотензия – резкое снижение артериального давления (систолического на 20 мм.рт.ст. и диастолического более 10 мм.рт. ст.), обусловленное нарушением его регуляции. В норме при быстром переходе из лежачего горизонтального положения в вертикальное (стоячее) положение создаются условия для депонирования крови в емкостных сосудах ног и нижней части тела, что приводит к уменьшению притока крови к сердцу, снижению сердечного выброса и умеренному снижению артериального давления. Это раздражает барорецепторы дуги аорты и каротидных синусов, что активирует вегетативные рефлексы. Увеличивается выброс катехоламинов, повышается тонус резистивных сосудов, увеличивается сократимость сердца, нормализуются сердечный выброс и артериальное давление. Следовательно, ортостатическая гипотензия является физиологическим явлением.
Одной из наиболее частых причин артериальной гипотензии является поражение вегетативной нервной системы, при котором снижается адренергическая (катехоламиновая) реакция на вставание. Такая ортостатическая гипотензия наблюдается при сахарном диабете, амилоидозе, пернициозной анемии, алкоголизме, тяжелой форме варикозного расширения вен. Ортостатическая гипотензия может быть обусловлена снижением чувствительности барорецепторов. В этих случаях некоторые химические и лекарственные препараты вызывают более значительное снижение артериального давления при быстрой перемене положения тела.
К лекарственным препаратам, нарушающим вегетативные рефлекторные механизмы контроля артериального давления, относятся гипотензивные препараты (ганглиоблокаторы, блокаторы β-адренорецепторов, вазодилататоры и др.).
Общий упрощенный патогенез гипертонической болезни
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.