
 |
Из 118 известных на данный момент химических элементов 96 образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
 Металлические химические
элементы в природе могут встречаться как в виде простых веществ, так и в виде
соединений. То, в каком виде встречаются металлические элементы в природе,
зависит от химической активности образуемых ими металлов.
Металлические химические
элементы в природе могут встречаться как в виде простых веществ, так и в виде
соединений. То, в каком виде встречаются металлические элементы в природе,
зависит от химической активности образуемых ими металлов.
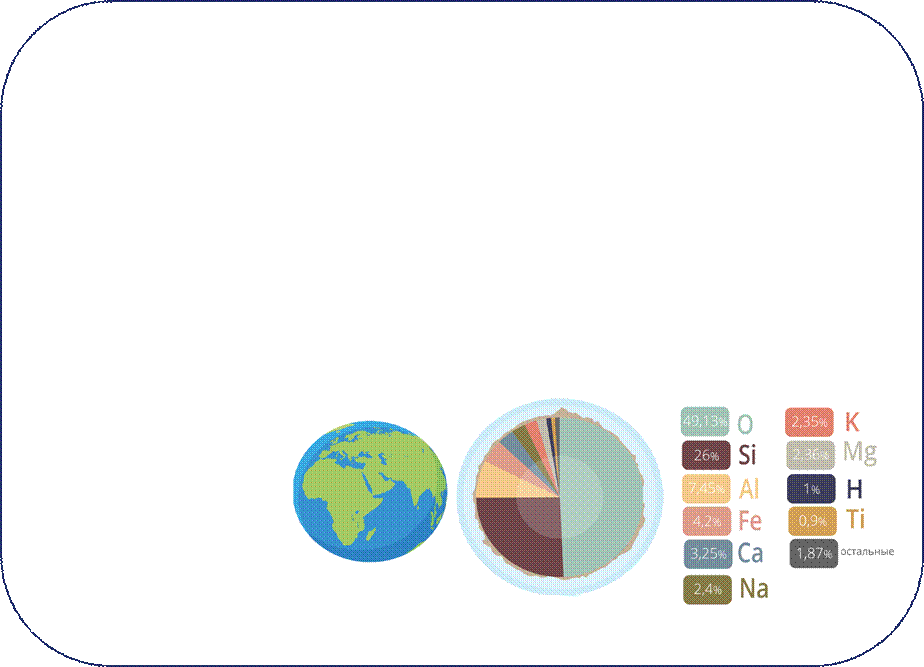
Алюминий Al — 7,5 %.
Железо Fe — 4,7 %.
Кальций Ca — 3,4 %.
Натрий Na — 2,6 %.
Калий K — 2,4 %.
Магний Mg — 1,9 %.
Водород H — 0,9 %.
Титан Ti — 0,9 %.



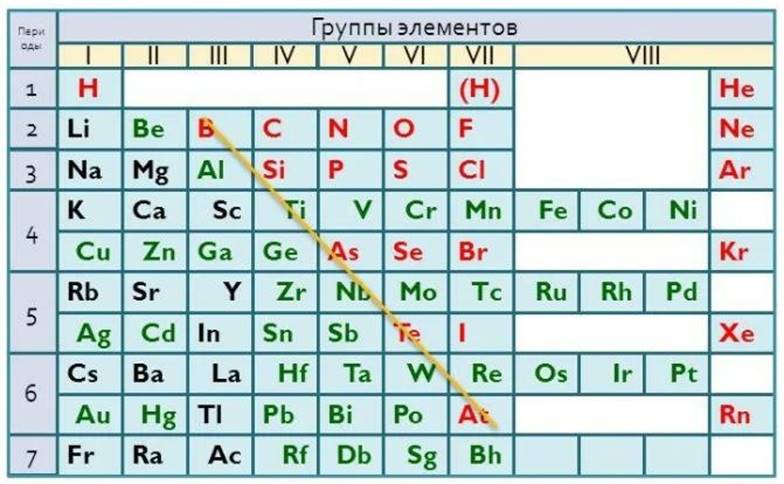
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах. От неметаллов их отделяет ступенчатая линия водород — бор — оганесон.

 |
 кристаллической
решѐтки металлов: в узлах кристаллической решѐтки находятся как
электрически нейтральные, так и положительно заряженные катионы металлов, а
между ними свободно перемещаются Кристаллическая решѐтка
металлов:
кристаллической
решѐтки металлов: в узлах кристаллической решѐтки находятся как
электрически нейтральные, так и положительно заряженные катионы металлов, а
между ними свободно перемещаются Кристаллическая решѐтка
металлов:
отрицательно заряженные электроны (электронный газ).в узлах кристаллической решѐтки находятся как электрически
нейтральные, так и положительно
За счѐт наличия в кристаллах свободно движущихся электронов для
большинства металлов характерны общие физические свойствазаряженные катионы металлов, а между
ними свободно перемещаются
отрицательно заряженные электроны (электронный газ).
За счѐт наличия в кристаллах свободно движущихся электронов для большинства металлов характерны общие физические свойства.
Агрегатное состояние и цвет металлов
При обычных условиях все металлы (за исключением ртути, еѐ температура плавления — –39 °C) являются твѐрдыми веществами.
Способность металлов отражать падающий на них свет
Аллотропия является причиной наличия у них особого металлического блеска. Из 118 известных на данный момент химических элементов 22 элемента
Металлыобразуют простые вещества, обладающие неметаллическими свойствами. не имеют запаха.
Неметаллических простых веществ намного больше, чем самих
 В своѐмнеметаллических химических элементов. Причиной тому служит большинстве
металлы имеют серебристо-белый или существование
явления, называемого аллотропией. серебристо-серый цвет. Исключение
составляют медь (красного цвета) и золото (жѐлтого цвета).
В своѐмнеметаллических химических элементов. Причиной тому служит большинстве
металлы имеют серебристо-белый или существование
явления, называемого аллотропией. серебристо-серый цвет. Исключение
составляют медь (красного цвета) и золото (жѐлтого цвета).
В технике металлы принято подразделять на чѐрные и цветные. Как правило, к чѐрным металлам относят железо и его сплавы, а к цветным — все остальные металлы.
 Характер изменения радиусов атомов химических элементов в периодах
Металлы
хорошо проводят и в группахтепло. Все металлы хорошо проводят электрическийРадиусы атомов неметаллов существенно меньше, чем радиусы атомов ток, что
обусловлено наличием в кристаллической решѐтке электронов,металлов, находящихся в том же периоде. которые
способны свободно перемещаться. Очень хорошими проводниками
электрического тока являются золото Au, медь Cu и серебро Ag.
Характер изменения радиусов атомов химических элементов в периодах
Металлы
хорошо проводят и в группахтепло. Все металлы хорошо проводят электрическийРадиусы атомов неметаллов существенно меньше, чем радиусы атомов ток, что
обусловлено наличием в кристаллической решѐтке электронов,металлов, находящихся в том же периоде. которые
способны свободно перемещаться. Очень хорошими проводниками
электрического тока являются золото Au, медь Cu и серебро Ag.
Металлы в большинстве своѐм пластичны. Их можно ковать, вытягивать в проволоку и прессовать. Исключение составляют сурьма и висмут, они хрупкие и от удара рассыпаются.
 Температура плавления металлов
изменяется в широком интервале: от –39 °C у ртути до 3420 °C у вольфрама. По
температуре плавления металлы условно подразделяют на: легкоплавкие
(температура плавления до 1000 °C); среднеплавкие (температура плавления
от 1000 °C до 1600 °C);
Температура плавления металлов
изменяется в широком интервале: от –39 °C у ртути до 3420 °C у вольфрама. По
температуре плавления металлы условно подразделяют на: легкоплавкие
(температура плавления до 1000 °C); среднеплавкие (температура плавления
от 1000 °C до 1600 °C);
Характер изменения радиусов атомов химических элементов в периодах тугоплавкие (температура плавления выше 1600 °C). и в группах
ПлотностьРадиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде.
Плотность различных металлов также колеблется в сравнительно широких пределах: от 0,53 г/см³ у лития до 22,61 г/см³ у осмия.
По плотности металлы принято подразделять на лѐгкие (плотность меньше 5 г/см³) и тяжѐлые (плотность свыше 5 г/см³).
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
v благородные металлы (серебро, золото, платина);
v щелочные металлы (металлы, образованные элементами IА группы периодической системы);
Характер изменения радиусов атомов химических элементов в периодах v щелочноземельные металлыи в группах (кальций, стронций, барий, радий ).
Радиусы атомов неметаллов существенно меньше, чем радиусы атомов
 Простые вещества,металлов, находящихся в том же периоде. обладающие
металлическими свойствами, в химических реакциях
всегда являются восстановителями. Положение металла в ряду активности
характеризует то, насколько активно данный металл способен вступать в химические
реакции (т. е. то, насколько сильно у него проявляются свойства
восстановителя).
Простые вещества,металлов, находящихся в том же периоде. обладающие
металлическими свойствами, в химических реакциях
всегда являются восстановителями. Положение металла в ряду активности
характеризует то, насколько активно данный металл способен вступать в химические
реакции (т. е. то, насколько сильно у него проявляются свойства
восстановителя).
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
 Металл
+ кислород → оксид Mg +
O2→ ___________
Металл
+ кислород → оксид Mg +
O2→ ___________
серебро,
K + O2 → ___________ золото, Ca + O2→ ___________ не реагируют Al + O2→ ___________
с кислородом платина
 2. Металлы взаимодействуют с
галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
2. Металлы взаимодействуют с
галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид
Mg + Cl2→ ___________
K + Br2→ ___________ Na + F2→ ___________ Al + I2→ ___________

Общие химические свойства металлов
 4. Активные
металлы взаимодействуют с азотом, фосфором, образуя нитриды и фосфиды.
4. Активные
металлы взаимодействуют с азотом, фосфором, образуя нитриды и фосфиды.
Металл + азот →нитрид
Ca + N2 → ___________
Металл + фосфор→фосфид
Ca + Р → ___________ K + Р → ___________ Na + Р → ___________
 1. Щелочные и щелочноземельные
металлы взаимодействуют с водой при обычных условиях, образуя растворимое в
воде основание (щѐлочь) и водород.
1. Щелочные и щелочноземельные
металлы взаимодействуют с водой при обычных условиях, образуя растворимое в
воде основание (щѐлочь) и водород.
Активный металл + вода → основание + водород
 1. Некоторые
металлы средней активности реагируют с водой при повышенной температуре,
образуя оксид металла и водород.
1. Некоторые
металлы средней активности реагируют с водой при повышенной температуре,
образуя оксид металла и водород.
Средней активноти металл + вода → оксид + водород
неактивные металлы + вода →
реакции нет
 2. Mеталлы, стоящие в ряду
активности металлов левее водорода, взаимодействуют с растворами кислот,
образуя соль и водород.
2. Mеталлы, стоящие в ряду
активности металлов левее водорода, взаимодействуют с растворами кислот,
образуя соль и водород.
металл + кислота → соль + водород Al + H2SO4 → ___________
неактивные металлы + кислота →
реакции нет
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
 металл
+ соль → новая соль + новый металл Al + FeSO4
→ ___________
металл
+ соль → новая соль + новый металл Al + FeSO4
→ ___________
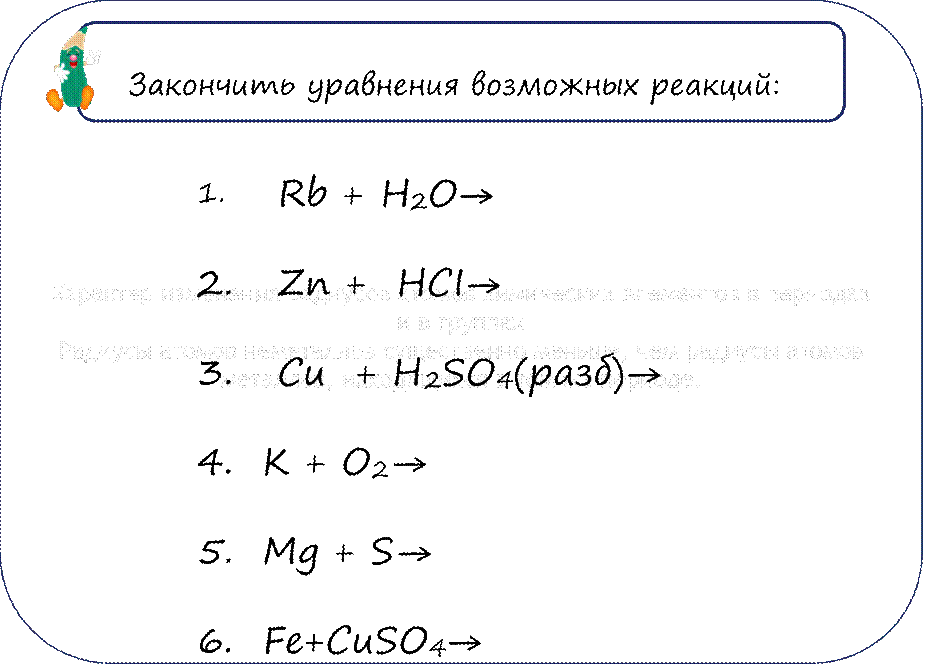
Закончить уравнения возможных реакций:
 Характер
изменения радиусов атомов химических элементов в периодах 2. Fe+
CI2→
Характер
изменения радиусов атомов химических элементов в периодах 2. Fe+
CI2→
и в группах
Радиусы атомов неметаллов существенно меньше, чем радиусы атомов 3.металлов, находящихся в том же периоде. Au+ H2SO4(разб)→
4. Cu+ O2→
5. AL+Pb(NO3)2→
6. Cu+H2SO4(разб)→
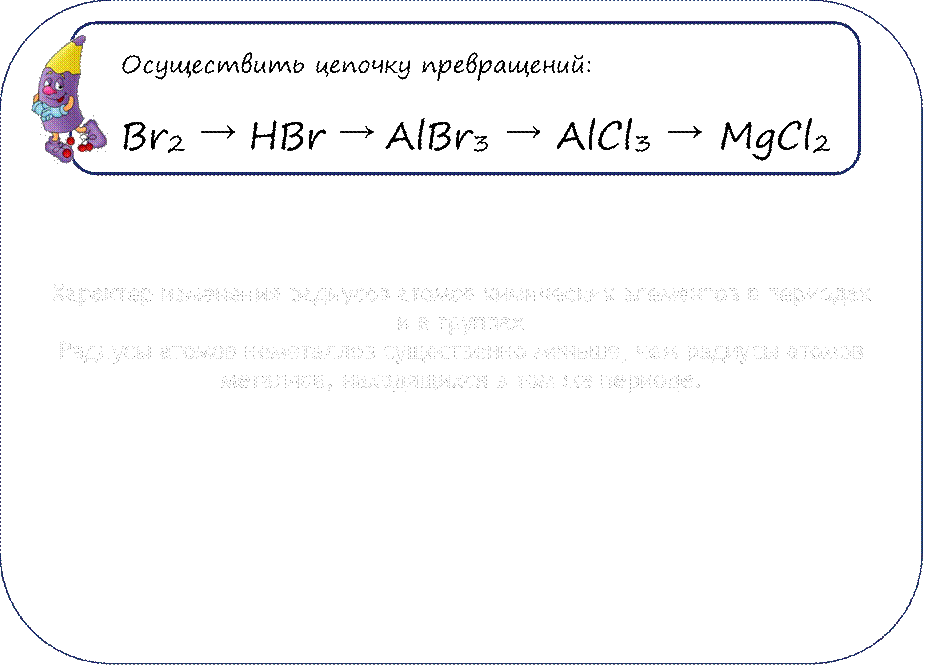

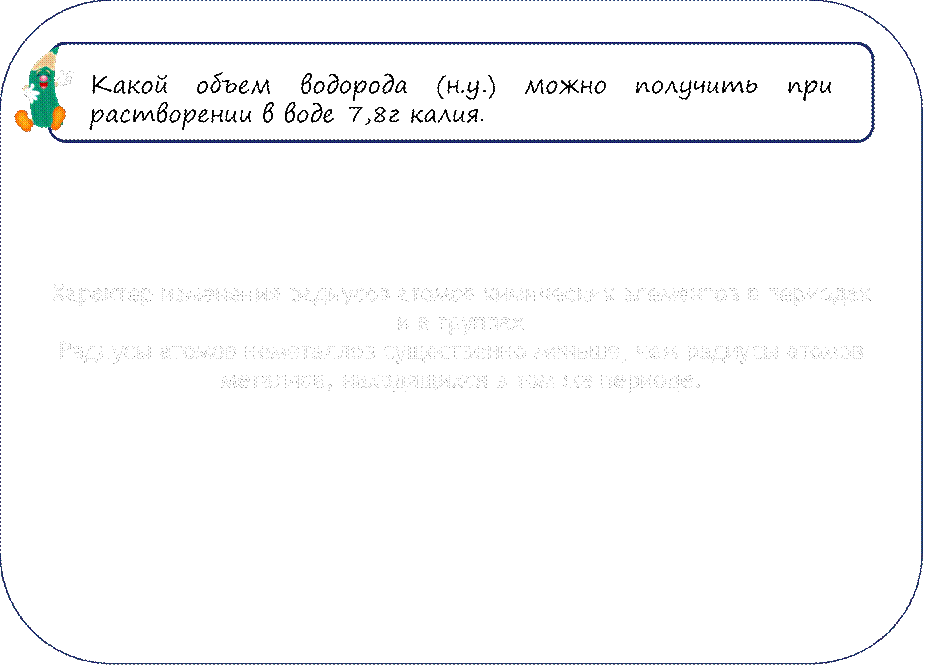



Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.