
Занятие 22
Тема. Основное уравнение молекулярно-кинетической теории газов.
Связь между давлением идеального газа и средней кинетической энергией теплового движения его молекул.
Цели: усвоить понятия идеального газа, основное уравнение МКТ; на основе МКТ установить количественную зависимость давления газа от массы одной молекулы и среднего квадрата скорости ее движения; воспитывать ответственное отношение к учебе, положительное отношение к предмету физики.
Тип занятия: комбинированный.
Ход занятия.
1. Организационный момент.
2.Проверка домашнего задания
Упражнение 11 (5)
Чему равно число молекул в 10 г кислорода?
Дано: Решение:
m=10 г =10·10-3 кг N=Na·m/M= 6,02·1023 ·10-4/32·10-3 =1,8·1023
М=32·10-3 кг/моль
N=?
Ответ: 1,8·1023
3. Знакомство аудитории с темой и целью занятия.
Мотивация учебной деятельности студентов.
4 .Изучение нового материала.
1. Макроскопические параметры.
Состояние газа (так же как жидкости и твердого тела) может быть описано и без рассмотрения молекулярного строения вещества. Это делают с помощью макроскопических величин, совокупность которых однозначно определяет состояние системы. Такие величины называют параметрами состояния (или термодинамическими параметрами). Параметрами состояния любой системы являются ее объем, давление и температура. Если в каком-либо процессе изменяется хотя бы один из параметров состояния системы, то и само состояние системы становится другим.
Величины, характеризующие состояние макроскопических тел без учета их внутреннего строения называются макроскопическими параметрами.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу. При высоких давлениях молекулы газа настолько сближаются, что пренебрегать их собственными размерами нельзя. При понижении температуры кинетическая энергия молекул уменьшается и становится сравнимой с их потенциальной энергией, следовательно, при низких температурах пренебрегать потенциальной энергией нельзя.
При высоких давлениях и низких температурах газ не может считаться идеальным. Такой газ называют реальным. (Поведение реального газа описывается законами, отличающимися от законов идеального газа.)
2. Идеальный газ
Известно, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг относительно друга на расстояниях, существенно превышающих их собственные размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше энергии межмолекулярного взаимодействия. Для выяснения наиболее общих свойств, присущих всем газам, используют упрощенную модель реальных газов - идеальный газ. Основные отличия идеального газа от реального газа:
1. Частицы идеального газа -
сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно упругими.
Следует отметить, что разреженный водород (под очень маленьким давлением) практически полностью удовлетворяет модели идеального газа
2. Основное уравнение молекулярно-кинетической теории идеального газа.
Давление газа определяется столкновением молекул газа со стенками сосуда.
В СИ за единицу давления принимают 1 Па.
Давление, при котором на площадь 1 м2 действует сила давления в 1 Н, называется Паскалем.
1мм. рт. ст. = 133 Па
1атм = 101325 Па
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами - массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа.
Поскольку давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул n: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы, равном по модулю m0υ, где υ- модуль скорости молекулы. Поэтому можно было бы ожидать, что давление пропорционально nm0υ, где υ- среднее значение модуля скорости молекул.
Однако, на самом деле давление пропорционально не первой, а второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. И действительно, расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
![]()
где m0
- масса одной молекулы газа, n -
концентрация молекул, ![]() -
среднее значение квадрата скорости молекул.
-
среднее значение квадрата скорости молекул.
Коэффициент 1/3 обусловлен трехмерностью пространства - тем, что во время хаотического движения молекул все три направления равноправны.
Итак, немецкий физик Г. Клаузиус выяснил, что давление идеального газа прямо пропорционально концентрации частиц, массы частицы и среднего значения квадрата скорости частицы.
Полученное уравнение связывает макроскопічну величину - давление,- что может быть измерено манометром, с микроскопическими величинами, характеризующими молекулы, и является как бы мостиком между двумя мирами: макроскопическим и микроскопическим.
3. Связь давления со средней кинетической энергией молекулы
Если через ![]() обозначить среднюю кинетическую
энергию поступательного движения молекулы,
обозначить среднюю кинетическую
энергию поступательного движения молекулы, 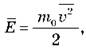 то уравнение Клапейрона можно
записать в виде:
то уравнение Клапейрона можно
записать в виде:
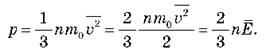
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы В этой формуле концентрация частиц характеризует число ударов молекул о поршень, а средняя кинетическая энергия молекул определяет интенсивность одного удара.
4. Решение задач.
Задача №1.
Кислород находится в нормальных условиях. Вычислите среднюю квадратичную скорость молекул газа.
Решение.
При нормальных условиях давление кислорода равна 1,01·105 Па, а плотность - 1,43 кг/м3. Считая, что концентрация газа n = N/V, можно записать:
![]()
Отсюда получаем: ![]()
Проверив единицы величин и выполнив
расчеты, получаем ![]() =
460 м/с.
=
460 м/с.
Задача №2. Определите кинетическую энергию хаотического поступательного движения всех молекул любого газа в баллоне объемом 5 л с давлением 1 МПа.
Задача №3. Чему равна средняя кинетическая энергия хаотического движения молекул аргона, если 2 кг его, находясь в сосуде объемом 2 м3, оказывают давление 3·105 Па?
5. Закрепление изученного на занятии.
1.Что такое макроскопические параметры?
2. Какие величины относятся к их числу?
3.Изменяется ли состояние системы при изменении одного такого параметра?
4. Какой газ называют идеальным? Что является моделью идеального газа?
5. При каких условиях газ по своим свойствам близок к идеальному? При каких условиях и почему газ не может считаться идеальным?
6.Каков механизм возникновения давления газа с точки зрения молекулярно-кинетической теории строения вещества?
7. Почему можно считать, что молекулы в газе движутся только вдоль трех взаимно перпендикулярных направлений?
6. Задание на дом.
§ 61, § 63, Физика 10 класс Г.Я. Мякишев, Б.Б Буховцев, записи в тетради, упр. 11 (задачи 8,9)
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.