
Открытый урок по химии
в 9-м классе
на тему «Оксиды углерода (II) и (IV).
Задачи: 1) Образовательная – сформировать знания о строении молекул оксидов угле-рода (II) и (IV), их физических и химических свойствах, получении и при-менении, о важнейших карбонатах (кальцит, сода, поташ), их значении и применении, о распознавании карбонатов, переходе карбонатов в гидро-карбонаты и обратно.
2) Развивающая – развивать навыки обращения с лабораторным оборудова-нием и химическими реактивами, знания о соединениях углерода.
3) Воспитательная – воспитывать убеждённость в познаваемости мира ве-ществ, а также внимательность и наблюдательность.
Форма организации: классный урок.
Тип урока: комбинированный.
Методы: словесный (беседа, рассказ), наглядно-демонстрационный.
Оборудование: школьный учебник, мел, штатив с пробирками, шпатели, трубочка, резиновые пробки, пробирка для собирания газов, лучинка, спички.
Вещества: кусочки мела, раствор соляной кислоты, известковая вода, карбонат натрия, раствор хлорида кальция, вода.
Ход урока.
I. Организация начала урока. Приветствие, отметка присутствующих.
II. Проверка домашнего задания.
1) вопросы 1-5 на стр. 133-134 учебника.
2) Заполните паспорт Господина Углерода (название, адрес, особенности внутрен-него мира, ближайшие родственники, география минералов).
3) Доклад об алмазе – Мармалёв Олег (из книги для чтения).
4) Доклад о графите – Сарсенбаев Асылбек (из книги для чтения).
5) Что называют адсорбцией? Пропустите метилоранж через активированный уголь. Что вы наблюдаете? (один ученик проводит опыт).
6) Какими химическими свойствами обладает углерод? (один ученик у доски).
7) Как происходит круговорот углерода в природе?
8) Что произойдёт, если вдруг на мгновение с лица Земли исчезнут атомы углеро-да?
9) Что случилось бы с алмазными подвесками королевы Франции, если бы судно, на котором их вёз д′-Артаньян, подожгли?
10) Стихотворение «Углерод» читает Магомедгаджиева Марьям.
Углерод.
Из элемента углерода
(В таблице он шестым стоит)
И были созданы природой
Алмаз, и уголь, и графит.
Алмаз – прозрачные кристаллы.
Он самый твёрдый минерал.
Алмазом можно резать скалы,
До блеска шлифовать металл.
Что бриллиантом называют?
Бриллиант – шлифованный алмаз.
Так ослепительно сияет,
Что завораживает нас.
Графит – совсем другое дело,
Другое вещество, точней.
Его с углём сравним мы смело,
Так легче суть познать вещей.
Не все сравнения удачны…
Нам повезло на этот раз:
Графит и уголь не прозрачны
И не сверкают, как алмаз.
Три вещества так не похожи –
Алмаз, и уголь, и графит.
Но что в них общего? Но что же
Три этих вещества роднит?
Все вещества одной природы,
И формула у них одна.
Все состоят из углерода,
И все – простые вещества.
Так аллотропия предстала,
Родство веществ обосновала:
Элементарный углерод
Три вещества простых даёт.
Графит ли, уголь ли сжигают
Или сверкающий алмаз,
А в результате получают
Всё тот же углекислый газ:
С + О2 = СО2
III. Формирование новых знаний.
1) Отгадайте загадку: В минеральной воде я бурлю,
В топочном газе летаю,
Растениям пользу несу,
Пожар затухать заставляю. (Углекислый газ)
2) Незадолго до урока была обнаружена древняя рукопись, предназначенная уча-щимся 9-го класса. Давайте его прочтём.
«Чада мои! Дозвольте поведать вам о государстве нашем, ежели оно вам по сердцу. Государство наше таково, что формулы веществ нащих состоят только из двух элементов. И главным является Кислород. А теперь аз есмь желаю знати: ве-даете ли вы, как именуется оно? Огласите ваши примеры.
К сему руку приложил Углекислый газ.»
Прочитав рукопись, учащиеся приходят к выводу, что государство это именуется оксиды. Далее учащиеся записывают тему урока.
3) Изучив новую тему, в конце урока ответьте на вопрос: «Какую воду можно за-мутить своим дыханием?»
Угарный газ СО – бесцветный газ, малорастворим в воде, ядовит. СО + Hb = карбоксигемоглобин. 0,1 % СО в воздухе – человек теряет сознание и умирает. СО образуется при неполном сгорании топлива => опасно преждевременное закрыва-ние дымоходов. СО – несолеобразующий оксид, хороший восстановитель, сгорает в кислороде до СО2: 2СО + О2 = 2СО2↑ Fe2O3 + 3CO = 2Fe + 3CO2↑
CO применяется в металлургии при выплавке чугуна.
Углекислый газ СО2 – бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха, при обычных условиях в 1 объёме воды растворяется 1 объём углекислого газа. При давлении в 60 атмосфер CO2 превращается в бесцветную жидкость. При испа-рении жидкого СО2 образуется снегообразная масса, которую прессуют – «сухой лёд» - для хранения пищевых продуктов. Вы уже знаете, что твёрдый СО2 имеет молекулярную решётку, способен к возгонке (что это такое?).
СО2 – кислотный оксид (реагирует со щелочами, основными оксидами и водой).
СО2 + NaOH = NaHCO3 СО2 + 2NaOH = Na2CO3 + H2O
СО2 + Ca(OH)2 = CaCO3↓ + H2O СО2 + CaO = CaCO3 СО2 + H2O = H2CO3
Угольная кислота H2CO3 – неустойчивая, равновесие смещается влево.
СО2 не горит и не поддерживает горение, однако магний Mg горит в СО2:
СО2 + 2Mg = 2MgO + С (сажа)
Получение СО2: 1) в лаборатории СаСО3 + 2HCl = CaCl2 + H2O + СО2↑
Как распознают и собирают СО2?
2) в промышленности обжигом известняка СаСО3 → СаО + СО2↑
Угольная кислота H2CO3 – двухосновная кислота => 2 ряда солей: 1) средние – карбонаты и 2) кислые – гидрокарбонаты. Из карбонатов в воде растворимы только соли К+, Na+, NH4+. Кислые соли растворимы в воде.
CaCO3 + H2O + СО2 (изб.) → Сa(HCO3)2.
Временная (карбонатная) жёсткость – Жк : Сa(HCO3)2 и Mg(HCO3)2 удаляют кипячением: Сa(HCO3)2 → CaCO3↓ + H2O + СО2↑ образуется накипь на стенках котлов, труб парового отопления и домашних чайников. В природе – в кар-стовых пещерах свисающие вниз сталактиты (в учебнике рис. 45 стр. 136).
Постоянная (некарбонатная) жёсткость – Жн : CaCl2 , MgCl2 , CaSO4 ,MgSO4 устраняется содой: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Соду можно использовать и для устранения временной жёсткости.
![]() CO32- + 2Н+
= H2O + СО2↑ качественная
реакция на соли
CO32- + 2Н+
= H2O + СО2↑ качественная
реакция на соли
HCO3- + Н+ = H2O + СО2↑ угольной кислоты
О применении важнейших карбонатов Na2CO3 , CaCO3 , К2CO3 , (NН4)2CO3 и гидрокарбонатов NaHCO3 и NН4HCO3 вы уже знаете.
IV.Первичная проверка понимания
Учитель предлагает использовать дополнительные материалы, которые лежат на столах для получения информации, необходимой для заполнения таблицы. Учащиеся изучают эту информацию.
1 группа Строение молекул СО и СО2
I. Угарный газ — оксид углерода (II)
Рассмотрение строения СО начните с определения степени окисления элементов С+2 О-2 и соответственно с вывода, сколько электронов передал в общее пользование атом углерода (два), а значит, и сколько электронов оттянул к себе более электроотрицательный кислород — два.
![]()
Однако дальнейшее рассмотрение строения СО показывает, что при таком раскладе у углерода не будет заветной восьмерки электронов на внешнем уровне — четыре своих и два общих с атомом кислорода. Как быть? Очевидно, атому кислорода придется передать в общее пользование одну свою свободную электронную пару, т. е. выступить в качестве донора. Акцептором, разумеется, будет атом углерода:
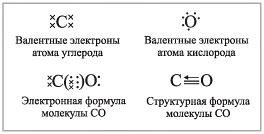
т.е. ковалентных связей будет три, а оттянутых от углерода к кислороду электронов — два (с. о. +2).Связь в молекуле СО – ковалентная полярная. Число смещенных от углерода к кислороду электронов – два, значит степень окисления атома углерода +2. У атома углерода в молекуле СО имеется два свободных электрона, значит СО может участвовать в реакциях, проявляя восстановительные свойства. Такое возможно с такими окислителями как кислород, галогены и даже оксиды металлов
II Углекислый газ
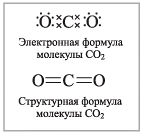
Все четыре связи – ковалентные полярные и образовались за счет обобществления электронов атомами углерода и кислорода. Однако из-за линейного строения молекула CO2 в целом неполярна. Проявляет окислительные свойства.
2 группа Физические свойства оксидов
I СО
Газ без цвета, без запаха (почувствовать его невозможно) — тем и коварен! Этот газ коварен еще и тем, что распределяется в воздухе равномерно. Мr (СО) = 28 и приблизительно равна Мr (воздуха) = 29 В воде нерастворим. Горит голубоватым пламенем. Ядовит, ПДК (СО) = 20 мг/м3Соединяясь с гемоглобином красных кровяных телец, переносчиков кислорода от легких к тканям организма, угарный газ вызывает кислородное голодание, и человек может погибнуть. При вдыхании воздуха, содержащего до 0,1% CO человек может потерять сознание и умереть. При отравлении наблюдается резкая потеря сознания, в тяжелых случаях — смерть. Угарный газ необратимо связывается с гемоглобином крови, препятствуя газообмену, человек — задыхается. Оказание помощи — дышать чистым кислородом, переливание крови. Где же можно встретить такого «монстра»? Наблюдать его можно в пламени свечи, топке. Присутствует он и в выхлопных газах двигателей внутреннего сгорания, и в сигаретном дыме. Образуется при сгорании большинства горючих материалов в условиях ограниченного доступа воздуха.
II СО2
Газ без цвета, без запаха, хорошо растворим в воде, Мr(СО2) = 44. Сравним с Мr(воздуха) = 29. В 1,5 раза тяжелее воздуха. При t = - 760С – сухой лёд.
Оказывает на человека наркотическое действие, раздражает кожу и слизистые оболочки, оказывает центральное сосудосуживающее и местное сосудорасширяющее действие, вызывает повышение содержания аминокислот в крови, ингибирует действие ферментов в тканях. ПДК (СО2) = 30 мг/м3 Для человека вреден как избыток его, так и недостаток. В небольших количествах (до 2%) углекислый газ стимулирует деятельность дыхательного центра. С увеличением концентрации возникают серьёзные расстройства, и при 10%-й концентрации дыхание останавливается, происходит потеря сознания, при 20% - паралич жизненных центров в течение нескольких секунд. К счастью, человек редко сталкивается с такими большими концентрациями СО2 в воздухе ( это возможно, например, в подвалах без вентиляции, где хранят сухой лёд).
Как помочь человеку, отравившемуся углекислым газом? — вывести на свежий воздух.
3 группа Химические свойства оксидов
I СО - горючий газ, горит голубым пламенем:
2CO +O2 = 2CO2 (углекислый газ) +577 кдж
CO +Cl2 =COCl2 (фосген)
Оксид углерода (II) может восстановить
большинство металлов из их оксидов, например:
CO + СuО → Сu+ CO2
CO +FeO =CO2 +Fe
СO +2H2 =CH3 OH (метанол)
II Углекислый газ – кислотный оксид, он взаимодействует с
основными оксидами и основаниями с образованием кислых и средних солей, с
некоторыми солями, водой:
CaО+ CO2 → CaCO3
Ca(OH)2+ CO2 → CaCO3 + H2O (качественная реакция на CO2)
Ca(OH)2+ 2CO2 → Ca(HCO3)2
СаСО3 + СО2 + Н2О → Са(НСО3)2
СО2 + Н2О = Н2СО3
СО2 – окислитель
а) СО2 + С = 2СО
б)Магний способен гореть в атмосфере CO2, восстанавливая при этом углерод.
2Mg + CO2 → 2MgO+ C (5000C)
Не тушите загоревшуюся пиротехнику углекислотным огнетушителем!
Пероксид натрия поглощает углекислый газ:
2Na2O2 + 2CO2 → 2Na2CO3+O2↑
Это реакцию используют в подводных лодках и в космических кораблях для регенерации воздуха.
Огромная масса углекислого газа превращается в органические вещества и кислород в результате фотосинтеза:
6CO2 + 6H2O →C6H12O6 + 6O2↑
4 группа Получение оксидов и применение
I CO1.В промышленности С + О2 = 2СО
2.В лаборатории НСООН = Н2О + СО↑
II CO2 1.В промышленности СаСО3 = СаО + СО2↑
2.В лаборатории СаСО3+2НСl=СаСl2+СО2↑+Н2О
Применение оксидов
I СО
1) Топливо.
2) Основная часть генераторного газа – одного из видов газообразного топлива.
3) Как восстановитель в металлургии.
4) Исходное вещество при синтезе органических веществ.
5) Применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и свежий вид, не изменяя вкуса
6) Недавно выяснилось, что угарный газ может уменьшить поражение мозга при инсульте: по результатам исследований на мышах ученые установили, что лечение малыми дозами угарного газа может помочь ограничить повреждение головного мозга.
II СО2
1)В производстве сахара, соды, газированных напитков;
2) Не поддерживает жизнедеятельность бактерий и плесени – в его атмосфере сохраняют продукты. Сухой лёд – для хранения продуктов.
3) В жидком виде – в огнетушителях;
V.Закрепление знаний и способов действий
Представители каждой группы освещают свой вопрос. Остальные слушают, заносят материал в таблицу, задают вопросы
VI. Обобщение и систематизация знаний.
Учитель: давайте обобщение проведем в практическом применение полученных знаний
1.В вулканической зоне близ Неаполя находится «собачья пещера». Страшная тайна долгое время будоражила воображение местного населения. Ответим на вопрос, прозвучавший в начале урока.
2. Лаборант нашей школы не уважает углекислый газ за то, что из-за него баночки с растворами щелочей невозможно открыть после школьных каникул. Объясните — почему лаборант обвиняет в этом углекислый газ?
3. Проблема очищения воздуха от углекислого газа на космических станциях и подводных лодках — больная проблема. Еще писатель-фантаст Ж. Верн пытался решить ее. А какой выход нашли современные ученые?
4.Шумная компания городских жителей решила отметить Новый год на природе, в деревенском домике с печкой. Когда дрова прогорели, они закрыли вьюшку у печки, не заглянув вовнутрь, чтобы, как они решили, тепло сохранилось дольше. Что могло случиться, но, к счастью, не произошло, так как дверь в домике очень часто была открыта?
5.Водитель, нарушая привычные для себя правила, заехал в гараж задним ходом, чтобы утром быстрее выехать. Но утром было очень холодно и водитель, не открыв ворота, решил прогреть двигатель. Через некоторое время случилось непредвиденное…
6. Основной вопрос урока « Оксиды углерода – друзья или враги?»
7. Объясните выражение: «Угорел в избе (бане)».
8. Установите признак, объединяющий указанные объекты



9. Провести качественный анализ шипучих прохладительных напитков на содержание углекислого газа.
а. Собрать прибор для получения газов.
б.Определителем наличия углекислого газа является известковая вода.
в.Осторожно нагреть напиток, пропуская образующийся газ через известковую воду.
г. Наблюдается помутнение известковой воды. Образуется осадок белого цвета.
10. Известно, что при прохождении технического осмотра автомобиля водитель предоставляет справку о состоянии выхлопных газов автомобиля. Концентрация какого газа указывается в справке?
11.В большую открытую ёмкость поместили свечу и зажгли её (рис.1).
Свеча горела нормально. Затем по краю сосуда поместили кольцо из ваты и подожгли его.
Вата загорелась, и через несколько секунд свеча погасла (рис. 2). Объясните происходящее.
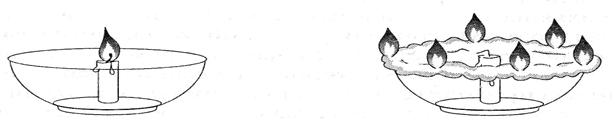
Рис. 1 Рис. 2
12. У вас есть все необходимое для проведения качественной реакции на оксид углерода (IV). Проделайте эту реакцию.
VII.Закрепление знаний
«Пятый лишний»
У четырех веществ можно найти что-то общее, а пятое вещество выбивается из ряда, лишнее. Найдите это вещество.
1. Углерод, алмаз, графит, карбид, карбин.
2. Антрацит, торф, кокс, нефть, стекло.
3. Известняк, мел, мрамор, малахит, кальцит.
4. Кристаллическая сода, мрамор, поташ, каустик, малахит.
5. Фосген, фосфин, синильная кислота, цианид калия, сероуглерод
6. Морская вода, минеральная вода, дистиллированная вода, грунтовая вода, жесткая вода.
7. Известковое молоко, пушонка, гашеная известь, известняк, известковая вода.
8. Li2СО3; (NH4)2CO3; СаСО3; K2CO3, Na2CO3.
«Синонимы»
Напишите химические формулы веществ или их названия.
1. Генераторный газ-….
2. Парниковый газ – …
3. Несолеобразующий оксид- …..
4. Соединение СО с гемоглобином – …
5. Реактив на СО2 – …
6. « Сухой лед» – …
7. Компонент выхлопных газов автомобиля-…..
8. Условно ядовитый газ-…..
9. Природный газ – …
«Антонимы»
Напишите химические термины, противоположные по значению предложенным.
1. Окислитель – …
2. Донор электронов – …
3. Кислотные свойства – …
4. Ковалентная полярная связь – …
5. Адсорбция – …
6. Избыток – …
7. Анион – …..
8. Металл – …
9. Исходные вещества – …
«Поиск закономерностей»
Установите признак, объединяющий указанные вещества и явления.
1. Алмаз, карбин, графит – …
2. Стекло, цемент, кирпич – …
3. Дыхание, гниение, извержение вулкана – …
4. СО, NO, N2O- …
5. NaHCO3,СО, CaCO3, CO2, H2CO3 – …
«Крестики и нолики». Определить выигрышные пути:
Вещества, с которыми взаимодействует оксид углерода (IV)
Вещества, имеющие одинаковое значение степени окисления углерода:
VIII. Подведение итогов
Что мы сегодня изучили на уроке и ответили ли на главный вопрос: оксиды углерода – друзья или враги?
IX.Рефлексия
На уроке
Я узнал(а)….
Я научился….
Я почувствовал, что…..
Мне это пригодится в жизни …
На уроке я работал(а) …..
Цели урока достиг(ла) …..
Я получил(а) оценку-………
X. Домашнее задание
Дома посмотрите содержимое аптечки, ванной комнаты, кухни и найдите предметы бытовой химии, содержащие в своём составе СО2 и другие соединения углерода. Заполнить таблицу до конца. П.30.
Урок начинается с организационного момента, задача которого - подготовить учащихся к работе на уроке. (Приветствие друг друга, запись в журнал фамилии тех, кто отсутствует, проверка готовности ребят к занятию.) Этот этап урока, хотя и был непродолжительным, позволил быстро включить учащихся в ход урока.
Следующий этап - обзор изученного материала - повторение ранее изученных тем и проверка домашнего задания.
Задача - выявить пробелы в знаниях и устранить их, совершенствовать знания и умения, подготовиться к восприятию новой темы.
Чтобы определить уровень знаний большинства учеников за короткий промежуток времени, я пригласила двоих из них к доске: одного для воспроизведения письменного домашнего задания, другого - для выполнения интерактивных упражнений мультимедийного учебного пособия "Химия-9". Этот материал в дальнейшем использовался при изучении новой темы. Один человек устно на основании положения элемента углерода в ПСХЭ ДИМ, в ряду электроотрицательности неметаллов обосновал его окислительно-восстановительные свойства (индивидуальный опрос).
С сидящими за своими партами ребятами мы объяснили результаты проблемного эксперимента (куда исчез раствор краски?) Обсудили вопросы применения и лекарственного действия активированного угля. Проверив правильность выполнения заданий на доске (обычной и интерактивной), перешли к работе с презентацией, составили названия к иллюстрациям. В ходе фронтальной беседы я стремилась проверить качество усвоения материала, степень сформированности общеучебных навыков и умений. Обязательны на этапе повторения комментирование ответов учащихся, оценка их знаний, умений и навыков, стимулирование деятельности школьников похвалой, одобрением.
Затем была проведена актуализация опорных знаний. Запись схемы электронного строения атома, распределение электронов атома углерода по орбиталям позволило подвести итог беседы, и послужила вспомогательным материалом для изучения новой темы.
Этап изучения нового материала я начала с сообщения темы, целей и задач урока, поставила перед школьниками учебную проблему. Поскольку ребята уже знают важнейшие теоретические вопросы курса химии, то большую часть учебного материала этого урока я предпочла преподавать дедуктивно. Для этого учащимся предлагаются вопросы, при ответе на которые школьники привлекают ранее приобретенные знания и в то же время изучают новый материал. К тому же это позволяет использовать такие важнейшие принципы дидактики, как научность и доступность. Новые понятия и схемы реакций предлагались учащимся по слайдам презентации. Соблюдая принцип систематичности, я шла по пути от известного к неизвестному, от простого к сложному. Логично, на мой взгляд, сначала рассмотреть строение молекул оксидов, а затем перейти физических и химических свойств и т. д. Никак нельзя было обойтись на уроке без демонстрационного эксперимента, поскольку он способствует выработке умений и навыков проведения химического эксперимента. Реализации принципа систематичности способствует осуществление межпредметных связей. Установление таких связей помогает формированию в сознании учащихся целостной картины мира. Связь с экологией особо тесная. На этом уроке она реализуется через систему понятий об атмосфере, рассмотрены значения ПДК углекислого и угарного газов, заслушано сообщение об экологической ситуации Унцукульского района. Связь с биологией видна при рассмотрении биологического воздействия на организм оксидов углерода, причем основную информацию этого вопроса ребята изложили сами.
При изучении нового материала учащиеся работали с рабочими тетрадями: записывали формулировки, составляли реакции, затем проверяли их правильность с изображением на экране (формат презентации строила таким образом, чтобы информация появлялась дозировано).
Для закрепления полученных знаний я использовала схему учебника на странице 175, на основе которой ребята рассказали о способах применения углекислого газа. Устно сравнили изученные оксиды по плану упражнения 1 страницы 122 рабочей тетради. Это упражнение предстоит выполнить ученикам дома письменно.
Химический графический (тест) диктант с экспресс-проверкой проводился с применением слайд-демонстрации. Слайды сменяются автоматически с промежутком в 10 секунд. Ученикам необходимо определить какому оксиду характерна данная информация, занести в свой листок ответы "да", или "нет" , соединив точки на выданных листках. Работа проводилась по вариантам: Углекислый газ и Угарный газ.
|
Углекислый газ . . . . . 1 2 3 4 5 6 7 Фамилия:___________ |
Зная интерес ребят к реальным историям с "химическим содержанием" приготовила несколько вопросов, основанных на физических и химических свойствах углекислого газа. Все истории были успешно "расшифрованы".
Целью этапа закрепления Хадижат Ахмедовна ставила повторение, воспроизведение усвоенного, но не дословное, а преобразованное, что способствует выработке у учащихся умения применять полученные знания.
Домашнее задание. Инструктажу по выполнению домашнего задания было уделено особое внимание, т.к. оно является сравнительным и требует качественного понимания темы в целом.
Завершающим этапом была оценка учителем результатов урока, подведение итогов, комментирование деятельности учащихся, выставление отметок.
Проведенный урок - комбинированный. В ходе урока были использованы объяснительно-иллюстративные методы (беседа, объяснение учителя, сообщение ученика), применялись средства наглядности (слайды презентации, демонстрационный эксперимент), эвристические методы (беседа о соответствии строения и свойств молекул), исследовательский метод (исследование физических и химических свойств оксида углерода (IV)). На уроке многократно использовались технические средства обучения: учебный модуль "InterWrite" - интерактивная доска", применялись упражнения мультимедийного учебного пособия, велась работа с учебником, рабочей тетрадью.
Проведенная проверочная работа и фронтальный опрос показали, что ученики, в целом, тему освоили, способны не только воспроизводить полученные знания, но и применять в нестандартных ситуациях.
В целом урок прошел успешно, настроение учащихся и учителя было великолепным, все остались довольны своей работой.
Данная тема занимает очень важное значение в системе уроков 9 класса ,т.к.
готовит учащихся к изучению органической химии в 10 классе. Урок построен в
традиционной форме и направлен на изучение нового материала. Учитель начал урок с организации класса и создания психологической комфортности. Ученики сами определяли тему урока. Педагог чѐтко озвучил цели и задачи для детей.
Учителем на протяжении всего урока была создана ситуация успеха, возможность самопроявления всех детей.
На уроке использовалась групповая, классная и индивидуальная работа учащихся.
С целью подведения ребят к изучению нового материала был осуществлен
фронтальный опрос по необходимым для изучения темы вопросам. Для наглядности и более успешного изучения материала использовались слайды и модели кристаллических решеток алмаза и графита, проведен опыт по адсорбции углерода.
Урок соответствует учебной программе. Реализуются все дидактические
требования к изложению материала. Выбраны необходимые средства обучения. В
ходе проведения урока царила атмосфера сотрудничества. Результативность очень высокая. Все учащиеся работали над выполнением задания по технологическим картам, все выступили с сообщениями по проделанной работе, смогли сами организоваться, что очень важно в становлении личности учащегося. По итогам урока выполнили небольшую дифференцированную проверочную работу на 5-7 минут, осуществили
взаимопроверку.
Деятельность учащихся на уроке направлена на развитие умственной активности. Учитель приобщает учащихся к научным методам познания, используя на уроке такие виды деятельности как наблюдение, выдвижение гипотез, доказательства, обобщение и выводы.
В конце урока была проведена рефлексия.
Деятельность учащихся можно оценить следующим образом: на уроке
чѐтко проявился интерес у предмету, эмоциональное состояние учащихся
было приподнятым в начале и к концу урока. На уроке присутствовали
самоконтроль, взаимоконтроль и самокоррекция со стороны учащихся. Была
высока степень самостоятельности в учебной деятельности.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.