
УТВЕРЖДАЮ
Зам.директора по УР
___________ Довгалюк Л.Е.
ПЛАН ОТКРЫТОГО УРОКА
ПО ХИМИИ
Преподователь: Коянбаева Р. Ж.
Дата проведения:
|
1 |
Адрестік категориясы /Адресная категория |
|
|
1.1 |
Специальность |
Сврочное дело |
|
1.2 |
Группа |
СД-15-15 |
|
1.3 |
Курс |
первый |
|
1.4 |
Тема |
«Кислород содержащие органические вещества» |
|
1.5 |
Тема занятия |
«Химические свойства альдегидов» |
|
1.6 |
Цель урока |
Актуализировать знания о свойствах альдегидов, познакомить студентов качественными реакциями на альдегиды |
|
1.7 |
Задачи урока: |
1. Закрепить знания студентов по теме, создать условия для применения знаний и умений в практических ситуациях. 2. Развивать позновательный интерес на основе инновационных средств представления учебного материала. 3. Воспитывать заинтересованность,мотивацию к изучению предмета. |
|
1.7 |
Форма обучения |
Индивидуальная, наглядно практический |
|
1.8 |
Тип и вид занятия |
Комбинированный Урок –практических самостоятелных работ с элементами лабороторных опытов. |
|
1.8 |
Необходимо знать |
Строения, номенклатуру, изомерии, получения альдегидов. Физические свойства альдегидов. |
|
2 |
Біліктіліктер / Компетенции |
|
|
2.1 |
Базовые компетенции |
Планировать правильно рабочее время Уметь четко и ясно излагать свои мысли Планировать и применять действия, необходимые для выполнеия заданий Использовать необходимую дополнительную информацию Анализировать свою работу |
|
2.2 |
Предметные компетенции |
Называть изученное вещество по международной номенклатуре,знать определение, карбонильную группу. Определять альдегиды по строению Характеризовать физ. и хим. Свойства альдегидов Изучить свойства альдегидов, делать выводы, составлять уравнения реакции. |
|
3. |
Жоспарлау фазасы /Фаза планирования |
|
|
3.1 |
Учебно-методичес-кие и справочные источники |
Учебник. Атамура«Мектеп», 2007. химия 11 кл. Химия. «Электронный учебник» 11 кл.
|
|
3.2 |
Оборудование приспособления, инструмент, материалы |
Карточки
с заданиями.
Мультимедиа проектор, «Виртуальная химическая лабораторная работа». |
|
4 |
Болжамды нәтиже /Ожидаемый результат |
|
|
4.1 |
Продукт деятельности |
Характерные химические свойства альдегидов |
|
5 |
Сабақ барысы /Ход урока |
|
|
5.1 |
Структура, краткое содержание урока |
I. Организационный момент.3-мин Проверка посещаемости, дом. задания. Сегодня на уроке мы продолжим изучение карбонильных соединений, рассмотрим химические свойства альдегидов II. Актуализация знаний.7-мин 1. Какие соединения называются альдегидами? 2. Какие знаете гомологи альдегидов? 3. Назовите общ. формулу альдегидов 4. Как образуются альдегиды? 5. Какие типы изомерии характерны для альдегидов? 6. Что можем сказать о физических свойствах альдегидов? Задания по карточкам. 1. Дайте названия следующим соединениям: 2. Изобразите структурную формулу2,2,4триметилпентаналь.
1. Дайте названия следующим соединениям: 2. Составьте формулу соединения 5-метил-2-этилгексаналь.
III. Изучение нового материала.20-мин
2. Реакции окисления. 3. Реакция замещения. 4. Полимеризация формальдегидоа. 5. Реакцияполиканденсации Демонстрация «Виртуальная химическая лабораторная работа
» 2. Реакция с гидроксидом меди(II).
V. Рефлексия. 2-мин Сегодня
я узнал… VI. Оценки за урок. 1-мин Домашнее задание |
|
6 Үй тапсырмасы /Задание на дом |
||
|
|
|
§9.1 применение альдегидов |
Преподаватель ______________Коянбаева Р. Ж.
ЦЕЛИ:
Образовательные:
1.Закрепить знания о строении, номенклатуре, изомерии .
2.
Изучить химические свойства альдегидов.
3.Рассмотреть способы получения альдегидов.
ХОД УРОКА
На доске записана тема «Химические свойства альдегидов»
I. Организационный момент.
Сегодня на уроке мы продолжим изучение карбонильных соединений, рассмотрим
химические свойства альдегидов и кетонов, способы получения альдегидов и
кетонов.
II. Актуализация знаний.
Учитель вызывает двух учащихся к доске для работы с карточками.
Задания первой карточки.
Какая функциональная группа называется карбонильной, а какая - альдегидной? Какая между ними разница?
Составьте структурные формулы альдегидной, карбонильной и гидроксидьной группы.
В каком гибридном состоянии находится атом углерода карбонильной группы? Какие виды химических связей он образует?
Задания второй карточки.
Номенклатура альдегидов и кетонов.
Дайте названия следующим соединениям:
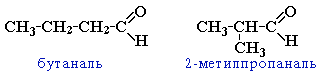
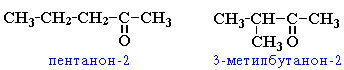
Составьте формулу соединения 5-метил-2-этилгексаналя.
Учитель раздает письменные задания нескольким учащимся.
Письменные задания:
1. Определите формулу предельного альдегида, дайте ему название по
систематической номенклатуре:
А) С4Н8О ; Б) С2Н6О; В) С6Н14О;
Г) С7Н16О
2.
Укажите соединение, в молекуле которого атом углерода находится в состоянии sp2
гибридизации:
А) бутан, Б) ацетилен, В) этаналь, Г)этиловый спирт.
3. Составьте структурную формулу 2-метилбутаналя.
Вопросы к классу:
Сформулируйте определение класса альдегидов и кетонов.
Назовите общую формулу предельных альдегидов и кетонов.
Существует ли водородная связь между молекулами альдегидов (кетонов)? Почему?
Наличие какой функциональной группы свойственно и для альдегидов и для кетонов?
А каково же ее строение? (ответ по карточке № 1)
Номенклатура альдегидов и кетонов. (ответ по карточке № 2)
Какие типы изомерии характерны для альдегидов?
Что можем сказать о физических свойствах альдегидов и кетонов?
Учитель просит
сдать письменные задания.
III. Изучение нового материала.
Учитель организует самостоятельное изучение учащимися нового материала.
Говорит о том, что им сейчас предстоит самостоятельно изучить химические
свойства альдегидов , рассмотреть способы получения альдегидов . Результатом
самостоятельной работы на уроке будет являться краткий конспект по теме.
Химические свойства. Рассмотрим поведение альдегидов в отношении
стандартного набора реагентов: кислорода воздуха О2, окислителей
[О], а также Н2, Н2О, спиртов, Na, НСl.
![]() Альдегиды
медленно окисляются кислородом воздуха в карбоновые кислоты:
Альдегиды
медленно окисляются кислородом воздуха в карбоновые кислоты:
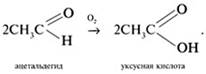
![]() Качественная
реакция на альдегиды – реакция «серебряного зеркала». Реакция состоит
во взаимодействии альдегида RСНО с водно-аммиачным раствором оксида серебра(I),
представляющим растворимое комплексное соединение [Ag(NН3)2]OH.
Реакцию проводят при температуре, близкой к температуре кипения воды
(80–100 °С). В результате на стенках стеклянного сосуда (пробирки, колбы)
образуется осадок металлического серебра – «cеребряное зеркало»:
Качественная
реакция на альдегиды – реакция «серебряного зеркала». Реакция состоит
во взаимодействии альдегида RСНО с водно-аммиачным раствором оксида серебра(I),
представляющим растворимое комплексное соединение [Ag(NН3)2]OH.
Реакцию проводят при температуре, близкой к температуре кипения воды
(80–100 °С). В результате на стенках стеклянного сосуда (пробирки, колбы)
образуется осадок металлического серебра – «cеребряное зеркало»:
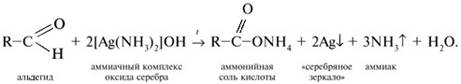
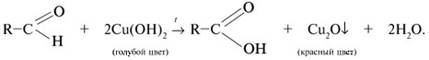
Восстановление гидроксида меди(II) в оксид меди(I) – другая характерная реакция альдегидов. Реакция протекает при кипячении смеси и состоит в окислении альдегида. Точнее сказать, происходит внедрение атома [О] окислителя Cu(OH)2 по связи С–Н альдегидной группы. При этом изменяются степени окисления карбонильного углерода (от +1 до +3) и атома меди (от +2 до +1). При нагревании голубого осадка Cu(OH)2 в смеси с альдегидом наблюдается исчезновение голубой окраски и образование красного осадка Cu2O:
![]() Альдегиды
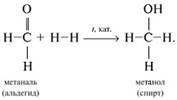
присоединяют водород Н2 по двойной связи С=О
при нагревании в присутствии катализатора (Ni, Pt, Pd). Реакция сопровождается
разрывом
Альдегиды
присоединяют водород Н2 по двойной связи С=О
при нагревании в присутствии катализатора (Ni, Pt, Pd). Реакция сопровождается
разрывом ![]() -связи в карбонильной группе С=О
и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким
образом из альдегидов получают спирты:
-связи в карбонильной группе С=О
и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким
образом из альдегидов получают спирты:
![]() Альдегиды с
электроноакцепторными заместителями в
Альдегиды с
электроноакцепторными заместителями в ![]() -положении к альдегидной
группе присоединяют воду с образованием гидратов альдегидов
(диолов-1,1):
-положении к альдегидной
группе присоединяют воду с образованием гидратов альдегидов
(диолов-1,1):
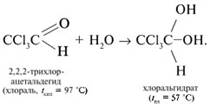
Для
того чтобы удерживать две электроотрицательные гидроксильные группы, атом
углерода должен нести достаточный положительный заряд. Созданию дополнительного
положительного заряда на карбонильном углероде способствуют три
электроноакцепторных атома хлора при соседнем ![]() -углероде хлораля.
-углероде хлораля.
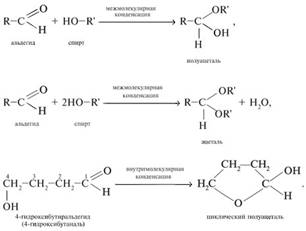
![]() Реакция
альдегидов со спиртами. Синтез полуацеталей и ацеталей. В
благоприятных условиях (например: а) при нагревании с кислотой или в
присутствии водоотнимающих средств; б) при внутримолекулярной конденсации с
образованием пяти- и шестичленных циклов) альдегиды реагируют со спиртами. При
этом к одной молекуле альдегида может присоединиться либо одна молекула спирта
(продукт – полуацеталь), либо две молекулы спирта (продукт – ацеталь):
Реакция
альдегидов со спиртами. Синтез полуацеталей и ацеталей. В
благоприятных условиях (например: а) при нагревании с кислотой или в
присутствии водоотнимающих средств; б) при внутримолекулярной конденсации с
образованием пяти- и шестичленных циклов) альдегиды реагируют со спиртами. При
этом к одной молекуле альдегида может присоединиться либо одна молекула спирта
(продукт – полуацеталь), либо две молекулы спирта (продукт – ацеталь):
![]() Альдегиды не
присоединяют НСl по двойной связи С=О. Также
альдегиды не реагируют с Na, т.е. альдегидный водород группы
–СНО не обладает заметными кислотными свойствами.
Альдегиды не
присоединяют НСl по двойной связи С=О. Также
альдегиды не реагируют с Na, т.е. альдегидный водород группы
–СНО не обладает заметными кислотными свойствами.
Применение
альдегидов основано на их высокой реакционной способности. Альдегиды
используют в качестве исходных и промежуточных соединений в синтезе веществ с
полезными свойствами других классов.
![]() Формальдегид НСНО – бесцветный
газ с резким запахом – используют для производстваполимерных материалов.
Вещества с подвижными атомами Н в молекуле (обычно при связях С–Н или N–H, но
не О–Н) соединяются с формальдегидом СН2О по типу:
Формальдегид НСНО – бесцветный
газ с резким запахом – используют для производстваполимерных материалов.
Вещества с подвижными атомами Н в молекуле (обычно при связях С–Н или N–H, но
не О–Н) соединяются с формальдегидом СН2О по типу:
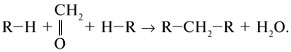
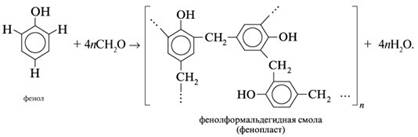
Если в молекуле исходного вещества два или несколько подвижных протонов (у фенола С6Н5ОН – три таких протона), то в реакции с формальдегидом получается полимер. Например, с фенолом – фенолформальдегидная смола:
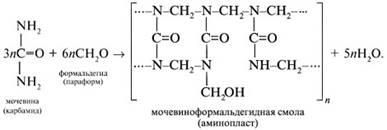
Подобным образом мочевина с формальдегидом дает мочевиноформальдегидные смолы:
![]() Формальдегид служит
исходным веществом для производства красителей, фармацевтических
препаратов, синтетического каучука, взрывчатых веществ и многих других
органических соединений.
Формальдегид служит
исходным веществом для производства красителей, фармацевтических
препаратов, синтетического каучука, взрывчатых веществ и многих других
органических соединений.
![]() Формалин (40%-й водный
раствор формальдегида) применяется в качестве антисептика(обеззараживающего
средства). Свойство формалина свертывать белок используется в кожевенном
производстве и для сохранения биопрепаратов.
Формалин (40%-й водный
раствор формальдегида) применяется в качестве антисептика(обеззараживающего
средства). Свойство формалина свертывать белок используется в кожевенном
производстве и для сохранения биопрепаратов.
![]() Ацетальдегид СН3СНО
– бесцветная жидкость (tкип = 21 °С) с резким
запахом, хорошо растворимая в воде. Главное использование ацетальдегида –
получение уксусной кислоты. Из него также получают синтетические
смолы, лекарства и т.д.
Ацетальдегид СН3СНО
– бесцветная жидкость (tкип = 21 °С) с резким
запахом, хорошо растворимая в воде. Главное использование ацетальдегида –
получение уксусной кислоты. Из него также получают синтетические
смолы, лекарства и т.д.
Дальнейшая работа состоит из нескольких этапов:
Сбор
информации.
Обсуждение.
Написание конспекта.
1.Этап сбора информации.
Предлагает изучить материал , воспользоваться дополнительной литературой,
использовать возможности ИКТ
(
использовать возможности интернета).
Учащиеся готовят устный ответ на вопросы карточки-путеводителя. (Работают в
микрогруппах по два человека).
Карточка-путеводитель №1 (для тех, кто затрудняется).
Химические свойства альдегидов и кетонов
Реакции восстановления.
Реакции окисления.
Качественная реакция на альдегиды.
2.Этап обсуждения собранной информации.
В ходе этапа обсуждения учитель обращает внимание учащихся на то, что в
результате гидрирования альдегидов образуются первичные спирты, а в результате
гидрирования кетонов – вторичные. Альдегиды легко окисляются, а кетоны не
окисляются ни кислородом воздуха, ни аммиачным раствором оксида серебра.
Окисление кетонов идет значительно труднее.
Демонстрация
Реакция «серебряного зеркала».
Реакция с гидроксидом меди(II).
Одновременно с мультимедиа презентацией «Виртуальная химическая лаборатория
8-11 класс» на демонстрационном столе проводят реакцию «серебряного зеркала»
два ученика.
3.Этап
написания конспекта.
Сейчас вам предстоит написать конспект. Давайте вспомним, какие способы
сворачивания и фиксации информации вам известны. ( Текстовый конспект с
использованием специальных сокращений, опорный конспект, схема, таблица).
Какими способами можно воспользоваться ?
Итак, приступаем к написанию конспекта.
Двух-трех человек прошу написать конспект на выданных листах. Проецирую на доску.
Обсуждаем способы написания конспекта.
1.Как составлял конспект?
2.Как рассуждал?
Учащиеся самостоятельно изучают способы получения альдегидов и кетонов
используя карточку- путеводитель №2 (для тех, кто затрудняется).
Карточка – путеводитель №2.
Способы получения альдегидов и кетонов.
Окисление или дегидрирование спиртов.
Реакция Кучерова (гидратация алкинов)
Нагревание кальциевых и бариевых солей карбоновых кислот
IV.Рефлексия
На экране выведены фразы, которые ученики должны дополнить:
Сегодня я узнал…
Было интересно…
Было трудно…
Меня заинтересовало….
Урок дал мне для жизни…
V. Оценки за урок
VI. ДОМАШНЕЕ ЗАДАНИЕ
Тест
1.
Реакция присоединения водорода к альдегидам происходит за счет:
а) разрыва π – связи карбонильной группы;
б) разрыва ϭ – связи карбонильной группы;
в) разрыва ϭ - и π – связи карбонильной группы;
г) образования новой π – связи между атомами углерода и кислорода.
2.
Альдегиды в своем составе имеет:
а) гидроксогруппу; б) карбонильную группу;
в) карбоксильную группу; г) альдегидную группу.
3. При восстановлении альдегидов образуются:
а) фенолы; б) углеводороды; в) спирты; г) кислоты.
4. Реакция с аммиачным раствором оксида серебра (I) характерна для:
а) пропанола -1; б) прапаналя;
в) пропионовой кислоты; г) этандиола.
5.
При окислении альдегидов образуются:
а) фенолы; б) углеводороды; в) спирты; г) кислоты.
6.
При взаимодействии альдегидов с водородом в присутствии катализатора при
нагревании образуются:
а) углеводороды; б) спирты; в) карбоновые кислоты; г) арены.
Тест
1.
Реакция присоединения водорода к альдегидам происходит за счет:
а) разрыва π – связи карбонильной группы;
б) разрыва ϭ – связи карбонильной группы;
в) разрыва ϭ - и π – связи карбонильной группы;
г) образования новой π – связи между атомами углерода и кислорода.
2.
Альдегиды в своем составе имеет:
а) гидроксогруппу; б) карбонильную группу;
в) карбоксильную группу; г) альдегидную группу.
3. При восстановлении альдегидов образуются:
а) фенолы; б) углеводороды; в) спирты; г) кислоты.
4. Реакция с аммиачным раствором оксида серебра (I) характерна для:
а) пропанола -1; б) прапаналя;
в) пропионовой кислоты; г) этандиола.
5.
При окислении альдегидов образуются:
а) фенолы; б) углеводороды; в) спирты; г) кислоты.
6.
При взаимодействии альдегидов с водородом в присутствии катализатора при
нагревании образуются:
а) углеводороды; б) спирты; в) карбоновые кислоты; г) арены.
Ответы
1-а, 2-г, 3-г, 4-б, 5-г, 6-б.
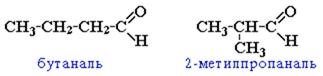
Составьте формулу соединения 5-метил-2-этилгексаналя.
Задания первой карточки.
1. Дайте названия следующим соединениям:
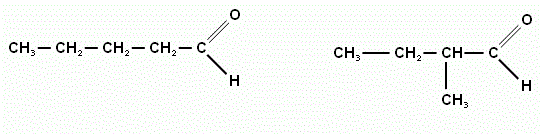
2. Изобразите структурную формулу 2,2,4триметилпентаналь.
Задания второй карточки.
1. Дайте названия следующим соединениям:

Составьте формулу соединения 5-метил-2-этилгексаналя
9.
Формалин – это …
а) 20 %- ный спиртовой раствор уксусного альдегида;
б) 4 % - ный спиртовой раствор ацетона;
в) 2 % -ный водный раствор валерианового альдегида;
г) 40 % - ный водный раствор муравьиного альдегида.
а)
R-O-R1; б) R-O-H; в) R-COH; г) R-COH;
7.
Вещество, формула которого СН3СНО, называется:
а) этанол; б) этаналь; в)этановая кислота; г) ацетон.
8.
Формула уксусного альдегида:
а) СН3СООН; б) СН3СНО; в) НСНО; г) С2Н5СНО;
1.
Газообразным является альдегид:
а) муравьиный; б) уксусный; в) пропионовый; г) валериановый.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.