
Приложение
к рабочей программе
по химии
г. Новочеркасск
муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа №23
«Утверждаю»
Директор МБОУ СОШ № 23
Приказ от 30.08.2017 №________
_______________П.А.Петровсков
Практикум
по химии
Уровень общего образования (класс)
основное общее, 8 класс
Количество часов 7
Учитель: Семёнычева Лариса Витальевна
практикум разработан на основе
Программы основного общего образования по химии для 8–9 классов
Авторы О. С. Габриелян, А. В. Купцова: Москва 2016; к учебнику
О. С. Габриелян; (Москва «Дрофа» 2016).
2017 – 2018 уч. год
муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа №23
Практикум
по химии
ДЛЯ УЧАЩИХСЯ 8 КЛАССА
 |
г. Новочеркасск
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Преподавание основ химии в школе не может совершенствоваться без соответствующей организации школьного химического эксперимента.
Химический эксперимент – источник знаний о веществе и химической реакции – важное условие активизации познавательной деятельности учащихся, воспитания устойчивого интереса к предмету, а также представлений о практическом применении химических знаний.
Данное методическое пособие по ХИМИИ «Практикум для 8 класса» составлено в соответствии с действующей рабочей программой и разработан на основе обязательного минимума содержания химии для основной общеобразовательной школы и требований Федерального государственного образовательного стандарта основного общего образования к уровню подготовки учащихся, что явилось главным принципом его структурирования.
Инструктивные карточки составлены в соответствии с образовательной линией О. С. Габриеляна. Многие практические работы составлены с учётом замены химического оборудования и реактивов на более простые и доступные.
Представленные инструктивные карточки содержат краткое описание выполняемых опытов, иллюстрации, показывающие как должен быть собран прибор для проведения опыта, что даёт возможность учащимся ясно видеть цель работы, не отвлекаться на чтение опытов, которые не будут выполняться в данной работе, а также даёт представление о том, какие записи необходимо сделать в тетради для составления отчёта о работе.
В ходе выполнения практических работ инструктивные карточки должны находиться на столах у учащихся и способствовать чёткой и слаженной работе во время проведения опытов.
Во введении изложены правила техники безопасности при работе в химической лаборатории, сведения о посуде, оборудовании и приборах, используемых при проведении лабораторных работ.
На лабораторных и практических занятиях устанавливается связь между теоретическими и практическими знаниями и умениями, облегчается понимание фактического материала.
 |
ИНСТРУКЦИЯ ПО ОХРАНЕ ТРУДА ДЛЯ УЧАЩИХСЯ
ПРИ РАБОТЕ В КАБИНЕТЕ ХИМИИ
ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
1. Соблюдение требований настоящей инструкции обязательно для учащихся, работающих в кабинете.
2. Запишите на обложке тетради номер своего рабочего места в кабинете химии.
3. Пребывание учащихся в помещении кабинета разрешается только в присутствии учителя химии; пребывание учащихся в лаборантской запрещается.
4. Портфели, сумки и другие вещи следует убирать в ящики стола. Во время работы на столе должны находиться только: необходимое оборудование, тетрадь и письменные принадлежности.
5. В ходе выполнения работы по одному варианту координируйте свои действия с действиями соседа по парте, разговаривая при этом шепотом.
6. Перед началом практической работы (ПР) учащиеся должны изучить правила техники безопасности.
7. Прежде чем приступить к выполнению ПР, следует подготовиться к ней, уяснить цели и задачи, прочитав инструкцию по ее выполнению и внимательно выслушав объяснение учителя.
8. Уборку рабочих мест по окончании работы следует проводить в соответствии с инструкцией к работе и указаниями учителя.
9. После окончания работы сдать рабочее место дежурному по классу. По окончании ПР учащиеся должны тщательно вымыть руки с мылом.
10. При получении травмы, а также при плохом самочувствии учащиеся должны немедленно сообщить об этом учителю.
11. При необходимости ученик должен уметь пользоваться содержимым аптечки и согласно инструкции уметь оказать первую помощь при порезах и ожогах.
12. При возникновении в кабинете во время занятий аварийных ситуаций (пожар, появление сильных посторонних запахов) не допускать паники и подчиняться только указаниям учителя.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ВО ВРЕМЯ РАБОТЫ
В КАБИНЕТЕ ХИМИИ
ЗАПРЕЩАЕТСЯ!?
1. Есть, пить в химическом кабинете, пробовать вещества на вкус.
2. Брать вещества руками.
3. Оставлять неубранными рассыпанные или разлитые реактивы.
4. Выливать или высыпать отработанные реактивы в раковину.
5. Выливать или высыпать остатки реактивов в склянки и банки, из которых они были взяты.
6. Использовать вещества, если они находятся не в подписанных склянках.
7. Набирать одной и той же ложечкой или пипеткой различные вещества.
8. Менять пробки и пипетки от различных банок или склянок.
9. Оставлять открытыми склянки с жидкостями и банки с сухими веществами.
10. Работать с легковоспламеняющимися веществами вблизи огня.
11. Переходить на другие рабочие места без разрешения учителя.
12. Перебрасывать друг другу какие-либо предметы.
13. Бесцельно смешивать растворы или испытывать вещества по собственному усмотрению, проводить самостоятельно любые опыты, не предусмотренные данной работой.
14. Уносить с собой что бы то ни было из предметов и веществ, предназначенных для проведения опытов.
15. Зажигать спиртовку без надобности.
16. Оставлять пробирки и другую химическую посуду грязной.
 |
ТРЕБОВАНИЯ ОХРАНЫ ТРУДА В АВАРИЙНЫХ СИТУАЦИЯХ
u При разливе водного раствора кислоты или щелочи, а также при рассыпании твердых реактивов немедленно сообщить об этом учителю (преподавателю) или лаборанту. Не убирать самостоятельно любые вещества.
u При разливе легковоспламеняющихся жидкостей или органических веществ немедленно погасить открытый огонь спиртовки и сообщить об этом учителю (преподавателю) или лаборанту.
u При разливе легковоспламеняющейся жидкости и ее воспламенении немедленно сообщить об этом учителю (преподавателю) и по его указанию покинуть помещение.
u В случае, если разбилась лабораторная посуда, не собирать ее осколки незащищенными руками, а использовать для этой цели щетку и совок.
u При получении травмы учащийся немедленно сообщает об этом преподавателю.
u Учитель немедленно оказывает первую помощь пострадавшему и сообщает администрации учреждения.
ТРЕБОВАНИЯ ОХРАНЫ ТРУДА ПО ОКОНЧАНИИ РАБОТЫ
u Погасить спиртовку специальным колпачком, не задувать пламя спиртовки, а также не гасить его пальцами.
u Привести в порядок рабочее место, сдать все оборудование, приборы, реактивы учителю (преподавателю) или лаборанту, отработанные водные растворы слить в стеклянный сосуд вместимостью не менее 3 л.
u
 |
КРАТКАЯ ИНСТРУКЦИИ ПО ОКАЗАНИЮ МЕР
ПЕРВОЙ ПОМОЩИ ПРИ
РАЗЛИЧНОГО РОДА ОТРАВЛЕНИЯХ ИЛИ ПОРАЖЕНИЯХ ОРГАНИЗМА
|
Поражения |
Первая помощь |
|
При порезах стеклом |
Обработать рану 3%-ным водным раствором пероксида водорода для остановки кровотечения. Затем продезинфицировать водным раствором KMnO4 или спиртом, смазать йодом и наложить повязку. После оказания первой помощи направить к врачу. |
|
При ожогах: |
|
|
1. термическом (огнем, паром, горячим предметом) А) первой степени(краснота)
Б) второй степени (пузыри)
В) третьей степени (разрушение тканей) |
Для снятия болевых ощущений смазать место ожога глицерином. Наложить повязку с ватой, смоченной этиловым спиртом. |
|
Обработать аналогично ожогу первой степени, а затем 3 – 5%-ным водным раствором KMnO4 или 5%-ным водным раствором танина. Наложить стерильную повязку. Пострадавшего направить к врачу. |
|
|
Покрыть рану стерильной повязкой и направить пострадавшего к врачу. |
|
|
2. кислотном (серной, азотной, фосфорной), хлором или бромом |
Промыть пораженный участок кожи большим количеством воды (УПГ), затем 5%-ным водным раствором NaHCO3 (соды). Наложить повязку с ватой, смоченной риванолом или фурацилином. Для обработки глаз после промывания струей воды (УПГ) использовать 3%-ный водный раствор NaHCO3 (соды). |
|
3. щелочном |
Участок кожи обильно промыть водой (УПГ). Глаза промыть струей воды (УПГ). Затем глаза и кожу обработать 2%-ным водным раствором борной кислоты Н3ВО3. |
|
При отравлениях: |
|
|
А) кислотами |
Вызвать рвоту (например, выпив 1%-ный водный раствор CuSO4), сделать промывание желудка. Принять внутрь 4 – 6 таблеток или одну столовую ложку активированного угля или 250 гр крахмального клейстера. Пить кашицу из оксида магния. |
|
Б) щелочами |
Первая помощь как при отравлении кислотами. Затем пить 1%-ный водный раствор лимонной или уксусной кислоты. |
|
В) газами |
Обеспечить доступ чистого воздуха и покой. В тяжелых случаях - кислород. |
|
При поражениях электрическим током |
Обеспечить доступ свежего воздуха. Дать понюхать вату, смоченную 10%-ным водным раствором аммиака. При наличии электрического удара (отсутствие дыхания, не бьется сердце) – искусственное дыхание, резиновая грелка |

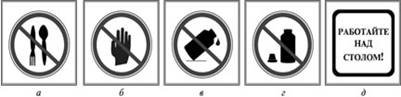

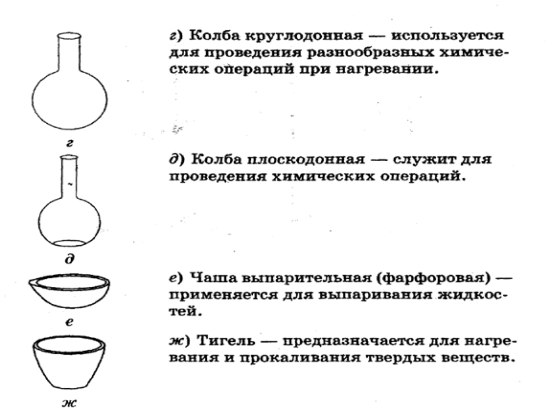
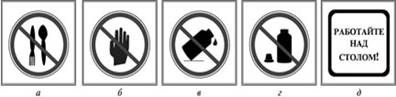
а) - запрещается пробовать вещества на вкус
б) - брать вещества руками
в) - оставлять неубранными рассыпанные или разлитые реактивы
г) - оставлять открытыми склянки с жидкостями и банки с сухими веществами
д) - работу проводить только над столом


ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ

 |
 |
ПЕРЕЧЕНЬ ПРАКТИЧЕСКИХ РАБОТ
Практическая работа №1
Тема: «Лабораторное оборудование и приемы обращения с ним. Правила безопасной
работы в химической лаборатории»
Практическая работа №2
Тема: «Приготовление растворов с определенной массовой долей растворенного
вещества»
Практическая работа №3
Тема: «Очистка загрязненной поваренной соли».
Практическая работа №4
Тема: «Получение кислорода и изучение его свойств»
Практическая работа №5
Тема: «Признаки протекания химических реакций»
Практическая работа №6
Тема:«Реакции ионного обмена»
Практическая работа №7
Тема: «Решение экспериментальных задач по теме «Основные классы неорганических
соединений»
Практическая работа №1
Тема: «Лабораторное оборудование и приемы обращения с ним. Правила безопасной работы в химической лаборатории»
Цель работы: ознакомиться с правилами техники безопасности при работе в кабинете химии,
лабораторным оборудованием и приемами обращения с ним.
Оборудование: Лабораторный штатив с кольцом и лапкой, спиртовка, пробиркодержатель, колбы,
стаканы, воронка, фарфоровая посуда, спички.
Примечание: Внимательно слушай указания учителя?!
Алгоритм проведения работы
1 этап: Изучение техники безопасности при работе в кабинете химии - учебник стр.198
2 этап: Строение и обращение с лабораторным штативом.
Ø Изучи строение лабораторного штатива, используя учебник стр. 200.
Ø Собери штатив для работы и разбери его.
Ø Зарисуй строение штатива, отметь его назначение в тетради.
3 этап: Строение спиртовки, приемы работы с ней.
Инструкция по технике безопасности
u Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
u Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
u Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком.
Колпачок должен находиться всегда под рукой.
Ø Изучите строение спиртовки, используя учебник стр. 201.
Ø Изучите приемы обращения со спиртовкой, используя инструкцию, выданную учителем.
Правила работы со спиртовкой
1. Снять колпачок
2. Проверить плотно ли прилегает диск к отверстию сосуда.
3. Зажечь спиртовку горящей спичкой.
Запрещается передавать соседу зажжённую спиртовку и зажигать одну спиртовку от другой горящей спиртовки, во избежания пожара!
4. Погасить спиртовку, накрыть пламя колпачком.
Ø Изучи строение пламени спиртовки, выясни, в какой зоне пламени следует производить нагревание и почему.
Ø В тетради зарисуйте спиртовку и укажите ее части, отметь назначение спиртовки и правила нагревания.
4 этап: Строение пламени.
Ø Изучите строение пламени
Ø Рассмотрите пламя спиртовки, выделите три зоны: нижняя часть - тёмная и самая холодная, средняя часть — яркая, верхняя часть — менее яркая но с наиболее высокой температурой.
Ø Внесите на короткое время лучину в разные зоны пламени и по характеру обугливания определите какая часть пламя самая горячая.
Рекомендуется нагревать вещества в верхней части пламени!
5 этап: Знакомство и обращение с лабораторным оборудованием и посудой.
Внимательно следи за рассказом учителя, в тетради сделай рисунки (а, б, в, г, е, к) и вывод о том, как следует обращаться с оборудованием и посудой.
6 этап: Оформите отчёт о проделанной работе.
Обратите внимание на оформление в тетради отчёта, записи и рисунки делай аккуратно.
Ход работы
|
№ |
Название прибора, его рисунок |
Назначение прибора и его частей |
|
1. |
Лабораторный штатив
|
Лабораторный штатив служит для…
1 –
2 –
3 –
4 –
5 – |
|
2. |
Спиртовка
|
Спиртовка служит для …
1 –
2 –
3 –
4 – |
|
3.
|
Строение пламени
|
1 –
2 –
3 –
|
|
4. |
Лабораторное оборудование и посуда
а) б)
в) г)
е) к)
|
а- ….... служит для …
б -…... служит для …
в -…... служит для …
г -…... служит для …
е -…... служит для …
к -…... служит для …
|
7 этап: Сделайте вывод к работе
Вывод: …...
8 этап: Приведите в порядок своё рабочее место
Практическая работа №2
Тема: «Приготовление растворов с определенной массовой долей растворенного вещества»
Цель: научиться взвешивать на лабораторных весах, определять объем жидкости с помощью мерного цилиндра, приготовлять раствор с определенной массовой долей вещества.
Оборудование: химический стакан, палочка для перемешивания, мерный цилиндр, лабораторные весы,
разновесы.
Реактивы: сахар, соль, вода.
Инструктаж по технике безопасности?!
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.
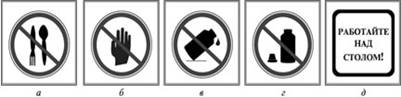
а) - запрещается пробовать
вещества на вкус
б) - брать вещества руками
в) - оставлять неубранными рассыпанные или разлитые реактивы
г) - оставлять открытыми склянки с жидкостями и банки с сухими
веществами
д) - работу проводить только над столом
Алгоритм проведения работы
1 этап: В тетради записать название темы, цели, оборудование, реактивы.
2 этап: Расчёт задачи
u Рассчитайте массу сахара и массу воды, необходимые для приготовления необходимого вам раствора используя формул: m(вещества) = m(раствора) · ω(вещества)
m(H2O) = m(раствора) - m(вещества)
u Определите объем воды, соответствующий вычисленной массе, используя формулу: V = m · ρ Помните, что для воды ρ = 1 г/мл.
u Определите количества вещества, используя формулу: n = m:M
u Определите число молекул, используя формулу: N = n· NА
Задачи для выполнения
Вариант №1 Задача 1 Вычислите сколько г сахара (С12Н22О11) необходимо и какой объём воды
потребуется для приготовления 60 г 4% раствора. Чему равно количество
сахара в растворе?
Задача 2 Приготовьте 50 мл 6% раствора NaCl и рассчитайте количество и число
молекул данного вещества в растворе.
Вариант №2 Задача 1 Вычислите сколько г сахара (С12Н22О11) необходимо и какой объём воды
потребуется для приготовления 50 г 3% раствора. Чему равно количество
сахара в растворе?
Задача 2 Приготовьте 30 мл 9% раствора NaCl и рассчитайте количество и число
молекул данного вещества в растворе.
*Задача дополнительно (при успешном выполнении первых двуд задач): Для подкормки комнатных растений применяют раствор сульфата калия с массовой долей 2 %. Приготовьте 75 г такого раствора
3 этап: Оформление работы в тетради (теоретической части - приложение №1 )
После произведенных расчетов по одному из вариантов оформите их в тетради (6–7 мин).
4 этап: Практическая часть
u На лабораторных весах взвесьте вычисленную массу сахара. (приложение №2)
u Всыпьте сахар в стакан. Помните! К соли приливают воду!
u С помощью мерного цилиндра отмерьте вычисленный объем воды. Перелейте воду в химический стакан с сахором.(приложение №3)
u Перемешайте содержимое химического стакана до полного растворения сахара.
5 этап: Оформление работы в тетради (практической части - приложение №1)
(приложение №1)
Ход работы
|
Теоретическая часть (расчёт ) |
Вывод |
|||||||
|
Задача №1
m(раствора)= ω(вещества)=
m(С12Н22О11)- ?
Задача №2 Дано Решение
ω(вещества)=
n (NaCl) - ? N (NaCl ) - ? |
1) …....
2) ….... |
|||||||
|
Практическая часть |
||||||||
|
Что делали (рисунок) |
Что наблюдали? |
Вывод |
||||||
|
1) 2) 3) …. |
1) 2) 3) …. |
1) 2) 3) …. |
||||||
6 этап: Сделайте вывод по работе Вывод: …...
(приложение №2)
Правила взвешивания на лабораторных весах
Перед началом работы проверьте, в порядке ли набор разновесов, находятся ли весы в равновесии, и, если нет, уравновесьте их с помощью чистого речного песка или бумаги. Не кладите вещество на чашу весов! Взвешивайте его обязательно на листе бумаги. Располагая на весах взвешиваемый предмет или разновесы, придерживайте чашу весов (но не стрелку), чтобы избежать резких колебаний чаши в ту или иную сторону. Разновесы кладите только пинцетом. Снимая разновесы с весов, помещайте их только на отведенное место в футляре. При взвешивании разновесы всегда размещайте на правой чаше весов, а взвешиваемое вещество (предмет) — на левой. Разновесы ставьте на чашу весов всегда в определенном порядке: начните с более тяжелого разновеса, чем взвешиваемый предмет. Если он слишком тяжел, то снимите его и положите следующий, более легкий. И наоборот. Если масса разновесов мала, то, не снимая положенные разновесы, дополните более тяжелыми. Приведите весы в равновесие. По окончании взвешивания чаши весов необходимо протереть.
(приложение №3)
Правила пользования мерным цилиндром
Чтобы правильно отмерить измерительным цилиндром необходимый объем неокрашенной прозрачной жидкости — воды, её наливают так, чтобы нижний край мениска находился на уровне необходимого деления цилиндра. Соблюдайте правильное положение цилиндра относительно глаз при наполнении его жидкостью! Последние порции воды приливайте по каплям с помощью пипетки, чтобы не перелить.
7 этап: Приведите в порядок своё рабочее место.
Сдайте тетради на проверку.
Практическая работа №3
Тема: «Очистка загрязненной поваренной соли».
Цель работы: научиться проводить простейшие способы разделения смесей: отстаивание,
фильтрование, выпаривание. Формировать важнейшие методы познания – наблюдения и
умения описывать его.
Оборудование: 2 стаканчика, стеклянная палочка, фильтр, воронка, спички, спиртовка, зажим, чашка
для выпаривания
Реактивы: смесь песка с солью, дистиллированная вода.
Инструктаж по технике безоасности?!
Примечание: Внимательно слушай указания учителя?!
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.

а)
- запрещается пробовать вещества на вкус
б) - брать вещества руками
в) - оставлять неубранными рассыпанные или разлитые реактивы
г) - оставлять открытыми склянки с жидкостями и банки с сухими веществами
д) - работу проводить только над столом
Алгоритм проведения работы
1 этап: Растворение загрязненной поваренной соли в воде.
u Возьмите загрязненную поваренную соль из стакана сухой ложкой.
u Насыпьте 3 ложки этой соли в чистый стакан.
u Налейте в стакан воды на 1/3 его объема.
u Перемешайте содержимое стеклянной палочкой с резиновым наконечником.
2 этап: Очистка загрязненной поваренной соли фильтрованием.
u Возьмите кружок фильтровальной бумаги, сложите его пополам и еще раз пополам. Сектор, стоящий из четырех слоев бумаги, разверните так, чтобы образовался бумажный конус – фильтр.
u Вложите фильтр в стеклянную воронку так, чтобы он плотно прилегал к его стенкам и не доходил до края воронки примерно на 0,5 см. Смочите фильтр водой, держа воронку наклонно и вращая ее над банкой или стаканом.
u Воронку с фильтром вставьте в кольцо штатива. Под воронку поставьте пустой стакан так, чтобы конец воронки касался внутренней стенки стакана (предупреждения разбрызгивания жидкости).
u Фильтруемую жидкость наливайте на фильтр по стеклянной палочке. Нижний конец палочки направьте к стенке воронки, а не в середину фильтра, чтобы его не порвать.
u В воронку следует наливать столько фильтруемый жидкости, чтобы она не доходила до края фильтра на 0,5 см.
3 этап: Получение кристаллической поваренной соли выпариванием раствора.
u Фильтрат из стакана вылейте в выпарительную чашу.
u Поставьте чашу в кольцо штатива.
u Зажгите спиртовку.
u Нагревайте фильтрат до начала образования кристаллов.
u Во время нагревания помешивайте жидкость палочкой, не доводя ее до кипения во избежание ее разбрызгивания.
4 этап: Составьте отчет о проделанной работе, используя таблицу.
Ход работы
|
Название опыта, рисунки с обозначениями
|
Что наблюдал? |
Выводы, ответы на контрольные вопросы |
|
1. Растворение загрязненной поваренной соли в воде.
|
Запишите наблюдения |
Вывод: …...
1. Какие способы разделения смеси вы применили в данной работе? Ответ: …....
2. На каких свойствах поваренной соли и воды основано их разделение? Ответ: …....
|
|
2. Фильтрование
|
Запишите наблюдения |
Вывод: …..
Какие вещества находятся в фильтрате?
Ответ: ….... |
|
3. Выпаривание
|
Запишите наблюдения |
Вывод: …..
1. Какие процессы проходят при выпаривании раствора соли? Ответ: …....
2. Приведите примеры использования в быту таких операций, как а) растворение, б) фильтрование, в) выпаривание. Для чего они применяются? Ответ: а) ….... б) ….... в) …....
|
5 этап: Сделайте вывод по работе
Вывод: …...
6 этап: Приведите в порядок свое рабочее место. Сдайте тетради на проверку.
Практическая работа №4
Тема: «Получение кислорода и изучение его свойств»
Цель работы: рассмотреть один из способов получения кислорода в лаборатории ( разложением
перманганата калия или пероксида водорода), изучить химические свойства кислорода,
полученного в результате опыта.
Оборудование: штатив лабораторный, пробирки, спиртовка, пробка с газоотводной трубкой, лучинка,
спички, ложка для сжигания веществ, пробка.
Реактивы: пероксида водорода - H2O2, оксид марганца (lV)-MnO2 (или перманганата калия - KMnO4),
кусочек древесного угля.
Инструктаж по технике безоасности?!
Примечание: Внимательно слушай указания учителя?!
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.

а)
- запрещается пробовать вещества на вкус
б) - брать вещества руками
в) - оставлять неубранными рассыпанные или разлитые реактивы
г) - оставлять открытыми склянки с жидкостями и банки с сухими веществами
д) - работу проводить только над столом
- тушить спиртовку только колпачком
- запрещается зажигать одну спиртовку от другой,
Алгоритм проведения работы
1 этап: (в лаборатории можно получать одним из предложенных способам)
А. Получение кислорода путем разложения перманганата калия-KMnO4 методом вытеснения воздуха.
u Соберите прибор, как показано на рисунке №1 или №2
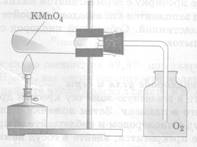
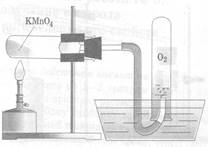
рис.1 вытеснение воздуха рис.2 вытеснение воды
u Поместите в пробирку на 1/5 ее объема перманганата калия.
u В отверстие пробирки вставьте неплотный кусочек ваты и закройте пробирку пробкой с газоотводной трубкой. Проверьте прибор на герметичность: опустите конец газоотводной трубки в стакан с водой, выделившийся из трубки пузырек свидетельствует о герметичности прибора.
u Пробирку с перманганатом калия закрепите горизонтально в лапке штатива. Газоотводную трубку, погрузите почти до дна склянки – приемника.
u Нагревайте пробирку по всем правилам. Полноту наполнения склянки кислородом контролируйте тлеющей лучинкой.
u После заполнения склянки кислородом, закройте ее стеклянной пластиной и сохраните кислород для следующих опытов.
Б. Получение кислорода путем разложения пероксида водорода - H2O2 методом вытеснения воды.
u Соберите прибор, как показано на рисунке.
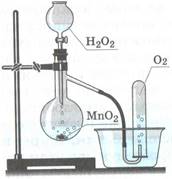
2 этап: Сжигание угля в кислороде
u В железной ложечке нагревайте кусочек древесного угля в пламени спиртовки до красного каления.
u Внесите тлеющий уголек в склянку с собранным кислородом.
u Сделайте вывод.
3 этап: Сжигание серы в кислороде.
u В железную ложечку положите кусочек серы и подожгите его в пламени.
u Внесите горящую серу в сосуд с кислородом.
u Сделайте вывод.
4 этап: Сжигание красного фосфора в кислороде.
u В железную ложечку положите красного фосфора и подожгите его в пламени.
u Внесите горящий фосфор в сосуд с кислородом.
u Сделайте вывод.
5 этап: Составьте отчет о проделанной работе, используя таблицу.
Ход работы
|
Название опыта, рисунки с обозначениями |
Что наблюдал? Уравнения реакций? |
Выводы, ответы на контрольные вопросы |
|
1. Получение кислорода
Рис. ? |
1. Запишите наблюдения...
2. Допишите уравнения ... H2O2 = или KMnO4 = |
Вывод:..............
Охарактеризуйте физические свойства кислорода: (цвет, запах, состояние, отношение к воде)
Ответ: ..... |
|
2. Сжигание угля в кислороде
Рис. ? |
1. Запишите наблюдения...
2. Допишите уравнения … C + O2 = |
Вывод:..............
Как изменилось пламя? Почему?
Ответ: ..... |
|
3. Сжигание серы в кислороде.
Рис. ? |
1. Запишите наблюдения...
2. Допишите уравнения … S + O2 = |
Вывод:..............
Как изменилось пламя? Почему?
Ответ: ..... |
|
4. Сжигание красного фосфора в кислороде.
Рис. ? |
1. Запишите наблюдения...
2. Допишите уравнения … P + O2 = |
Вывод:..............
Как изменилось пламя? Почему?
Ответ: ..... |
6 этап: Сделайте вывод по работе
Вывод: …...
7 этап: Приведите в порядок свое рабочее место. Сдайте тетради на проверку.
Практическая работа №5
Тема: «Признаки протекания химических реакций»
Цель работы: научиться распознавать признаки химических реакций, соблюдать осторожность при
работе с химическими реактивами, закрепить правила оказания первой помощи при
попадании кислоты на кожу человека.Продолжить отработку навыков составления
уравнений химических реакций.
Оборудование: штатив лабораторный, спиртовка, спички, тигельные щипцы, пробирки, лучинка.
Реактивы: кусочки мрамора, медная проволока, разбавленная серная кислота;
растворы хлорида железа (lll), роданида калия, карбоната натрия, хлорида кальция
Инструктаж по технике безопасности?! Примечание: Внимательно слушай указания учителя?!
Вспомните оказание первой помощи при попадании кислоты или щелочи на кожу или глаза
Если на кожу попала кислота - промыть пораженный участок кожи большим количеством воды
(УПГ), затем 5%-ным водным раствором NaHCO3 (соды). Наложить
повязку с ватой, смоченной риванолом или фурацилином. Для обработки
глаз после промывания струей воды (УПГ) использовать 3%-ный водный
раствор NaHCO3 (соды).
Если на кожу попала щёлочь - участок кожи обильно промыть водой (УПГ). Глаза промыть струей
воды (УПГ). Затем глаза и кожу обработать 2%-ным водным раствором
борной кислоты Н3ВО3.
Осторожно обращайтесь с химическим оборудованием!
 |


Алгоритм проведения работы
Выполните опыты, предложенные в учебнике стр. 207-208
1 этап: Прокаливание медной проволоки и взаимодействие оксида меди (ll) с раствором
серной кислоты.
u Зажгите спиртовку.
u Возьмите тигельными щипцами медную проволочку и внесите в пламя спиртовки.
u Поместите черный налёт в пробирку и прилейте в неё раствор серной кислоты
u Сделайте вывод.
2 этап: Взаимодействие мрамора с кислотой.
u В пробирку положите кусочки мрамора и прилейте раствор соляной кислоты
u Зажгите лучину и внесите её в стакан.
u Сделайте вывод.
3 этап: Взаимодействие хлорида железа (lll) с роданидом калия.
u В пробирку налейте 2 мл раствора хлорида железа (lll), затем добавьте несколько капель роданида калия.
u Сделайте вывод.
4 этап: Взаимодействие карбоната натрия с хлоридом кальция
u В пробирку налейте 2 мл раствора карбоната натрия, затем добавте несколько капель хлорида кальция.
u Сделайте вывод.
5 этап: Составьте отчет о проделанной работе, используя таблицу.
Ход работы
|
Название опыта, рисунки с обозначениями |
Что наблюдал? Уравнения реакций? |
Выводы, ответы на контрольные вопросы |
|
1. Прокаливание медной проволоки и взаимодействие оксида меди (ll) с раствором серной кислоты.
1. Рис. ? 2. Рис. ?
|
1. Запишите наблюдения ....
2. Допишите уравнения ... Cu + O2 = CuO + H2 SO4 = |
Вывод: …...
а) Тип реакции? б) Название образовавшихся веществ?
Ответ: а) ….. б) ….. |
|
2. Взаимодействие мрамора с кислотой.
Рис. ?
|
1. Запишите наблюдения ....
2. Допишите уравнения ... CaCO3+ HCl =
|
Вывод: …...
а) Тип реакции? б) Название образовавшихся веществ?
Ответ: а) ….. б) ….. |
|
3. Взаимодействие хлорида железа (lll) с роданидом калия.
Рис. ?
|
1. Запишите наблюдения ....
2. Допишите уравнения ... FeCl3 + KSCN = |
Вывод: …...
а) Тип реакции? б) Название образовавшихся веществ?
Ответ: а) ….. б) ….. |
|
4. Взаимодействие карбоната натрия с хлоридом кальция
Рис. ?
|
1. Запишите наблюдения ....
2. Допишите уравнения ... Na2CO3 + CaCl2 = |
Вывод: …...
а) Тип реакции? б) Название образовавшихся веществ?
Ответ: а) ….. б) ….. |
6 этап: Сделайте вывод по работе
Вывод: …...
7 этап: Приведите в порядок свое рабочее место.
Сдайте тетради на проверку.
Практическая работа №6
Тема: «Реакции ионного обмена»
Цель работы: научиться на практике осуществлять реакции ионного обмена, проведение которых
необходимы для доказательства наличия сульфат – и хлорид – ионов в растворах.
Совершенствовать умение объяснять наблюдения и результаты проводимых опытов.
Оборудование: штатив с пробирками
Реактивы: растворы сульфата натрия и сульфата калия, хлорида бария, хлорида натрия, нитрата
серебра, сульфата магния, карбоната аммония, гидроксид натрия.
Инструктаж по технике безопасности?!
Примечание: Внимательно слушай указания учителя?!
Вспомните оказание первой помощи при попадании щелочи на кожу или глаза
Если на кожу попала щёлочь - участок кожи обильно промыть водой (УПГ). Глаза промыть струей
воды (УПГ). Затем глаза и кожу обработать 2%-ным водным раствором
борной кислоты Н3ВО3.
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.








Не забывайте о требовании безопасности во время работы!
Требования охраны труда в аварийных ситуациях!
Алгоритм проведения работы
Выполните опыты, предложенные в учебнике стр. 270-271 (опыт 1,2,4)
1 этап: Опыт №1. Обнаружение сульфат – ионов SО42-
u В одну пробирку налейте 1-2 мл раствора сульфата натрия
u В другую пробирку налейте 1-2 мл раствора сульфата калия
u В обе пробирки добавьте раствор хлорида бария
2 этап: Составьте отчет о проделанной работе, используя таблицу.
|
Название опыта, рисунки с обозначениями |
Что наблюдал? Уравнения реакций? |
Выводы, ответы на контрольные вопросы |
|
1. Обнаружение сульфат – ионов SО42- Рис. ? |
1. Запишите наблюдения ....
2. Запишите уравнения в молекулярном и ионном виде ... |
Вывод: …...
В чём сущность обнаружения ионов с помощью реактива? Ответ: …..
|
3 этап: Опыт №2. Обнаружение хлорид – ионов Сl-
u В пробирку налейте 1-2 мл раствора хлорида натрия
u Добавьте раствор нитрата серебра
4 этап: Составьте отчет о проделанной работе, используя таблицу.
|
Название опыта, рисунки с обозначениями |
Что наблюдал? Уравнения реакций? |
Выводы, ответы на контрольные вопросы |
|
1. Обнаружение хлорид – ионов Сl- Рис. ? |
1. Запишите наблюдения ....
2. Запишите уравнения в молекулярном и ионном виде ... |
Вывод: …...
Какие соединения могут служить реагентом на ионы хлора? Ответ: …..
|
5 этап: Опыт №4. Распознавание веществ.
u В первую пробирку налейте 1-2 мл раствора сульфата магния
u Во вторую пробирку налейте 1-2 мл раствора карбоната аммония
u В третью пробирку налейте 1-2 мл раствора хлорида бария
u Во все три пробирки добавьте по каплям раствор гидроксида натрия
6 этап: Составьте отчет о проделанной работе, используя таблицу №1 и №2
таблица №1
|
Определяемые вещества |
Используемоё вещество для определения - NaOH |
|
MgSO4 |
Что наблюдал? …. Признак - ? …. |
|
(NH3)2CO3 |
Что наблюдал?.... Признак - ?.... |
|
BaCl2 |
Что наблюдал? …. Признак - ?.... |
таблица №2
|
Название опыта, рисунки с обозначениями |
Уравнения реакций? (в молекулярном и ионном виде |
Выводы |
|
1..... Рис. ? |
|
|
|
2..... Рис. ? |
|
|
|
3..... Рис. ? |
|
|
7 этап: Сделайте вывод по работе
Вывод: …...
8 этап: Приведите в порядок свое рабочее место.
Сдайте тетради на проверку.
Практическая работа №7
Тема: «Решение экспериментальных задач по теме
«Основные классы неорганических соединений»
Цель работы: на практике применить знания, полученные при изучении химических свойств и
способов получения классов неорганических веществ. Совершенствовать умение
объяснять наблюдения и результаты проводимых опытов.
Оборудование: штатив с пробирками, химическая ложечка.
Реактивы: хлорида магния, гидроксид натрия, сульфат калия, карбонат натрия, нитрат цинка, фосфат
калия, хлорид кальция, 15-% раствор соляная кислота, хлорид железа (lll), раствор серной
кислоты, оксид меди (ll), гидроксид меди (ll).
Инструктаж по технике безопасности?!
Примечание: Внимательно слушай указания учителя?!
Вспомните оказание первой помощи при попадании кислоты или щелочи на кожу или глаза
Если на кожу попала кислота - промыть пораженный участок кожи большим количеством воды
(УПГ), затем 5%-ным водным раствором NaHCO3 (соды). Наложить
повязку с ватой, смоченной риванолом или фурацилином. Для обработки
глаз после промывания струей воды (УПГ) использовать 3%-ный водный
раствор NaHCO3 (соды).
Если на кожу попала щёлочь - участок кожи обильно промыть водой (УПГ). Глаза промыть струей
воды (УПГ). Затем глаза и кожу обработать 2%-ным водным раствором
борной кислоты Н3ВО3.
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.












Не забывайте о требовании безопасности во время работы!
Требования охраны труда в аварийных ситуациях!
Алгоритм проведения работы
1 этап: Опыт №1
u В пять пробирок налейте раствор хлорида магния
u В каждую из пробирок налейте растворы:
пробирка №1 - гидроксид натрия
пробирка №2 - сульфат калия
пробирка №3 - карбонат натрия
пробирка №4 - нитрат цинка
пробирка №5 - фосфат калия
u Составьте отчет о проделанной работе, используя таблицу (уравнения реакций запишите в молекулярном и ионном виде)
|
Что делили? (рисунки с обозначениями) |
Уравнения реакций? (в молекулярном и ионном виде) |
Вывод |
|
1..... Рис. ? |
|
Что наблюдал? …. Признак - ? …. |
|
2..... Рис. ? |
|
Что наблюдал? …. Признак - ? …. |
|
3..... Рис. ? |
|
Что наблюдал? …. Признак - ? …. |
|
4..... Рис. ? |
|
Что наблюдал? …. Признак - ? …. |
|
5..... Рис. ? |
|
Что наблюдал? …. Признак - ? …. |
2 этап: Опыт №2
u Задание: Получите сульфат меди (ll) двумя способами.
u Составьте план решения задачи.
u Оформите отчет о работе используя таблицу
|
План решения (последовательность действий) |
Наблюдения. Объяснения. Уравнения реакций |
Выводы |
|
1.....
|
|
|
|
2.....
|
|
|
3 этап: Опыт №3 FeCl3 → Fe(OH)3 → Fe2(SO4)3
u Предложи план осуществления данной цепочки превращений.
u Оформите отчет о работе используя таблицу
|
План решения (последовательность действий) |
Наблюдения. Объяснения. Уравнения реакций |
Выводы |
|
1.....
|
|
|
|
2.....
|
|
|
4 этап: Сделайте вывод по работе
Вывод: …...
5 этап: Приведите в порядок свое рабочее место.
Сдайте тетради на проверку.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.