
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Мичуринский государственный аграрный университет» Центр-колледж прикладных квалификаций
Рассмотрено Утверждаю:
на заседании цикловой методической Заместитель директора
комиссии образовательных центра-колледж прикладных
дисциплин квалификаций
Протокол № 4 от 21.09.23 ФГБОУ ВО Мичуринский ГАУ
Председатель __________ Лазина Н.А. _____________ Толпеева Т.В.
КОМПЛЕКТ ИНСТРУКЦИОННЫХ КАРТ
для проведения практических занятий по дисциплине - ОУД.07 Химия
Специальность 09.02.07 Информационные системы и программирование
Подготовила преподаватель химии Струкова Светлана Сергеевна
Мичуринск 2023
Комплект инструкционных карт по дисциплине «Химия » разработан на основе федерального государственного образовательного стандарта среднего общего образования (ФГОС СОО), утвержденного приказом Министерства образования и науки РФ от 17 мая 2012 г. № 413; приказа Министерства просвещения РФ от 12 августа 2022 г. № 732 «О внесении изменений в федеральный государственный образовательный стандарт среднего общего образования, утвержденный приказом Министерства образования и науки Российской Федерации от 17 мая 2012 г. № 413», в
соответствии с Рекомендациями по реализации среднего общего образования в пределах освоения образовательной программы среднего профессионального образования (письмо Департамента государственной политики в сфере среднего профессионального образования и профессионального обучения от 1 марта 2023 г. N 05-592).
Автор: Струкова Светлана Сергеевна, преподаватель центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
Комплект инструкционных карт предназначен для проведения практических занятий по дисциплине «Химия» для студентов специальности 09.02.07 Информационные системы и программирование.
Перечень практических работ по химии
Практическая работа № 1. Решение практических заданий на составление электронно-графических формул элементов 1–4 периодов.
Практическая работа №2. «Металлические / неметаллические свойства в соответствие с их электронным строением и положением в периодической системе химических элементов Д.И. Менделеева».
Практическая работа № 3. Составление уравнений реакций соединения, разложения, замещения, обмена. Расчет количественных характеристик продукта реакции.
Практическая работа № 4. «Окислительно-восстановительные реакции»
Практическая работа № 5. «Реакции гидролиза».
Практическая работа № 6. Решение задач на расчет массовой доли (массы) химического элемента (соединения) в молекуле (смеси).
Практическая работа № 7 «Свойства металлов и неметаллов».
Практическая работа № 8. Номенклатура органических соединений отдельных классов Составление структурных формул органических веществ отдельных классов.
Практическая работа № 9:Решение цепочек превращений на генетическую связь между классами органических соединений с составлением названий органических соединений по тривиальной или международной систематической номенклатуре.
Практическая работа № 10. «Получение метана и изучение его, номенклатура алканов»
Практическая работа №11. Изучение зависимости скорости химической реакции от концентрации реагирующих веществ и температуры.
Практическая работа №12. «Исследование дисперсных систем».
Практическая работа №13. Денатурация белков при нагревании, цветные реакции белков.
Практическая работа № 1.
Решение практических заданий на составление электроннографических формул элементов 1–4 периодов.
Цель: научиться составлять электронные и графические формулы атомов; определять степени окисления в молекулах. Вопросы при доступе к работе:
1. Как определить число электронов в атоме?
2. Что такое электронное облако?
3. Как узнать количество электронных уровней и подуровней в атомах?
4. Сколько электронов может находиться на S, p, d, f- орбиталях ?
5. Что такое степень окисления?
6. Что такое валентность?
7. Что такое высшая и низшая степени окисления? Приведите пример.
Задание 1. Составление электронных формул.
Распределение электронов в атомах по энергетическим уровням и подуровням изображают в виде электронных формул. В электронной формуле число впереди означает номер энергетического уровня, буквой выражается подуровень (тип орбитали), индекс справа вверху- число электронов на подуровне.
Распределение электронов по уровням и подуровням, а также их максимальное число на них показано в табл. 1. Пример: Na 11e (1s2 2s2 2p6 3s1 )
Составьте электронные формулы атомов азота, фтора, хлора, неона, железа.
Задание 2. Составление графических электронных формул.
Очень часто структуру электронных оболочек изображают с помощью энергетических или квантовых ячеек – это так называемые графические электронные формулы. Каждая такая ячейка обозначается клеткой: клетка - орбиталь, стрелка – электрон, направление стрелки – направление спина, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. По принципу Паули в ячейке может быть один или два электрона (если два электрона, то они спарены), спины электронов должны быть направлены в противоположные стороны. Заполнение ячеек в пределах подуровня происходит сначала по одному электрону, а затем по второму.
Пример. Напишите схему распределения электронов по квантовым ячейкам в атоме углерода
|
|
|
|||||||||||
n =2
6С 1s2 2s2 2р2
|
↑↓ |
n =1
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2р – подуровне три орбитали (рх , ру, рz) у атома углерода два неспаренных электрона. Справа от схемы в электронной формуле дана более подробная запись с указанием расположения электронов на Рх , Ру, Рz – орбиталях.
2.Составьте графические электронные формулы атома азота, кислорода, фтора.
Задание 3. Определение степени окисления.
Степень окисления – это электрический заряд, который возник бы на атоме если бы электронные пары, которыми он связан с другими атомами в соединении были смещены к более электроотрицательным атомам, а электронные пары, принадлежащие одинаковым атомам, были между ними поделены. Степень окисления может иметь положительное, отрицательное и нулевое значение, которые обычно ставятся над символом элемента сверху.
Например: 1Na+2O-2 , Сl20
Правила определения.
1. Степень окисления атомов в молекулах простых веществ равна нулю.
2. Сумма всех степеней окисления в соединении равна нулю.
3. У одноатомных ионов степень окисления равна заряду иона.
4. В большинстве соединений атомы водорода имеют степень окисления +1, в гидридах металлов -1.
5. Степень окисления атома кислорода в большинстве соединений равна -
2, в пероксидах -1.
Пример. Вычислите степень окисления фосфора в фосфорной кислоте Н3РО4.
Сумма всех степеней окисления в соединении должна быть равна нулю, поэтому обозначив степень окисления фосфора через Х и умножив известные степени окисления водорода /+1/ и кислорода /-2/ на число их
атомов в соединении, составим управление /+1/3+ х +/-2/4 = 0
Из этого уровня найдем, что х = -5
3. Определите степень окисления атома в молекулах:
Cr2 O7; N2 ; CrO3; Ca(OH)2; H2 CO3; HCrO4; K2 Cr2 O7; NaClO3; P2 O5; O2 ; Na2 SO4.
4*. Составить формулы кислородосодержащих кислот, если степень окисления хлора в них а)+1, б) +5, в) +7.
5*. Составьте по степеням окисления атомов формулы следующих соединений: нитрида углерода; карбида алюминия; фторида иода.
Контрольные вопросы:
1.Выполните задания помеченные * (№ 4 и 5).
Практическая работа №2.
«Металлические / неметаллические свойства в соответствие с их электронным строением и положением в периодической системе химических элементов Д.И. Менделеева».
Цель: закрепить теоритические знания о строении атома;
повторить закономерности поведения электронов в атоме, характеризующих состояние электрона в атоме, закономерности распределения электронов по орбиталям и их взаимосвязь со структурной периодической системой химических элементов Д.И. Менделеева.
Состав и строение атома из Периодической системы элементов
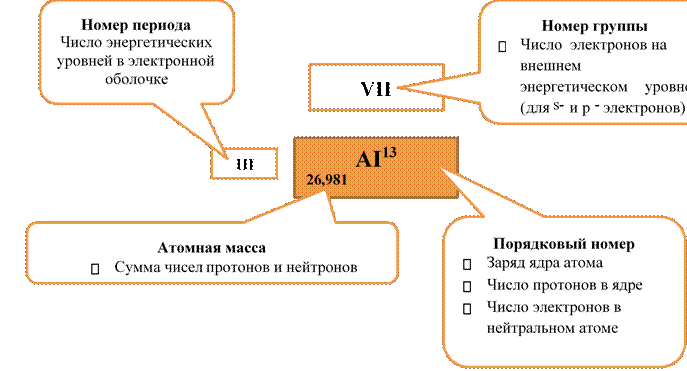
1.Строение электронной оболочки
Электроны расположены на энергетических уровнях.
Число энергетических уровней (n) равно номеру периода.
На одном энергетическом уровне может находиться максимальное число электронов, равное Ne=2n2: n=1 Ne=2 n=2 Ne=8 n=3 Ne=18 n=4 Ne=32
На энергетическом уровне электроны распределяются по энергетическим подуровням: n=1 1 подуровень-s n=2 2 подуровень-s, p
n=3 3 подуровень-s, p, d n=4 4 подуровень-s , p, d, f
На одном энергетическом подуровне может находиться определенное количество орбиталей одного типа:
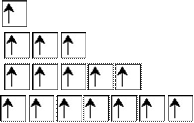 s
– 1 p – 3 d – 5
s
– 1 p – 3 d – 5
f – 7
На одной орбитали может находиться не более 2-х электронов:
![]() или
или ![]()
2.Принципы заполнения атомныхорбиталей электронами
Принцип наименьшей энергии: электроны в невозбужденном атоме распределяются по энергетическим уровням и подуровням так,чтобы их суммарная энергия была минимальной.
Порядок заполнения атомных орбиталей: 1s 2s 2p 3s 3p 4s 3d 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Принцип Паули: на одной орбитали может находиться не более двух электронов, причем их спины должны быть противоположными
![]() .
.
Правило Хунда: электроны в пределах одного подуровня занимают максимальное число свободных орбиталей
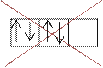
p
4![]() р4
р4
ЗАДАНИЕ: Составить характеристику химических элементов в соответствие с вариантом по данному плану:
1.Название элемента и его обозначение.
2. Положение элемента в Периодической системе.
Ø номер группы
Ø подгруппа
Ø номер периода
Ø порядковый номер
3. Состав атома
Ø атомная масса
Ø заряд ядра
Ø количество протонов
Ø количество нейтронов
Ø количество электронов
4. Строение электронной оболочки
Ø распределение электронов по энергетическим уровням
Ø электронная формула
Ø графическая электронная формула
Ø строение внешнего энергетического уровня, валентные возможности атома
5. Свойства простого вещества и его соединений
Ø металл или неметалл
Ø формула и характер высшего оксида
Ø формула и характер гидроксида
Ø формула летучего водородного соединения
6. Дополнительные сведения
Ø нахождение в природе, распространенность Ø когда и кем открыт данный элемент.
Ø физические свойства простого вещества
Ø практическое применение простого вещества
|
№ варианта |
Порядковый номер химических элементов |
№ варианта |
Порядковый номер химических элементов |
№ варианта |
Порядковый номер химических элементов |
|
1 |
9 22 35 |
6 |
6 12 22 |
11 |
8 15 35 |
|
2 |
11 24 44 |
7 |
10 37 21 |
12 |
4 30 53 |
|
3 |
19 25 45 |
8 |
38 32 42 |
13 |
18 28 38 |
|
4 |
5 20 43 |
9 |
33 13 48 |
14 |
7 47 27 |
|
5 |
1 38 47 |
10 |
34 50 21 |
15 |
16 29 51 |
Практическая работа № 3.
Составление уравнений реакций соединения, разложения, замещения, обмена. Расчет количественных характеристик продукта реакции.
Цель: продолжить формирование знаний о классификации химических реакций, сформировать практические навыки по решению задач на продукты реакций.
Оборудование: периодическая система элементов Д.И. Менделеева, таб. «Единицы измерения в системе СИ» Вопросы для допуска к работе.
1. Что такое химическое уравнение? (Слайд презентации)
2. Какие реакции называются реакциями соединения?
3. Какие реакции называются реакциями разложения?
4. Какие реакции называются реакциями замещения?
5. Какие реакции называются реакциями обмена?
В природе существует огромное множество различных химических реакций. Для их упорядочивания и систематизации придумано несколько способов их классификации, то есть разделения на различные типы.
Чаще всего химические реакции классифицируют по числу и составу реагентов и продуктов реакции. По этой классификации выделяют четыре типа химических реакций — это реакции соединения, разложения, замещения, обмена.
Задание 1. Составление уравнений реакций соединения, разложения, замещения, обмена.
Задача 1. На месте знаков “?” правильно заполните пропуски в уравнениях химических реакций:
Ca + 2HCl = Ca”?” + H2 ↑ 2Mg + “?” = 2MgO
2H2”?” + 3O2 = 2H2O + 2SO2
Fe2O3 + 3H2 = 2Fe + 3”?”O
CaCl2 + 2NaOH = Ca(OH)2 + 2Na”?”
Задача 2. Приведены 8 разных химических реакций. а) Найдите среди них реакции соединения, разложения, замещения и обмена. Запишите их уравнения в 4 столбика (по две реакции каждого типа в столбике); б) Уравняйте реакции; в) Подчеркните те реакции, которые являются окислительно-восстановительными. Укажите в них степени окисления атомов в реагентах и продуктах:
H2 + O2 = H2O (реакция идет со взрывом)
Zn + CuCl2 = Cu + ZnCl2 (реакция происходит в растворе) NH3 = N2 + H2 (реакция идет при нагревании в газовой фазе)
Cu + S = CuS (реакция идет при нагревании порошков Cu и S)
AgF + NaCl = AgCl¯ + NaF (реакция происходит в растворе) CaCO3 = CaO + CO2 ↑ (реакция происходит при нагревании)
CuBr2 + NaOH = Cu(OH)2¯ + NaBr (реакция происходит в растворе) Fe + H2O = H2↑ + Fe2O3 (реакция происходит при нагревании).
Задача 3. Приведены схемы реакций. Составьте уравнения химических реакций, расставьте коэффициенты и укажите их тип: а) нитрат серебра + хлорид железа (III) → хлорид серебра + нитрат железа
(III);
б) гидроксид свинца (II) → оксид свинца (II) + вода.
Задание 2. Расчет количественных характеристик продукта реакции.
Задача 4. Железо массой 448 г полностью прореагировало с хлором.
Рассчитайте массу образовавшегося вещества FeCl3.
Задача 5. При разложении малахита (CuOH)2CO3 , образуется оксид меди (II), углекислый газ и вода. Определите массы веществ, образующихся при разложении 0,12 моль малахита. (CuOH)2CO3 = CuO + CO2 +H2O.
Задача 6. При разложении карбоната кальция CaCO3 , образуется углекислый газ и оксид кальция CaO. Определите массы продуктов реакции, образовавшихся при разложении 5 моль карбоната кальция. CaCO3= CaO + CO2.
Задача 7. Какая масса кислорода потребуется для полного сжигания 36г углерода?
Контрольные вопросы.
1. Расставьте коэффициенты, преобразовав схемы в уравнения реакций. Укажите тип каждой реакции.
AgNO3 + Al = Ag + Al(NO3)3
Fe(NO3)3 = Fe2O3 + NO2 + O2
P + O2 = P2O3
CaCl2 + AgNO3 = CaNO3 + AgCl
Mg + H2SO4 = MgSO4 + H2
KClO3 = KCl + KClO4
P4 + Cl2 = PCl5
K + H2O = KOH + H2
NaNO3 = NaNO2 + O2
Na2SO4 + BaCl2 = NaCl + BaSO4
2. Закончите уравнения реакций замещения. Расставьте коэффициенты.
Al + Fe2O3 =
KI + Cl2 =
HCl + Zn =
HCl + Al =
3. Какую массу воды нужно подвергнуть разложению электрическим током, чтобы получить 1,6г кислорода?
Практическая работа № 4.
«Окислительно-восстановительные реакции» Цель: научить составлять уравнения окислительно-восстановительных реакций.
Оборудование: «Ряд напряжений металлов», таблица электродных потенциалов.
Вопросы для допуска к работе:
1. Что такое окислительно-восстановительные реакции?
2. Что такое окисление? Восстановление?
3. Какие вещества называются окислителями, а какие - восстановителями? 4. Назовите важнейшие восстановители и Составьте самостоятельно уравнение реакций окислители.
5. Назовите основные правила определения степеней окисления.
Задание 1. Составить уравнения окислительно-восстановительных реакций методом электронного баланса.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции.
В его основе лежит правило, что число электронов, отданных восстановителем и принятых окислителем должно быть равно. Для составления уравнений надо составить схему реакции, найти атомы, которые меняют степень окисления в реакции, а затем составить электронный баланс. На основании его расставляются коэффициенты перед окислителем и восстановителем, а затем путем простого подсчета определяются коэффициенты для других веществ – участников и продуктов реакции.
Пример 1. Составьте уравнение реакции меди с нитратом ртути.
А) запишем схему реакции и определим степени окисления элементов: Cu0 + Hg+2(NO3)2 = Cu+2(NO3)2 + Hg0
Б) составим электронные уравнения:
Cu0 – 2е = Cu+2 | 2 | 1 окисление
Hg+2 + 2е = Hg0 | 2 | 1 восстановление
Медь имела степень окисления равную нулю, после реакции повысилась до +2, атом меди отдает два электрона. Ртуть со степенью окисления +2 понижает ее до 0, присоединяя два электрона.
Далее определяем, где идет процесс окисления, а где - восстановления.
Называем окислитель (нитрат ртути) и восстановитель (медь).
В) Определяем коэффициенты в уравнениях реакции. Так как число принятых и отданных электронов одинаковое (два), то коэффициенты равны 1.
Проверяем правильность составленного уравнения, подсчитывая число атомов каждого элемента до и после реакции. Если их количества равны, уравнение составлено верно.
Пример 2. Составить уравнение реакции:
HCl-1 + Mn+4O2 = Cl2 0 + Mn+2Cl2-1 + H2O Составляем электронные уравнения:
2Cl -1 - 2е = Cl2 0 | 2 | 1 окисление Mn+4 + 2е = Mn+2 | 2 | 1 ...?
Так как не все атомы хлора изменили степени окисления, подсчитаем, сколько всего атомов хлора образовалось после реакции, их четыре. Выставляем коэффициенты:
4HCl-1 + Mn+4O2 = Cl2 0 + Mn+2Cl2-1 + 2H2O
Проверьте правильность расстановки коэффициентов, укажите окислители и восстановители.
Пример 3. Составьте самостоятельно уравнения реакций, укажите процессы окисления, восстановления, а также окислители и восстановители:
K2S-2 + KMn+7O4 + H2SO4 = S0 + Mn+2SO4 + K2SO4 + H2O
Cu + HNO3 = Cu(NO3)2 + NO + H2O
Контрольные вопросы.
1. Из приведенных ниже веществ укажите отдельно окислители и восстановители:
K2CrO4, KClO3 , NH3, Ca, Cl2, Fe2(SO4)3, HI, NaMnO4
2. Составьте уравнение реакции методом электронного баланса:
NaMnO4 + K2SO3 + H2SO4 = MnSO4 + K2SO4 + Na2SO4 + H2O
Практическая работа № 5.
«Реакции гидролиза».
Цель: углубить знания о гидролизе солей.
Оборудование: раствор Na2CO3, NaCl, FеС13, Na2SO3, пробирки, лакмусовая бумажка красная и синяя, дистил. Н2О.
Вопросы для допуска к работе.
1. Гидролиз, понятие, причины.
2. Ступенчатый характер гидролиза. Пример.
3. Степень диссоциации. Сильные и слабые электролиты. Задание1. Испытать растворы различных солей индикаторами.
В четыре пробирки налейте по 1 мл растворов: карбоната натрия, хлорида натрия, хлорида железа(3) и сульфита натрия. Нанесите каплю каждого раствора на синию и красную лакмусовую бумажку стеклянной палочкой (промывайте ее в стакане с дистиллированной водой каждый раз). В какой цвет окрашивается бумажка от действия на нее каждого из указанных растворов? Почему? Составьте уравнение реакций гидролиза в трех формах (молекулярной, полной и краткой ионных). Результаты оформите в виде таблицы:
|
Формула соли |
Реакция на лакмус |
Каким основанием (сильным или слабым электролитом) образована соль, формула |
Какой кислотой (сильным или слабым электролитом) образована соль, формула |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Укажите причины полученных реакций растворов.
Контрольные вопросы:
1. Какие соли подвергаются гидролизу в водных растворах?
2.Какую реакцию имеют растворы следующих солей: хлорида аммония, сернокислого алюминия, азотнокислого калия?
Практическая работа № 6.
Решение задач на расчет массовой доли (массы) химического элемента (соединения) в молекуле (смеси).
Цель: сформировать практические навыки по решению задач, основанных на законах химии.
Оборудование: периодическая система элементов Д.И. Менделеева, таб.
«Единицы измерения в системе СИ»
Вопросы для допуска к занятию.
1.Сформулируйте основные понятия химии: молекула, атом, молекулярная масса, атомная масса, моль, молярная масса. Как они определяются?
2.Сформулируйте законы химии: постоянства состава вещества, сохранения массы и энергии, кратных отношений, закон Авогадро.
Задание:1. Расчеты с использованием понятия «моль»
А) Вычисление количества вещества, соответствующего определенной массе вещества
Задача 1. Дано 32 г меди. Вычислите количества меди. m
Р е ш е н и е. Пользуясь формулой v ![]() , где v – количество
вещества,
, где v – количество
вещества,
M
m – масса вещества, М – молярная масса данного вещества, находим количество вещества меди:
v=m/M=32/64=0.5 ; v=(Cu)=0.5 моль
Можно рассуждать и так:
64 г меди составляют 1 моль
32 г меди - х
64:32 =1: х;
![]() 321
0,5; х=0,5
моль Сu
321
0,5; х=0,5
моль Сu
64
Ответ. 32 г меди составляют 0,5 моль.
Задача 2. Какое количество вещества составляют 66 г оксида углерода
(IV)? Ответ. 1,5 моль.
Б)Вычисление массы вещества по известному числу молей вещества Задача 3. Дано 0,25 моль серы. Вычислите массу серы. Р е ш е н и е. v=m/M; m=v∙M= …
Ответ. 8 г серы.
В)Вычисление объема определенной массы газообразного вещества
(н.у.)
При расчетах необходимо следить за тем, чтобы единицы измерения разных величин были пропорциональными. Так, если масса газообразного вещества выражена в килограммах, то объем следует выражать в кубических метрах.
Задача 4. Какой объем занимают 48 г кислорода?
Ре ш е н и е.
1) Вычисляем молярную массу кислорода:
М(О2 )= 32 г/моль
2) Находим количество вещества, которому соответствует 48 г кислорода:
![]() m ; (О2)
m ; (О2) ![]() 48 1,5моль
48 1,5моль
M 32
3) Рассчитываем объем, который занимают 1,5 моль кислорода (р. у.):
(О2) 1,522,4 33,6л
Ответ. Кислород массой 48 г занимает объем 33,6 л.
Г) Вычисление массы газообразного вещества, занимающего определенный объем
Задача 5. Вычислите массу газовой смеси, состоящей из 5,6 м3 метана и 2,24 м3 оксида углерода (II): Р е ш е н и е. 1) Вычисляем молярные массы и оксида углерода (II): М(СН4)=16 г/моль; М(СО)=28 г/моль 2) Определяем массу 5,6 м3 метана:
масса 22,4 м3 СН4 составляет 16 кг
масса 5,6 м3 СН4 - х1
22,4:5,6=16: х1; 1
![]() 4; х1=4
кг СН4
4; х1=4
кг СН4
3) Аналогично определяем массу 2,24 м3 оксида углерода (II): масса 22,4 м3 СО составляет 28 кг
? …
22,4: … =28 : х2; х2= … кг СО 4) Находим общую массу газовой смеси :
4 кг + … кг = 6,8 кг
Ответ. Общая масса газовой смеси 6,8 кг.
Задание 2.Расчеты по уравнениям химических реакций
При решении задач по уравнениям химических реакций рекомендуется соблюдать указанную ниже последовательность:
1. Если вещества даны с примесями, то сначала вычисляют массу чистого вещества, содержащего в смеси.
2. Составляют уравнение соответствующей химической реакции.
3. В уравнении реакции одной чертой подчеркивают химические формулы веществ, массы которых требуется вычислить.
4. Вычисляют количества тех веществ, формулы которых подчеркнуты.
5. Найденные числа пишут под соответствующими химическими формулами и производят вычисления, как показано ниже.
А) Вычисление массы вещества (исходного или получаемого) по уравнению реакции, если известна масса другого вещества
(получаемого или исходного)
Задача 6. Какая масса гидроксида натрия образуется при взаимодействии 2,3 г натрия с водой?
![]() Р е ш е н и е.
Составляем уравнение реакции и находим массы, соответствующие тем количествам
вещества, которые заданы уравнением: 2Na2НОН2NaOHН2
М(Na)=23 г/моль
Р е ш е н и е.
Составляем уравнение реакции и находим массы, соответствующие тем количествам
вещества, которые заданы уравнением: 2Na2НОН2NaOHН2
М(Na)=23 г/моль
![]()
46 г 80 г m(Na)=2∙23=46 г 2,3 г х г М(NaOH) = 40 г/моль m(NaOH) = 2∙40 = 80 г
46:2,3
= 80 : х;
![]() 2,380
4
2,380
4
46
х=4 г NaOH
Вычисление можно производить и так:
2М(Na) m(Na) m(Na) 2,3
![]()
![]() ;m(NaOH)
2M(NaOH)
80
4; m(NaOH) 4г
;m(NaOH)
2M(NaOH)
80
4; m(NaOH) 4г
2M(NaOH) m(NaOH) 2M(Na) 46
Ответ. Образуется 4 г гидроксида натрия.
Задача 7. Какая масса карбоната кальция потребуется, чтобы получить 224 т оксида кальция?
Р е ш е н и е. Составляем уравнение реакции и производим вычисление: СаСО3 tCaOCO2 …
![]()
Ответ: 400 т СаСО3.
Контрольные задания. 1.Дано 2 моль серной кислоты. Определите массу серной кислоты.
(Отв. 196г)
2. Определить количество моль азота, содержащихся а) в 700 г его;
б) в 56 л.
3. Каковы объем и масса аммиака, которые потребуются для получения 5 т нитрата аммония?
4. Вычислите массу сульфата бария, выпадающего в осадок при сливании растворов, один из которых содержит 522 г нитрата бария, а второй – 500 г сульфата калия. (Отв. В осадок выпадает 466 г ВаSO4).
Практическая работа № 7
«Свойства металлов и неметаллов».
Цель: изучить на практике свойства металлов и неметаллов.
Оборудование: пробирки в штативе, растворы хлорида цинка, нитрата свинца, хлорида меди, свинец, цинк, медь, спиртовки, спички, газоотводные трубки, хлорид аммония. гидроксид кальция, кристаллизатор с водой, красная лакмусовая бумага.
раствор сульфата аммония, раствор гидроксида натрия.
Вопросы для допуска к работе.
1.Строение металлов, положение в Периодической системе.
2.Химические свойства металлов.
3.Ряд активности металлов, понятие, значение.
4.Химические свойства солей аммония.
5.Качественная реакция на ион аммония.
6.Осуществить превращения:
С à СО à С02 à СаСО3 à Са(НСО3)2 à СО2. Задание: Изучить взаимодействие металлов с солями
Опыт 1. Налейте в одну пробирку около 2мл раствора хлорида цинка, а в другую - столько же раствора нитрата свинца. В первую опустите кусочек свинца, предварительно очистив его поверхность ножом, а во вторую кусочек цинка. Что наблюдаете? В какой из пробирок заметны изменения, свидетельствующие о происходящей реакции? Составьте уравнение реакции.
Опыт 2. Налейте в одну пробирку 2мл раствора хлорида цинка, а в другую столько же раствора хлорида меди (II). В первую пробирку опустите кусочек меди, а во вторую - кусочек цинка. Проведите те же наблюдения, какие проводили при выполнении опыта 1. Составьте уравнение реакции.
Опыт 3. Налейте в одну пробирку около 2 мл раствора нитрата свинца, а в другую - столько же раствора хлорида меди (II). В первую пробирку опустите кусочек меди, а во вторую - кусочек свинца. Проведите те же наблюдения, какие проводили при выполнении первых двух опытов.
Напишите сокращенные ионные уравнения реакций. Дайте объяснение происходящим реакциям, основываясь на активности металлов.
Задание 2. Получите аммиак, изучите его свойства и свойства солей аммония.
Опыт 1. Получения аммиака.
В пробирку насыпьте смесь хлорида аммония с гидроксидом кальция (до 1/3 объема пробирки), закройте ее пробкой с газоотводной трубкой и укрепите в лапке штатива. Содержимое пробирки нагревайте пламенем спиртовки, предварительно опустив конец газоотводной трубки в пробирку с водой. Что наблюдаете? Составьте уравнение проделанной реакции. Опыт 2. Растворимость аммиака в воде.
Повторите опыт, заменив пробирку с водой пустой пробиркой, отверстие которой закройте кусочком бумаги или ваты. Нагревайте смесь пламенем спиртовки до появления запаха аммиака. Снимите пробирку, наполненную аммиаком и, закрыв отверстие большим пальцем, опустите в чашку с водой (кристаллизатор). Уберите палец и слегка покачивайте пробирку, не вынимая ее из воды. Дайте объяснение наблюдаемому явлению. Когда уровень воды перестанет подниматься, закройте отверстие пробирки под водой пальцем и переверните ее. Испытайте среду раствора красной лакмусовой бумагой или фенолфталеином. Какое вещество образовалось? Составьте уравнение реакции.
Опыт 3. Качественная реакция на катион аммония.
В пробирку налейте 1 мл раствора сернокислого аммония и 0,5 мл раствора гидроксида натрия. Пробирку нагрейте над пламенем спиртовки. Что наблюдаете? Составьте уравнение проделанной реакции. Сделайте вывод. Опыт 4. Получение и свойства углекислого газа.
В пробирку насыпьте 1 см3 карбоната кальция и прилейте 3-5 капель раствора НCl.
Что наблюдаете? Закройте пробирку пробкой с газоотводной трубкой, опустив ее конец в пробирку с водой. Что наблюдаете? Какой газ выделяется? Напишите ионные уравнения реакции (полное и сокращенное). Испытайте среду раствора лакмусовой бумагой. Какое вещество образовалось? Составьте уравнение реакции.
Контрольные вопросы:
1. Какими физическими свойствами обладают металлы? Объясните их причину.
2. Составьте уравнения реакций в тех случаях, где это возможно, дайте
объяснение: а) Fe + CuS04 à в) Аl + NaNO3 à
б) Си + FeSO4 à г) Ca + Mg(NO3)2 à
3.Какие металлы будут взаимодействовать с кислотами? Составьте
уравнения реакции: а) Zп +HCl à в) Си + HCl à б) Fe+H2SO4 à г)Аg+НNO3 à
4.Выполните превращение (составьте уравнения реакций) N2 à (NH4)2SO4 à NH3 à NH4OH
5. Как можно получить NH4Cl, NH4OH? Составьте уравнение реакций.
Практическая работа № 8.
Номенклатура органических соединений отдельных классов Составление структурных формул органических веществ отдельных классов.
Цель: сформировать знания о номенклатуре органических соединений отдельных классов, научиться навыкам составления структурных формул органических веществ .
Вопросы для допуска к работе.
1. Что означает понятие номенклатура?
2. Назовите основные принципы составления названий органических соединений.
3. Какие вещества называются изомерами. Примеры.
Задание 1. Написать полное и сокращенное структурное уравнение для веществ с формулами (линейная цепочка): С3Н8, С5Н12, С7Н16, С6Н14.
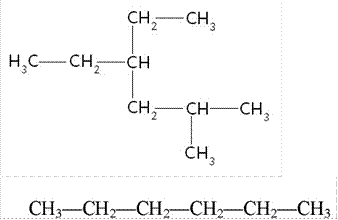 Задание 2.
Написать все возможные изомеры для следующих веществ: а)
Задание 2.
Написать все возможные изомеры для следующих веществ: а)
б)
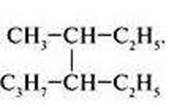 в)
в)
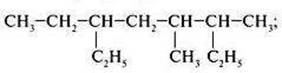 г)
г)
Контрольные вопросы:
1. Теория строения органического вещества.
2. Что такое валентность ? Какова валентность углерода в органическом веществе?
3. Почему в органической химии обязательно писать труктурные формулы?
Практическая работа № 9
Решение цепочек превращений на генетическую связь между классами органических соединений с составлением названий
органических соединений по тривиальной или международной систематической номенклатуре.
Цели: рассмотреть взаимосвязь между основными классами органических соединений, научиться составлять уравнения химических реакций по генетической цепочке.
Генетической связью – называется связь между веществами разных классов,
основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ. Что же означает понятие «генетическая связь»
1.Превращение веществ одного класса соединений в вещества других классов.
2.Химические свойства веществ.
3.Возможность получения сложных веществ из простых.
4.Взаимосвязь простых и сложных веществ всех классов веществ.
Понятие генетического ряда веществ, который является частным проявлением генетической связи.
Генетическим называют ряд веществ – представителей разных классов веществ являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающими общность происхождения этих веществ.
Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле. Например:
C2H6 →C2H4→ C2H5OH→CH3CHO → CH3 – COOH →CH2Cl – COOH →NH2CH2COOH
Этан этен этанол этаналь уксусная кислота хлорэтановая кислота аминоэтановая к-та алкан алкен алканол алканаль карбоновая кислота хлоркарбоновая кислота аминокислота
1.C2H6 → C2H4 + H2 ; 2.C2H4 + H2O → C2H5 OH
3.C2 H5OH + [O] → CH3CHO + H2O; 4.CH3CHO + [O] → CH3COOH
5.CH3COOH + Cl2 → CH2Cl - COOH; 6.CH2Cl - COOH + NH3 → NH2 CH2 – COOH + HCl Между гомологическими рядами углеводородов существует генетическая связь, которая обнаруживается в процессе взаимного превращения этих веществ. Для перехода от одной группы веществ к другой используют процессы: дегидрирование, гидрирование, циклообразование и другие. Так можно осуществить большинство переходов, однако, этот способ получения углеводородов не является универсальным. Стрелками в схеме указаны углеводороды, которые непосредственно можно превратить друг в друга одной реакцией.
Схематически это выглядит так:
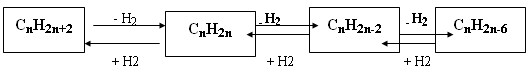
Углеводороды, спирты, альдегиды и карбоновые кислоты генетически связаны между собой. При этом можно проследить постепенное усложнение строения веществ. Перечисленными классами далеко не исчерпывается круг органических соединений. Разнообразные преобразования кислот и других веществ обусловливают появление новых классов и, таким образом, дальнейшее развитие разнообразия органических соединений. Прослеживая связь веществ в направлении их усложнения, можно заметить, что простейшими первичными
«кирпичиками» являются углеводороды, от которых можно перейти к галогенопроизводным, спиртам и т.д.
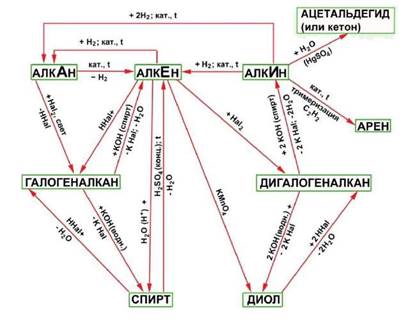
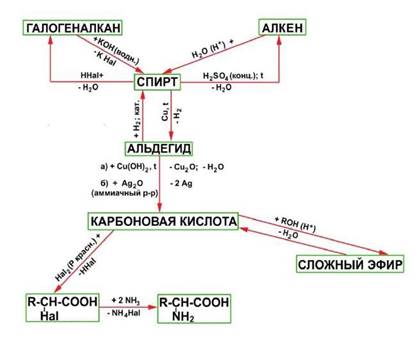
Вопросы для допуска к работе.
1.Дайте определения понятий: «генетическая связь», «генетический ряд веществ».
2.В чем выражается генетическая связь между углеводородами?
3. Перечислите названия реакций, которые вы записывали при выполнении заданий.
4.Какая группа веществ лежит в основе большинства генетических цепочек? Задания для практической работы:
Напишите уравнения реакций, с помощью которых можно осуществить превращения. Назовите получившиеся вещества. Укажите условия протекания реакций.
![]() Задание № 1. С→ СН4→С2Н6→С2Н4→С2Н2→—>С6Н6→С6Н5СI Задание № 2.СаСО3 → СаО →
СаС2 → С2Н2→ тримеризация,
С(акт) Х Задание
№ 3.СН4
Задание № 1. С→ СН4→С2Н6→С2Н4→С2Н2→—>С6Н6→С6Н5СI Задание № 2.СаСО3 → СаО →
СаС2 → С2Н2→ тримеризация,
С(акт) Х Задание
№ 3.СН4 ![]() С3Н8
С3Н8 ![]() С3Н7Сl Х
СО2.
С3Н7Сl Х
СО2.
Задание № 4. Этан→ этен→ этин→бензол.
Задание № 5. С3Н8→С3Н6→С3Н7СI→С6Н14→C6Н12→С6Н6 → С6Н5Вr.
Задание № 6. Ацетилен → → этилен → этанол → уксусный альдегид → уксусная кислота.
Задание № 7. С→ СН4→С2Н2→ C6Н6 → С2Н5 Br →С6Н5 ОН
Задание №8. CН4 → C2H2 → СН3-СН=О → СН3-СООН→этиловый эфир уксусной кислоты
↓
C2H5ОН
Задание № 9. CН4 → C2H2 → C2H4→ C2H5ОН → СН3-СН=О → СН3-СООН
Задание № 10. СaC2 → C2H2 → C2H4 → C2H5CI → C2H5ОН → СН3-СН=О→ СН3-СООН
↓
C2H5ОН
Задание № 11. СН4 → СO2 → С6Н12О6 → (С6Н10O5)n
Задание № 12.Из предложенных веществ составьте 2 генетических ряда:С2Н2, С3Н8, С2Н4, С2Н6, С4Н10, СН3-СН=СН2, С6Н6, С9Н12, СН4,С2Н5СООН, С3Н4,С2Н5О-ОССН3,C2H5-OH.
Практическая работа № 10.
«Получение метана и изучение его, номенклатура алканов» Цель: изучить способ получения метана в лаборатории, а также его свойства.
Оборудование: уксуснокислый натрий, натронная известь, раствор марганцовокислого калия и бромная вода, пробирки, штативы, спиртовки, спички, кристаллизаторы, газоотводные трубки, лучины.
Вопросы для допуска к работе:
1. Каково строение метана?
2. Как получить метан в лаборатории?
3. Какие реакции характерны для метана?
4. Почему метан малоактивен?
Работая с метаном соблюдайте осторожность, так как его смесь с воздухом взрывоопасна!
Задание 1. Получение метана.
Опыт1. Смешайте 1в.ч. уксуснокислого натрия с 3 в.ч. натронной извести. Поместите смесь в сухую пробирку, закройте её пробкой с газоотводной трубкой и укрепите в штативе так, чтобы вода не могла стекать к нагреваемой части пробирки. Нагревайте содержимое пробирки горелкой. Напишите уравнение реакции получения метана.
Задание 2. Изучение свойств метана Опыт 1. Горение метана.
Пользуясь кристаллизатором с водой, наполните метаном пробирку. Подожгите его горящей лучиной. Что наблюдаете? Составьте уравнение реакции.
Опыт 2. Не прекращая нагревания смеси, пропустите метан сначала через раствор марганцовокислого калия, а затем через бромную воду (в пробирках). Почему растворы не обесцвечиваются?
Задание 3.
Освоение номенклатуры алканов.
1. Дать названия следующим соединениям по международной номенклатуре:
![]()
![]() а)
СН3 – СН2 – СН – СН – СН2 – СН3
а)
СН3 – СН2 – СН – СН – СН2 – СН3
СН3 С2Н5
![]()
![]() б) СН3 – СН – СН2
– СН – СН3
б) СН3 – СН – СН2
– СН – СН3
СН3 СН3
2. Составить формулы:
а) 3-этилпентана;
б) 2,2-диметилбутана.
Контрольные вопросы
1. Напишите структурные формулы девяти изомеров углеводорода С7Н16. Назовите их.
2. Составьте уравнение реакции получения бутана по реакции Вюрца.
3. Напишите формулы углеводородов с названиями:
а) 2-метил-3-этилгексан,
б) 2-метил - 2-этилгексан,
в) 2,2,3 – триметилпентан.
Практическая работа №11. Изучение зависимости скорости химической реакции от концентрации реагирующих веществ и температуры. Цель работы: Закрепить и совершенствовать знания и умения по исследованию зависимости скорости химической реакции от температуры, концентрации и др.
Скорость химической реакции определяется изменением концентрации реагирующего вещества в единицу времени: V = ± ∆С\∆t Скорость химической реакции зависит от природы и концентрации реагирующих веществ, температуры, присутствия катализатора. Площади поверхности соприкосновения реагентов (для гетерогенных реакций). Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс: скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов, возведенных в степени, соответствующие стехиометрическим коэффициентам в уравнении реакции.
Для реакции А+ 2В→ с
V = k · СА · (СВ)2
Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости не зависит от температуры, для гетерогенных реакций – от площади поверхности раздела фаз, и изменения в присутствии катализатора.
При повышении температуры скорость реакции увеличивается. Вант – Гоффом было установлено следующее эмпирическое правило: при повышении температуры на каждые 100 скорость химической реакции увеличивается 2 – 4 раза.
Оборудование и реактивы: , секундомер, водяная баня, термометры на 1000 C. Растворы: Na2S2O3 (1 М), H2SO4 (2 М).
Опыт 1: Определение зависимости скорости химической реакции от концентрации реагирующих веществ.
1. Налить в три пробирки равные объёмы растворов Na2S2O3 различной концентрации, добавив в две пробирки воду, как указано в таблице 2:
Таблица 2
|
|
Кол-во капель раст-ра Na2S2O3 |
Кол-во капель воды |
Кол-во капель H2SO4 |
Общий объём раст-ра (число капель) |
Условная конц-ция Na2S2O3, моль/л |
Время течения р-ции t,с |
Скорость р- ции в у.е., 1/t V, с-1 |
|
1 |
5 |
10 |
1 |
16 |
1 М |
|
|
|
2 |
10 |
5 |
1 |
16 |
2 М |
|
|
|
3 |
15 |
0 |
1 |
16 |
3 М |
|
|
2. Пробирки №1 и 2 осторожно встряхнуть и поставить в штатив. Включить секундомер. В пробирку № 1 добавьте одну каплю 2 М раствора H2SO4. По секундомеру определите время с момента добавления кислоты до помутнения раствора.
3. Опыт повторить поочерёдно с пробирками №2 и 3.
4. Все данные опыта занести в таблицу. Сделать вывод о зависимости скорости реакции от концентрации реагирующих веществ.
5. Построить график зависимости скорости реакции от концентрации Na2S2O3. Для этого на оси абсцисс отложить в определённом масштабе относительные концентрации Na2S2O3, а на оси ординат - отвечающие им скорости.
Опыт 2: Определение зависимость скорости реакции от температуры.
1. Налить в три сухие пробирки 2 М раствор H2SO4, а в три другие - по 10 капель 1 М раствора Na2S2O3. Первый опыт провести при комнатной температуре. Быстро прилить 1 каплю раствора H2SO4 в раствор Na2S2O3.
Отмерить время сливания по секундомеру до появления заметной мути.
2. Второй опыт провести аналогично первому, но при температуре на 100 выше комнатной, для чего следующую пару пробирок нагреть в ванне с водой, температура которой контролируется термометром. Выдержать растворы в бане в течение 15-20 мин, а затем слить вместе. По секундомеру измерьте время течения реакции, как и в первом случае.
3. Третий опыт провести при температуре на 200 выше комнатной, нагревая растворы таким же образом, как указано выше.
4. Все данные опыта занести в таблицу 1. Сделать вывод о зависимости скорости реакции от температуры.
Таблица 2
|
Номер пробирк и |
Объём раствора H2SO4, мл |
Объём раствора Na2S2O3, мл |
Температура, 0С |
Время, с |
|
1 2 3 |
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дать определение скорости химической реакции.
2. Математическое выражение скорости химической реакции.
3. Перечислить факторы, влияющие на скорость химической реакции.
4. Зависимость скорости реакции от концентрации реагирующих веществ. Написать математическое выражение закона действия масс.
5. Зависимость скорости реакции от температуры. Записать математическое выражение правила Вант-Гоффа.
6. Вещества называемые катализаторами.
Практическая работа №12.
«Исследование дисперсных систем».
Цель работы: получить дисперсные системы и исследовать их свойства, отрабоать навык работы с химически реактивами с соблюдением техники безопасности.
Оборудование: химический стакан на 200 мл, штатив с пробирками, пробки к пробиркам, мерный цилиндр, спиртовка, пробиркодержатель
Реактивы: дистиллированная вода, раствор желатины 0,5% , карбонат кальция в порошке, раствор тиосульфата натрия, раствор серной кислоты, раствор соляной кислоты, раствор, силиката натрия, раствор хлорида железа трехвалентного, раствор перманганата натрия, раствор хлорида натрия.
Ход работы:
Опыт №1: «Приготовление суспензии карбоната кальция в воде»
Налить в две пробирки по 5 мл дистиллированной воды, в первую пробирку добавить 0,5% раствор желатина, затем в обе пробирки внести небольшое количество мела и сильно взболтать, поставить обе пробирки в штатив и наблюдать за расслаиванием суспензии.
Опыт №2: «Получение коллоидного раствора серы»
В пробирку добавить раствор тиосульфата натрия и серной кислоты, образуется свободная сера в мелкодисперсном состоянии. Поскольку сера нерастворима в воде, получается желтовато-синеватый опалесцирующий коллоидный раствор:
Na2S2O3 + H2SO4 = S↓ + SO2 + H2O + Na2SO4
Опыт №3: « Получение геля кремниевой кислоты»
В пробирку прилить раствор силиката натрия, добавить раствор соляной кислоты, полученная кремниевая кислота немного мутнеет, далее застывает, при опрокидывание не стекает.
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
Опыт №4: «Получение золя гидроксида железа трехвалентного реакцией гидролиза».
В пробирку налить 2 мл 2% раствора хлорида железа трехвалентного и 10 мл дистиллированной воды, раствор перемешать и нагреть на спиртовке до кипения, при этом получится красно-бурый прозрачный золь гидроксида железа трехвалентного.
FeCl3+3H2O=Fe(OH)3+3HCl
Опыт №5: «Получение золя диоксида марганца реакцией восстановления»
Прилить раствор перманганата калия 5 мл и 1-2 капли тиосульфата натрия, раствор перемешать, образуется золь вишнево-красного цвета.
8KMnO4+3Na2S2O3+H2O=8MnO2+3Na2SO4+3K2SO4+2KOH
Опыт №6: «Получение эмульсии хлорида натрия в растительном масле» В пробирку приливают 2 мл растительного масла и 2 мл раствора хлорида натрия, взбалтывают, после образуется эмульсия. Верхний слой представляет собой опалесцирующий коллоидный раствор. Вывод по работе оформить по таблице:
|
№ опыта |
Что делали? |
Что наблюдали? |
Уравнение реакции |
Вывод |
|
1. |
|
|
|
|
|
2. |
|
|
|
|
|
3. |
|
|
|
|
|
4. |
|
|
|
|
|
5. |
|
|
|
|
|
6. |
|
|
|
|
Практическая работа №13.
Денатурация белков при нагревании, цветные реакции белков.
Норма времени: 2 часа
Цель: научиться распознавать белки по качественным реакциям.
Оборудование: раствор белка, конц. НNОз, NH40H, лакмусовая бумага, 10% раствор CuS04, 30% раствор NaOH, 5% раствор уксуснокислого свинца, пробирки, штативы, спиртовки, спички, держатели.
Вопросы для допуска к работе
1. Какие вещества называются белками? Из чего они состоят?
2. Что такое пептидная связь?
3. Какие функциональные группы могут содержать белки? Как их можно обнаружить с помощью химических реакций?
Задание: Изучите денатурацию и цветные (качественные) реакции белков.
Опыт 1. Денатурация белков.
В три пробирки поместить по 1 мл белка. В одну пробирку добавить 2-3 капли кислоты, в другую 5 капель NaOH, а третью пробирку нагрейте. Что наблюдаете? Сделайте вывод.
Опыт 2. Ксантопротеиновая реакция.
К 2-3 мл раствора белка прилейте 0,5 мл конц. азотной кислоты и осторожно нагрейте 3-5 мин. Наблюдайте появление желтого осадка, дайте содержимому пробирки остыть, слейте жидкость с осадка, прибавьте к нему NН40H до щелочной реакции /на лакмус/. Как изменилась окраска? Какие группировки белка обнаруживают этой реакцией?
Опыт 3. Биуретовая реакция.
К 1-2 мл белка прилейте равный объем 10% раствора NaOH и хорошо взболтайте. Добавьте 2-3 капли 5% раствора CuS04 и нагревайте до появления фиолетовой окраски. Какие группировки белка обнаруживают этой реакцией?
Опыт 4. Реакция на серу.
К 2-3 мл раствора белка прилейте 1-2 мл раствора 30% раствора NaOH и 0,5 мл 5% раствора уксуснокислого свинца. Как изменилась окраска раствора? Почему?
Контрольные вопросы
1.Почему белки амфотерны? Как они диссоциируют в водных растворах?
2.На какие продукты гидролизуются белки?
3.Как классифицируют белки? Где они применяются?
4.Каковы структуры молекул белка?
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.