Бұл материалда оқушылар Галогендер топшасымен танысады. Галогендер топшасына жататын хлор, бром, фтор, йод, астат элементтерінің хмимялық және физикалық қасиеттерімен танысады. Әр элементтің табиғаттағы және адам өміріндегі алатын орны жайлы білімдерін жетілдіреді. Химиялық қасиеттеріне байланысты химиялық реакция теңдеулерін жазып үйренеді және реакция өнімдерін теңестіреді.Презентация по химии на тему "Галогены" 8-класс
Галогендер
1. Галогендердің ашылу тарихы
2. Периодтық жүйеде орналасуы
3. Химиялық қасиеттері
4. Қолданылуы
5. Білімін тексеру
6. Үйге тапсырма. Қорытындылау
История открытия
галогенов
Фтор
Хлор
Бром
Йод
Астат
Фтордың ашылу тарихы
•
Фтордың грекше аты «фторос»
бүлдіру деген мағынаны білдіреді, ол
өте агрессивті газ. Фторды бос
күйінде алуға тырысқан көптеген
ғалымдар оның осы қасиетінен зардап
шекті. Фторды 1886 ж. Г. Муассон
ашты, алғаш рет оны бос күйінде алды.
Фтор бос күйінде белінуі үшін мына
үдеріс жүру керек:
• Ғ е >Ғ0
• ал осыны жүзеге асыру тек электр
тоғының әсерімен (электролиз) ғана
жүреді.
Анри
Муассан
(1852 –
1907)
Хлордың ашылу тарихы
Карл
Вильгельм
Шееле
(1742 – 1786)
Зертханада
тұз
концентірлі
қышкылына
марганец
диоксидін (МnО2) қосып,
арқылы
тотықтыру
алады.
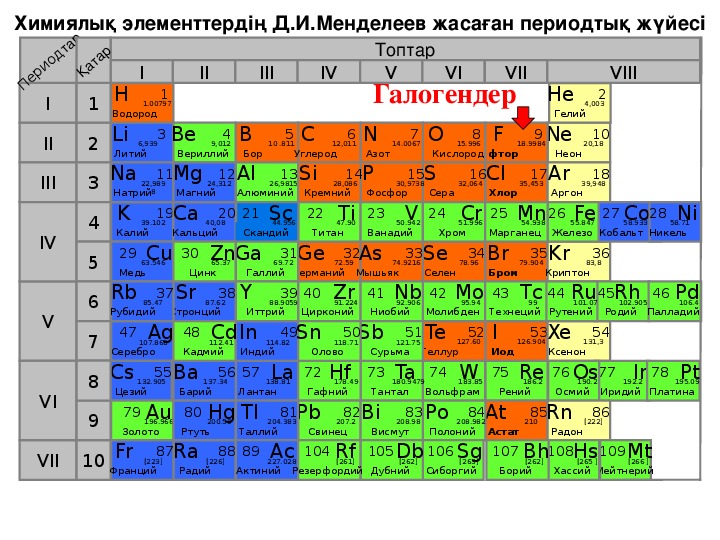
Химиялық элементтердің Д.И.Менделеев жасаған периодтық жүйесі
Периодтар
Қатар
1
2
3
4
5
6
7
8
9
10
24,312
39.102
22,989
II
Литий
Магний
Натрий
8
49,012
Вериллий
12
I
11.00797
Водород
Be
36,939
Mg
11
Ca
2040,08
Кальций
Zn
30 65.37
Цинк
Sr
38
Cd
48
Кадмий
Ba
56
137.34
Барий
Hg
80 200.59
Ртуть
Ra
88
H
Li
Na
K
19
Калий
Cu
29 63.546
Медь
Rb
37
85.47
Рубидий
Ag
47
Серебро
Cs
55
132.905
Цезий
Au
79 196.966
Золото
Fr
87
87.62
Стронций
107.868
112.41
[226]
[223]
Франций
Радий
I
II
III
IV
V
VI
VII
Бор
Азот
Сера
III
Неон
IV
VI
Гелий
Углерод
VIII
Топтар
V
VII
He
Галогендер
24,003
N
C
F
O
Ne
В
612,011
918.9984
714.0067
815.996
1020,18
510 .811
фтор
Кислород
Si
Cl
P
S
Ar
Al
1530,9738
1428,086
1632,064
1839,948
13
1735,453
26,9815
Хлор
Кремний
Фосфор
Аргон
Алюминий
27 58.933 Ni
Ti
V
24 51.996 Mn
Cr
Fe
Sс
22 47.90
23 50.942
25 54.938
26 55.847
21 44.956
28 58.71
Кобальт
Марганец
Ванадий
Титан
Железо
Скандий
Никель
Br
Se
As
Kr
Ga
Ge
3683,8
3478.96
3374.9216
3579.904
3169.72
3272.59
Бром
Селен
Криптон
Германий
Nb
Zr
Tс
Mo
Ru
Y
39
41
40
42
43
45
44
95.94
99
101.07
91.224
Иттрий
Ниобий
Цирконий
Технеций
Молибден
Рутений
Родий
In
Sn
Te
I
Xe
Sb
50
49
51
52127.60
53126.904
54131,3
118.71
114.82
121.75
Иод
Олово
Сурьма
Теллур
Ксенон
Индий
La
Hf
Ta
W
Re
Ir
Os
72
73
74
75
76
77
57
192.2
183.85
Лантан
Гафний
Тантал
Вольфрам
Рений
Осмий
Иридий
82207.2 Bi
Pb
85210 Rn
At
Po
Tl
81204.383
83208.98
84208.982
86[222]
Астат
Висмут
Радон
Полоний
Таллий
Свинец
Rf
Db
Sg
Bh
Ac
Hs
106 [263]
107 [262]
89 227.028
108 [265 ]
104 [261]
105 [262]
Сиборгий
Борий
Актиний
Хассий
Дубний
Резерфордий
Mt
109 [266 ]
Мейтнерий
46
106.4
Палладий
Pt
78
195.09
Платина
Rh
Co
Pd
Мышьяк
Галлий
178.49
180.9479
186.2
190.2
Хром
88.9059
92.906
102.905
138.81
Химиялық элементтердің Д.И.Менделеев жасаған периодтық жүйесі
I
II
III
IV
Период
I
II
III
IV
V
VI
VII
Қатар
1
2
3
4
5
6
7
8
9
10
Топтар
V
Фтор/Fluorum (F)
VII
VI
VIII
Ашықсары түсті
газ. Өте улы.
1s2 2s2 2p5
Сыртқы түрі
Электрондық
конфигуранцияс
ы
Тотығу дәрежесі
Тығыздығы
Балқу
температурасы
Кайнау
температурасы
0, −1
(−189 °C)
1,108 г/см ³
53,53 К
85,01 К
Химиялық элементтердің Д.И.Менделеев жасаған периодтық жүйесі
Периоды
I
II
III
IV
V
VI
VII
I
II
III
IV
Қатар
1
2
3
4
5
6
7
8
9
10
Т О П Т А Р
VI
V
VIII
Хлор / Chlorum (Cl)
VII
Сыртқы түрі
Сары жасыл
түсті өткір иісті,
үлы газ
1s2 2s2 2p6
3s2 3p5
Электрондық
конфигуранцияс
ы
Тотығу дәрежесі +7, +6, +5, +4, +3,
Тығыздығы
Балқу
температурасы
Қайнау
температурасы
+1, 0, −1
(−33.6 °C)
1,56 г/см ³
172.2 К
238.6 К
Химиялық элементтердің Д.И.Менделеев жасаған периодтық жүйесі
Т О П Т А Р
VI
V
VIII
Бром / Bromum (Br)
VII
Сыртқы түрі
Өткір жағымсыз
иісті қою қоңыр
сұйықтық
[Ar] 3d10 4s2 4p5
Электрондық
конфигурациясы
Тотығу дәрежесі +7,+5, +3, +1,0, 1
Тығыздығы
Балқу
температурасы
Қайнау
температурасы
3,12 г/см³
265,9 К
331,9 К
Периодтар
I
II
III
IV
Қатар
1
2
3
4
5
6
7
8
9
10
I
II
III
IV
V
VI
VII
Химиялық элементтердің Д.И.Менделеев жасаған периодтық жүйесі
V
Т О П Т А Р
VI
оо
И д / Iodum (I)
Сыртқы түрі
VII
VIII
Күлгін қара,
металдық
жарқылы бар
[Kr] 4d10 5s2 5p5
Электрондық
конфигуранцияс
ы
Тотығу дәрежесі 7, 5, 3, 1, 1
Тығыздығы
Балқу
температурасы
Қайнау
температурасы
4,93г/см³
386,7 К
457,5 К
Периодтар
I
II
III
IV
Қатар
1
2
3
4
5
6
7
8
9
10
I
II
III
IV
V
VI
VII
Химиялық элементтердің Д.И.Менделеев жасаған периодтық жүйесі
I
II
III
IV
Қатар
1
2
3
4
5
6
7
8
9
10
Т О П Т А Р
VI
ао
VIII
V
Аст т / Astatium (At)
VII
Сыртқы түрі
Қара көк
кристалдар
Электрондық
конфигуранцияс
ы
Тотығу дәрежесі 7, 5, 3, 1, −1
[Xe] 4f14 5d10 6s2 6
p5
Балқу
температурасы
Қайнау
температурасы
517 К
582 К
Периодтар
I
II
III
IV
V
VI
VII
Химиялық қасиеттері
45
F2 Фтор бос күйінде өте белсенді бейметалл,
инертті газдардың ішінде гелий, неон, аргоннан
басқа заттардың барлығымен әрекеттеседі
H2 + F2 →
→
→ Xe + F2 →
Жай заттармен:
Na + F2
Mo + F2
Күрделі заттармен:
H2O + F2 →
KCl + F2 →
KBr + F2 →
KI + F2 →
ТЕКСЕРУ
Химиялық қасиеттері
F2 Фтор бос күйінде өте белсенді бейметалл,
инертті газдардың ішінде гелий, неон, аргоннан
басқа заттардың барлығымен әрекеттеседі
→
H2 + F2
Жай заттармен:
→
2NaF
2Na + F2
2HF
→ MoF6 Xe + 2F2 → XeF4
Mo + 3F2
Күрделі заттармен:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
→ Br2 + 2КF
2KBr + F2
2KI + F2 → I2 + 2КF
Химиялық қасиеттері
Cl2 реакцияға түсу қабілеті жоғары, күшті тотықтырғыш
Жай заттармен:
→ H2 + Cl2 →
Fe + Cl2
→
P + Cl2 →
Cu + Cl2
Күрделі заттармен:
H2O + Cl2 →
NaOH + Cl2 →
KBr + Cl2 →
KI + Cl2 →
Темірдің хлорда жануы
ТЕКСЕРУ
2FeCl
3 H2 + Cl2
2HCl
Химиялық қасиеттері
Cl2 реакцияға түсу қабілеті жоғары, күшті тотықтырғыш
Жай заттармен:
2Fe + 3Cl2
Cu + Cl2
Күрделі заттармен:
H2O + Cl2 → HCl + HClO (хлорлылау қышқылы)
2NaOH + Cl2 → NaOCl + NaCl + H2O (натрий гипохлориді)
→ Br2 + 2КCl
2KBr + Cl2
2KI + Cl2 → I2 + 2КCl
→
→ Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº )
(tº, hυ)
→
Химиялық қасиеттері
→ H2 + Br2 →
→ P + Br2 →
Жай заттармен:
Al + Br2
Cu + Br2
Күрделі заттармен:
Br2 + H2O →
KI + Br2 →
ТЕКСЕРУ
Химиялық қасиеттері
Br3 H2 + Br2
Жай заттармен:
→
2Al + 3Br2
2Al
→ Cu Br2 2P + 5Br2 → 2PBr5
Cu + Br2
Күрделі заттармен:
Br2 + H2O
2KI + Br2 → I2 + 2КCl
HBr + HBrO
бром суы
→
2HCl
→
→ H2 + I2
→
→ P + Br2 →
Химиялық қасиеттері
I2 химиялық белсенді элемент
Жай заттармен:
Hg + I2
Al + I2
Күрделі заттармен:
I2 + H2O →
I2 + крахмал ерісі →
Крахмалға иодтың әсері
ТЕКСЕРУ
Химиялық қасиеттері
I2 Химиялық белсенді элемент
Жай заттармен :
С металлами С неметаллами
Hg + I2
(tº)
2Al + 3I2
Күрделі заттармен:
I2 + H2O
HI + HIO
→
I2 + крахмал ерісі
→ HgI2 H2 + I2
→
қара көк түсті
→
2HCl
3 2P + 3Br2 → 2PI3
2AlI
→
F
Сүйек, тісте
Сl
Қанда
Биологиялық
маңызы
Br
Нерв жүйесін
реттейді
I
Зат алмасуды
реттейді
Ауыз суды
тазалауда
Органикалық
еріткіштер
Дәрі
дәрмектер
ХЛОР
Матаны
ағартуда
Органикалық
заттарды
хлорлауда
HCl
Өндіруде
Хлоридтерді
алуда
Бром, йодты
алуда
Дәрі дәрмектер
Киімді
залалсыздан
дыруда
Йодтың
қолданылуы
Бояғыштар
Фотография
Электро
лампалар
Галогендердің химиялық қасиеттері
Коэффициенттерді қойыңдар:
3
5
2
Na + Cl2 = NaCl
2
2
S + F2 = SF6
2
Fe + Br2= FeBr3
2
P + Cl2 = PCl5
2
NaI + Cl2 = NaCl + I2
2
F2 + H2O = HF + O2
2
NaBr + Cl2 = NaCl + Br2
6
KOH + Cl2 = KCl + KClO3 + H2O
2
2
2
4
2
3
3
3
5
Галогендердің химиялық
қасиеттері
Сәйкестікті орында:
2H2 O + 2F2 =
Xe + 2F2 =
H2 + F2 =
2Au + 3Cl2 =
2NaCl + 2H2 O
=
2NaI + Cl2 =
2NaOH + H2 +Cl2
2NaCl + I2
2AuCl3
XeF4
4 HF + O2
2HF
Үйге тапсырма:
§8.19. Галогендер тақырыбын
қайталау.
710 есептерді жазбаша
орындау (278 бет)
