
Кислород. Физические свойства. Получение
Химический элемент
O
1)
Заполните пропуски в предложениях.
|
Химический
знак элемента – … |
|
Ar (O) = …
Валентность = …
Нахождение в природе
Кислород
— самый распространённый элемент на нашей планете.
На его долю приходится почти половина массы литосферы — твёрдой оболочки Земли.
В составе воды кислород и водород образуют водную оболочку Земли — гидросферу.
В воздушной оболочке Земли — атмосфере на долю кислорода приходится 21 % её
объёма.
Элемент кислород входит в состав
почти всех окружающих нас веществ. Так, например, вода, песок, многие горные
породы и минералы, составляющие земную кору, содержат кислород. Кислород
является также важной частью многих органических соединений, например белков,
жиров и углеводов, имеющих исключительно большое значение для живых организмов.
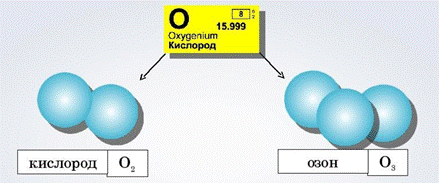
Простые
вещества O2 и O3
Вы уже знаете, что для кислорода характерна аллотропия, т. е. образование двух
простых веществ, различающихся числом атомов в молекуле:
кислорода О2 и озона О3.
С биологической
ролью озона вы уже познакомились на прошлом уроке
(видео «О чем речь – элемент или вещество»). Поэтому лишь отметим, что озон —
эффективное средство для обеззараживания питьевой воды.
Более подробно познакомимся с простым веществом кислородом O2.
2) Изучите видео «Кислород.
Физические свойства. Получение».
Выпишите физические свойства кислорода и способы его получения, поставив видео
на паузу.
Физические
свойства кислорода O2
1)
при обычных условиях: …;
2) при температуре ниже -1830 С: …;
3) при температуре ниже -2190 С: …;
4) по отношению к воде … .
Получение кислорода O2
|
а) в лаборатории |
|
KMnO4 t= ? + ? + ?
H2O2 MnO2= ? + ?
KClO3 MnO2 t=
HgO t=
|
Как собрать кислород?
Как распознать кислород?
|
|
б) в промышленности – фракционная перегонка воздуха. |
3) Изучите материал §13 на
с.66 учебника о получении кислорода в природе. Запишите уравнение и название
процесса.
|
в) в природе |
СO2 + H2O
= ? + ?
процесс …
Применение кислорода O2
Кислород используют в металлургии, химической
промышленности, для газовой сварки и резки металлов, в качестве окислителя
ракетного топлива космических кораблей. Он необходим для жизнеобеспечения на
подводных лодках, орбитальных станциях и в авиационной технике.
В медицине кислород применяют для обеспечения дыхания больного, лечения ожогов. Некоторые области применения кислорода представлены на рисунке 48.
4) Изучите рисунок 48 и составьте
рассказ (устно) о применении кислорода.

![]() Вопросы и
задания
Вопросы и
задания
I. Тест
1. Самый распространённый химический элемент в земной коре – это
1) водород
2) кислород
3) железо
4) кремний
2. В предложении «Кислород входит в состав воздуха» речь идёт о кислороде
1) как о химическом элементе
2) как о простом веществе
3. Укажите правую часть уравнения химической реакции разложения пероксида
водорода Н2О2
1) 2Н2 + 2O2
2) 2Н2O + O2
3)
2Н2O + H2
4) Н2O + O2
4. Для получения кислорода в лаборатории не используют вещество
1) KMnO4
2) КС1O3
3) Н2O2
4) СаО
II. Повторите
материал 16 файла и решите задачу.
Найдите относительные плотности кислорода и озона по воздуху.
III. Задания со
свободным ответом (устно)
1.
Назовите аллотропные модификации кислорода и сравните их свойства.
2. Какое значение в природе имеет озон и где он применяется?
3.
Выучите наизусть уравнения реакций получения кислорода в лаборатории.
Каким образом можно: а) собрать кислород в сосуд; б) доказать наличие кислорода
в сосуде?
4. Как кислород получают в промышленности?
5. Назовите области применения кислорода.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.