
Министерство образования и науки Пермского края
ГБПОУ «Кизеловский политехнический техникум»
Рабочая тетрадь
по учебной дисциплине Химия
Раздел «Общая и неорганическая химия»
Рабочая тетрадь представляет собой сборник заданий для самостоятельной работы студента по основным разделам общей и неорганической химии. Выполнение заданий поможет лучшему усвоению знаний и успешному освоению курса химии. Задания можно выполнять при изучении нового материала и при повторении тем, а также при подготовке к экзаменам.
В рабочей тетради подобраны задания, при выполнении которых необходимо вписать ключевые моменты изучаемого теоретического материала, подобрать ключевое слово, написать уравнение реакции, решить задачу. Рабочая тетрадь предназначена для обучающихся среднего профессионального образования.
|
1 |
Основные химические понятия и законы химии |
4 |
|
2 |
Периодический закон и периодическая система Д.И. Менделеева |
5 |
|
3 |
Строение атома. Распределение электронов по энергетическим уровням. Значение Периодического закона |
6 |
|
4 |
Химическая связь. Строение вещества |
7 |
|
5 |
Дисперсные системы |
9 |
|
6 |
Теория электролитической диссоциации Аррениуса. Реакции ионного обмена. |
11 |
|
7 |
Гидролиз солей |
12 |
|
8 |
Закономерности протекания химических реакций |
13 |
|
9 |
Классификация химических реакций |
14 |
|
10 |
Окислительно-восстановительные реакции. |
15 |
|
11 |
Классы неорганических соединений |
16 |
|
12 |
Химические свойства кислот, оснований, солей в свете теории электролитической диссоциации. |
17 |
|
13 |
Электролиз. Ряд стандартных потенциалов. |
19 |
|
14 |
Металлы, физические и химические свойства металлов, их применение. |
20 |
|
15 |
Неметаллы |
21 |
1. Установите соответствие:
|
Химические явления |
Признаки химических явлений |
|
А. Гниение листьев Б. Горение магния В. Почернение серебра Г Помутнение известковой воды |
1) Яркое свечение 2) Изменение цвета 3) Выделение газа(запаха), выделение тепла 4) Выпадение осадка |
Приведите два примера химических явлений, встречающихся в быту. Укажите признаки химических реакций.
_____________________________________________________________
_____________________________________________________________
2. Заполните таблицу по приведенному списку: кирпич, поваренная соль, мел, железная кнопка, вода, сахар, свеча, колба, уксусная кислота, гвоздь, тетрадь, крахмал, карандаш, серная кислота, углекислый газ, книга, стеклянная воронка, спирт.
|
Вещество |
Тело |
|
|
|
|
|
|
|
|
|
|
|
|
3.Впишите в предложение вместо точек слова атом или молекула:
В состав … сахара С12H22O11 входят … углерода, кислорода и водорода.
4.Запишите химический знак элемента:
це, феррум, аргентум, аш, цинк, хлор, кальций
5.Вычислите относительную молекулярную массу:
K3PO4, Вa(NO3)2, CH3COOH
6. Решите задачи
1. Сколько молекул содержится в 11 г углекислого газа СО2?
2. Какое количество вещества составляет 342г гидроксида бария Ва(ОН)2 ?
3. Какой объем занимают 14 г азота при н.у.?
4. Какое количество вещества алюминия содержится в образце этого металла массой 10,8г?
5. Рассчитайте массу 1,5моль карбоната кальция СаСО3.
6. Какой объем займут 640г кислорода при н.у. ?
7. Юный радиотехник при травлении омедненной платы опустил ее в раствор хлорида железа (III).Какая масса меди перейдет в раствор, если в результате реакции, идущей согласно уравнению 2FeCl3 + Сu = 2FeCl2 + СuСl2, выделилось 1,35г хлорида меди(II).
8. Какова масса нитрата меди, образующегося при взаимодействии оксида меди(II) массой 4г с азотной кислотой?
9. Какое количество вещества (n) воды можно получить, если сжечь 3 моль газа водорода.
10. Какой объем кислорода (н.у.) потребуется для сжигания 2,4г магния?
11. Сколько литров водорода (н.у.)можно получить при действии избытка разбавленной серной кислоты на цинк массой 24г?
12. Сколько граммов гидроксида калия потребуется для взаимодействия с 70г серной кислоты?
13. Сколько граммов водорода можно получить при взаимодействии алюминия массой 54г с соляной кислотой?
Тема 2.
Периодический закон и периодическая система Д.И. Менделеева
1.Дайте формулировку периодического закона
2.Вставьте пропущенные слова в текст:
А) Периодический закон был сформулирован …….. в …… году.
Б) Свойства элементов и их соединений изменяются периодически, потому что периодически повторяются строение ……. .
В) Периодическая система содержит 7 ……. и 8 ……. .
4. Как, исходя из строения атома, объяснить, что при переходе от углерода к свинцу неметаллические свойства ослабевают и возрастают металлические
5. Как изменяются:
а) радиус атома у галогенов в группе сверху вниз
б) электроотрицательность?
6. Металлические свойства элементов 3-го периода от Na к Cl
а) усиливаются в) не изменяются б) ослабевают
Ответ поясните.
7. В состав оксидов ЭO2 могут входить атомы элементов
а ) азот б)углерод в)магний г)сера
8. Решить кроссворд.

1. Индикатор.
2. Растворимое в воде основание.
3. Элемент III группы, 5 периода.
4. Основная отрасль использования кислорода.
5. Драгоценный металл.
6. Гидроксид, соответствующий оксидам неметаллов.
7. Отрицательно заряженная частица, входящая в состав атома.
8. Элемент VI группы, 4 периода.
9. Месяц, в котором был открыт периодический закон.
Тема 3.
Строение атома. Распределение электронов по энергетическим уровням.
Значение Периодического закона и периодической системы Д.И. Менделеева для развития науки.
1.Вставьте пропущенные слова в текст:
2.Под изображением атомных орбиталей впиши их символы
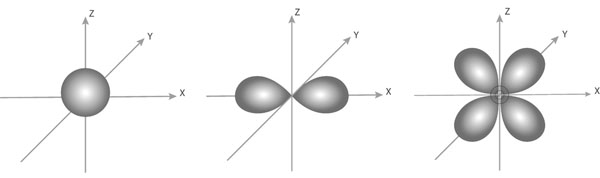
_________________________________________________________________
3. Приведите в соответствие:
Электронная формула Элемент
…1s22s22р63s2 Cl
…3s23р63d104 s2 Мg
…3s23р6 Zn
…3s23р63d104 s24p2 Вr
…3s23р63d104 s24p5 Аr
Gе
4. Определить число протонов и нейтронов в ядрах атомов железа, кальция, кислорода, серы
___________________________________________________________________________
5. Дать понятие изотопов. Привести примеры.
6. Дать общую характеристику элемента с порядковым номером 33. Указать его основные химические свойства.
_____________________________________________________________________________
7. В чём значение Периодического закона и Периодической системы химических элементов Д.И. Менделеева?
1. Допиши определение
Связь, образующаяся между катионами и анионами за счет их электростатического притяжения называется________________ .
2.Запиши номера свойств, характерных для соединений с ионной связью
1) хрупкость
2) легкоплавкость
3) твердость
4) пластичность
5) электролитическая диссоциация растворов
6) летучесть
_____________________________________
3.Закончи предложение.
Ионные кристаллы образуются за счет______________ взаимодействия противоположно заряженных __________________ .
4. Подчеркни прямой чертой формулы веществ с иными кристаллическими решетками
KCl, AlCl3 , BaO , Fe2O3, Fe2 (SO4)3, H2 SO4, C2H5 ONa , C6H5 ONa , SiO2, NH3
5. Под соответствующим изображением кристаллической решетки приведи формулу соединения (NaCl или СsCl)
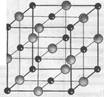 __________
__________
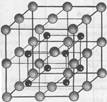 ___________
___________
Допиши определение.
Связь возникающая между атомами за счет образования общих электронных пар называется_________ .
6. Вставь в текст пропущенные слова
Для веществ с ковалентной связью характерны два типа кристаллических решеток - __________________ и _________________ .
7. Допиши схему
Ковалентная связь
![]()
![]()
______ _____
8.Допиши определение
Способность атомов химических элементов оттягивать к себе общие электронные пары называется_______________ .
9.Установи соответствие между элементом и его характеристикой.
МОЛЕКУЛА ХАРАКТЕРИСТИКА
А) Н2 1) неполярная молекула
Б) NH3 2) полярная молекула
В) Н2 О
Г) СО2
Д) ССl4
10. Допиши определение.
Связь в металлах и сплавах, которая осуществляется совокупностью валентных электронов между атом- ионами металлов называется_________ .
11. Подчеркни материал из которого изготовлен «Медный всадник»
1) медь 2) бронза 3) чугун 4) сталь
12. Подчеркни свойства, характерные для соединений с металлической кристаллической решеткой
1) пластичность
2) хрупкость
3) электропроводность
4) летучесть
5) ковкость
6) блеск
13. Допиши определение.
Химическую связь между атомами водорода одной молекулы и атомами наиболее электроотрицательных элементов (фтор, кислород, азот) другой молекулы называют________________ .
14. Допиши схему Водородная связь
![]()
![]()
_________________ _____________________
15. Допиши предложение.
Плотность воды при переходе из жидкого состояния в твердое ___________.
16. Какой тип связи в молекуле PF3 (выбрать правильный ответ):
а)полярная ковалентная
б)неполярная ковалентная
в)ионная
17. Определить тип связи в молекулах: KCI, Cl2, HCl, AgCl, Cu, Na2O2, Fe, H2O
18.Определите тип кристаллической решетки вещества и внесите ее в соответствующую колонку таблицы:
КF, С6Н12О6, I2, СО2, Сu, МgВr2, Н2S, Сl2, С (алмаз), Н2О, Аl, NаСl, Fе.
|
Тип кристаллической решетки |
Вещества |
|
|
|
|
|
|
|
|
|
|
|
|
Тема 5
Дисперсные системы.
1. Продолжить определение: дисперсными называют ________________системы, в которых_______________________________
___________________________________________________________________________
2. Вещество, которое присутствует в ______________ количестве и распределено в объёме другого, называют________________________________ .
Вещество присутствующие в количестве, в объёме которого распределена____________________ называют ______________________ .
3. Дополните предложения: в дыме дисперсная фаза —- … , дисперсионная среда — … ; в молоке — дисперсная фаза — … , дисперсионная среда — …
4. Изучите таблицу в учебнике стр.
Распределите нижеприведенные вещества по определенным дисперсным системам: ил, нефть, газвода, зубная паста, майонез, почва, поролон, облака, пыль, минералы, цветные стекла, пористый шоколад, плазма крови, губная помада, кисель, порошок.
5. Прочитайте внимательно текст «Коллоидные растворы» и ответьте на вопросы:
1. Приведите примеры коллоидных систем.
2. В чем отличие коллоидных растворов от истинных?
3. Почему коллоидные частицы не соединяются в более крупные?
4. Если к молоку добавить лимонной кислоты, что произойдет? Как называется этот процесс?
5. К какому типу коллоидных систем относится мармелад?
6. Вставьте пропущенные слова в текст:
Если в сосуд с водой поместить кристаллы поваренной соли, то мы можем наблюдать, как количество твердого вещества постепенно …. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства: у нее появляется … вкус , изменяется плотность, температура замерзания и т.д. Полученные жидкости уже нельзя назвать водой, даже если они неотличимы от воды по внешнему виду. Это – …
Задание 5. Что является растворителем и растворенным веществом в данных растворах: 1) воздух 2) 70% уксусная кислота 3) водопроводная вода
Задание 4. Опишите процесс растворения сахара в трех предложениях.
7. Постройте графики растворимости медного купороса и натриевой селитры по следующим данным
|
Температура0С |
Растворимость в г |
|
0 |
73 |
|
10 |
80 |
|
20 |
88 |
|
30 |
97 |
|
40 |
106 |
|
50 |
115 |
|
60 |
125 |
|
Температура 0С |
Растворимость в г |
|
0 |
15 |
|
10 |
17 |
|
20 |
19 |
|
30 |
24 |
|
40 |
29 |
|
50 |
34 |
|
60 |
39 |
8. Какое явление изображено на рисунке
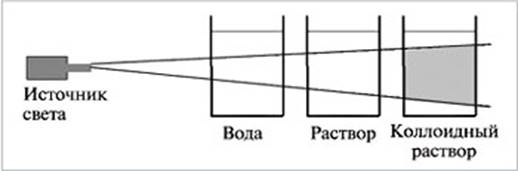
_________________________________________________________________
9. Значение различных дисперсных систем быту:
_____________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________
Тема 6.
Теория электролитической диссоциации Аррениуса.
Реакции ионного обмена.
1. Дать понятие электролитов и неэлектролитов (привести примеры)
Электролиты- это
Неэлектролиты- это
2.Какие из следующих жидкостей проводят электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор гидроксида натрия, раствор кислорода в воде, водный раствор карбоната натрия, расплав гидроксида калия? Ответ объясните.
_____________________________________________________________________________
___________________________________________________________________
3.Составьте уравнения диссоциации следующих электролитов: KOH, Al(NO3)2, K3PO4, NiSO4, HNO3, Ca(OH)2, FeCl3, Na2HPO4, HCOONa.
_____________________________________________________________________________
___________________________________________________________________________
_________________________________________________________________________
__________________________________________________________________________
4.Составьте молекулярные и ионные уравнения реакций между веществами:
а) KOH и MgCl2__________________________________________________
б) NaOH и H2SO3__________________________________________________
в) CH3COONa и H2SO4_____________________________________________________
г)Na2S и HCl_______________________________________________________
д)Na2SO4 Ва(NO3)2_________________________________________________
Тема 7
Гидролиз солей.
1. Заполните таблицу
|
Формула вещества |
Лакмус |
Фенолфталеин |
Универсальная индикаторная |
Реакция |
|
Кислота |
|
|
|
|
|
Основание |
|
|
|
|
|
Вода |
|
|
|
|
2.Тест. Выберите один вариант ответа.
Гидролиз-это…….
а) окислительно-восстановительная реакция.идущая на электродах под действием электрического тока;
б) реакция между ионами соли и ионами воды,приводящая к образованию слабого электролита;
в) реакция,при которой из одного сложного вещества образуется несколько простых;
г)реакция при которой атомы простого вещества замещают атомы сложного.
2. Выберите формулу сильного электролита: уксусная кислота ; гидроксид натрия;,ацетат натрия;кремниевая кислота; угольная кислота; сероводородная кислота; гидроксид магния.
3.Соль образована сильной кислотой и сильным основанием. Определите характер среды: кислая,щелочная; нейтральная.
4. Дана соль- сульфид аммония. Определите тип гидролиза:
а) гидролиз по аниону;
б)гидролиз по катиону;
в) гидролиз по катиону и аниону;
г)гидролизу не подвергается.
5. Гидролиз соли по катиону .Каким основанием и какой кислотой по силе образована эта соль:
а)сильной кислотой и сильным основанием;
б)слабой кислотой и слабым основанием;
в)слабой кислотой и сильным основанием;
г)сильным основанием и слабой кислотой;
6.Сильный электролит-это..
а)вещество,которое при растворении в воде или расплавлении полностью диссоциирует на ионы
б) вещество,которое при растворении в воде или расплавлении неполностью диссоциирует на ионы
в)вещество, которое не диссоциирует на ионы.
7.Водородный показатель равен 7. Какова окраска лакмуса?
а)синяя
б)красная,
в)фиолетовая
______________________________________________________________________________________________________________________________________________________________________________________________________
Тема 8
Закономерности протекания химических реакций
1. Допиши определение:
Изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени называют ___________________ .
2. Допиши формулу: V = ± ∆С/ ____
3.Допиши схему
Реакции
![]()
![]()
___________________________________________________________
Протекают в однородной среде Протекают между веществами
в неоднородной среде
4.Заполни пропуски
Скорость химической реакции прямо пропорциональна произведению __________________ реагирующих веществ, взятых в степенях, равных их ____________ .
5. Допиши предложение
Зависимость скорости химической реакции от температуры определяется правилом ___________________ .
6. В равновесной системе при синтезе аммиака его концентрация [NH3] = 0,4 моль/л, азота[N2] = 0,2 моль/л, водорода [H2] = 0,2 моль/л. Определи начальные концентрации азота и водорода.
__________________________________________________________________________________
________________________________________________________________________________
__________________________________________________________________________________
7. Допиши определение
Катализ – это __________________________________________________________________________________________________________________________________________________________
8. Допиши определение
Катализаторами называют ____________________________________________________________________________
9. Написать уравнение реакций взаимодействия соляной кислоты с магнием и цинком. Указать в каком случае реакция протекает с большей скоростью. Почему?
Какой из факторов оказал влияние на скорость химической реакции?
_______________________________________________________________________
10.Определить скорость химической реакции А+B=AB, если начальная концентрация вещества А была равна 1 моль/л, а через 4 сек. концентрация этого вещества стала 0,6моль/л.
![]() Дано:
Решение:
Дано:
Решение:
Найти:
Ответ:_________________
Тема 9
Классификация химических реакций.
1.Привести классификацию химических реакций идущих с изменением состава вещества
__________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________
________________________________________________________________________________________
(привести пример)
3. Привести примеры гетерогенных реакций:
________________________________________________________________________________________
____________________________________________________________________________________
4. Привести примеры гомогенных реакций:
__________________________________________________________________________________
____________________________________________________________________________________
5.Дать характеристику реакции синтеза оксида серы (IV) S+O2![]() SO2
по всем возможным признакам классификации химических реакций.
SO2
по всем возможным признакам классификации химических реакций.
______________________________________________________________________________________
___________________________________________________________________________________
6. Написать реакцию разложения оксида ртути (HgO) и нитрата калия (KNO3)
__________________________________________________________________
__________________________________________________________________
7. Написать реакцию взаимодействия уксусной кислоты с гидроксидом натрия. Определить тип реакции
__________________________________________________________________
Тема 10
Окислительно-восстановительные реакции.
1.. Продолжить определение: окислительно – восстановительные реакции – это
__________________________________________________________
(привести пример)
2. Вставь в текст пропущенные слова
Вещества или атомы, которые отдают свои электроны в окислительно-восстановительной реакции, называют ___________ , а принимают чужие электроны –___________.
3..По изменению степени окисления определить в схемах, какие процессы произошли (окисление или восстановление), записать это под стрелкой, а над стрелкой указать число потерянных (с минусом) или число приобретённых (с плюсом) электронов.
Например: Clo ![]() Cl-
Cl-
Восстановление
А )Cl+5 ![]() Cl- _____________________________________________________________
Cl- _____________________________________________________________
б) F2o ![]() F- _____________________________________________________________
F- _____________________________________________________________
в) J- ![]() J2o
__________________________________________________________________
J2o
__________________________________________________________________
г )Cl2o ![]() Cl-
Cl-
4.Определите, какие реакции являются окислительно – восстановительными:
а) CaO + H2O = Ca (OH)2
б )Ca + H2O = Ca (OH)2 + H2
в) H2 + J2 = 2HJ
г) HJ + KOH = KJ + H2O
д) 2KJ + Cl2 = 2KCl + J2
__________________________________________________________________
5. Используя метод электронного баланса (или метод электронно-ионного баланса), составьте уравнения любых 3 реакций.
Определите окислитель и восстановитель.
K2Cr2O7 + HCl —> Cl2 + KCl + … + …
KMnO4 + H2S + H2SO4 —> Mn SO4 + S + …+ …
KMnO4 + … —> Cl2 + MnCl2 + … + …
H2S + HMnO4 —> S + MnO2 + …
KMnO4 + KBr + H2SO4 —> MnSO4 + Br2 + … + …
6.Определите степени окисления указанных атомов:
а) атом серы в ЅО2, Н2ЅО4 , Н2Ѕ, Н2ЅО3;
б) атом галогена в КІ, КСІО3, НСІО, НСІ;
в) атом марганца в КМnО4, К2МnО4, МnО2 ,МnЅО4;
г) атом хрома в К2Сr2О7, К3 [Сr(ОН)6 ], Сr2(ЅО4)3 , МnЅО4;
д) атом азота в НNО3, НNО2, NО, NО2, NН4СІ;
е) атом металла в РbО2, К[АІ(ОН)4], К2[Zn(ОН)4], СuЅО4,FeЅ,Fe(NО3)3
7. Составьте уравнения окислительно – восстановительных реакций с участием галогенов.
а) … + Br2![]() AlBr3
AlBr3
б) Al + J2 ![]() …
…
в) H2 + Br2 ![]() …
…
г) NaJ + Br2 ![]() …
…
д) MgBr2 + Cl2 ![]() …
…
Укажите окислитель и восстановитель.
_____________________________________________________________________________
Тема 11
Классы неорганических соединений.
1.Запишите определения кислот, оснований, оксидов, солей.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
2.Приведенные формулы веществ распределите по классам:
|
Оксиды |
Основания |
Кислоты |
Соли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НNO3, CO2, KOH, P2O5, NaNO3, CaSO4, MgO, FeCl3, Cu(OH)2, SO2, HClO4, BaO, Fe2O3, LiOH, H2SiO3, Ca(OH)2, K3PO4, NaOH, Sr(OH)2.
3.При помощи ПСХЭ составьте формулы оксидов и гидроксидов следующих элементов: алюминия, углерода, серы, мышьяка, цинка, железа (ΙΙ). Укажите их характер.
__________________________________________________________________________________________________________________________________________________________________________________________
4.Для элементов: Nа, Аl, Si, Вr – составьте формулы высших оксидов и гидроксидов. Расположите гидроксиды по усилению кислотных свойств.
________________________________________________________________________________________________________________________________________________
5.Среди перечисленных оксидов укажите основные и кислотные: СаО, SО2, Р2О5, СuО, FеО, SiО2, Мn2О7, ВаО, заполните таблицу:
|
Основные оксиды |
Кислотные оксиды |
|
|
|
|
|
|
6. Среди перечисленных оснований укажите щелочи и нерастворимые основания: NаОН, Сu(ОН)2, Fе(ОН)3, Са(ОН)2, Ва(ОН)2, КОН, А1(ОН)3.
Щелочи:_____________________________________________________
Нерастворимые основания:_____________________________________
7. Выберите из списка, одноосновные, двухосновные и трехосновные кислоты: Н2SО4, Н3РО4, НС1, Н2СО3, НI, НNО3, Н2S, НС1О4, заполните таблицу:
|
Одноосновные кислоты |
Двухосновные кислоты |
Трехосновные кислоты |
|
|
|
|
8. Выпишите из списка только формулы солей и дайте им названия: МgСО3, СаО, Мg(ОН)2, FеSО4, КС1, СuО, НF, Nа2SiО3, А1(ОН)3, Ва3(РО4)2, НРО3, Zn(ОН)2, Zn (NО3)2, Н2SО3, Nа2SО3, К2О, КВr, заполнив таблицу:
|
Формула соли |
Название |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9. Осуществите превращения:
а) FеС12 → Fе(ОН)2 → FеSО4 → Fе → Fе С12
б) Р → Р2О5 → Н3РО4 → Nа3РО4 → Са3(РО4)2
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
10. Напишите уравнения возможных реакций между веществами: оксид калия, оксид фосфора(V), гидроксид бария, серная кислота, иодид калия, нитрат свинца(||).
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
11. Закончите уравнения реакций:
СuSО4 + … = Сu(ОН)2 + ___________________________________
LiОН + Н2SО4 = ________________________________________________
А1(ОН)3 + … = Н2О + _________________________________________
Сr2О3 + НNО3 = ________________________________________________
Н3РО4 + … = Са3(РО4)2 + _____________________________________
Mg(OH)2 + HNO3 = _____________________________________________
Na2SiO3 + … = NaCl + __________________________________________
Fе2О3 + … = FеСl3 + ___________________________________________
Напишите уравнения реакций в ионном виде.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
12. Каждому из веществ укажите соответствующую формулу
1. Марганцовка а) NaCl
2. Питьевая сода б) C2H5OH
3. Нашатырный спирт в) KMnO4
4. Поваренная соль г) NaHCO3
5. Этиловый спирт д) NH4OH
6. Уксусная кислота е) CH3COOH
13. Составьте ряд генетически взаимосвязанных веществ:
1.BaSO4, 2.CaO, 3.H2CO3, 4.BaO, 5.Ba, 6.HCl, 7.Na2O 8.Ba(OH)2
________________________________________________________________________________________
_________________________________________________________________________________________
14. Какое из перечисленных веществ является солью:
а) HNO3 б) KNO3 в) N2O5, г ) H2SO4, Д) H2S Ж) H2SO3
_____
Тема 12
Химические свойства кислот, оснований, солей в свете теории электролитической диссоциации.
1. В молекулярном уравнении реакции
Cr2O3 + О2 + К2СО3 -> К2СгО4 + СО2
сумма коэффициентов равна 1)5 2)17 3)23 4)34
__________________________________________________________________________
2. Решить задачу.
При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
![]() Дано:
Решение:
Дано:
Решение:
Найти:
Ответ:_________________
3. Из раствора сульфата цинка(II) выпадает осадок при добавлении каждого из веществ набора (написать уравнения реакций)
1) НС1, LiOH 2) Ва (ОН)2, ВаС12
3) Са (ОН)2, HNO3 4) Ва (ОН)2, А1(ОН)3
____________________________________________________________________________
____________________________________________________________________________
___________________________________________________________________________
4. В схеме превращений CaCO3à X à CaCl2 веществом «Х» является А) CaO Б) Ca(OH)2 В) CaH2
_______________________________________________________________________
___________________________________________________________________________
![]() Дано: Решение:
Дано: Решение:
Найти:
Ответ:_________________
6. Решить задачу: Во взаимодействие вступило 20г CaO и 20г CO2. Какова масса и состав образовавшейся соли?
Дано: Решение:
Найти:
Ответ:____________
7.Составить молекулярные и ионные уравнения реакций между веществами:
а) HCOOH и Ca (OH)2
б) Fe (OH)3 и HCl
в) Pb (OH)2 и HCl
г) K2CO3 + HCI
__________________________________________________________________
8. Определить возможность протекания реакций обмена между водными растворами веществ:
а) сульфатом калия и гидроксидом бария;
б) карбонатом натрия и хлоридом кальция;
в) нитратом меди(II) и сульфатом железа (II)
г) гидроксидом натрия и серной кислотой;
д) сульфатом калия и азотной кислотой
Составить уравнения возможных реакций в молекулярной, ионной и сокращённой ионных формах.
Тема 13
Электролиз. Ряд стандартных потенциалов.
1. При электролизе водного раствора сульфата меди (II) на катоде выделяется: а) медь, б) вородод, в) кислород, г) оксид серы (IV)
____________________________________________________________________________
2..Установите соответствие между формулой соли и продуктом, который образуется на аноде в результате электролиза её водного раствора:
|
Формула соли |
Продукт на аноде |
||
|
А) |
K3PO4 |
1) |
кислород |
|
Б) |
FeCl3 |
2) |
оксид фосфора (V) |
|
В) |
NiSO4 |
3) |
оксид серы (IV) |
|
Г) |
CrBr2 |
4) |
водород |
|
|
|
5) |
галоген |
____________________________________________________________________________
_________________________________________________________________________
3.. При электролизе водного раствора хлорида меди (II) на катоде выделилось 12,8 г металла. Объем газа, выделившегося на аноде, равен при нормальных условиях _____л. (Запишите число с точностью до сотых).
4.. Составьте уравнение реакций, протекающих на катоде и аноде, и суммарное уравнение электролиза водного раствора сульфата калия.
____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
5.. Составьте уравнение реакций, протекающих на катоде и аноде, и суммарное уравнение электролиза водного раствора хлорида лития.
____________________________________________________________________________
____________________________________________________________________________
6..Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде в результате электролиза её водного раствора:
|
Формула соли |
Процесс, протекающий на катоде |
||
|
А) |
HNO3 |
1) |
2H2 + 2e → H2 |
|
Б) |
KOH |
2) |
2H2O + 2e → H2 + 2OH- |
|
В) |
BaCl2 |
3) |
K+ + 1e → K0 |
|
Г) |
AgNO3 |
4) |
Ba2+ + 2e → Ba0 |
|
|
|
5) |
Ag+ + 1e → Ag0 |
|
|
|
6) |
4OH- - 4e → O2+ 2H2O |
____________________________________________________________________________
________________________________________________________________________
Тема 14
Металлы, физические и химические свойства металлов, их применение.
1. Ответить на вопрос: почему алюминий называют металлом будущего?
2. Составить сообщение на тему: «Получение Al в промышленности»
3. Ответить на вопросы:
1. Каков порядковый номер алюминия?___________________________
2. Алюминий элемент III группы, какой подгруппы?____________________
3. Какому элементу соответствует строение электронной оболочки
2е 8е 3е?_________
4. Чему равна валентность алюминия?__________
5. Чему равно число электронов в атоме алюминия?__________
6. Чему равно число протонов в ядре атома алюминия?________
7. Какой характер имеют оксид и гидроксид алюминия?_______
8. Чему равно число нейтронов в ядре атома алюминия?________
9. Каков характер простого вещества алюминия? (… металл)_____
10. Как называется сплав на основе алюминия?______________
11. Как называется соль алюминиевой кислоты?_____________
12. Каково число электронов на внешнем уровне в атоме алюминия?_______
4. Написать уравнения реакции, с помощью которых в промышленности получают алюминий:
__________________________________________________________________________________________________________________________________________________________
5. Решить задачу: Смесь алюминия и меди массой 5г обработали водным раствором щелочи. При этом образовался газ объемом 2.241 (н.д.) Вычислить массовую долю алюминия в смеси.
![]() Дано: Решение:
Дано: Решение:
Ответ: ______________
6. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения; Al →Al2(SO4)3 → Al(OH)3 → Al(NO3)3.
7.Закончить реакцию взаимодействия металлов с простыми веществами
а) Na+Cl®_________________________________________
б) Na+О2®________________________________________
в) Na+H2®________________________________________
а) NaO2®NaCl®NaOH
â
NaOH®Na2SO4®NaNO3
9. Продолжить уравнения реакций, указать тип каждой:
Nа+Н3PO4![]()
Mg+НBr![]()
K2O+НNO3![]()
Na2O + HCl →
NaOH + HCl →
10. Количество гидроксида калия, способного вступить в реакцию с 4 моль серной кислоты, равно …1) 0,8 моль; 2) 8 моль; 3) 80 моль; 4) 4 моль
11. Напишите уравнения реакций, позволяющих осуществить следующие превращения: NаСl → Nа → NаН → NаОН → NаНSО3.
12. Какой металл в следующем ряду является наиболее активным : Fe, Zn, Mn, K, Au. Ответ поясните.
13. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: Cu → CuCl2 → Cu(NO3)2 → Cu(OH)2→ CuO → Cu
14. Рассчитайте массу нитрата меди, которая может быть получена из 38,4 г меди.
![]() Дано:
Решение:
Дано:
Решение:
Ответ: _______________
15. В лаборатории цинком «заряжают» аппарат Киппа для получения Н2.В реакции используют 20%-ю серную кислоту. Напиши уравнение этой реакции.

_____________________________________________________________________________
16. Ответьте на вопросы
1.Самым распространенным металлом в земной коре является алюминий. Однако каменный век в истории человечества сменился медным, а не алюминиевым. Как объясняется такое противоречие?
_____________________________________________________________________________
2. Родители не разрешают детям сидеть на трубах, ограждающих газоны и детские площадки, объясняя это тем, что дети могут простудиться. Объясните по-научному причину возможной простуды.
____________________________________________________________________________
3.Самой лучшей посудой для варки варенья издавна считаются неглубокие медные тазы. Какими свойствами меди это объясняется?
______________________________________________________________________________
4.Работники жилищно-коммунальных организаций убедительно просят не сжигать мусор в мусорных контейнерах, так как из-за сжигания мусора контейнеры разрушаются. Объясните с точки зрения химии причину разрушения мусорных контейнеров.
____________________________________________________________________________________________________________________________________________________________
5.Хром активнее железа, однако во влажном воздухе железо начинает разрушаться (ржаветь), а хром не изменяется. Почему так происходит?
_____________________________________________________________________________
6.Со временем темнеют даже золотые украшения. Почему это происходит, ведь золото – благородный инертный металл?
_____________________________________________________________________________
7.Владельцам садовых участков для работы часто необходим раствор медного купороса. Для хранения некоторые пытаются взять алюминиевые фляги, другие – оцинкованные ведра. А что посоветуете вы? Подтвердите свой ответ записью возможных химических реакций.
______________________________________________________________________________
______________________________________________________________________________
8.Если поцарапать оцинкованное ведро, то на месте царапины сначала появляется белёсое пятно, а потом в центре его появляется ржавчина. Объясните такую последовательность изменений. Запишите уравнения происходящих реакций.
___________________________________________________________________________________________________________________________________________________________
9. В сетчатке глаза орла содержание селена в 100 раз больше, чем у человека. Суточная потребность организма человека в селене составляет 100 мг.
Вопросы:
1.Запишите химический знак селена.
2.Дайте характеристику селена на основании его положения в ПСХЭ Д. И. Менделеева и строения его атома.
3.Вычислите массу фисташек, которые необходимо съедать ежесуточно для того, чтобы восполнить суточную потребность организма в селене. В 100 г фисташек содержится 0,45 г. селена.
4.Почему орел зоркий?
17. Продолжить определение: коррозия-это
18. Виды коррозии-
19. Способы защиты от коррозии-
20. Рассмотрите коррозию железа в водопроводной и «морской» воде. Где процесс протекает быстрее, и чем вы это объясните?
21. Рассмотрите процесс коррозии при соединении медной трубы с гальванизированной (оцинкованной) стальной трубой, если обе трубы находятся в земле.
22. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
Тема 15
Неметаллы
1. В каких группах и периодах периодической системы химических элементов Д.И.Менделеева сосредоточены элементы-неметаллы?
__________________________________________________________________________________________________________________________________________________________
2. Как изменяются неметаллические свойства элементов в таблице Д.И.Менделеева в периодах слева направо и в главных подгруппах сверху вниз
__________________________________________________________________________________________________________________________________________________________
3. Элементы VIa группы таблицы Д.И.Менделеева называют халькогенами (рождающие соли). Напиши пять формул солей с различными кислотными остатками, содержащих элементы VI a группы. Назови эти соли.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Напиши по две формулы кислотных оксидов, кислот и оснований. Где они встречаются в природе и какие неметаллы их образуют?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Галогены взаимодействуют между собой с образованием межгалоидных соединений: ВrСl, СlF3, ВrF5, IСl5, IF7. Какие степени окисления атомов галогенов в этих соединениях?
__________________________________________________________________________________________________________________________________________________________
6. Напиши формулы соединений неметаллов с металлами:
а) нитрида магния
________________
б) фосфида калия
________________
в) сульфида алюминия
________________
г) хлорида железа(III)
________________
д) силицида кальция
_________________
7. По каким причинам простые вещества кислород, серу, бром и йод нельзя хранить в открытых сосудах? Поясни по каждому веществу в отдельности.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
8. Некоторые неметаллы взаимодействуют с кислотами-окислителями, превращаясь в кислоты или в кислотные оксиды с высшими степенями окисления. Составь уравнения следующих реакций:
а) С + Н2SО4 (конц.) = _________________________________________;
б) С + НNО3 (конц.) = __________________________________________;
в) Р + НNО3 (конц.) = __________________________________________;
г) S + НNО3 (разб.) = __________________________________________.
9. Древесный уголь применяется в противогазах ив процессе очистки сахара благодаря свойству:
а) черный цвет; в) растворимость;
б) способность адсорбировать; г) все перечисленные.
10. Растворимым стеклом называют:
а) водный раствор силикатов натрия и калия;
б) кремниевую кислоту;
в) кремний(IV) оксид;
г) водный раствор натрий карбоната
__________________________________________________________________
11.Минимальная отрицательная степень окисления атома неметалла равна:
а) номеру группы;
б) номеру периода;
в) порядковому номеру;
г) разности номера группы и числа 8.
_________________________________________________________________
12. Кремний (IV) оксид не реагирует с:
а) натрий гидроксидом;
б) калий карбонатом;
в) кальций оксидом;
г) водой.
__________________________________________________________________
13. Углерод(II) оксид и углерод (IV) оксид отличаются между собой:
а) цветом;
б) запахом;
в) качественным составом;
г) способностью восстанавливать металлы из их оксидов.
__________________________________________________________________
14.В схеме превращений Na![]() SiO
SiO![]() → A
→ Б→ Na
→ A
→ Б→ Na![]() SiO
SiO![]() буквой «А» и «Б»
зашифрованы вещества, формулы которых:
буквой «А» и «Б»
зашифрованы вещества, формулы которых:
а) А - SiO![]() , Б - H₂SiO
, Б - H₂SiO![]() ;
;
б) А - K![]() SiO
SiO![]() , Б - K
, Б - K![]() SiO
SiO![]() ;
;
в) А - H₂SiO![]() , Б - SiO
, Б - SiO![]() .
.
2. 2.Габриелян О.С., Остроумов И.Г., Сладкое С.А., Дорофеева Н.М. Практикум учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
3. 3.Габриелян О.С., Лысова Г.Г. Химия. Тесты, задачи и упражнения, учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
4. 4.Ерохин Ю.М. Химия: Задачи и упражнения учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Интернет – источники
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.