
РАЗРАБОТКА УРОКА
Тема занятия: « Углерод и кремний. Свойства соединений»
Цель занятия: Дать характеристику углероду и кремнию по их положению в периодической системе химических элементовД.И. Менделеева. Изучить аллотропные модификации .Определить химические и физические свойства. Познакомиться с понятием адсорбция.
Задачи
1. Обучающие: Выявление и оценка степени овладения системой знания и комплексом навыков и умений об элементах и их соединениях на примере углерода и кремния; готовности учащихся успешно применять полученные знания на практике
2 Воспитательные:
Воспитание навыков самоконтроля и взаимоконтроля;
воспитание интереса к предмету и изучаемой теме;
воспитание культуры общения , умения работать в коллективе, взаимопомощи.
3 Развивающие:
Развитие навыков реализации теоретических навыков в практической деятельности;
Развитие интереса к химии через содержание учебного материала.
Ожидаемые результаты:
1 Учащиеся должны понимать: основное содержание материала по теме : «Углерод и кремний. Свойства соединений» т.е. написание электронного строения кремния и углерода ,распознавать аллотропные модификации и применять их химические и физические свойства в соединениях. Применение и нахождение в природе.
2. Учащиеся должны иметь ценностные установки : познавательного интереса к предмету , самостоятельного анализа, контроля и самоконтроля
3. Учащиеся должны уметь : делать выводы и заключения; формировать вопросы к учебному материалу в связи с осмыслением его на уроке
Межпредметная связь: История, география, физика, математика, литература.
Комплексное учебно-методическое обеспечение:ПО Activstudio, раздаточный материал, реактивы и оборудование к лабораторной работе
Учащиеся, зайдя в класс выбираю цвет квадрата и рассаживаются по группам в соответствии с выбранным цветом . Урок начинается с организационного момента и настроя учащихся на урок.
Проверка домашнего задания:
1 задание: Проверяем знания учеников простыми ответами «да» или «нет»
1. 1s22s22p3 - электронная формула азота. да
2. N, P - элементы главной подгруппы VI группы. нет
3. На последнем энергетическом уровне атома азота находится пять электронов. да
4. Для элементов подгруппы азота характерны высшая степень окисления «+3» и низшая степень «-5». нет
5. Фосфор реагирует в обычных условиях с водородом. нет
6. Соли азотной кислоты называются нитратами. да
7. Азотная кислота реагирует с кислотными оксидами. нет
8. Оксид фосфора (V) - P2O3. нет
9. Водородное соединение с резким специфическим запахом NH3 да
10. Азотистая кислота - слабая одноосновная кислота Да
За каждый правильный ответ ставят себе балл
2 задание: « Заморочки из бочки» Учащиеся по одному из команд выбирают из бочонка листочки с заданием. Они читают, советуются между собой и отвечают. За каждый правильный ответ 1 балл
1. Я непригоден для дыхания!
Но все как будто бы не слышат
И постоянно мною дышат. (Азот)
2. Найди меня. Я газ. Я прост.
Я рыжий, словно лисий хвост.
Я образуюсь из нитрата,
А в воздухе – из газа-брата.
А если встречусь я с водой, то стану сильной кислотой.
(Диоксид азота, бурый газ)
3. В печи однажды проклят
Аммония нитрат.
Теперь я газ. Прощай, нитрат!
Признаться, я не рад…
Но ни людей, ни печь я в этом не виню;
Наоборот, развеселю и даже… опьяню!
(Оксид азота (I) – “веселящий газ”)
4. Белый воздуха боится, покраснел чтоб сохраниться. (Белый и красный фосфор)
5. Стоя рядом с Холмсом, я мельком взглянул не его лицо – бледное, взволнованное, с горящими при лунном свете глазами. И вдруг оно преобразилось: взгляд стал сосредоточен и суров. В ту же секунду Лейстрейд вскрикнул от ужаса и упал ничком на землю. Да! Это было собака, огромная, черная как смоль. Но такой собаки еще никто из нас не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем мозгу не могло бы возникнуть видение более страшное, более омерзительное, чем это адское существа, выскочившее на нас из тумана.
Чудовище, лежавшее перед нами, поистине могло кого угодно напугать своими размерами и мощью. Его огромная пасть все еще светилось голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.
- Фосфор, - сказал я.
-Да, какой-то особый препарат, - подтвердил Холмс.
Вопрос: Возможны ли явления, описанные в повести А. Конан Дойля?
6. « Сегодня Чёрная Зоя сдавала экзамен за октябрь и вдруг как шлёпнется в обморок! Ну, теперь этим никого не удивишь. Сейчас же опрыскали водой, дали понюхать нашатырю, и она встала».
«… Раз сунул голову под вытяжной шкаф, чтобы свой тигель понюхать, забывши, что он выделяет циан ; ужасающей вонью ударило в нос. Ничего, я отправился и побежал к лаборанту; тот дьявольски :- Коли живы, так нюхайте, что ль, нашатырь …»
Вопросы : Какое вещество называется нашатырём? Что дают нюхать человеку, потерявшему сознание ?
Ответы : Нашатырь – это техническое название хлорида аммония NH4Cl .Это бесцветная кристаллическая соль без запаха, применяемая в паяльном деле, для изготовления сухих элементов, в химических производствах. В качестве лекарственного средства при обмороке применяют нашатырный спирт- 10%-ный водный раствор аммиака. Выделяющийся из раствора газообразный аммиак раздражает нервные окончания верхних дыхательных путей и рефлекторно возбуждает центральную нервную систему- пострадавший приходит в сознание. Вдыхать аммиак рекомендуют также при отравлениях некоторыми газообразными ядовитыми веществами.
7. Я светоносный элемент. Я спичку вам зажгу в момент. Сожгут мен и под водой оксид мой станет кислотой. .. (фосфор).
8. Гулять в грозу - какой резон? Подышим воздухом, дружище. В природе словно стало чище, повсюду в воздухе ..(озон).
3 задание : Найти соответствие между реагентами и продуктами химической реакции (если справились полностью 3 бала , если неправильный 1- то 2 балла; если неправильных 2-то 1 балл)
1 вариант
|
6Li+N2 |
2NH3 |
|
NH4CI+NaOH |
4NO2 + O2 |
|
4P+ 3O2 |
2Li3N |
|
N2+3H2 |
4NO2 + 2H2O+ O2 |
|
Ca3(PO4)2 + 4H3PO4 |
2P2O3 |
|
4 HNO3 |
NaCI+ NH3 + H2O |
|
N2O5 |
2NO2 |
|
2NO + O2 |
3Ca(H2PO4)2
|
2 вариант
|
4NH3 + 3O2 |
HNO3 + HNO2 |
|
2AgNO3 |
2P2O5 |
|
P2O5 +3 H2O |
2N2 + 6 H2O |
|
Ca3(PO4)2 + 3H2SO4 |
Mg3P2 |
|
2NO2 + H2O |
Cu(NO3)2 + H2O |
|
3Mg + 2P |
2Ag + 2NO2 + O2 |
|
CuO + 2HNO3 |
H3PO4 |
|
4P+ 5O2 |
3CaSO4 + 2H3PO4 |
Тема урока: «Углерод и кремний. Свойства соединений»
План урока
1. Электронное строение Углерода и Кремния
2. Распространение в природе
3. История элементов
4. Аллотропные модификации элементов
5. Химические свойства
6. Применение
1. Электронное строение Углерода и кремния
Задние 4 Учитывая положение углерода и кремния в Периодической системе, ответьте на вопросы:
1. Каков химический знак углерода и кремния ?
2. Какова атомная масса?
3. Какова валентность у этих элементов?
4. Чему равна низшая степень окисления?
5. Чему равна высшая степень окисления?
6. Напишите электронное строение углерода и кремния
Правильные ответы на вопросы оцениваются по 1 баллу.
В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р- элементы IV группы периодической системы Д.И. Менделеева. Их атомы а внешнем уровне содержат по четыре электрона ns2np2,чем объясняется сходство их химических свойств.
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней.
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода.
2.Распространение в природе
учащимся предлагаю прочитать предложенный в раздаточном материале конспект урока только раздел «распространение элементов в природе »
Задание 5 Выбрать из представленных картинок 1 и 3 команде - нахождение углерода в природных веществах; 2 и 4 команде –нахождение кремния в природных веществах
Массовая доля углерода в земной коре составляет 0,1 %. Он встречается природе в свободном состоянии ( алмаз, графит).В виде простого вещества и соединений углерод входит в состав многих природных веществ: бурого и каменного угля, сланцев, торфа, нефти, горных пород и минералов, например известняка. Углерод содержится в атмосферном воздухе в виде оксида СО2.
Кремний-второй химический элемент после килорода по распространенности на Земле, его массовая доля в земной каре составляет 27,6 %. Наиболее распространенным кремнесодержащим веществом является диоксид кремния (кремнезем).В природе он встречается в виде минерала кварца , горного хрусталя, яшмы, опала ,агата и др. Кремния много содержится в виде силикатов.
3.История элементов
Историю открытия углерода и кремния рассказываю двое учащихся:
Углерод известен с глубокой древности. В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучения горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 А.Лавуазье. В начале XIX в. старое слово уголь в русской химической литературе иногда заменялось словом "углетвор" (Шерер, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод. Латинское название сarboneum углерод получил от сarbo — уголь.
Соединения кремния были известны человеку с незапамятных времен. Но с простым веществом кремнием человек познакомился всего около 200 лет тому назад. Фактически первыми исследователями, получившими кремний, были французы Ж. Л. Гей-Люссак и Л. Ж. Тенар . Они в 1811 обнаружили, что нагревание фторида кремния с металлическим калием приводит к образованию буро-коричневого вещества:SiF4+ 4K = Si + 4KF, однако сами исследователи правильного вывода о получении нового простого вещества не сделали. Честь открытия нового элемента принадлежит шведскому химику Й. Берцелиусу, который для получения кремния нагревал также с металлическим калиемсоединение состава K2SiF6. Он получил тот же аморфный порошок, что и французские химики, и в 1824объявил о новом элементарном веществе, которое назвал «силиций». Кристаллический кремний былполучен только в 1854 году французским химиком А. Э. Сент-Клер Девилем
5. Химические свойства
1. Взаимодействие с кислородом:
С + О2 изб →СO2 . С + О2 недост →СO
Si + О2изб = SiO2, 2Si + O2недост = 2SiO,
2 Взаимодействие с водородом и с серой при нагревании
С + 2Н2 = СН4 (метан). С + 2S = СS2 (cероуглерод).
4Si + S8 = 4SiS2
3) Восстановление металлов из их оксидов:
С + 2СuO = 2Cu + CO2.
При нагревании же с оксидами активных металлов углерод и кремний образуют карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si= Мg2Si + 2SiO.
4) Взаимодействие с металлами:
3С + 4 Al = Al4C3 (карбид алюминия).
5) Оксид углерода (II) горит в кислороде и на воздухе с выделением большого числа теплоты.
2СО + О2 →2СO2
6) Оксид углерода (IV) растворяется в воде
СО2 + Н2О →Н2СO3
6) Диоксид углерода – кислотный оксид, поэтому для него характерны реакции с основными оксидами и основаниями
СО2 + BaО →BaСO3 СО2 + 2KOH →K2СO3 + Н2О
СО2 + KOH →KHСO3
7) Взаимодействие с концентрированными кислотами:
С + 2H2SO4 = 2SO2 ↑ + CO2 ↑ + 2H2O.
8) Получение диокисида углерода в промышленности
Са СО3 = СаО+ CO2
9) Получение диоксида углерода в лаборатории
Na2CO3 + H2SO4→Na2 SO4 + СО2 + Н2О
10) Угольная кислота проявляет свойства кислот
Н2СO3+ 2NaOH→ Na2СO3 + 2Н2О
Н2СO3+ BaCI2→ Ba2СO3 + 2НCI
11) Адсорбция
Уголь проявляет интересное свойство: он способен поглощать из жидкостей или газов некоторые вещества, как бы впитывая их в себя. Адсорбция – это концентрирование различных веществ на поверхности раздела двух систем. Вещество, которое удерживает на своей поверхности частицы, называется адсорбентом. Активный уголь, который получают из древесного угля, применяют для очистки многих продуктов.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3+ Н2↑.
Студентам предлагается составить цепочку превращений .
После составления студенты меняются между собой цепочками превращений и проверяют друг друга
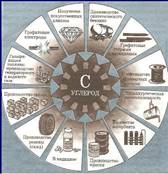
Основные области применения элементов
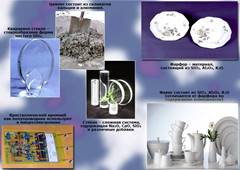
Применение Кремния
В конце урока все баллы подсчитываются и делятся на 7 и учащиеся сами оценивают себя
Домашнее задание: «Химия » 10 класс Н.Н. Нурахметов, К.Б. Бекишов, Н.А. Заграничная, Г.В. Абрамов - Гл. 7 § 7.3-7.6
Рефлексия проводится методом «Светофор». У каждого учащегося имеется набор кругов трёх цветов –красный ,желтый и зелёный. Если на уроке все понятно – зеленый круг, если не все понятно , то желтый , если не понял –красный.
Список использованных источников:
1. «Химия » 10 класс Н.Н. Нурахметов, К.Б. Бекишов, Н.А. Заграничная, Г.В. Абрамов. Мектеп. 2014г.
2. Общая химия И.Г. Хомченко Москва 1987 г. 464 с.
3. Справочник школьника «Химия» 8-11 класс. Н.Б. Алистратова.Астана «Арман-ПВ». 2015г.
4. Химия 8, 9, 11 классы/О.С. Габриэлян. Дрофа 2007.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.