
Подготовка учащихся к ЕГЭ по химии в рамках ФГОС
Решение задач по общей химии.
Моль - количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 12 г. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Примерное определение моль
Моль - единица количества вещества, в котором содержится число Авогадро (NA=6,022140857(74)⋅1023 моль−1) структурных элементов.
Моль является одной из основных единиц измерения СИ.
Формулы для решения задач по химии
n – количество вещества, [моль]
m – масса вещества, [г]
M – молярная масса, [г/моль]
N – число атомов, молекул, ионов и пр., [безразмерная величина]
NA – число Авогадро, NA = 6,02∙1023 [1/моль]
T – температура, [К]
P – давление газа, [атм], [Па], [мм. рт. ст.]
V – объем, [л], [м3]
Vm – молярный объем, при н. у. для газов Vm = 22,4 [л/моль]
С – концентрация вещества, [моль/л]
R – универсальная газовая постоянная, R = 8,31 [Дж/(моль∙К)], если давление в Па, а объем в м3; R = 0,082, если давление в атм, а объем в л.
ρ – плотность вещества, [г/мл]
Dy(x) – относительная плотность газа X по газу Y, [безразмерная величина]
ω – массовая доля, [%] χ – мольная доля, [%] φ – объемная доля, [%]
η – выход продукта реакции, [%]
Q – количество теплоты, [кДж]
Qобр – теплота образования вещества, [кДж/моль]
Qобр – количество теплоты выделяющейся при образовании 1 моль вещества из простых веществ, находящихся в устойчивых состояниях при стандартных условиях.
Qобр=Q/n
1. Количество вещества через массу:
|
n = |
т |
т = n × M |
|
т |
|
|
|
|
|
|
||
|
M |
M = n |
|
|||
|
|
|
|
|||
2. Количество вещества через объем:
|
n = |
V |
V = n ×V |
|
|
|
|
||
|
Vm |
m |
|
|
|
|
|
||
3. Количество вещества через число частиц:
|
n = |
N |
N = n × Na |
|
|
Na |
|
||
|
|
|
|
4. Массовая доля вещества в растворе (смеси, руде и т.д.):
w (вещества ) = тт((веществараствора)) ×100%
![]()
т(вещества )
т( раствора) = ×100%
![]()
т(вещества ) = m( раствора) ×w(вещества )
![]()
100%
Массовая доля элемента в соединении:
w(элемента) = Ar(элемента) × N (элемента) ×100% M (вещества )
![]()
5. Мольная доля вещества в смеси
c (вещества ) = n(вещества ) ×100% n(смеси)
![]()
n(вещества )
n(смеси) = ×100%
![]()
= n(смеси) × c(вещества )
n(вещества )
![]()
100%
6. Объемная доля вещества в смеси
j (вещества ) = V (вещества ) ×100% V (смеси)
![]()
V (вещества )
V (смеси) = ×100%
![]()
V (вещества ) = V (смеси) ×j(вещества ) 100%
![]()
7. Концентрация вещества
= n(вещества )
С(вещества )
![]()
V ( раствора)
n(вещества) =V ( раствора) ×C(вещества)
= n(вещества )
V ( раствора)
![]()
C(вещества )
8. Связь массы, объема и плотности
r = Vт V = тr т = r ×V
![]()
![]()
9. Относительная плотность газа X по газу Y
= M (x) Dy (x) M ( y)
![]()
10. Выход продукта реакции
|
h = |
m(практическая) |
×100% = |
n(практическое) |
×100% = |
|
V (практический) |
×100% |
|
|
m(теоретическая) |
n(теоретическое) |
V (теоретический) |
|
|||||
|
|
|
|
|
|
||||
11. Уравнение состояния идеального газа:
P∙V=n∙R∙T
1 л = 1 дм3 = 1000 мл = 0,001 м3
1 атм = 101 325 Па = 760 мм рт ст; 1 бар=100000 Па=100 кПа
0° C = 273 К, 100° C = 373 К
Нормальные условия (н. у.): P = 1 атм, T = 273 К
Стандартные условия: P = 1 бар, T = 298 К
Типы задач ЕГЭ. Задания № 28, 29
1. Расчеты массы вещества или объема газа по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
![]()
![]()
![]()
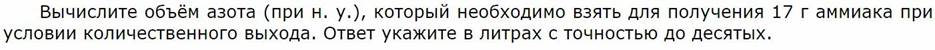
![]()

2. Расчеты объемных отношений газов при химических реакциях.

3. Расчеты по химическим уравнениям, если одно из веществ дано в избытке.
![]()
![]()
![]()
4. Задачи на выход продукта реакции.

![]()

5. Расчеты по термохимическим уравнениям.

![]()
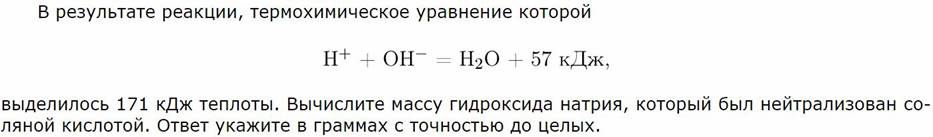
6. Задачи на примеси.
![]()
Задачи № 34
Чтобы верно решить задачи №34 нужно:
•Верно составлять уравнения реакций (особенно ОВР, электролиз, кислые и основные соли, реакции разложения…), не забывать про коэффициенты.
•При расчете массы раствора помнить, что массы осадков и газов не входят в массу
раствора.
•Уметь определять избыток/недостаток.
•иметь представление о кристаллогидратах , уметь находить их молярные массы и учитывать кристаллизационную воду в расчетах.
•Обладать базовыми знаниями математики и уметь считать на калькуляторе.
•Знать формулы для расчета физических величин, применяемых в химии.

![]()
![]()


Типы заданий № 35
1. Установление формулы вещества по уравнению реакции и определении молярной массы.
![]()
![]()
![]()
![]()



2. Установление формулы вещества по уравнению реакции сгорания. Обычно в таких задачах используют относительную плотность паров вещества.



3. Задачи на нахождение молекулярной формулы вещества через массовые доли элементов.

![]()



Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.