
СЕРА.
|
ü Положение в Периодической системе; ü Строение атома;
|
|
|
ü Свойства атома;
|
S0 + 2e → S-2 – окислитель a. бинарные соединения с металлами - cульфиды; b. бинарное соединение с менее электроотрицательным водородом - сероводород; S0 - 4e → S+4 – восстановитель S0 - 6e → S+6 – восстановитель c. бинарные соединения с более электроотрицательным кислородом (оксиды); H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F
|
ü Сера в природе:
o В свободном виде в жерлах вулканов;
o В форме сульфидов и сульфатов в минералах.

В каком минерале массовая доля серы больше:
глауберова соль Na2SO4 x 10H2O, алебастр 2СaSO4 x H2O или гипс СaSO4 x 2H2O?
ü Сера – простое вещество;
Аллотропия –
способность атомов одного ХЭ образовывать несколько простых веществ
(аллотропных модификаций или аллотропных видоизменений).
сера ромбическая (S8) ↔ сера пластическая (S)  Д.
Д.
|
СЕРА РОМБИЧЕСКАЯ |
СЕРА ПЛАСТИЧЕСКАЯ
|
|
МОЛЕКУЛА S8; ХРУПКОЕ КРИСТАЛЛИЧЕСКОЕ ВЕЩЕСТВО ЛИМОННО-ЖЕЛТОГО ЦВЕТА |
МОЛЕКУЛА – ДЛИННЫЕ ПОЛИМЕРНЫЕ ЦЕПИ; ПРОЗРАЧНАЯ РЕЗИНООБРАЗНАЯ МАССА ТЁМНО-КОРИЧНЕВОГО ЦВЕТА |
Флотация порошкообразной серы -
ü Химические свойства серы;
1) Взаимодействует с простыми веществами (металлами и неметаллами):
Составьте уравнения реакций серы и алюминия; серы и кислорода.
2) Взаимодействует со сложными веществами:
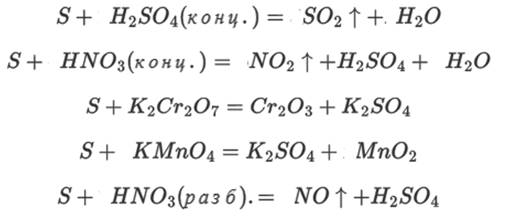
Определите окислитель/ восстановитель.
К раствору сульфида калия массой 183,33 г и массовой долей 15% прилили избыток раствора нитрата железа (II). Вычислите массу образовавшегося осадка.
СОЕДИНЕНИЯ СЕРЫ. СЕРОВОДОРОД – H2S.
|
Физические свойства |
o Бесцветный газ природного происхождения с резким запахом – с запахом тухлых яиц; Ядовит при незначительном содержании в воздухе – 0,01%; Способность накапливаться в организме → кислородное голодание → гибель человека; Использование природных вод с сероводородом в медицине (бальнеотерапия – питьевое лечение и ванны). o Мало растворим в воде (раствор в воде - слабая сероводородная кислота). o Относительная плотность по воздуху: 32/ 29.
|
|
Получение
|
1. Взаимодействие серы и водорода; 2. Взаимодействие сульфидов с сильными кислотами. Составьте уравнения ХР. В ионных уравнениях записывают H2S↑ (летучая кислота).
|
|
Химические свойства |
Сероводород – сильнейший восстановитель; a) Сероводород + оксид серы (IV) → сера + вода; очистка промышленных выбросов от сероводорода при переработке нефти, газа, угля b) Сероводород + кислород (недостаток/ избыток) → сера/ оксид серы (IV) + вода; c) H2S + HNO3(конц.) → H2SO4 + NO2↑ + H2O
Химические свойства сероводорода/ сероводородной двухосновной кислоты: · С расплавленными металлами до водорода в ряду активности металлов взаимодействует газообразный сероводород; Почернение серебряных и медных изделий: Ag + H2S + O2 → Ag2S + H2O (чёрные сульфиды) Нерастворимые сульфиды определяют по специфической окраске: белый, телесно-розовый, оранжевый, красный, шоколадный, черный … · С щелочами (образуются средние и кислые соли); · С растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути. Образуются «черные сульфиды», нерастворимые ни в воде, ни в минеральных кислотах. H2S + Pb(NO3)2 → PbS↓ + HNO3 темно-коричневый осадок качественная реакция на сероводород и сульфид-ионы
|
СОЕДИНЕНИЯ СЕРЫ. ОКСИДЫ.
|
ОКСИД СЕРЫ (IV) SO2 (сернистый газ) |
ОКСИД СЕРЫ (VI) SO3
|
|
Физические свойства |
|
|
Бесцветный газ природного происхождения с резким запахом; Ядовит.
Хорошо растворим в воде, раствор в воде - слабая сернистая кислота – H2SO3 (неустойчивая, существующая только в растворе). |
Бесцветная жидкость с удушающим запахом (летучая); Ядовита. Раздражающее воздействие на слизистую оболочку. Хорошо растворима в воде, раствор в воде – сильная серная кислота H2SO4. |
|
Получение |
|
|
o Взаимодействие простых веществ (серы и кислорода); o Горении сероводорода при избытке кислорода; o Обжиг сульфидов.
|
o --------------------------------
o Окисление оксида серы (IV) кислородом.
|
|
Химические свойства - кислотные оксиды: С основными оксидами; С щелочами (соли средние и кислые); С водой.
|
|
СОЕДИНЕНИЯ СЕРЫ. СЕРНАЯ КИСЛОТА H2SO4.
|
Физические свойства |
Ø Бесцветная нелетучая тяжёлая маслянистая жидкость; Ø Растворима в воде в любых соотношениях, раствор в воде - сильный электролит (степень диссоциации стремится к 1); Ø Раствор оксида серы (VI) в серной кислоте – о´леум; Ø Сильные гигроскопические (водоотнимающие) свойства концентрированной кислоты;
|
|
Получение
|
|
Химические свойства раствора серной кислоты:
o С растворами солей;
o С основаниями (щелочами и нерастворимыми);
o С оксидами металлов (основными и амфотерными);
o С металлами до водорода в электрохимическом ряду напряжений металлов.

Составьте уравнения реакций концентрированной серной кислоты с металлами разной активности. Определите окислитель/ восстановитель.
Качественные реакции на сульфит и сульфат-ионы – катионы Ba2+.
Сульфит бария растворяется в растворах сильных кислот, сульфат бария - не растворяется.

Лабораторный опыт.
Изучение свойств разбавленной серной кислоты.
Цель:
опытным путем доказать, что разбавленная серная кислота проявляет типичные свойства кислот.
Оборудование и реактивы: __________________________________________.
Ход работы.
|
Что делаю |
Что наблюдаю |
Уравнения ХР (молекулярное, ионное, ОВР)
|
Вывод по опыту |
|
|
|
|
Взаимодействует с …
|
Вывод по лабораторному опыту: см. цель опыта.
Задание № 1.
Налейте в пробирку 1 мл серной кислоты и добавьте на кончике шпателя стружку магния.
Задание № 2.
В пробирку налейте предложенную щёлочь и добавьте одну каплю фенолфталеина.
Добавляйте по каплям раствор серной кислоты до исчезновения окраски раствора.
Задание № 3.
В пробирку с оксидом меди добавьте 1 мл раствора серной кислоты.
Задание № 4.
В пробирку налейте 1 мл раствора серной кислоты и добавьте немного
соли бария/ карбоната натрия.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.