
1. В раствор, содержащий 31 г нитрата серебра, добавили 14.35 г 17%-ного раствора соляной кислоты. Какая масса 32%-ного раствора хлорида калия потребуется для полного осаждения серебра из получившегося раствора.
Очевидно, что не весь нитрат серебра вступил в реакцию с соляной кислотой. Какое-то количество нитрата серебра осталось (надо выяснить точно сколько) и прореагировало с хлоридом калия. Теперь, когда план составлен, можно приступать к решению.


ответ: 25.6 г.
2. В раствор хлорида аммония 176 г 24%, добавили 17 г нитрита натрия. Какова массовая доля хлорида аммония в получившемся растворе, и какой объем (н.у.) азота выделится при этом?
Очевидно, что не весь хлорид аммония вступил в реакцию с нитритом натрия. Какое-то количество хлорида аммония осталось. Необходимо точно выяснить, сколько его осталось, разделить это значение на массу раствора и найти массовую долю. Важно не забыть вычесть из массы раствора массу азота, который выделился из раствора. Теперь, когда план составлен, можно приступать к решению.
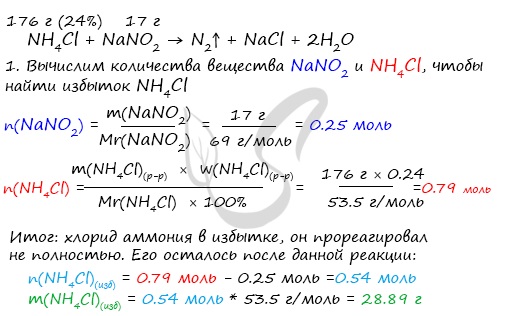

ответ: w(NH4Cl) = 15.53% v(N2)
= 5.6 л
3. Карбид кальция массой 5.8 г добавили к 125 мл 7%-ного раствора соляной кислоты (плотностью 1.12 г/мл). Сколько миллилитров 36% азотной кислоты (плотностью 1.05 мг/л) нужно добавить к полученной смеси для ее полной нейтрализации?
Очевидно, что не весь карбид кальция вступил в реакцию соляной кислотой. Какое-то количество карбида кальция осталось (надо выяснить точно сколько) и прореагировало с водой, образовав Ca(OH)2. Именно гидроксид кальция и реагирует с азотной кислотой. Теперь, когда план составлен, можно приступать к решению.


ответ: 255 мл.
4. Газ, выделившийся при взаимодействии 9.6 г меди с 218 мл
70% азотной кислоты (плотностью 1,3 г/мл) растворили в 250 г 14% раствора
гидроксида натрия. Рассчитайте массовую долю нитрата натрия в полученном
растворе.
1) Записав реакцию между медью и азотной кислотой (концентрированной, а значит
газообразный продукт - NO2), мы найдем количества вещества меди и
азотной кислоты, после чего сравним (в соответствии с коэфициентами в
уравнении) и узнаем, какое вещество в избытке, а какое - в недостатке.
2) Зная количество вещества, которое в недостатке, перейдем от него к
количеству вещества NO2.
3) Узнав количество вещества NO2 в первой реакции, мы перейдем
ко второй (реакция между NO2 и NaOH), при этом важно чтобы
количество вещества не менялось (то есть ни в коем случае не умножать
количество вещества ни на какие коэфициенты). 4) Узнаем количество вещества
NaOH во второй реакции и, сравнив с количеством вещества NO2, узнаем
что в избытке, что в недостатке.
5) От того вещества, которое в недостатке, перейдем к количеству вещества NaNO3,
найдем его массу и разделим ее на общую массу раствора.



5. Какую массу оксида серы (VI) следует добавить к 200 г
10%-го раствора серной кислоты, чтобы увеличить ее массовую долю вдвое?
1) По мере добавления SO3 к раствору он соединяется с водой (в
соотношении 1 к 1) и образует серную кислоту:
SO3 + H2O = H2SO4
2) Получается, что мы добавляем SO3 и при этом образуется
серная кислота в таком же соотношении (количество вещества равное). Примем
количество вещества за x, выразим через x массы SO3 и H2SO4.


Количество вещества получилось 0.3 моль. Следовательно, чтобы
увеличить массовую долю серной кислоты вдвое нужно добавить к раствору:
m(SO3)добав. = ν(SO3) × M(SO3)
= 0.3 моль × 80 г/моль = 24 г
6. Какую массу оксида селена (VI) следует добавить к 150 г
20%-го раствора селеновой кислоты, чтобы увеличить ее массовую долю втрое?
1) По мере добавления SeO3 к раствору он соединяется с водой (в
соотношении 1 к 1) и образует селеновую кислоту:
SeO3 + H2O = H2SeO4
2) Получается, что мы добавляем SeO3 и при этом образуется
селеновая кислота в таком же соотношении (количество вещества равное). Примем
количество вещества за x, выразим через x массы SeO3 и H2SeO4.


Количество вещества получилось 0.87 моль. Следовательно, чтобы
увеличить массовую долю селеновой кислоты втрое нужно добавить к раствору:
m(SeO3)добав. = ν(SeO3) ×
M(SeO3) = 0.87 моль × 127 г/моль = 110.5 г
7. Смешали 240 мл раствора азотной кислоты с массовой долей
15% (плотность 1.1 г/мл) и 150 мл раствора гидроксида натрия с массовой доле
30% (плотность 1.2 г/мл). Сколько миллилитров воды нужно добавить к полученному
раствору, чтобы массовая доля соли в нем составила 8%?
1) Запишем реакцию и вычислим количества вещества азотной кислоты и гидроксида
натрия.
2) Сравнив их в соответствии с коэффициентами, узнаем, какое вещество в
избытке, а какое в недостатке.
3) Перейдем от количества вещества (которое в недостатке) к количеству вещества
образовавшейся соли, нитрату натрия, вычислим его массу, массу раствора и
количество воды, которое необходимо добавить, чтобы его концентрация достигла
4%.



Выходит, что к полученному раствору нужно добавить 176 г воды, чтобы концентрация соли стала равна 4%.
8. При термическом разложении карбоната кальция и карбоната
натрия выделилось 8.96 л газа. Оставшаяся смесь может реагировать с 120 г 30%
раствора соляной кислоты. Определите массовую долю карбоната натрия в смеси.
1) При термическом разложении газ выделяется лишь в реакции разложения
карбоната кальция, так как более неустойчив термически (нерастворим), в отличие
от карбоната натрия.
2) Найдем количество вещества выделившегося газа, CO2, узнаем
количество вещества оксида кальция, карбоната кальция и вычислим массу
карбоната кальция.
3) Вычислим общее количество соляной кислоты. Зная количество образовавшегося
оксида кальция, найдем количество прореагировавшей с ним соляной кислоты.
Вычтем это количество вещества из общего количества соляной кислоты, найдя то,
сколько приходится кислоты на вторую реакцию с карбонатом натрия.
4) Зная количество вещества соляной кислоты во второй реакции (с карбонатом
натрия), найдем количество вещества и массу карбоната натрия. Наконец сложим
массы карбоната кальция и карбоната натрия, посчитаем их массовые доли.



Массовая доля карбоната натрия в исходной смеси - 21%.
9. Аммиак, выделившийся при кипячении 20 г 20% раствора
гидроксида натрия и 15.6 г бромида аммония, растворили в воде. Сколько
миллилитров 8%-ной азотной кислоты (плотность 1.08 г/мл) потребуется для
нейтрализации полученного раствора аммиака?
1) Запишем реакцию между гидроксидом натрия и бромидом аммония. Вычислим их
количество вещества.
2) Зная количество вещества, определим какое вещество в избытке, а какое в
недостатке. Дальнейший расчет ведем по недостатку. Найдем количество
выделившегося аммиака.
3) Запишем реакцию между аммиаком и азотной кислотой. Зная количество вещества
аммиака, найдем количество вещества азотной кислоты и ее массу. Вычислим массу
8%-ного раствора (плотность 1.08 г/мл) в котором находится найденная масса
кислоты.


Для нейтрализации полученного раствора аммиака требуется 73 г 8%-ного раствора (плотность 1.08 г/мл) азотной кислоты.
10. При обработке карбида алюминия соляной кислотой (масса раствора которой 360 г, массовая доля 25%) выделилось 11.2 л (н.у.) метана.
Рассчитайте массовую долю
хлороводорда в образовавшемся растворе.
1) Запишем реакцию между карбидом алюминия и соляной кислотой. Вычислим
количество вещества метана и соляной кислоты, определим избыток соляной кислоты
(в данном случае очевидно, что в избытке соляная кислота, так как условие
задачи "рассчитайте массовую долю хлороводорода" - выходит, что
соляной кислоты было много и она осталась после реакции).
2) Найдем массу раствора, вычтем из нее массу метана (газ улетучился из
раствора). Найдем массовую долю хлороводорода в полученном растворе.


Массовая доля соляной кислоты в конечном растворе составляет 4.84%
11. Бром полностью прореагировал с при нагревании с едким
кали, содержащимся в 256 мл 8%-ного раствора его (плотность 1.1 г/мл).
Рассчитайте массовую долю бромида калия в полученном растворе.
1) Запишем реакцию (!при нагревании) между бромом и едким кали. Найдем
количество вещества едкого кали (гидроксида калия), от него перейдем к
количеству вещества брома и бромида калия.
2) Рассчитаем массу брома (понадобится для нахождения массы раствора), массу
бромида калия.
3) Рассчитаем массу раствора путем сложения массы брома и раствора едкого кали.
Вычислим массовую долю бромида калия.


Массовая доля бромида калия в конечном растворе составляет 12.5%
12. Смешали 145 мл 7%-ного раствора гидроксида натрия (плотность 1.15 г/мл) и 165 мл 12%-ного раствора азотной кислоты (плотность 1.05 г/мл).
Определите массовую долю соли
в полученном растворе.
1) Запишем реакцию между гидроксидом натрия и азотной кислотой. Вычислим
количество вещества гидроксида натрия и азотной кислоты, определим что в
избытке, а что в недостатке.
2) От вещества, которое в недостатке, перейдем к количеству вещества нитрата
натрия. Найдем массу нитрата натрия.
3) Вычислим массы растворов гидроксида натрия и азотной кислоты, найдем общую
массу раствора и массовую долю нитрата натрия в растворе.


Массовая доля нитрата натрия в конечном растворе составляет 7.5%
13. На нейтрализацию 12.4 г смеси азотной и соляной кислот израсходовано 46 мл 18%-ного раствора гидроксида натрия (плотность 1.15 г/мл).
Рассчитайте массу азотной кислоты и ее массовую долю в исходной
смеси.
1) Запишем реакции между азотной кислотой, соляной кислотой и гидроксидом
натрия. Примем количество азотной кислоты за x, а соляной - за y.
2) Найдем общее количество вещества израсходованного гидроксида натрия, и,
соответственно, общее количество вещества кислот.
3) Составим систему уравнений, выразив через x и y количества вещества азотной
и соляной кислот. Решим ее и найдем количество вещества азотной и соляной
кислоты.
4) Найдем массу азотной и соляной кислот, общую массу исходной смеси. Вычислим
массовую долю азотной кислоты.



Массовая доля азотной кислоты в исходной смеси составляет 70%
14. Смешали раствор гидроксида калия 67.3 мл 16% (плотность 1.3 г/мл) и раствор ортофосфорной кислоты 453.7 мл 5% (плотность 1.08 г/мл).
Определите, какая соль образуется в результате данной реакции,
назовите ее и вычислите ее массовую долю в растворе.
1) Запишем реакцию между гидроксидом калия и ортофосфорной кислотой, определим
их количество вещества.
2) Узнаем соль, которая образуется. Назовем данную соль и найдем ее массу.
3) Найдем массу конечного раствора, массовую долю соли в нем.



Массовая доля дигидрофосфата калия в конечном растворе составляет 5.9%
15. В 180 г 14%-ной соляной кислоты растворили карбид
алюминия. При этом выделилось 6.72 л (н.у.) газа. Рассчитайте массовую долю хлорида
алюминия в полученном растворе.
1) Запишем реакцию между карбидом алюминия и соляной кислотой. Найдем
количество вещества соляной кислоты и газа, выделившегося в ходе реакции, а
также количество хлорида алюминия. Вычислим массу хлорида алюминия.
2) От количества вещества выделившегося газа перейдем к количеству вещества
карбида алюминия, найдем его массу. Вычислим массы выделившегося газа и
раствора (!важно не забыть вычесть массу газа).
3) Рассчитаем массовую долю хлорида алюминия.


Массовая доля хлорида алюминия в конечном растворе составляет 28%
16. При комнатной температуре хлор полностью прореагировал с едким натром, содержащимся в 176 мл 15% раствора его (плотность 1.1 г/мл). Рассчитайте массовую долю гипохлорита натрия в образовавшемся растворе.
1) Запишем реакцию между едким натром и хлором (!при комнатной температуре).
Рассчитаем количество гидроксида натрия (едкого натра) и от него перейдем к
количеству вещества хлора, вычислим его массу.
2) Перейдем от гидроксида натрия к количеству вещества гипохлорита натрия.
Вычислим массу гипохлорита натрия.
3) Рассчитаем общую массу раствора (складывается из массы хлора и массы
раствора едкого натра). Найдем массовую долю гипохлорита натрия в полученном
растворе.


Массовая доля гипохлорита натрия в конечном растворе составляет 12.3%
17. Определите процентную концентрацию вещества,
образовавшегося в результате растворения 15.6 г калия в 550 мл воды.
1) Запишем реакцию между оксидом калия и водой. Найдем количество вещества
оксида калия. От количества вещества оксида калия перейдем к количеству
вещества гидроксида калия и выделившегося газа.
2) Найдем массы гидроксида калия и выделившегося газа. Вычислим массу раствора
(!не забудем вычесть из него массу газа).
3) Рассчитаем массовую долю гидроксида калия в полученном растворе


Массовая доля гидроксида калия в конечном растворе составляет 3.96%
18. Определите процентную концентрацию вещества,
образовавшегося в результате растворения 63.9 г оксида фосфора (V) в 342 мл
воды.
1) Запишем реакцию между оксидом фосфора (V) и водой. Вычислим количество
вещества оксида фосфора и от него перейдем к количеству вещества ортофосфорной
кислоты, найдем ее массу.
2) Найдем массу конечного раствора (нужно сложить массы оксида фосфора (V) и воды),
массу ортофосфорной кислоты. Вычислим массовую долю ортофосфорной кислоты в
растворе.

Массовая доля ортофосфорной кислоты в конечном растворе составляет 22%
19. Определите процентную концентрацию хлорида калия в
растворе, образовавшемся при сливании 120 г 12%-ного раствора соляной кислоты и
172.5 г 24%-ного раствора карбоната калия. Ответ запишите с точностью до целых.
1) Запишем реакцию между соляной кислотой и карбонатом калия. Вычислим
количества вещества соляной кислоты и и карбоната калия, найдем какое вещество
в избытке, а какое в недостатке. Дальнейшие расчеты будем вести по недостатку.
2) От количества вещеcтва, которое в недостатке, перейдем к количествам
вещества хлорида калия и углекислого газа. Найдем их массы.
3) Вычислим общую массу раствора (сложим массу раствора соляной кислоты и
раствора карбоната калия), не забыв при этом (!) вычесть массу газа, так как
она улетучивается из раствора. Найдем массовую долю хлорида калия в растворе.



Массовая доля хлорида калия в конечном растворе составляет 10%
20. Железо массой 28 г
растворили в 300 мл 14%-ного раствора серной кислоты (плотность 1.1 г/мл).
Вычислите массовую долю сульфата железа (II) в конечном растворе.
1) Запишем реакцию между железом и разбавленной серной кислотой. Рассчитаем
количество вещества железа и серной кислоты, сравним их и узнаем, какое
вещество в избытке, а какое - в недостатке.
Дальнейший расчет будем вести
по веществу, которое в недостатке.
2) От количества вещества, которое в недостатке, перейдем к количеству вещества
сульфата железа (II) и водорода. Вычислим их массы.
3) Вычислим массу конечного раствора, которая складывается из массы железа и
раствора серной кислоты, при этом важно (!) не забыть вычесть массу газа -
водорода. Найдем массовую долю сульфата железа в конечном растворе.



Массовая доля сульфата железа (II) в конечном растворе составляет 24.4%
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.