
Реакции ионного обмена. §20,с. 92 №2-5
При
взаимодействии друг с другом растворов электролитов в реакцию вступают не
молекулы, а ионы, которые находятся в растворе. Если в результате
взаимодействия между собой противоположно заряженных ионов образуется слабый
электролит (![]() ), газообразное (
), газообразное (![]() ) или нерастворимое (
) или нерастворимое (![]() ) вещество, то это вещество
удаляется из сферы реакции (раствора) и она протекает до конца в соответствии с
принципом Ле Шателье (положение равновесия этой системы будет смещаться
вправо, в сторону продуктов реакции).
) вещество, то это вещество
удаляется из сферы реакции (раствора) и она протекает до конца в соответствии с
принципом Ле Шателье (положение равновесия этой системы будет смещаться
вправо, в сторону продуктов реакции).
А+В-
+ С+D-![]() А+ D-+
С+В~
Протекает до конца, если один из продуктов реакции
А+ D-+
С+В~
Протекает до конца, если один из продуктов реакции ![]() ,
,![]() ,
,![]()
Правила составления ионных уравнений.
1. Составить молекулярное уравнение реакции.
2. Проверить
возможность протекания реакции (![]() ,
,![]() ,
,![]() )
)
3. Отметить вещества, которые будут записываться в молекулярном виде (осадки, газы, слабые электролиты и неэлектролиты).
4. Записать ионное уравнение, при этом не забыть:
— коэффициент перед формулой вещества относится к обоим ионам (!!!);
— формулы многоатомных (сложных) ионов не разрывают — OН-, СО32-, NO3-, SO42-, PO43-; HCO3-, HPO42- и т.п.;
— индекс после иона переходит в ионном уравнении в коэффициент перед ним.
5. Привести подобные члены в левой и правой частях уравнения («сократить»).
6. Переписать сокращённое ионное уравнение.
Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным.
При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости (см. табл.).
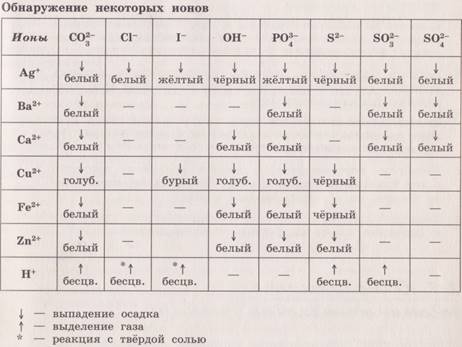
Внимание! Указанные в таблице растворимости (см. табл.) малорастворимые («м») и практически нерастворимые («н») соли выпадают в осадок именно в том виде, как они представлены в таблице (СаF2↓, PbI2↓, Ag2SO4↓, AlPO4↓ и т. д.).
В табл. не указаны карбонаты – средние соли с анионом CO32‑. Следует иметь в виду, что:
1) К2СO3, (NH4)2CO3 и Na2CO3 растворимы в воде;
2) Ag2CO3, ВаСO3 и СаСO3 практически нерастворимы в воде и выпадают в осадок как таковые, например:
![]()
3) соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимы в воде, но не осаждаются из водного раствора при проведении ионных реакций (т. е. их нельзя получить этим способом).
Например, карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и К2СO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ:
![]()
Аналогично FeCO3, сульфид хрома (III) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
![]()
В табл. не указаны также соли, которые разлагаются водой – сульфид алюминия Al2S3 (а также BeS) и ацетат хрома (III) Cr(СН3СОО)3:
![]()
Следовательно, эти соли также нельзя получить по обменной реакции в растворе:
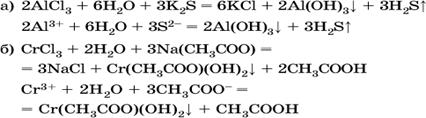
(в последней реакции состав осадка более сложный; подробнее такие реакции изучают в высшей школе).
Примеры реакций с выделением газов:

Примеры реакций с образованием слабых электролитов:

Если реагенты и продукты обменной реакции не являются сильными электролитами, ионный вид уравнения отсутствует, например:
![]()
Самостоятельная работа.
Пример. Составить ионное уравнение реакции взаимодействия нитрата железа(Ш) с гидроксидом натрия.
1. Составляем молекулярное уравнение:
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaN03.
2.
Проверяем
возможность протекания реакции (наличие в продуктах реакции ![]() ,
,![]() ,
,![]() ):
):
Fe(NO3)3 + 3NаOH =
Fe(OH)3![]() + 3NaN03.
+ 3NaN03.
3. Отмечаем вещества, которые в ионном уравнении будут записаны в виде молекул:
Fe(N03)3 + 3NaOH = FeC0H)3 ![]() , + 3NaNO,.
, + 3NaNO,.
4. Составляем полное ионное уравнение реакции:
Fe3+ + 3NO3-
+ 3Na+ + ЗОН- = Fe(OH)3 + 3Na+
+ 3NO3-.
5. «Сокращаем» (приводим подобные члены) одинаковые ионы в левой и правой частях уравнения:
Fe3- + 3NO3+ 3Na+ + ЗОН- = Fe(OН)3 + 3Nа+ + NO3.
6. Записываем сокращённое ионное уравнение:
Fe3+ + 3ОН- = Fe(OH)3.
1. Сильный электролит – это
1) С6Н5ОН
2) СН3СООН
3) С2Н4(ОН)2
4) К(НСОО)
2. В уравнении диссоциации слабой кислоты Н3РO4
по всем возможным ступеням сумма коэффициентов равна
1) 3 2) 6 3) 9 4) 12
3. Для уравнений диссоциации в растворе двух щелочей набора NaOH, Ва(ОН)2 общая сумма коэффициентов составляет
1) 5 2) 6 3) 7 4) 8
4. В известковой воде содержится набор частиц
1) СаОН+, Са2+, ОН‑ 2) Са2+, ОН‑, Н2O
3) Са2+, Н2O, О2‑ 4) СаОН+, О2‑, Н+
Самостоятельная работа.
Пример. Составить ионное уравнение реакции взаимодействия нитрата железа(Ш) с гидроксидом натрия.
1. Составляем молекулярное уравнение:
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaN03.
2.
Проверяем
возможность протекания реакции (наличие в продуктах реакции ![]() ,
,![]() ,
,![]() ):
):
Fe(NO3)3 + 3NаOH =
Fe(OH)3![]() + 3NaN03.
+ 3NaN03.
3. Отмечаем вещества, которые в ионном уравнении будут записаны в виде молекул:
Fe(N03)3 + 3NaOH = FeC0H)3 ![]() , + 3NaNO,.
, + 3NaNO,.
4. Составляем полное ионное уравнение реакции:
Fe3+ + 3NO3-
+ 3Na+ + ЗОН- = Fe(OH)3 + 3Na+
+ 3NO3-.
5. «Сокращаем» (приводим подобные члены) одинаковые ионы в левой и правой частях уравнения:
Fe3- + 3NO3+ 3Na+ + ЗОН- = Fe(OН)3 + 3Nа+ + NO3.
6.Записываем сокращённое ионное уравнение:
Fe3+ + 3ОН- = Fe(OH)3.
1. Слабый электролит – это
1) иодоводород
2) фтороводород
3) сульфат аммония
4) гидроксид бария
2. В уравнении диссоциации слабой кислоты H2SeO3
по всем возможным ступеням сумма коэффициентов равна
1) 3 2) 6 3) 9 4) 12
3. Для уравнений диссоциации в растворе двух щелочей набора Sr(OH)2, Са(ОН)2 общая сумма коэффициентов составляет
1) 5 2) 6 3) 7 4) 8
4. В известковой воде содержится набор частиц
1) СаОН+, Са2+, ОН‑ 2) Са2+, ОН‑, Н2O
3) Са2+, Н2O, О2‑ 4) СаОН+, О2‑, Н+
5. Реакция с выпадением осадка – это
1) MgSO4 + H2SO4 →…
2) AgF + HNO3 →…
3) Na2HPO4 + NaOH →…
4) Na2SiO3 + HCl →…
6. Краткое ионное уравнение ОН‑ + Н+ = Н2O отвечает взаимодействию
1) Fe(OH)2 + НCl →…
2) NaOH + HNO2 →…
3) NaOH + HNO3 →…
4) Ва(ОН)2 + KHSO4 →…
7. В молекулярном уравнении реакции
Na3PO4 + AgNO3 →… сумма коэффициентов равна
1) 4 2) 5 3) 7 4) 8
8. Для реакции полной нейтрализации
Fe(OH)2 + HI →…
сумма коэффициентов в полном ионном уравнении составляет
1) 6 2) 8 3) 10 4) 12
9. В кратком ионном уравнении реакции
NaF + AlCl3 →… сумма коэффициентов равна
1) 3 2) 4 3) 5 4) 6
10. Нейтральная среда будет в конечном растворе после смешивания растворов исходных солей в наборах
1) ВаCl2, Fe(NO3)3 2) Na2CO3, SrS
3) BaS, ZnSO4 4) MgCl2, RbNO3

5. Реакция с выделением газа – это
1) NaOH + СН3СООН →…
2) FeSO4 + КОН →…
3) NaHCO3 + HBr →…
4) Pl(NO3)2 + Na2S →…
6. В ионном уравнении реакции
SO2 + 2OН = SO32‑ + Н2O
ион ОН‑ может отвечать реагенту
1) Cu(ОН)2
2) Н2O
3) LiOH
4) С6Н5ОН
7. В молекулярном уравнении реакции
Na2S + Cu(NO3)2 →… сумма коэффициентов равна
1) 4 2) 5 3) 7 4) 8
8. Для реакции полной нейтрализации
Ва(ОН)2 + H2S →…сумма коэффициентов в полном ионном уравнении составляет
1) 6 2) 8 3) 10 4) 12
9. В кратком ионном уравнении реакции
К2СO3 + Sr(NO3)2 →…сумма коэффициентов равна
1) 3 2) 4 3) 5 4) 6
10. Нейтральная среда будет в конечном растворе после смешивания растворов исходных солей в наборах
1) ВаCl2, Fe(NO3)3 2) Na2CO3, SrS
3) BaS, ZnSO4 4) MgCl2, RbNO3

Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.