
Сопряжение и ароматичность.
В состав живых организмов входят непредельные соединения: алкены, алкадиены и арены. Их реакционная способность зависит от:
- валентного состояния атомов углерода;
- и природы химической связи.
Алкены:
Простейшим соединением, содержащим двойную связь, является этилен:
sp2 sp2
Н2С = СН2
Атомы углерода находятся в sp2 валентном состоянии, следовательно, все σ-связи лежат в одной плоскости под углом 1200. А перпендикулярно этой плоскости находится π-связь.
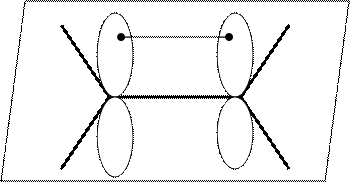
Энергия связи (Есв.) зависит от величины перекрывания атомных орбиталей, чем глубже перекрывание, тем прочнее связь.
Боковое перекрывание не может быть глубоким, т.к. этому мешает отталкивание между ядрами. Следовательно, π-связь не прочная, легко разрывается, благодаря чему у алкенов идут реакции присоединения. Они носят электрофильный характер. На π-электронное облако (отрицательно заряженное) алкенов ведут атаку положительно заряженные частицы – электрофильные реагенты.
Алкадиены – это углеводороды, содержащие две двойных связи. Эти связи в молекуле могут располагаться по-разному.
sp2 sp sp2
1. пропадиен – Н2С=С=СН2. Связи кумулированные. В живых организмах не встречаются. Почему? Т.к. являются ядами (как цианиды).
2. пентадиен-1,4 – Н2С=СН-СН2-СН=СН2. Изолированное расположение двойных связей, т.е. двойные связи располагаются через две или более простых (одинарных).
3. бутадиен-1,3 Н2С=СН-СН=СН2. Сопряжённые связи – это когда двойные связи находятся на расстоянии одной σ-связи.
Соединения, содержащие изолированные и сопряжённые двойные связи вступают в реакции электрофильного присоединения, но по-разному:
- диены с изолированными двойными связями вступают в реакции электрофильного присоединения легко, как алкены.
- а в сопряжённых системах реакционная способность изменяется.
Строение 1,3-бутадиена.
В его молекуле все атомы находятся в sp2–валентном состоянии, следовательно все σ-связи лежат в одной плоскости.
sp2 sp2 sp2 sp2
Н2С=СН-СН=СН2
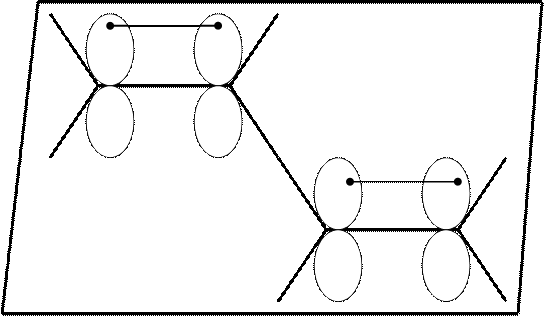
р-атомные орбитали 1 и 2, 3 и 4 атомов перекрываются между собой образуя π-связи.
- Перекрываются ли р-орбитали 2 и 3 атомов углерода?
Да, т.к. находятся на расстоянии 1 σ-связи. Но это перекрывание будет не глубокое, поэтому показывается пунктиром и называется СОПРЯЖЕНИЕМ.
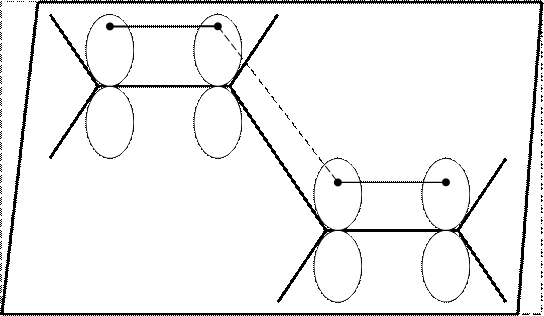
Существует правило:
Если две π-связи или π-связь и р-атомная орбиталь находятся на расстоянии 1 σ-связи друг от друга, то между ними возникает дополнительное перекрывание - сопряжение (конъюгация).
При перекрывании атомных орбиталей происходит выделение энергии (Е). При сопряжении, выделяется дополнительная энергия, которая называется – энергия сопряжения (Есопр.).
У бутадиена-1,3 Есопр= 14,5 кДж/моль.
Сопряжение приводит к возникновению единого π-электронного облака и 4 р-электрона могут свободно перемещаться в поле 4-х ядер атомов, в результате чего происходит перераспределение электронов – делокализация («потеря места»).
 Поэтому
Есопр так и называется – энергия делокализации (Е мезомерии).
Поэтому
Есопр так и называется – энергия делокализации (Е мезомерии).
Чем длиннее сопряжённая система, тем выше Еделок. (т.е. тем больше энергии выделяется), тем труднее разорвать π-электронное облако. Следовательно, термодинамическая стабильность (устойчивость) молекулы повышается, а реакционная способность понижается. Поэтому сопряжённые диены вступают в реакции электрофильного присоединения труднее, чем алкены.
Пр: 1,3,5-гексатриен.
Н2С=СН-СН=СН-СН=СН2
В организме человека много соединений относящихся к диенам и полиенам. Если их биологическая роль заключается в том, чтобы обеспечивать организм энергией (высшие карбоновые кислоты), то их двойные связи не бывают сопряжёнными.
Если система должна обеспечивать стабильность молекулы, то двойные связи в ней находятся в сопряжении (витамин А):
Пр:

Виды сопряжения.
1. В молекуле 1,3-бутадиена возникает сопряжение между двумя π-связями – это π,π-сопряжение. Изображается пунктиром:
Пр: Н2С=СН-СН=СН2
Н2С─СН─СН─СН2
2. р,π-сопряжение.
Винилхлорид или хлорвинил.
sp2 sp2 sp2
Пр: Н2С=СН-Cl
У атома хлора неспаренный электрон идёт на образование σ-связи с атомом углерода, и у него имеются три неподелённые электронные пары.
Гибридизация гетероатомов зависит от валентного состояния атома углерода, с которым он связан. Т.к. все атомы в sp2 состоянии, значит все σ-связи лежат в одной плоскости.
Между π-связью и р-атомной орбиталью возникает сопряжение, следовательно образуется единое π-электронное облако.
 В
этом облаке движется (делокализованно) 4 электрона.
В
этом облаке движется (делокализованно) 4 электрона.
Электроны, после делокализации (слияния орбиталей), идут в сторону меньшей электронной плотности (т.е. движение электронов будет идти от р-облака к π-связи) π←р. р,π-сопряжение изображается изогнутой стрелкой, направленной от неподелённой электронной пары к середине σ-связи:
![]()
Н2С=СН─Cl
3. π,р-сопряжение.
Оно характерно для карбкатионов, т.е. катионов, у которых положительный заряд находится на атоме углерода.
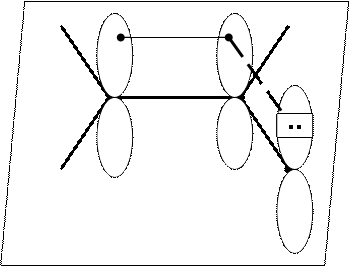
Пр: аллильный карбкатион, который образуется при взаимодействии хлористого аллила с катионами серебра:
sp2 sp2 sp3 sp3 Ag+ sp2 sp2 + sp2
![]()
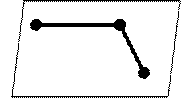
![]() Н2С=СН─СН2→
Cl Н2С=СН─СН2
Н2С=СН─СН2→
Cl Н2С=СН─СН2
хлористый аллил -AgCl аллильный
карбкатион
Если атом углерода образует три σ-связи, то он находится в sp2 валентном состоянии.
Электронное строение (схема образования π-связи):
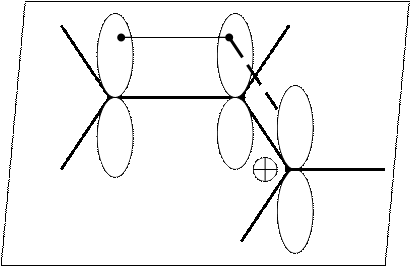
р-орбиталь третьего атома углерода – свободна и не несёт электроны.
В результате делокализации единое π-электронное облако содержит 2 электрона:
 Делокализация электронов будет идти
от π-связи к р-атомной орбитали и называется π,р-сопряжением.
Делокализация электронов будет идти
от π-связи к р-атомной орбитали и называется π,р-сопряжением.
![]()
![]() π→р В формуле его изображают изогнутой стрелкой,
направленной от середины π-связи к середине σ-связи:
+
π→р В формуле его изображают изогнутой стрелкой,
направленной от середины π-связи к середине σ-связи:
+
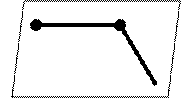
![]() Н2С=СН─СН2
Н2С=СН─СН2
Ароматические соединения.
Наибольшей устойчивостью к реакциям присоединения обладают соединения имеющие круговую сопряжённую систему типа бензола – ароматические соединения.
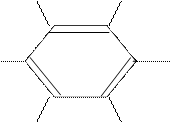
 В молекуле бензола все атомы находятся в sp2 валентном состоянии, следовательно все σ-связи
лежат в одной плоскости:
В молекуле бензола все атомы находятся в sp2 валентном состоянии, следовательно все σ-связи
лежат в одной плоскости:
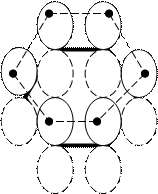
С современных позиций строение бензола рассматривается так:
Каждый атом углерода имеет негибридизованную р-
формула Кекуле орбиталь, содержащую 1 неспаренный электрон. Каждая р-орбиталь перекрывается с двумя соседними, в результате чего, образуется единое π-электронное облако, в котором 6 электронов делокализованны в поле 6 ядер атомов. Есопр.= 227,8 кДж/моль.
Сопряжение круговое, все связи равной длины. Происходит выравнивание π-электронной плотности. Равномерное распределение электронной плотности приводит к повышению энергии делокализации. Она велика! И чтобы её преодолеть, нужно затратить больше энергии, чем для разрыва σ-связи С-Н.
Следовательно, реакции электрофильного присоединения у бензола идут трудно, только в специальных условиях при жёстком УФ-освещении (кварцевые лампы). А вот реакции замещения идут легко. Эта особенность химического строения бензола называется ароматичностью.
Современная структурная формула бензола:

Раньше считали, что все ароматические соединения содержат бензольное кольцо. В середине 20-го века английские учёные: Робертсон, Ингольд, Хюккель и др., изучая различные ароматические соединения пришли к выводу, что для проявления ароматических свойств не обязательно наличие бензольного кольца, но все ароматические соединения должны отвечать трём правилам, которые назвали критерии ароматичности:
1. соединение обязательно должно быть цикличным;
2. все атомы образующие цикл должны находиться в sp2-валентном состоянии, т.е. σ-связи в одной плоскости, а р-орбитали должны быть параллельны друг другу. Т.о. цикл должен быть плоским (система копланарна);
3. количество π-электронов в едином π-электронном облаке должно подчиняться правилу Хюккеля, т.е. отвечать формуле: π= 4n + 2, где π- число электронов в π-облаке, а n- целое число (0,1,2…. ).
Пр:
1) нафталин
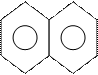 1)
циклическое соединение;
1)
циклическое соединение;
2) все атомы в sp2-состоянии, следовательно σ-связи в одной плоскости, а р-орбитали перпендикулярны ей и параллельны друг другу, система плоская;
3) 10 = 4n + 2
n = 2.
Вывод: соединение ароматично.
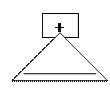 2)
циклопропенильный карбкатион
2)
циклопропенильный карбкатион
1) +
2) +
3) 2 = 4n + 2
n = 0.
Вывод: соединение ароматично.
3) циклопентадиенильный карбанион
 1)
+
1)
+
2) +
3) 6 = 4n + 2
n = 1.
Вывод: соединение ароматично.
4) циклооктатетраен-1,3,5,7
 1)
+
1)
+
2) +
3) 8 = 4n + 2
n = 1,5.
Вывод: соединение не ароматично.
Позже было выяснено, что цикл не плоский и образование единого π-электронного облака не возможно:
Гетероциклические соединения.
Это соединения, содержащие в цикле гетероатом: N, O, S.
N-содержащие:
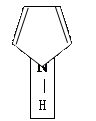
1) пиррол:
 1)
+
1)
+
2) +
3) 6 = 4n + 2
n = 1
Вывод: соединение не ароматично.
У атома азота 5 электронов на внешнем уровне. Три неспаренных образовали σ-связи с 2 С и Н.
Где? На какой атомной орбитали находится неподелённая электронная пара?
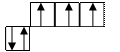 N 3sp2
гибридные орбитали + рz, т.е. у атома азота есть две возможности распределить
электроны по орбиталям:
N 3sp2
гибридные орбитали + рz, т.е. у атома азота есть две возможности распределить
электроны по орбиталям:
1 способ: (А) 11 способ: (В)


Т.к. атом азота образует 3 σ-связи, а гибридные орбитали могут образовать только σ-связи, следовательно распределение электронов соответствует схеме 1 (А). Формула пиррола верно написана.
 Значит атом азота, у которого неподелённая электронная
пара находится на р-орбитали, называется пиррольный атом азота.
Он способен отдавать электроны в р,π-сопряжение.
Значит атом азота, у которого неподелённая электронная
пара находится на р-орбитали, называется пиррольный атом азота.
Он способен отдавать электроны в р,π-сопряжение.
Задача:
Сравнить электронную плотность в молекулах бензола и пиррола.
N ∣ H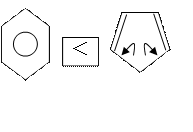
У бензола 6 р-электронов движутся в поле
6 ядер атомов, а у пиррола 6 электронов движутся в поле 5 ядер. Следовательно,
электронная плотность пиррола выше. В реакции Электрофильного замещения легче
будет вступать пиррол, чем бензол.
Пиррол называют π-избыточной системой по сравнению с бензолом. Пиррольный атом азота активирует ароматическое кольцо, т.е. облегчает в нём реакции электрофильного замещения.
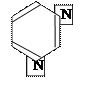
2) пиридин
 Его
электроны располагаются по схеме 11 (В).
Его
электроны располагаются по схеме 11 (В).
У пиридинового атома азота неподелённая электронная пара находится на гибридной орбитали (sp2) и в сопряжении не участвуют.
В молекуле пиридина 6 р-электронов движутся в поле 6 ядер атомов, но в отличие от бензола содержащего одинаковые атомы углерода, в пиридине имеется атом азота, который более электроотрицателен, чем атом углерода. Поэтому атом азота сдвигает электронную плотность к себе и понижает её в трёх положениях кольца (α, β, γ).
Таким образом это π-недостаточная система. Реакции замещения протекают труднее, чем у бензола, т.к. пиридиновый атом азота инактивирует ароматическое кольцо, особенно в положениях α, α, γ. А реакции будут идти в β – положения.
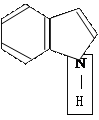
В живых системах встречаются:
индол имидазол пиримидин
(входит в состав а/к ТРИ) ( а/к-ГИС) (нуклеиновые кислоты)
пурин
(нуклеиновые кислоты)
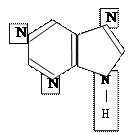 Пурин и пиримидин являются предшественниками для построения нуклеиновых
оснований – пуриновых (А,Г) и пиримидиновых (Ц,Т,У). Они входят в состав РНК и
ДНК, которые являются генетическим материалом клетки. Нуклеиновые кислоты
должны хранить наследственную информацию и передавать её следующим поколениям в
неизменном виде.
Пурин и пиримидин являются предшественниками для построения нуклеиновых
оснований – пуриновых (А,Г) и пиримидиновых (Ц,Т,У). Они входят в состав РНК и
ДНК, которые являются генетическим материалом клетки. Нуклеиновые кислоты
должны хранить наследственную информацию и передавать её следующим поколениям в
неизменном виде.
Генетический материал должен обладать устойчивостью к действию химических факторов, поступающих с пищей; к окислителям (О2); к излучению. Их реакционная способность снижена к реакциям присоединения благодаря ароматичности (сопряжение) и к реакциям замещения за счёт пиридинового атома азота.
Задача:
Объяснить, на примере порфина почему гем является сопряжённой системой.
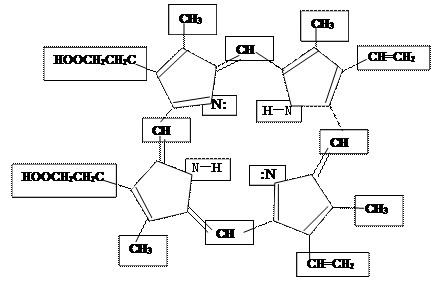
ПОРФИН
Из порфина образуется гем, если прибавить железо. А гем связывается с белком глобином и получается гемоглобин.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.