
Внедрение технологии «БиС» на уроках
химии
Учитель химии: Нсамбекова О.А.
КГУ «СОШ №10»
«Технология дает результат не тем, кто ее знает,
а тем, кто ее освоил и научился применять».
Как сделать урок качественным? Какие формы работы действительно могут показать рост качества знаний ученика? Как добиться максимальных результатов от вложенных учителем усилий? Эти и другие вопросы, и поиск их решения волнуют каждого, кто работает в школе.
Химия лежит в основе промышленного прогресса, и поэтому довольно распространенным является мнение, что главная ценность химии заключена в ее практических приложениях. Суть деятельности учителя это – высокие результаты. С сентября 2015-2016 учебного года я работаю по внедрению технологии «БиС» в процесс обучения на уроках химии. Не сразу, по частицам складывается мой опыт.
Скажи
мне – и я забуду,
Покажи мне – и я запомню,
Вовлеки меня – и я пойму.
(Древняя китайская мудрость)
Ранее для меня эти слова звучали лишь как хорошие мудрые слова, с которых, некоторые учителя начинали речь на семинаре или на заседании методического совета. Но теперь же, это звучит как девиз для каждого урока, проводимого по технологии «БиС». Технология «БиС» предлагает решение задач, которые ставит перед собой каждый учитель, который стремится не только дать знания своим ученикам, но и развить в них умения и навыки логического мышления и способов самостоятельного решения поставленной перед ними задачи.
Моей главной целью внедрения данной технологии является получение высоких результатов в работе. Для этого были поставлены следующие задачи:
1. Повысить интерес и привить любовь к предмету.
2. Расширить химический кругозор.
3. Оживить и сделать более интересным преподавание “сложной” химии.
4. Развитие логического мышления.
Данная технология раскрыла для меня следующие границы обучения:
1) Позволила мне уменьшить время на написание поурочных планов;
2) Реализовала дифференцированный подход к учащимся;
3) Дала новые и удобные измерители;
4) Объективность контроля и оценки результатов обучения;
5) Развивает у учащихся продуктивные, творческие функции мышления, интеллектуальные способности, формирует операционный стиль мышления.
При условии систематического использования технологии в учебном процессе в сочетании с традиционными методами обучения можно значительно повысить эффективность обучения. У меня уже есть опыт внедрения технологии «БиС» во всех параллелях классов (с 8 по 11). Кроме того, у меня хороший опыт проведения срезов знаний по методическим рекомендациям автора данной технологии, по итогам завершения изучения главы или целого раздела.
Одно из основных условий технологии «БиС» - участие на уроке всех учеников, при этом требуется введение в учебный процесс специальных средств управления – технологических карт. Я работаю по технологическим картам (УУ№1 и алгоритм), которые состоят из учебных элементов. Учебные элементы представляются в виде тренажёров. Составила свои ФРСы и ОСУДы. В дальнейшем, думаю, выпустить УМК по химии.
Педагогическая инновация - намеренное качественное или количественное изменение педагогической практики и повышение качества образовательного процесса. Сегодня наиболее очевиден тот факт, что новое качество образования невозможно получить, решая педагогические проблемы устаревшими методами. Требуются другие стратегии школы, созвучные нашему времени, новые инновационные технологии.
Хочу поделится с Вами своим опытом изучения и внедрения новой технологии «Биоинформатика и синергетика». Урок в 8 классе, проводимый по технологической карте алгоритм.
Урок №38. Тема. Закон Авогадро. Молярный объём газа.
Карта Алгоритм.
Анализ эффективности работы по карте Алгоритм:
|
Количество учащихся |
Уровень |
Результат |
Практический результат |
|
До 7 |
впс |
Высокий уровень задолженностей по навыкам. Низкий уровень предметной компетентности учителя. |
|
|
От 7 до 14 |
впс |
Средний уровень задолженностей по навыкам. Средний уровень предметной компетентности учителя. |
|
|
От 14 и выше |
впс |
Низкий уровень задолженностей по навыкам. Высокий уровень предметной компетентности учителя. |
|
Цель:- применение алгоритма при решении задач по химической формуле вещества; закрепить навыки работы с алгоритмами.
- достичь качественного усвоения новой темы максимальным количеством учащихся; определить уровень задолженности по ЗУН; выявить и устранить недостатки в объяснении новой темы; выработать интерес и мотивацию к качественному усвоению предмета, как критерий успешного человека.
Задача: выполнение регламента технологической карты.
Планируемый результат: достижение поставленной цели.
Учебное занятие по изучению и первичному закреплению нового материала имеет следующую логику:
|
1. |
Орг. момент |
Домашняя работа не проверяется это новая тема. Мотивация учащихся как класс команды. |
Объясняется порядок работы по карте. Для активизации класса дается слово лидеру. |
|
2. |
1 цикл «ПРОБА» Актуализация субъектного опыта учащихся. |
Первое объяснение по схеме ОСУД. Схемы на каждой парте. |
В 1 – первое время объяснения. Записать на доске. |
|
3. |
Организация восприятия |
Учащиеся: 1 хлопок. Записывают слово ПРОБА. Выполняют задания. Учитель: Анализ степени усвоения учебного материала после первого объяснения. |
Окончание работы по схеме 5 + 30. |
|
4. |
Организация осмысления. Рефлексия. |
Сигнал «Ручка в руках – ошибка». Учащиеся обмениваются тетрадями. Поэтапно выполняется проверка заданий. На каждом уровне отдельно определяется качество исполнения. На доске заносятся результаты. |
Ответы заносятся на доску поочередно. |
|
5. |
2 цикл. Актуализация субъектного опыта учащихся. |
Второе объяснение. Учитель опрашивает класс и начинает новое объяснение по схеме ОСУД по допущенным ошибкам. |
В 2 – второе объяснение. В 2 = В 1 / 2. |
|
6. |
Организация восприятия. |
Учащиеся: 2 хлопка. Записывают слово ЗАКРЕПЛЕНИЕ. Выполняют задания. Учитель: Анализ степени усвоения учебного материала после второго объяснения.
|
Три задания. По схеме 5+ 30. |
|
7. |
Организация осмысления. Рефлексия. |
Сигнал «Ручка в руках – ошибка». Учащиеся обмениваются тетрадями. Поэтапно выполняется проверка заданий. На каждом уровне отдельно определяется качество исполнения. На доске заносятся результаты. |
Ответы заносятся на доску поочередно. |
|
8. |
3 цикл ПАМЯТЬ. Актуализация субъектного опыта учащихся. |
Третье объяснение. Учитель опрашивает класс и начинает новое объяснение по схеме ОСУД по допущенным ошибкам. |
В 3 – третье объяснение. В 3 = В 2 /2. |
|
9. |
Организация восприятия. |
Учащиеся: 3 хлопка. Записывают слово ПАМЯТЬ. Выполняют задания. Учитель: Анализ степени усвоения учебного материала после третьего объяснения. |
Три задания. По схеме 5+ 30. |
|
10. |
Организация осмысления. |
Сигнал «Ручка в руках – ошибка». Учащиеся обмениваются тетрадями. Поэтапно выполняется проверка заданий. На каждом уровне отдельно определяется качество исполнения. На доске заносятся результаты. |
Ответы заносятся на доску поочередно. |
|
11. |
Рефлексия. |
Определяется уровень усвоения материала и схемы ОСУД классом. Определяется группа экспертов в карте БИОИНТЕРНЕТ. Дается прогноз времени работы по данной теме. Если нет уроков по карте БИОИНТЕРНЕТ в этот день, то дается задание на дом: умение решать задания и комментировать свои действия по схеме ОСУД. |
Количество заданий на дом должно быть не менее 10. |
|
12. |
Примечание. |
Если класс вышел на уровень 63% то данная тема считается завершенной. |
|
|
1 |
Нпс ≥ 63% |
Ппс ≤ 63% |
Впс ≤ 63% |
Нпс |
Нпс |
Ппс |
|
2 |
Нпс ≥ 63% |
Ппс ≥ 63% |
Впс ≤ 63% |
Ппс |
Ппс |
Впс |
|
3 |
Нпс ≥ 63% |
Ппс ≥ 63% |
Впс ≥ 63% |
Ппс |
Впс |
Впс |
|
4 |
Нпс ≥ 63% |
Ппс ≤ 63% |
Впс ≥ 63% |
Ошибка расчетов. |
||
Материалы к уроку.
Краткое объяснение учителя.
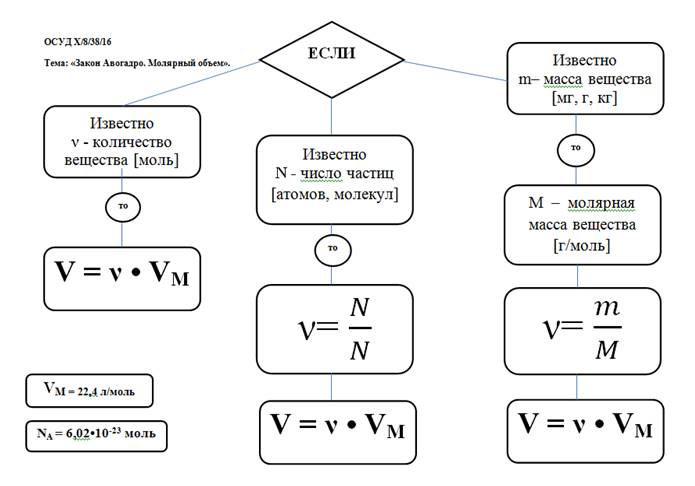
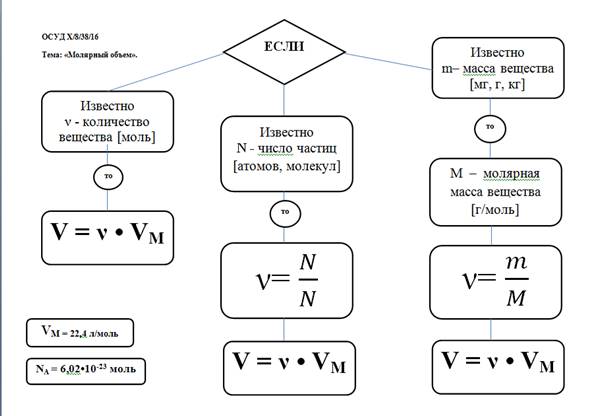
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.):
|
Vm = 22,4 л/моль н.у. = 1амт (101325 Па), t = 0 ˚C (273 К)
|
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
υ = V / Vm = N / Na = m / M
M = ρVm
Задача №1
Образец: Какой объем занимает 0,2 моль N2 при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль ν (N2) = 0,2 моль |
Решение: ν (N2) = V(N2 ) / Vm , следовательно
V (N2 ) = ν (N2) · Vm = = 0,2 моль · 22,4 л / моль = 4,48 л
|
|
Найти: V - ? Ответ: V (N2 ) = 4,48 л |
Задача №2
Образец: В каком объеме содержится 3·1023 молекул водорода Н2 при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль N = 3·1023 молекул Na = 6,02 ·1023 моль-1 |
Решение: ν (Н2) = V(Н2) / Vm , следовательно
V (Н2 ) = ν (Н2) · Vm
Неизвестное количество вещества найдём по формуле: ν = N / Na = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль
V (Н2 ) = ν (Н2) · Vm = 0,48 моль · 22,4 л/моль = 10,752 л |
|
Найти: V - ?
Ответ: V (Н2 ) = 10,752 л |
Задача №3
Образец: Какой объем займут 56 г. газа СО при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль m (CO) = 56 г |
Решение: ν (CO) = V(CO) / Vm , следовательно V (CO ) = ν (CO) · Vm
Неизвестное количество вещества найдём по формуле: ν = m/M
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л |
|
Найти: V - ?
Ответ: V (CO ) = 44,8 л |
ФРС Х/8/38/16 Тема. Закон Авогадро. Молярный объем газа.
|
№ |
НПС |
ППС |
ВПС |
|
1 |
Какой объем занимают 5 моль О2 при н.у.? |
В каком объеме содержится 12,04 ·1023 молекул углекислого газа - СО2 при н.у.? |
Какой объем займут 4 г. газа О2 при н.у.? |
|
2 |
Какой объем занимают 2,5 моль Н2 при н.у.? |
В каком объеме содержится 3,01·1023 молекул кислорода - О2 при н.у.? |
Какой объем займут 256 г. газа SО2 при н.у.? |
|
3 |
Определите объем (н.у.) 0,5 моль хлороводорода (НСl). |
Определите объем (н.у.) 0,6*1023 молекул кислорода. |
Определите объем (н.у.) 4 г водорода. |
|
4 |
Какой объем (н.у.) занимает кислород количеством вещества 1,5 моль? |
Определите объем (н.у.) 9,03*1023 молекул водорода. |
Определите, какой объем (н.у.) займет углекислый газ массой 132 г. |
8 класс. Тема. Закон Авогадро. Молярный объем газа. Решите задачи для закрепления:
ОСУД к уроку №38.
В этом учебном году была проведена исследовательская работа по этапам внедрения технологической карты «алгоритм». Исследование показало хорошие результаты при сравнении экспериментального и контрольного классов.
Тема исследования: «Анализ эффективности работы по карте алгоритм».
Цель:
- достижение качественного усвоения типовых расчетных задач максимальным количеством учащихся;
- выработка интереса и мотивации к качественному усвоению предмета.
Задачи:
1). Определить контрольный и экспериментальный классы для проведения сравнительного анализа.
2). Разработать дидактические материалы для проведения исследования.
3). Провести серию уроков по технологической карте «Алгоритм» с последующим анализом эффективности.
Планируемый результат: достижение поставленной цели.
Объекты исследования: контрольный класс – 8 «Б», экспериментальный класс – 8 «А».
Материалы: ОСУДы: Х/8/38/16, Х/8/45/16, Х/8/49/16; ФРСы: Х/8/38/16, Х/8/45/16, Х/8/49/16; КТП по химии 8 класс.
Использованная литература:
1. Вассерман Ф.Я. Методическое пособие учителя «Технология управления качеством в общеобразовательной школе «Биоинформатика и синергетика» - 2013 г.
2. Темирбулатова А.Е. Химия: Сборник задач и упражнений, 8 класс. – Алматы: «Мектеп», 2013 г.
Урок №1.
Тема. Закон Авогадро. Молярный объем газов.
Для данного урока был разработан ОСУД (обобщенные способы учебной деятельности), который является стандартом для всех учащихся и способствует повышению качества объяснения учителем и усвоения знаний учениками. В схеме ОСУД учтены психофизические особенности усвоения информации: запоминание 5-7 объектов; 10% устная информация; 90% визуальная информация. Каждый ОСУД вмещают в себя несколько тем или типов задач и обобщает их. Главная цель ОСУДа – передать учащимся ход мышления и последовательность действий.
ФРС Х/8/38/16 Тема. Закон Авогадро. Молярный объем газа.
|
№ |
НПС |
ППС |
ВПС |
|
1 |
Какой объем занимают 5 моль О2 при н.у.? |
В каком объеме содержится 12,04 ·1023 молекул углекислого газа – СО2 при н.у.? |
Какой объем займут 4 г. газа О2 при н.у.? |
|
2 |
Какой объем занимают 2,5 моль Н2 при н.у.? |
В каком объеме содержится 3,01·1023 молекул кислорода – О2 при н.у.? |
Какой объем займут 256 г. газа SО2 при н.у.? |
|
3 |
Определите объем (н.у.) 0,5 моль хлороводорода (НСl). |
Определите объем (н.у.) 0,6*1023 молекул кислорода. |
Определите объем (н.у.) 4 г водорода. |
|
4 |
Какой объем (н.у.) занимает кислород количеством вещества 1,5 моль? |
Определите объем (н.у.) 9,03*1023 молекул водорода. |
Определите, какой объем (н.у.) займет углекислый газ массой 132 г. |
Для эффективной отработки функциональных навыков и ЗУН, необходимы учебные задания, разбитые по уровням сложности. Для этого, разработана методика дифференцированных учебных заданий – ФРС (формула расчеты сложности), состоящая из трех уровней сложности: нижний НПС, промежуточный ППС, высший ВПС. Перед вами пример построения заданий. Главным условием при составлении ФРС является отличие между уровнями заданий на один шаг или операцию.
Урок №2.
Тема. Вычисления по химическим уравнениям.
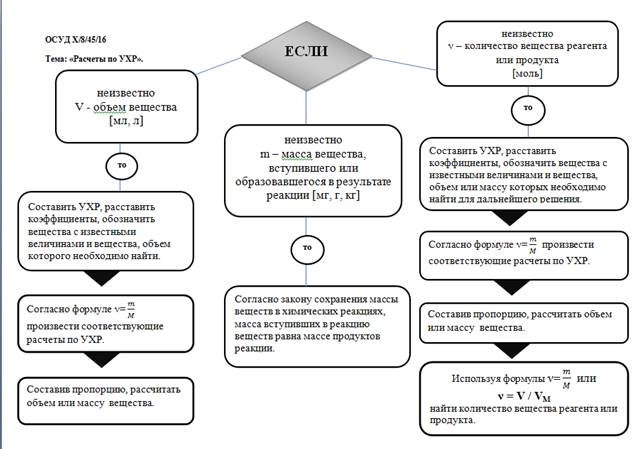
ФРС Х/8/45/16 Тема. Вычисления по химическим уравнениям.
|
№ |
НПС |
ППС |
ВПС |
|
1 |
При взаимодействии 40 г оксида меди CuO (II) с водородом: CuO + Н2 = Cu + Н2О образуются 32 г меди и 9 г воды. Найдите массу прореагировавшего водорода. |
Вычислите объем (н.у.) кислорода, необходимый для окисления 3,1 г фосфора. |
Рассчитайте количество вещества оксида алюминия, который образуется в реакции окисления кислородом 48 г алюминия: 4Al + 3O2 = 2Al2O3 |
|
2 |
При разложении 2,45 г бертолетовой соли KClO3 образовалось 1,49 г хлорида калия KCl: 2KClO3 = 2KCl + 3O2 Найдите массу выделившегося при этом кислорода. |
В результате реакции восстановления CuO + Н2 = Cu + Н2О Образовалось 4 г меди. Сколько литров водорода вступило в реакцию? |
В результате реакции взаимодействия красного фосфора с кислородом образуется оксид фосфора (V) – вещество белого цвета: 4P + 5O2 = 2P2O5. Сколько молей кислорода вступает в реакцию с 3,1 г фосфора? |
|
3 |
При взаимодействии 2,8 г железа с серой образовалось 4,4 г сульфида железа (II) FeS. Определите сколько грамм серы должно вступить в реакцию: Fe + S = FeS. |
Для приготовления пищи израсходовано 440 г пропана С3Н8. Найдите объем образовавшегося углекислого газа СО2 по уравнению реакции: С3Н8 + 5О2 = 3СО2 + 4Н2О. |
Рассчитайте количество серы, необходимой для получения образца сульфида натрия Na2S массой 5 г. 2Na + S = Na2S. |
Урок №3.
Тема. Вычисления, связанны с растворами.
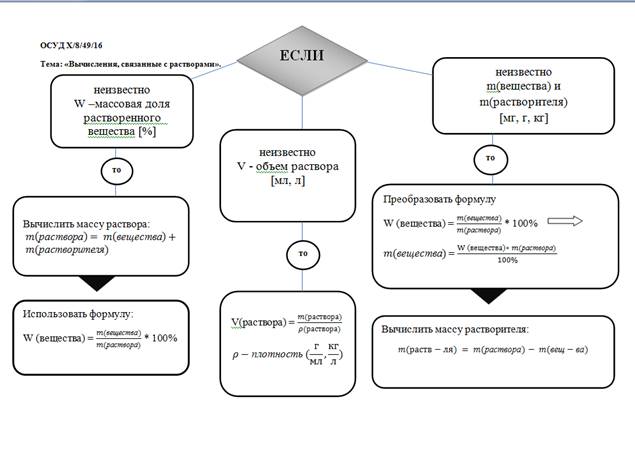
ФРС Х/8/38/16 Тема. Вычисления, связанные с растворами.
|
№ |
НПС |
ППС |
ВПС |
|
1 |
Вычислите объем раствора серной кислоты Н2SО4 массой 150 г и плотностью 1,08 г/см3. |
В 180 г воды растворено 20 г соли. Определите массовую долю соли в растворе. |
Сколько граммов соли и воды нужно взять для приготовления 120 г 20%-го раствора. |
|
2 |
Вычислите объем раствора уксусной кислоты СН3СООН массой 0,5 кг и плотностью 1 г/см3. |
Рассчитайте массовую долю соли (%) в растворе, полученном при растворении 30 г соли в 170 г воды. |
Сколько граммов соли и воды нужно взять для приготовления 250 г 25%-го раствора. |
|
3 |
Рассчитайте объем раствора этилового спирта С2Н5ОН массой 245 г и плотностью 0,8 г/см3. |
Определите массовую долю сахара в растворе, который образуется при растворении двух столовых ложек сахара (40 г) в 1 л воды. |
Сколько граммов соли и воды нужно взять для приготовления 1070 г 27%-го раствора. |
Итоговый срез знаний по химии.
Решение типовых расчетных задач по химии за курс 8 класса.
ФРС Х/51/8/16 Тема. Молярный объем газа. Вычисления по химическим уравнениям.
Вычисления, связанные с растворами.
|
№ |
НПС |
ППС |
ВПС |
|
1 |
Определите объем (н.у.) 0,5 моль хлороводорода (НСl). |
Сколько граммов соли и воды нужно взять для приготовления 120 г 20%-го раствора. |
Рассчитайте количество вещества оксида алюминия, который образуется в реакции окисления кислородом 48 г алюминия: 4Al + 3O2 = 2Al2O3 |
|
2 |
В каком объеме содержится 3,01·1023 молекул кислорода - О2 при н.у.? |
Рассчитайте массовую долю соли (%) в растворе, полученном при растворении 30 г соли в 170 г воды. |
В результате реакции восстановления CuO + Н2 = Cu + Н2О Образовалось 4 г меди. Сколько литров водорода вступило в реакцию? |
|
3 |
Определите объем (н.у.) 4 г водорода. |
Рассчитайте объем раствора этилового спирта С2Н5ОН массой 245 г и плотностью 0,8 г/см3. |
При взаимодействии 2,8 г железа с серой образовалось 4,4 г сульфида железа (II) FeS. Определите сколько грамм серы должно вступить в реакцию: Fe + S = FeS. |
Сравнительный анализ ЗУН по результатам серии уроков и итогового среза.
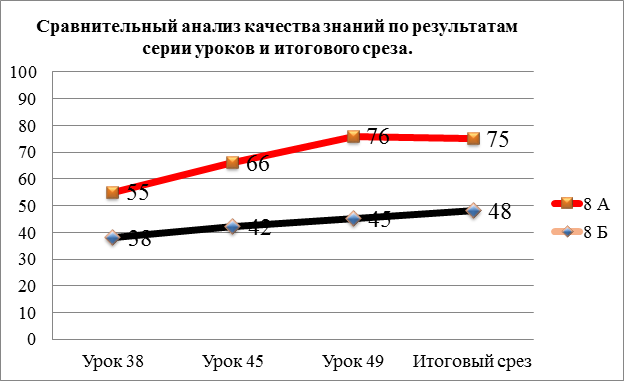
Сравнительный анализ показал рост качества ЗУН в экспериментальном классе, где самое максимальное значение 76%. Количество отличников и хорошистов увеличилось на 20%. При сравнении результатов с контрольным классом была выявлена разница 27%.
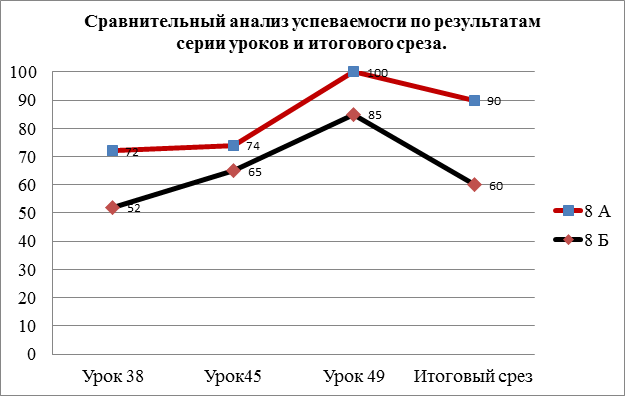
Данный анализ на диаграмме также показывает рост уровня успешности в экспериментальном классе, где самое максимальное значение 100%. Количество успевающих увеличилось на 18%. При сравнении результатов с контрольным классом была выявлена разница 30%.
Выводы по результатам исследования.
Свой опыт внедрения хочу представить в виде современного SWOT – анализа, который отражает сильные и слабые стороны внедрения технологии «БиС» в нашей школе, а также перспективные возможности и некоторые угрозы технологического эффекта.
|
Сильные стороны |
Слабые стороны |
|
1. Администрация школы получили сертификат о повышении квалификации по технологии БиС. 2. Разработано подробное руководство по качеству по всем базовым процессам. 3. Отход от традиционного урока и переход на технологических карты урока. 4. 11 технологических карт урока по основным 5 типам учебных занятий. 5. Разработаны уникальные объективные измерители и независимая оценка качества. 6. Охват учащихся на уроке 100%. 7. Качество знаний на уроке по оценкам 4 и 5 до 80%. 8. Высокая и позитивная мотивация учащихся. 9. Учитель получает готовый материал и не готовит поурочное планирование. 10. Разработаны уникальные учебные пособия по всем базовым предметам с тремя уровнями сложности от простого к сложному. 11. Норматив качества составляет 63% учащихся, которые должны получить оценки 4 и 5. 12. Обучение и рост квалификации учителей без отрыва от работы. 13. Воспитание системное, нацеленное на раскрытие личности, успешность и раннюю профориентацию учащихся. 14. Доверительная форма воспитания в рамках делегирования учащимся полномочий и ответственности в управлении школой. 15. Раскрытие талантов и творческого начала учащихся. 16. Определены основные направления развития мышления: скорость, внимание, оперативная память, логика, словарный запас. 17. Разработано и внедрено электронное управление процессом на базе сайта, который позволяет решать различные задачи. 18. В течении года проводятся бесплатные обучающие семинары и открытые уроки.
|
1. Нет функциональной единицы – «главный технолог». 2. Не 100% охват учителей прошедших курсы повышения квалификации по технологии «БиС». 3. Большой процент незаинтересованных родителей в успехах своих детей. 4. Разработаны дифференцированные учебные пособия по всем основным предметам, но не для всех классов. 5. Постепенный, а иногда длительный процесс освоения технологической картой урока учителем и учащимися.
|
|
Возможности |
Угрозы |
|
1. Заключение договора с ТОО Научно-Внедренческий Центр «Образовательный технопарк». 2. Дополнительное финансирование школы до 2 млн. 3. Повышение квалификации учителей. Выдается
соответствующий сертификат о прохождении 24 часового курса обучения по
технологии БиС. 4. В технологии есть три уровня классификации учителя: «классик», «мастер», «профи». 5. НИШ наш стратегический партнер. Было показано, что в технологии БиС есть все модули, необходимые для организации работы учителя на уроке по требованиям программы обучения учителей прошедших курсы НИШ. 6. Показатели ЕНТ и ВОУД повысятся настолько, насколько вы сможете активно внедрить технологию БиС. 7. Если кто - то из учителей работает так, как он считает нужным и дает качество соответствующее нашим измерителям, то никто не должен ему навязывать технологию БиС. 8. Использовать технологию может любой учитель, независимо от стажа или категории. |
1. Не все учителя четко выдерживают режим технологической карты. 2. Видимая жесткая дисциплина. 3. Отставание по времени КТП. 4. В каждом классе остаются учащиеся с критическим уровнем мотивации по нескольким предметам. |

Объяснение нового материала учителем

Самостоятельное выполнение заданий учащимися 8 класса

Переход к следующему этапу работы
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.