
ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ДЕНСАУЛЫҚ САҚТАУ МИНИСТРЛІГІ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ КАЗАХСТАН
ҚОСТАНАЙ ЖОҒАРЫ МЕДИЦИНАЛЫҚ КОЛЛЕДЖІ
КОСТАНАЙСКИЙ ВЫСШИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ

Бекітемін
ОЖ жөніндегі директордың
орынбасары___________
20__ж. «____» _______
ДӘРІС КЕШЕНІ
ЛЕКЦИОННЫЙ КОМПЛЕКС
Пәнінен/Дисциплины/модуля: код "Химия"
Мамандығы/Специальность: 0305000 «Лабораторная диагностика»
Біліктілігі/Квалификация: 0305013 "Медицинский лаборант"
Курс/Курс: 1
Семестр/Семестр:
Жалпы сағат саны/Общая трудоемкость всего часов/кредитов KZ
Қостанай, 2021 ж.
Лекционный комплекс дисциплины/модуля составлен преподавателем Чапаксин И.В. бакалавр химии (ФИО, ученая степень, ученое звание)
На основании рабочей учебной программы по специальности
0302043 «Медицинская сестра общей практики»
Рассмотрен и рекомендован на заседании ЦМК 1
от «28 » августа 2020 г., протокол № _____
Председатель ЦМК ____________ ____________________
(подпись) ( ФИО )
Лекционный комплекс включает следующие разделы:
4.1. Тема.
4.2. Цель.
4.3. Тезисы лекции.
4.4. Иллюстративный материал.
4.5. Литература.
4.6. Контрольные вопросы (обратная связь)
|
№ |
Название этапа занятия |
Теоретическое занятие (лекция, комбинированное занятие, мин.) |
|
1 |
Организационный момент: а) организация рабочей обстановки на занятий б) определение целей и задач занятия |
15 минут |
|
2 |
Актуализация опорных знаний по пройденной теме (методы и приемы ) - тест |
20 минут |
|
3 |
Изложение нового материала (план лекции) А) Апробация полученных знаний по ПСХИ; Б) Применение ранее полученных знаний о строении вещества; В) С помощью программы ChemLab провести лабораторные опыты по ЗСМ, З-А, ЗПВ . |
125 минут |
|
4 |
Закрепление пройденного материала (методы и приемы): А) Собеседования; Б) Виртуальный лабораторный опыт; |
25 минут |
|
5 |
Итоговый этап занятия: а) оценивание учащихся б) задание на дом |
15 минут |
|
|
|
200 минут |
4.1. Тема: Стехиометрические законы химии
4.2. Цель: изучить основные законы химии, интерпретировать знания в апробации на самостоятельную работу
4.4. Иллюстративный материал:
При изучении различных наук возникает вопрос: Каково место науки среди других наук? Какая из них главнее или важнее? И как они между собой соотносятся? Существует множество методов оценок роли наук. Среди них наиболее объективным методом является расположение и взаимосвязь наук по мере усложнения форм движения материи, предложенная Ф.Энгельсом. Именно определѐнная форма движения материи и является предметом определенной науки. Еще ранее философ Гегель предложил следующую схему: механизм-химизм-организм, которую существенно дополнил и описал Ф.Энгельс. По мере усложнения, формы движения материи располагаются в следующий ряд: физическая, химическая, биологическая и социальная. На примере величины тепловых эффектов, характерных для различных форм движения материи и для соответствующих наук, можно проследить условные границы фундаментальных наук.
не изучена
0 10 50 103 106
I социология I биология I химия I I_физика,механика →
∆H,кДж/моль
В каждой науке есть свой предмет изучения, свои законы и своя терминология.
Первая модель атома – 1903 г. (Дж.Томпсон), электроны в положительно-заряженной жидкости.
В 1897 г. он открыл электрон.
В 1911 г. Резерфорд (планетарная модель строения атома)
В 1913 г. Н.Бор – впервые квантовые представления (спектр водорода). Остались классические представления об орбитах и постулаты из-за противоречий с классической электродинамикой.
1. Существуют состояния атома водорода, при которых возможно движение электрона относительно ядра без выделения или поглощения (разрешенные орбитали).
2. При переходе из одного такого состояния в другое атом излучает или поглощает квант энергии.
ΔΕ = Δm·c2 – Эйнштейн ΔΕ = h ∙ ν – Макс. Планк
![]() λ = ℎ
λ = ℎ
𝑚 ∙ 𝑣
- де Бройль
![]() ∆p ∆x ≥ ℎ
∆p ∆x ≥ ℎ
2𝜋
– принцип неопред. Гейзенберга
н![]()
или ∆𝑉
∗ ∆x ≥ ℎ ; для
атомов водорода: 𝑉
𝑚
0,53Ǻ= 0,053 нм.
~ 2000 км/сек, Rн
= 0.53 ∗ 10-10 м =
Возб. Осн.состояние Ридберговские r ~10 -9 м r ~ 10-9м r ~ 10 -6м
Электронные состояния атома (иона) целесообразно разделить на валентные и ридберговские состояния. При этом под валентными состояниями понимаются состояния, соответствующие тем конфигурациям электронной оболочки, в которых главные квантовые числа n всех электронов не превышает значения n валентных электронов в основном состоянии атома. Под ридберговскими состояниями в соответствии с принятой терминологией понимаются состояния, соответствующие таким конфигурациям электронной оболочки, в которых по крайней мере у одного электрона главное квантовое число nбольше, чем у валентных электронов в основном состоянии атома. Энергия ридберговских состояний с удовлюю. точностью может быть определена по уравнению:
i![]()
T = R Z2[ 1
𝑛𝑘𝑖 +∆𝑘𝑖 2
- 1 ]
![]() (𝑛𝑘𝑜
−∆𝑘𝑜 )2
(𝑛𝑘𝑜
−∆𝑘𝑜 )2
Где R – постоянная Ридберга, Z – заряд ядра атома, nki – главное квантовое число к-го электрона в i=ом состоянии, ∆ki – квантовый дефект, являющийся функцией квантовых чисел n и l , в i-ом состоянии.
Литература:
Г.В. Голубев, Г.К.Иванов. Ридберговские состояния атомов и молекул и элементарные процессы с их участием. 2001г.
ХИМИЯ – это наука о веществах, их превращениях и явлениях, сопровождающих эти превращения.
Превращения – это изменение состава и структуры веществ, явления, сопровождающие эти превращения – это выделение или поглощение теплоты, газовыделение, прохождение электрического тока, свечение и другие.
Химическая реакция – это изменение координат ядер атомов во времени и пространстве, сопровождающееся устойчивым перераспределением электронной плотности:
Сгр → Салм ; ɣ - Al2O3 → α – Al2O3 : химические реакции
Обычно в химии изучаются вещества определенного состава и структуры, поэтому существует аналитическая химия с ее набором диагностических методов. В химии изучаются относительно низкоэнергетические превращения при условиях, близких к обычным (Т ≤ (4-5)∙103 oC,
∆H ≤ 1000 кДж/моль , Р ≤ 100МПа, 1000ат.)
Химические свойства вещества – это совокупность химических реакций, в которые они могут вступать. Химические свойства, как и физические свойства – цвет, плотность, твердость, электропроводность, температуры плавления и кипения определяются составом , электронным строением и структурой вещества.
Простое химическое вещество (простое вещество) – это вещество, построенное из атомов одного вида. Или вещество, которое не может быть разложено на другие вещества в условиях химических реакций.
Атом –это мельчайшая частица простого вещества, сохраняющая его основные химические свойства. В физике установлено, что атомы состоят из определенного числа протонов и нейтронов ( кроме атома легкого водорода), входящих в состав ядер и электронов. Количество электронов равно числу протонов, т.е. атом электронейтрален. Именно атом не может быть превращен в другие атомы в условиях химических реакций.
Трансмутация-переход одних элементов в другие при обычных условиях за счет протекания ядерных реакций по механизму туннелирования в течение миллионов лет.Изучается в геохимии и химии планетных атмосфер.
Элемент – это вид атомов, ядра которых содержат одинаковое число протонов. В соответствии с числом протонов каждому элементу присваивается порядковый номер. Каждому элементу присваивается название и символ элемента- это первые одна или две буквы названия. Одновременно символ означает один атом. Например, элемент с порядковым номером 18 – Argon (на латыни), символ Ar – один атом. Элемент с порядковым номером 17 – Chlorum – Cl, Cl2 – два химичеси связанных атомов.
Элемент С – углерод, простые вещества: Сгр, Салм, С поликумулен, Сполиацетилен, Сфуллерон, Снанотрубки О2 ~ О3=О2- - О-2 – О+4 . Аллотропия - существование простых веществ в виде различных кристаллических модификаций.
Сложное химическое вещество (химическое соединение) – вещество, состоящее из двух и более атомов различных химических элементов. Химические соединения могут состоять из групп атомов, отражающих их структуру.
Молекулой химического соединения называют наименьшую его частицу, способную к самостоятельному существованию и обладающую его основными химическими свойствами. Из молекул состоят например, следующие вещества: HCl, NH3, H2O и др. Во многих химических веществах в конденсированном состоянии (жидком и твердом) нельзя выделить молекулы, так как эти вещества состоят из прочно связанных между собой группировок - структурных единиц (CE) – элементарная ячейка, на которые невозможно разделить сложное вещество, не изменив существенно его свойства
(например, кристаллические NaCl, K2SO4, Fe3O4 – структурные единицы- кристаллическая ячейка.
Состав вещества представляют в виде химической формулы, которая указывает на:
1. соотношение между атомами элементов в соединении,
2. их количество в формуле или число атомов в простом веществе. Формула может соответствовать составу молекулы или не соответствовать: Cl и Cl2; P2O3 и P4O6, где сначала дана формула состава вещества, а затем – формула молекулы.
Левкипп и Демокрит- мельчайшие частицы, из которых состоят вещества – атомы (Древняя Греция). алхимики. Ломоносов М.В. (~1747г.) – закон сохранения массы (веса) веществ, закон сохранения энергии. В 1803-1807гг. англ. ученый Дж.Дальтон сформулировал постулаты атомно-молекулярного учения (АМУ).
1. Каждый элемент является совокупностью очень маленьких частиц – атомов7.
2. Все атомы одного элемента химически одинаковы,( но НДТ~ 1.2.3 а.е.м.).
3. Атомы различных элементов обладают различными свойствами, в том числе имеют разные массы (но изотопы U235, U238, U233 и изобары 3070 Zn , 3270Ge).
4. Атомы одного элемента не превращаются в атомы другого элемента в результате химических реакций ( но трансмутация).
5. Химические соединения образуются в результате объединения атомов двух или более элементов.
6. В данном соединении относительные количества атомов различных элементов всегда постоянны (дальтониды (NH3) и бертолиды (TiO2-x)).
Позже эти постулаты были косвенно подтверждены совокупностью стехиометрических законов:
- закон сохранения массы веществ;
- закон сохранения энергии в химических реакциях;
- закон постоянства состава;
- закон кратных отношений;
- закон объемных отношений;
- газовые законы и объединенный газовый закон;
- закон Авогадро;
- закон эквивалентов;
- правило Дюлонга-Пти.
Наука началась с количественных измерений, которые могут воспроизвести другие учѐные.
Химическая стехиометрия – учение о составе веществ и их изменений в ходе химических превращений («стехио» -по гречески – элемент и «метрон» – мера). Законы стехиометрии обычно считают составными частями АМУ. На основании этих законов были введены понятия о химических формулах, химических уравнениях и валентности.
1. Закон сохранения массы – энергии в химических реакциях. Ломоносов М.В. (1756-1759гг). -
В изолированной системе сумма масс и энергий постоянна.
В химии : закон сохранения массы веществ, закон сохранения энергии.
∆Е = ∆m∙c2 – ядерные процессы.
2. Закон постоянства состава (Пруст, 1801-1808гг). Определение: всякое чистое вещество имеет постоянный и неизменный состав независимо от способа получения и места нахождения (дальтониды).
Бертолиды: пределы колебания состава при сохранении кристаллической структуры называют широтой области гомогенности TiO2 → TiO1.9.
3. Закон эквивалентов (Рихтер, Дальтон, Валластон 1804-1814гг). – соединительные веса или эквиваленты. Массы веществ, реагирующих между собой нацело без остатка, относятся как их массы эквивалентов.
𝑚 1
![]()
𝑚 2
= 𝑀э1
![]() 𝑀 э2
𝑀 э2
, SO2
– Mэ
(S) = 8 г/моль, SO3
– Мэ
(S) = 5,3 г/моль
Эквивалент – это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом водорода или с одним электроном.H2O; SO2; P4O10. Масса эквивалента.
4. Закон кратных отношений (Дальтон 1808г) : если два вещества образуют между собой несколько соединений, то количество одного из них, отнесенные к одному и тому же количеству другого относятся как небольшие целые числа.
|
N2O |
NO |
N2O3 |
|
NO2 N2O5 |
|
|
16г/моль |
32 |
|
48 |
64 |
80 |
|
28г/моль |
28 |
|
28 |
28 |
28 |
|
0,57 |
1,14 |
|
1,71 |
2,28 |
2,86 |
|
1 |
2 |
|
3 |
4 |
5 |
Химический эквивалент не является постоянной величиной для элемента с переменной степенью окисления.
5. Закон объемных отношений (для газов) – при одинаковых условиях (Р,Т) объемы реагирующих без остатка газов и объемы газообразных продуктов реакций относятся между собой как небольшие целые числа (коэфф.уравнения хим.реакций),( Гей-Люссак, 1805г).
Газовый анализ :
1. 2N2 + O2 → 2N2O
2. N2 + O2 → 2NO
3. 2N2 + 3O2 → 2N2O3
4. N2 + 2O2 → 2NO2
5. 2N2 + 5O2 → 2N2O5
6. Закон Авогадро (1811г) – это один из основных законов естествознания: в равных объемах различных газов при одинаковых условиях содержится одинаковое количество частиц (молекул или атомов).
Следствие 1. При одинаковых физических условиях моли любых газов имеют равные объемы.
Молярный объем газа при н.у. (ОоС, 760 мм.рт.ст. = 1 атм. = 101325 Па) = 22,4 л/моль.
H2
Следствие 2. Молекулярная масса газообразного вещества равна
удвоенной плотности его по водороду, Перрен (1908-1910гг). Мх = 2∙Дх
No = 6,024 ∙ 1023 моль-1 (СГС) No = 6,024 ∙ 1026 кмоль-1 (СИ)
![]() P ∙ V = n ∙ RT = 𝑚 ∙ R ∙ T
P ∙ V = n ∙ RT = 𝑚 ∙ R ∙ T
𝑀
𝑖
Pоб ∙ Vоб = 𝑘 𝑛𝑖 ∙ R
∙T, для отдельного компонента Pi ∙ Vоб = ni
∙R ∙ T
(общие)
R – универсальная газовая постоянная:
62400 мм.рт.ст. ∙ мл/моль ∙ К 8,314 Па ∙ м3/моль ∙К
0,082 л ∙ атм/моль ∙ К 1,99 кал/моль ∙ К
8. Правило Дюлонга – Пти – эмпирипическое правило, согласно которому теплоемкость твердых тел при постоянном объеме (Cv) и Т ≥ 300К постоянна и равна 6 кал/моль К (26Дж/мольК) приближенно справедлив для большинства простых веществ и не сложных соединений. Используется для определения атомных масс элементов , не образующих летучих соединений, фазовые превращения Cv ∙ Ar ≈ 6.2 (26).
Международная система единиц измерения СИ (7 основных единиц)
- метр (м) – длина
- килограмм (кг) – масса
- секунда (с) – время
- ампер (А) – сила эл.тока
- Кельвин (К) – температура
- Кандела (Кд) – сила света
- моль – количество вещества
![]() (Ar,
Mr):
(Ar,
Mr):
Абсолютная масса Аr(н) = 1,67 ∙ 10-27 кг; Аr(o) = 26,6 ∙ 10-27кг; Ar(c) = 19,93 ∙ 10-27кг.
С 1961г за единицу массы атомов принята 1/12 массы изотопа углерода 12С – углеродная единица (у.е.) или атомная единица массы (а.е.м.). Масса 1 у.е. составляет 1,66 ∙ 10-27кг.
A = .
абсолютная масса атома
𝟏𝟐
r 𝟏 части абс.массы С𝟏𝟐
Ar показывает, во сколько раз масса атома данного элемента больше 1/12 массы атома изотопа 12С. Mr вещества называется масса его молекулы, выраженная в у.е..
Mr (H2SO4): 2H - 2∙ 1.008 = 2.016
S - 1∙ 32.064 = 32.064
4O – 4 ∙ 16.02 = 64.08 / 98,016 ≈98 у.е.(а.е.м).
Количество вещества определяется числом структурных единиц (атомов, молекул, ионов и др.) этого вещества и выражается в молях (моль).
Моль – это количество вещества, содержащее столько структурных единиц, сколько атомов содержится в 12г изотопа 12С. Экспериментально установлено, что в указанном количестве изотопа 12С содержится 6,02∙1023 атомов. Это число или постоянная Авогадро (Na) моль .
Законы Дальтона (1801-1803гг) для химиков
1. Давление смеси химически не взаимодействующих идеальных газов равно сумме их парциальных давлений. Pоб = ∑Pi
2. При постоянной Т растворимость в данной жидкости каждого компонента газовой смеси, находящейся над жидкостью, пропорциональна его парциальному давлению. Каждый газ смеси растворяется так, как будто остальных компонентов нет.
Масса эквивалента, элементы и вещества (реакции обмена и ОВР):
-
![]() масса эквивалента элемента Мэ = 𝐴𝑟 ;
масса эквивалента элемента Мэ = 𝐴𝑟 ;
![]()
![]() 𝑛ē
𝑛ē
М
-
![]() масса эквивалента вещества окислителя или восстановителя: Мэ =
масса эквивалента вещества окислителя или восстановителя: Мэ =
,
![]()
![]() 𝑛ē
𝑛ē
![]() где Ar – масса атома
элемента; М – молярная масса сложного вещества; ne - число
электронов, участвующих в окислении или восстановлении.
где Ar – масса атома
элемента; М – молярная масса сложного вещества; ne - число
электронов, участвующих в окислении или восстановлении.
Реакции обмена, разложения, ОВР, фотохимические.
4.5. Литература:
1. К.Маркс, Ф.Энгельс. Присхождение семьи, частной собственности, государства и права. Соч. 2-е изд. Т.45 – С.227-372.
2. Б.М.Кедров. Классификация наук. Книги 1,2,3.
3. Р.Б.Добротин. Химическая форма движения материи. С-Петербург, 1967г.
4.6. Контрольные вопросы (обратная связь):
Этот вид расчетов чрезвычайно важен для химической
практики, т.к. позволяет на основании экспериментальных данных определить
формулу вещества (простейшую и молекулярную). На основании данных качественного
и количественного анализов химик находит сначала соотношение атомов в молекуле
(или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy,
в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80%
и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их
количества вещества (число молей):
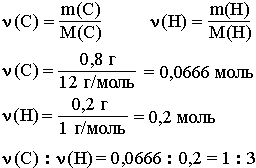
Целые числа (1 и 3) получены делением числа 0,2 на число 0,0666. Число 0,0666 примем за 1. Число 0,2 в 3 раза больше, чем число 0,0666. Таким образом, CH3 является простейшей формулой данного вещества.
Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D.
Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль =
30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой
необходимо удвоить индексы в формуле. Следовательно, молекулярная формула
вещества: C2H6.
Определение формулы вещества зависит от точности математических вычислений. При нахождении значения ν элемента следует учитывать хотя бы два знака после запятой и аккуратно производить округление чисел. Например, 0,8878 ≈ 0,89 но не 1.
Соотношение атомов в молекуле не всегда определяется простым делением полученных чисел на меньшее число. Рассмотрим этот случай на следующем примере.
Задача 1. Установите формулу вещества, которое состоит из углерода (ω=25%) и алюминия (ω=75%).

Разделим 2,08 на 2. Полученное число 1,04 не укладывается целое число раз в числе 2,78 (2,78 : 1,04 = 2,67 : 1). Теперь разделим 2,08 на 3. При этом получается число 0,69, которое укладывается ровно 4 раза в числе 2,78 и 3 раза в числе 2,08. Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно.
Ответ: Al4C3 (карбид алюминия).
Более сложным вариантом задач на вывод формул соединений является случай, когда состав вещества задается через продукты сгорания этих соединений.
Задача 2. При сжигании углеводорода массой 8,316 г образовалось 26,4 г CO2. Плотность вещества при нормальных условиях равна 1,875 г/мл. Найдите его молекулярную формулу.

Расчет массы (объема, количества) продуктов реакции по массе (объему, количеству вещества) исходных веществ и обратные вычисления
Задача. Какую массу углекислого газа можно получить, если сжечь 3,2 г метана? Определите объем, который займет углекислый газ, образовавшийся в этой реакции при нормальных условиях.
Краткие условия в данном случае целесообразно записать, учитывая уравнение реакции сгорания метана, следующим образом:
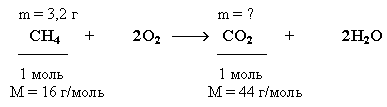
Решение
1. Находим количество вещества метана, вступившего в реакцию:
![]()
2. Количество углекислого газа согласно уравнению реакции равно количеству метана:
ν(CO2) = ν(CH4) = 0,2 моль
3. Определяем массу CO2:
m(CO2) = ν(CO2) • M(CO2) = 0,2 моль • 44 г/моль = 8,8 г
Ответ: m(CO2) = 8,8 г
Пример 1.
Какой объем водорода при н.у. выделится при растворении 4,8 г магния в избытке
соляной кислоты?
Решение.Mg + 2HCl ® MgCl2 + H2
При растворении 24 г (1 моль) магния в HCl выделилось 22,4 л (1 моль) водорода;
при растворении 4,8 г магния -- Х л водорода.
X = (4,8 ∙22,4) / 24 = 4,48 л водорода
Пример 2.
3,17 г хлора занимают объем равный 1 л (при н.у.). Вычислите по этим данным
молекулярную массу хлора.
Решение.
Находим массу 22,4 л хлора
1 л--3,17 г хлора
22,4 л-- Х г хлора
X = 3,17 ∙22,4 = 71 гСледовательно, молекулярная масса хлора - 71.
Пример 3
Сколько г меди образуется при восстановлении 8 г оксида водородом, если выход
реакции составил 82% от теоретического?
РешениеCuO + H2 ® Cu + H2O
1. Рассчитаем теоретический выход меди по уравнению реакции: 80 г (1 моль) CuO при восстановлении может образовать 64 г (1 моль) Cu; 8 г CuO при восстановлении может образовать Х г Cu
2. Определим, сколько граммов меди образуется при 82% выходе продукта:
6,4 г -- 100% выход (теоретический)
Х г -- 82%
X = (8 • 82) / 100 = 5,25 г
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.