
Инструкция к выполнению работы
На выполнение экзаменационной работы по химии дается 1,5 часа (90 минут). Работа состоит из 3 частей и включает 50 заданий.
Часть 1 включает 35 заданий (А1 – А35). К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 12 заданий (В1 – В12), на которые надо дать краткий ответ в виде числа или последовательности цифр. В этой части используются задания на установление соответствия, на выбор нескольких правильных ответов из числа предложенных, а также расчетные задачи.
Часть 3 содержит 3 самых сложных заданий по общей, неорганической и органической химии. Задания C1 – C3 требуют развернутого ответа.
Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
Выполняйте задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
За выполнение различных по сложности заданий дается два или более баллов. Каждое задание части А оценивается в 2 балла, части В - 3 балла, а части С - 5 баллов.
Баллы, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. Максимальное количество баллов – 121.
Оценка «5» - 100 - 121 балл
«4» - 80 - 100 баллов
«3» - 70 - 79 баллов
«2» - менее 70 баллов
Желаем успеха!
|
Депобразования и молодежи Югры бюджетное учреждение среднего профессионального образования Ханты-Мансийского автономного округа – Югры «Мегионский профессиональный колледж» (БУ «Мегионский профессиональный колледж») |
||
|
Материал рассмотрен и согласован на заседании ЦМК естественно- научных дисциплин |
|
УТВЕРЖДАЮ Заместитель директора по учебной работе |
|
Протокол № __ от «__» __________ 201__ г. |
|
________________________ Н.Е. Зябкина |
|
Председатель цикловой методической комиссии: ___________Т. А. Антоненко |
|
«____»____________________201__г. |
тесты для проведения дифференцированного зачета по химии
Курс:
Группа:
Специальность:
Вариант 1
Часть 1
При выполнении заданий этой части напротив номера выполняемого
вами задания (А1 – А35) поставьте знак « ´ ».
А1. B ряду химических элементов
Na ® Mg ® Al ® Si
|
1) |
увеличивается число валентных электронов в атомах |
|
2) |
уменьшается число электронных слоев в атомах |
|
3) |
уменьшается число протонов в ядрах атомов |
|
4) |
увеличиваются радиусы атомов |
А2. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
|
1) |
Mg, Ca, Ba |
|
2) |
Fe, Mg, Al |
|
3) |
Cr, Ca, Fe |
|
4) |
Sc, K, Mg |
А3. Вещество с ковалентной полярной связью имеет формулу
|
1) |
KCl |
2) |
HBr |
3) |
Р4 |
4) |
CaCl2 |
А4. В фосфорной кислоте
H3PO3
фосфор имеет степень окисления, соответственно равную:
|
1) |
+ 5; |
|
2) |
– 3; |
|
3) |
– 5; |
|
4) |
+ 3; |
А5.К веществам с атомной кристаллической решеткой относится
|
1) |
натрий |
|
2) |
азотная кислота |
|
3) |
алмаз |
|
4) |
хлорид калия |
А6. Только кислоты расположены в ряду
|
1) |
HNO3, Ca(NO3)2, NO2 |
|
2) |
KHCO3, Ba(HSO4)2, Zn(OH)Cl |
|
3) |
HNO2, HNO3, CH3COOH |
|
4) |
H2S, Na2SO3, SO2 |
А7. Атом углерода имеет заряд ядра:
|
1) |
+4 |
|
2) |
+6 |
|
3) |
+3 |
|
4) |
+8 |
А8. Газообразный кислород состоит из…..
|
1) |
двухатомных молекул |
|
2) |
свободных атомов |
|
3) |
атомов, объединенных в кристаллическую решетку |
|
4) |
трёхатомных молекул |
A9. Единственный жидкий металл?
|
1) |
медь |
|
2) |
цинк |
|
3) |
ртуть |
|
4) |
железо |
А10.А. Оксид хрома (III) проявляет амфотерные свойства.
Б. Оксид хрома (III) проявляет только восстановительные свойства.
|
1) |
верно только А |
|
2) |
верно только Б |
|
3) |
верны оба суждения |
|
4) |
оба суждения неверны |
А11.Сера является окислителем в реакции с
|
1) |
кислородом |
|
2) |
металлами |
|
3) |
хлором и фтором |
|
4) |
азотной кислотой |
А12.С образованием щелочи с водой взаимодействует
|
1) |
алюминий |
2) |
цинк |
3) |
калий |
4) |
ртуть |
А13.Гидролиз – это обменная реакция между веществом и…..
|
1) |
CaO |
|
2) |
Ba(OH)2 |
|
3) |
CaCO3 |
|
4) |
Н2О |
А14.Железо не взаимодействует с
|
1) |
HCl |
2) |
О2 |
3) |
Н2SО4(конц.) |
4) |
S |
А15..Раствор сульфата меди (II) реагирует с веществом:
|
1) |
HCl |
|
2) |
Cu(OH)2 |
|
3) |
О2 |
|
4) |
Na2SO4 |
А16. В схеме превращений
NН3 ![]() X
X ![]() NН4NO3
NН4NO3
веществом «X» является
|
1) |
N2 |
|
2) |
NН4ОН |
|
3) |
КNO3 |
|
4) |
NO2 |
А17. Коррозия металлов – это.
|
1) |
самопроизвольный окислительно-восстановительный процесс |
|
2) |
восстановительный процесс |
|
3) |
процесс, протекающий под действием электрического тока |
|
4) |
обменный процесс |
А18.К фенолам относится вещество, формула которого
|
1) |
C6H5 – O – CH3 |
|
2) |
C6H13 – O-С2Н5 |
|
3) |
C6H5 – OH |
|
4) |
C6H5 – CH3 |
А19.В молекулах какого вещества отсутствуют p-связи?
|
1) |
этина |
2) |
бутана |
3) |
этена |
4) |
гексена |
А20.Уксусная кислота может реагировать с
|
1) |
гидроксидом калия |
|
2) |
соляной кислотой |
|
3) |
серебром |
|
4) |
медью |
А21.В схеме превращений
магний ® X ® гидроксид магния
веществом «Х» является
|
1) |
оксид магния |
2) |
азот |
3) |
соляная кислота |
4) |
сера |
А22.К реакциям обмена относится соответственно
|
1) |
2Cu + O2 = 2CuO |
|
2) |
2H2 + O2 = 2H2O |
|
3) |
K2SO3 + ZnCl2= 2KCl +Zn SO3 |
|
4) |
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu |
А23.Газ, содержание которого в атмосфере составляет 20-21%:
|
1) |
O2 |
|
2) |
CO2 |
|
3) |
N2 |
|
4) |
CL2 |
А24.В какой системе понижение температуры смещает химическое равновесие
в сторону продуктов реакции?
|
1) |
2SO2(г) + O2(г) |
|
2) |
N2(г) + О2(г) |
|
3) |
CO2(г) + 2C(тв.) |
|
4) |
2NH3(г) |
А25.В качестве катионов только ионы Н+ образуются при диссоциации
|
1) |
NaOH |
2) |
Nа3PO4 |
3) |
H2SO4 |
4) |
Na2SO4 |
А26.Сокращенное ионное уравнение
Ca2+ + CO32– ® CaCO3
соответствует взаимодействию
|
1) |
хлорида кальция и карбоната натрия |
|
2) |
сульфида кальция и углекислого газа |
|
3) |
гидроксида кальция и угарного газа |
|
4) |
фосфата калия и карбоната калия |
А27.К сплавам железа относится:
|
1) |
бронза |
|
2) |
латунь |
|
3) |
сталь |
|
4) |
дюралюминий |
С образованием щелочи с водой взаимодействует
|
1) |
алюминий |
2) |
цинк |
3) |
калий |
4) |
ртуть |
А28.Кислую среду имеет водный раствор
|
1) |
Na3PO4 |
|
2) |
KCl |
|
3) |
Na2CO3 |
|
4) |
ZnSO4 |
А29.Метан горит :
|
1) |
сильно коптящим пламенем |
|
2) |
голубоватым пламенем |
|
3) |
с выделением пахучих веществ |
|
4) |
зеленоватым пламенем |
А30.При сжигании органических веществ образуются
|
1) |
Этилен и вода |
|
2) |
Этан и водород |
|
3) |
этиловый спирт и азот |
|
4) |
углекислый газ и вода |
А31.Формула соединения углерода, проявляющего токсичные свойства,
|
1) |
NaHCO3 |
2) |
Na2CO3 |
3) |
CaCO3 |
4) |
CO |
А32.Реакции полимеризации этилена соответствует схема
|
1) |
nCH2 = CH2 ® (– CH2 – CH2 – )n |
|
2) |
R× + CH2 = CHCl ® R – CH2 – CH× ÷ Cl |
|
3) |
2R× + CH2 = CH2 ® R – CH2 – CH2 – R |
|
4) |
CH2 = CH2 |
А33.Соединение состава С3Н8 относится к гомологическому ряду
|
1) |
алканов |
2) |
алкенов |
3) |
алкинов |
4) |
аренов |
34. Этилен является сырьем для получения полимера:
|
1) |
тефлона |
2) |
полиэтилена |
3) |
каучука |
4) |
капрона |
35. Гидролизу подвергаются:
|
1) |
алканы |
2) |
арены |
3) |
спирты |
4) |
углеводы |
В заданиях В1 – В5 на установление соответствия запишите в таблицу буквы выбранных вами ответов. (Буквы в ответе могут повторяться.)
В1.Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
|
НАЗВАНИЕ ВЕЩЕСТВА |
|
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
1) |
гидрокарбонат свинца (II) |
А) |
бескислородная кислота |
|
2) |
серная кислота |
Б) |
щелочь |
|
3) |
соляная кислота |
В) |
основная соль |
|
4) |
гидроксид бериллия |
Г) |
кислородсодержащая кислота |
|
|
|
Д) |
амфотерный гидроксид |
|
|
|
Е) |
кислая соль |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В2.Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней восстановителем.
|
|
СХЕМА РЕАКЦИИ |
|
ВОССТАНОВИТЕЛЬ |
|
1) |
Si + C ® SiC |
А) |
Si |
|
2) |
NO2 + Mg ® MgO + N2 |
Б) |
C |
|
3) |
SO2 + O2 ® SO3 |
В) |
Mg |
|
4) |
NO2 + SO2 ® SO3 + NO |
Г) |
NO2 |
|
|
|
Д) |
SO2 |
|
|
|
Е) |
O2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В3.Установите соответствие между названием соли и типом гидролиза ее в водном растворе.
|
|
НАЗВАНИЕ СОЛИ |
|
ТИП ГИДРОЛИЗА |
|
1) |
сульфид алюминия |
А) |
по катиону |
|
2) |
сульфид натрия |
Б) |
по аниону |
|
3) |
нитрат магния |
В) |
по катиону и аниону |
|
4) |
сульфит калия |
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В4.Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
|
|
формулы веществ |
|
продукты электролиза |
|
1) |
CaCl2 |
А) |
Ca, O2 , Cl2 |
|
2) |
Fe(NO3)3 |
Б) |
Fe, H2, Cl2 |
|
3) |
K2SO4 |
В) |
K, H2, SO3 |
|
4) |
FeCl3 |
Г) |
Fe, H2, O2 |
|
|
|
Д) |
H2, Cl2 |
|
|
|
Е) |
H2, O2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В5.Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
|
|
формула вещества |
|
рЕАГЕНТЫ |
||||
|
1) |
C2H5OH |
А) |
NaOН |
||||
|
2) |
CH3 СОOH |
Б) |
Ag |
||||
|
3) |
C2H5CHO |
В) |
СL2 |
||||
|
4) |
СН4 |
Г) |
Na2CO3 |
||||
|
|
|
Д) |
Н2 |
||||
|
1 |
2 |
3 |
4 |
|
|||
|
|
|
|
|
|
|||
Ответом к заданиям В6 – В8 является последовательность букв.
В6.И серная кислота способна реагировать с
|
А) |
гидроксидом калия |
|
Б) |
гидроксидом алюминия |
|
В) |
оксидом углерода (II) |
|
Г) |
водородом |
|
Д) |
оксидом магния |
|
Е) |
силикатом натрия |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.)
В7. Для ацетилена характерны:
|
А) |
sp2- гибридизация атомов углерода в молекуле |
|
Б) |
наличие в молекуле 3σ - и 2π-связей |
|
В) |
высокая растворимость в воде |
|
Г) |
реакция полимеризации |
|
Д) |
взаимодействие с оксидом меди (II) |
|
Е) |
взаимодействие с аммиачным раствором оксида серебра (I) |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.)
В8.Диметиламин взаимодействует с
|
А) |
гидроксидом бария |
|
Б) |
кислородом |
|
В) |
азотной кислотой |
|
Г) |
пропаном |
|
Д) |
уксусной кислотой |
|
Е) |
водой |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.)
Ответом к заданиям В9, В10 является число. Запишите это число в текст работы.
В9. Масса соли, которая вводится в организм при вливании 353 г физиологического раствора, содержащего 0,85% по массе поваренной соли, равна _______ г. (Запишите число с точностью до целых.)В10.Объем воздуха (н.у.), необходимый для сжигания 32 л (н.у.) угарного газа, равен ________ л. (Запишите число с точностью до целых.)
В11..Масса фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12%-ного раствора гидроксида натрия, равна ___________ г.
(Запишите число с точностью до десятых.)
В12..При взаимодействии 56 л оксида серы (IV) и 48 л кислорода остается избыток кислорода объемом (н.у.) _________ л. (Запишите число с точностью до целых.
Часть 3
|
Запишите сначала номер задания (С1 и т.д.), а затем полное решение. Ответы записывайте четко и разборчиво. |
С1.Используя метод электронного баланса, составьте уравнение ракции:
P + HNO3 ® NO2 + … .
Определите окислитель и восстановитель.
С2.Даны водные растворы: хлорида железа (III), иодида натрия, бихромата натрия, серной кислоты и гидроксида цезия.
Приведите уравнения четырех возможных реакций между этими веществами.
С3.Оксид серы (VI) массой 8 г растворили в 110 г 8%-ной серной кислоты. Какая соль и в каком количестве образуется, если к полученному раствору добавить 10,6 г гидроксида калия?
Бланк ответов для тестов по химии
Ф.И.О. ___________________________________________________________________
Группа___________________________________________________________________
Курс_____________ Дата___________2013г
Вариант ____
ЧАСТЬ 1
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А1 |
|
|
А11 |
|
|
А21 |
|
|
А2 |
|
|
А12 |
|
|
А22 |
|
|
А3 |
|
|
А13 |
|
|
А23 |
|
|
А4 |
|
|
А14 |
|
|
А24 |
|
|
А5 |
|
|
А15 |
|
|
А25 |
|
|
А6 |
|
|
А16 |
|
|
А26 |
|
|
А7 |
|
|
А17 |
|
|
А27 |
|
|
А8 |
|
|
А18 |
|
|
А28 |
|
|
А9 |
|
|
А19 |
|
|
А29 |
|
|
А10 |
|
|
А20 |
|
|
А30 |
|
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А31 |
|
|
А32 |
|
|
А33 |
|
|
А34 |
|
|
А35 |
|
|
|
|
ЧАСТЬ 2
|
№ |
Ответ |
|
В1 |
|
|
В2 |
|
|
В3 |
|
|
В4 |
|
|
В5 |
|
|
В6 |
|
|
В7 |
|
|
В8 |
|
|
В9 |
|
|
В10 |
|
|
В11 |
|
|
В12 |
|
Часть 3
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Инструкция по проверке и оценке работ обучающихся по химии
Вариант-1
ЧАСТЬ 1
Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается невыполненным. За полный правильный ответ на задания А1 – А35 ставится 2 балла, за неверный ответ (или при его отсутствии) – 0 баллов.
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А1 |
1 |
|
А11 |
2 |
|
А21 |
1 |
|
А2 |
1 |
|
А12 |
3 |
|
А22 |
3 |
|
А3 |
2 |
|
А13 |
4 |
|
А23 |
1 |
|
А4 |
1 |
|
А14 |
3 |
|
А24 |
1 |
|
А5 |
3 |
|
А15 |
1 |
|
А25 |
3 |
|
А6 |
3 |
|
А16 |
2 |
|
А26 |
1 |
|
А7 |
3 |
|
А17 |
1 |
|
А27 |
3 |
|
А8 |
1 |
|
А18 |
3 |
|
А28 |
4 |
|
А9 |
3 |
|
А19 |
2 |
|
А29 |
2 |
|
А10 |
1 |
|
А20 |
1 |
|
А30 |
4 |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А31 |
4 |
|
А32 |
1 |
|
А33 |
1 |
|
А34 |
2 |
|
А35 |
4 |
|
|
|
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность символов – число или последовательность букв.
За полный правильный ответ на задания В1 – В8 ставится 3 балла, за правильный неполный – 1 балл, за неверный ответ (или при его отсутствии) – 0 баллов.
|
№ |
Ответ |
|
В1 |
ЕГАД |
|
В2 |
АВДД |
|
В3 |
ВБАБ |
|
В4 |
ДГЕБ |
|
В5 |
АГБВ |
|
В6 |
АБДЕ |
|
В7 |
БГЕ |
|
В8 |
БВДЕ |
|
В9 |
3 |
|
В10 |
80 |
|
В11 |
11,6 |
|
В12 |
20 |
ЧАСТЬ 3
За выполнение заданий С1- С3 ставится от 0 до 5 баллов;
|
C1 |
Используя метод электронного баланса, составьте уравнение реакции:
P + HNO3 ® NO2 + … .
Определите окислитель и восстановитель.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
||
|
Элементы ответа: 1) Составлен электронный баланс:
|
|
||
|
2) Расставлены коэффициенты в уравнении реакции: P + 5HNO3 = H3PO4 + 5NO2 + Н2О |
|||
|
3) Указано, что фосфор в степени окисления 0 является восстановителем, а азот в степени окисления + 5 (или азотная кислота за счет азота в степени окисления + 5) – окислителем. |
|||
|
Ответ правильный и полный, включает все названные выше элементы |
5 |
||
|
В ответе допущена ошибка только в одном из элементов |
2 |
||
|
В ответе допущены ошибки в двух элементах |
1 |
||
|
Все элементы ответа записаны неверно |
0 |
||
|
Максимальный балл |
5 |
|
C2 |
Даны водные растворы: хлорида железа (III), иодида натрия, бихромата натрия, серной кислоты и гидроксида цезия.
Приведите уравнения четырех возможных реакций между этими веществами.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Приведены четыре уравнения возможных реакций с участием указанных веществ: 1) 2FeCl3 + 2NaI = 2NaCl + 2FeCl2 + I2 2) FeCl3 + 3CsOH = Fe(OH)3¯ + 3CsCl 3) H2SO4 + 2CsOH = Cs2SO4 + 2H2O 4) Na2Cr2O7 + 2СsOH = Na2CrO4 + Cs2CrO4 + Н2O или 6NaI + Na2Cr2O7 + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4Na2SO4 + 7H2O
|
|
|
Ответ правильный и полный, включает все названные выше элементы |
5 |
|
Правильно записаны 3 уравнения реакций |
3 |
|
Правильно записаны 2 уравнения реакций |
2 |
|
Правильно записано одно уравнение реакции |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
|
C3 |
Оксид серы (VI) массой 8 г растворили в 110 г 8%-ной серной кислоты. Какая соль и в каком количестве образуется, если к полученному раствору добавить 10,6 г гидроксида калия?
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Записано уравнение реакции: SO3 + H2O = Н2SО4
2) Рассчитано количество вещества образовавшейся серной кислоты: n(SО3) = 8/80 = 0,1 моль, n(Н2SО4) = n(SО3) = 0,1 моль
3) Определено соотношение количества вещества взятой щелочи и суммарного числа моль кислоты, находящейся в полученном растворе: n(КOH) = 10,6/56 = 0,19 моль n(Н2SО4) = 110∙0,08/98 + 0,1 = 0,19 моль Количества веществ кислоты и щелочи относятся как 1 : 1, значит при их взаимодействии образуется кислая соль.
4) Составлено уравнение реакции и определено число моль соли: Н2SО4 + КOH = КНSО4 + H2O, n(Н2SО4) = n(КOH) = n(КНSО4) = 0,19 моль. |
|
|
Ответ правильный и полный, включает все названные выше элементы |
5 |
|
В ответе допущены ошибки только в 4-м элементе |
3 |
|
В ответе допущены ошибки в 3-м и в 4-м элементах |
2 |
|
В
ответе допущена ошибка в одном из первых двух элементов, которая повлекла
ошибки в последующих вычислениях (элементы |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
|
Депобразования и молодежи Югры бюджетное учреждение среднего профессионального образования Ханты-Мансийского автономного округа – Югры «Мегионский профессиональный колледж» (БУ «Мегионский профессиональный колледж») |
||
|
Материал рассмотрен и согласован на заседании ЦМК естественно- научных дисциплин |
|
УТВЕРЖДАЮ Заместитель директора по учебной работе |
|
Протокол № __ от «__» __________ 201__ г. |
|
________________________ Н.Е. Зябкина |
|
Председатель цикловой методической комиссии: ___________Т. А. Антоненко |
|
«____»____________________201__г. |
тесты для проведения дифференцированного зачета по химии
Курс:
Группа:
Специальность:
Вариант -2
Часть 1
А1.B ряду химических элементов
Li ® Be ® B® C
|
1) |
увеличивается число валентных электронов в атомах |
|
2) |
уменьшается число электронных слоев в атомах |
|
3) |
уменьшается число протонов в ядрах атомов |
|
4) |
увеличиваются радиусы атомов |
А2.В каком ряду простые вещества расположены в порядке усиления металлических свойств?
|
1) |
Ba, Cu, AL |
|
2) |
Li, Na, K |
|
3) |
Cr, Ca, Fe |
|
4) |
Sc, K, Mg |
А3.Вещество с ковалентной полярной связью имеет формулу
|
1) |
KCl |
2) |
Br2 |
3) |
HCL |
4) |
CaCl2 |
А4..В фосфорной кислоте
H3PO3
фосфор имеет степень окисления, соответственно равную:
|
1) |
+ 5; |
|
2) |
– 3; |
|
3) |
– 5; |
|
4) |
+ 3; |
А5.К веществам с атомной кристаллической решеткой относится
|
1) |
натрий |
|
2) |
азотная кислота |
|
3) |
алмаз |
|
4) |
хлорид калия |
А6.Только кислоты расположены в ряду
|
1) |
HNO3, Ca(NO3)2, NO2 |
|
2) |
KHCO3, Ba(HSO4)2, Zn(OH)Cl |
|
3) |
HNO2, HNO3, CH3COOH |
|
4) |
H2S, Na2SO3, SO2 |
А7.Атом кислорода имеет заряд ядра:
|
1) |
+4 |
|
2) |
+6 |
|
3) |
+3 |
|
4) |
+8 |
А8.Газообразный азот состоит из…..
|
1) |
двухатомных молекул |
|
2) |
свободных атомов |
|
3) |
атомов, объединенных в кристаллическую решетку |
|
4) |
трёхатомных молекул |
А9.Единственный жидкий металл?
|
1) |
медь |
|
2) |
цинк |
|
3) |
ртуть |
|
4) |
железо |
А10, А. Оксид алюминия (III) проявляет амфотерные свойства.
Б. Оксид алюминия (III) проявляет только восстановительные свойства.
|
1) |
верно только А |
|
2) |
верно только Б |
|
3) |
верны оба суждения |
|
4) |
оба суждения неверны |
А11.Сера является окислителем в реакции с
|
1) |
кислородом |
|
2) |
металлами |
|
3) |
хлором и фтором |
|
4) |
азотной кислотой |
А12.С образованием щелочи с водой взаимодействует
|
1) |
алюминий |
2) |
натрий |
3) |
медь |
4) |
ртуть |
А13.Гидролиз – это обменная реакция между веществом и…..
|
1) |
CaO |
|
2) |
Ba(OH)2 |
|
3) |
CaCO3 |
|
4) |
Н2О |
А14.Железо не взаимодействует с
|
1) |
HCl |
2) |
О2 |
3) |
Н2SО4(конц.) |
4) |
S |
А15.Раствор сульфата цинка реагирует с веществом:
|
1) |
HCl |
|
2) |
Cu(OH)2 |
|
3) |
О2 |
|
4) |
Na2SO4 |
А16.В схеме превращений
NН3 ![]() X
X ![]() NН4NO3
NН4NO3
веществом «X» является
|
1) |
N2 |
|
2) |
NН4ОН |
|
3) |
КNO3 |
|
4) |
NO2 |
А17. Коррозия металлов – это..
|
1) |
самопроизвольный окислительно-восстановительный процесс |
|
2) |
восстановительный процесс |
|
3) |
процесс, протекающий под действием электрического тока |
|
4) |
обменный процесс |
А18. К фенолам относится вещество, формула которого
|
1) |
C6H5 – O – CH3 |
|
2) |
C6H13 – O-С2Н5 |
|
3) |
C6H5 – OH |
|
4) |
C6H5 – CL |
А19. В молекулах какого вещества отсутствуют p-связи?
|
1) |
этина |
2) |
этана |
3) |
этена |
4) |
гексена |
А20.Соляная кислота может реагировать с
|
1) |
гидроксидом калия |
|
2) |
уксусной кислотой |
|
3) |
серебром |
|
4) |
медью |
А21.В схеме превращений
магний ® X ® гидроксид магния
веществом «Х» является
|
1) |
оксид магния |
2) |
азот |
3) |
соляная кислота |
4) |
сера |
А22..К реакциям обмена относится соответственно
|
1) |
2Cu + O2 = 2CuO |
|
2) |
2H2 + O2 = 2H2O |
|
3) |
K2SO3 + ZnCl2= 2KCl +Zn SO3 |
|
4) |
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu |
А23.Газ, содержание которого в атмосфере составляет 79%:
|
1) |
O2 |
|
2) |
CO2 |
|
3) |
N2 |
|
4) |
CL2 |
А24.В какой системе повышение температуры смещает химическое равновесие в сторону продуктов реакции?
|
1) |
2SO2(г) + O2(г) |
|
2) |
N2(г) + О2(г) |
|
3) |
CO2(г) + 2C(тв.) |
|
4) |
2NH3(г) |
А25.В качестве катионов только ионы Н+ образуются при диссоциации
|
1) |
NaOH |
2) |
Nа3PO4 |
3) |
Na2SO4 |
4) |
HCL |
А26.Сокращенное ионное уравнение
Ca2+ + CO32– ® CaCO3
соответствует взаимодействию
|
1) |
хлорида кальция и карбоната натрия |
|
2) |
сульфида кальция и углекислого газа |
|
3) |
гидроксида кальция и угарного газа |
|
4) |
фосфата калия и карбоната калия |
А27.К сплавам железа относится:
|
1) |
бронза |
|
2) |
латунь |
|
3) |
дюралюминий |
|
4) |
чугун |
А28.Кислую среду имеет водный раствор
|
1) |
Na3PO4 |
|
2) |
KCl |
|
3) |
Na2CO3 |
|
4) |
ZnSO4 |
А29.Бензол горит :
|
1) |
сильно коптящим пламенем |
|
2) |
голубоватым пламенем |
|
3) |
с выделением пахучих веществ |
|
4) |
зеленоватым пламенем |
А30.При сжигании органических веществ образуются
|
1) |
Этилен и вода |
|
2) |
Этан и водород |
|
3) |
этиловый спирт и азот |
|
4) |
углекислый газ и вода |
А31.Формула соединения углерода, проявляющего токсичные свойства,
|
1) |
NaHCO3 |
2) |
Na2CO3 |
3) |
CaCO3 |
4) |
CO |
А32.Реакции полимеризации этилена соответствует схема
|
1) |
nCH2 = CH2 ® (– CH2 – CH2 – )n |
|
2) |
R× + CH2 = CHCl ® R – CH2 – CH× ÷ Cl |
|
3) |
2R× + CH2 = CH2 ® R – CH2 – CH2 – R |
|
4) |
CH2 = CH2 |
А33. Соединение состава С2Н6 относится к гомологическому ряду
|
1) |
алканов |
2) |
алкенов |
3) |
алкинов |
4) |
аренов |
А34.Пропилен является сырьем для получения полимера:
|
1) |
полипропилена |
2) |
полиэтилена |
3) |
каучука |
4) |
капрона |
А35. Гидролизу подвергаются:
|
1) |
алканы |
2) |
арены |
3) |
спирты |
4) |
жиры |
В заданиях В1 – В5 на установление соответствия запишите в таблицу буквы выбранных вами ответов. (Буквы в ответе могут повторяться.)
В1.Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
|
НАЗВАНИЕ ВЕЩЕСТВА |
|
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
1) |
гидрокарбонат магния |
А) |
бескислородная кислота |
|
2) |
сернистая кислота |
Б) |
щелочь |
|
3) |
фтороводородная |
В) |
основная соль |
|
4) |
гидроксид натрия |
Г) |
кислородсодержащая кислота |
|
|
|
Д) |
амфотерный гидроксид |
|
|
|
Е) |
кислая соль |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В2.Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней восстановителем.
|
|
СХЕМА РЕАКЦИИ |
|
ВОССТАНОВИТЕЛЬ |
|
1) |
Si + C ® SiC |
А) |
Si |
|
2) |
NO2 + Mg ® MgO + N2 |
Б) |
C |
|
3) |
SO2 + O2 ® SO3 |
В) |
Mg |
|
4) |
NO2 + SO2 ® SO3 + NO |
Г) |
NO2 |
|
|
|
Д) |
SO2 |
|
|
|
Е) |
O2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В3.Установите соответствие между названием соли и типом гидролиза ее в водном растворе.
|
|
НАЗВАНИЕ СОЛИ |
|
ТИП ГИДРОЛИЗА |
|
1) |
сульфид цинка |
А) |
по катиону |
|
2) |
сульфид натрия |
Б) |
по аниону |
|
3) |
нитрат хрома |
В) |
по катиону и аниону |
|
4) |
сульфит калия |
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В4.Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
|
|
формулы веществ |
|
продукты электролиза |
|
1) |
KCl |
А) |
Ca, O2 , Cl2 |
|
2) |
Fe(NO3)3 |
Б) |
Fe, H2, Cl2 |
|
3) |
Na2SO4 |
В) |
K, H2, SO3 |
|
4) |
FeCl3 |
Г) |
Fe, H2, O2 |
|
|
|
Д) |
H2, Cl2 |
|
|
|
Е) |
H2, O2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
В5.Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
|
|
формула вещества |
|
рЕАГЕНТЫ |
||||
|
1) |
CH3OH |
А) |
NaOН |
||||
|
2) |
CH3 СОOH |
Б) |
Ag |
||||
|
3) |
C2H5CHO |
В) |
СL2 |
||||
|
4) |
С2Н6 |
Г) |
Na2CO3 |
||||
|
|
|
Д) |
Н2 |
||||
|
1 |
2 |
3 |
4 |
|
|||
|
|
|
|
|
|
|||
Ответом к заданиям В6 – В8 является последовательность букв.
В7. серная кислота способна реагировать с
|
А) |
гидроксидом натрия |
|
Б) |
гидроксидом хрома (III) |
|
В) |
оксидом углерода (II) |
|
Г) |
азотом |
|
Д) |
оксидом кальция |
|
Е) |
силикатом калия |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.
В7.Для метана характерны:
|
А) |
sp3- гибридизация атомов углерода в молекуле |
|
Б) |
наличие в молекуле 3σ - и 2π-связей |
|
В) |
высокая растворимость в воде |
|
Г) |
Реакции замещения |
|
Д) |
взаимодействие с оксидом меди (II) |
|
Е) |
взаимодействие с аммиачным раствором оксида серебра (I) |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.)
В8.Этилен взаимодействует с
|
А) |
гидроксидом алюминия |
|
Б) |
водородом |
|
В) |
серебром |
|
Г) |
хлором |
|
Д) |
уксусной кислотой |
|
Е) |
водой |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.)
Ответом к заданиям В9, В10 является число. Запишите это число в текст работы
В9.Масса соли, которая вводится в организм при вливании 353 г физиологического раствора, содержащего 0,85% по массе поваренной соли, равна _______ г. (Запишите число с точностью до целых.)
В10.Объем кислорода (н.у.), необходимый для сжигания 32 л (н.у.) метана, равен ________ л. (Запишите число с точностью до целых.)
В11.Масса фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12%-ного раствора гидроксида натрия, равна ___________ г.
(Запишите число с точностью до десятых.)
В12.При взаимодействии 56 л оксида серы (IV) и 38 л кислорода остается избыток кислорода объемом (н.у.) _________ л. (Запишите число с точностью до целых.
Часть 3
|
Запишите сначала номер задания (С1 и т.д.), а затем полное решение. Ответы записывайте четко и разборчиво. |
С1.Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 +
… + H2SO4 ![]() I2
+ Cr2(SO4)3 + … + H2O
I2
+ Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
С2.Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
С3.Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
Инструкция по проверке и оценке работ обучающихся по химии
Вариант-2
Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается невыполненным. За полный правильный ответ на задания А1 – А35 ставится 2 балла, за неверный ответ (или при его отсутствии) – 0 баллов.
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А1 |
1 |
|
А11 |
2 |
|
А21 |
1 |
|
А2 |
2 |
|
А12 |
2 |
|
А22 |
3 |
|
А3 |
3 |
|
А13 |
4 |
|
А23 |
3 |
|
А4 |
1 |
|
А14 |
3 |
|
А24 |
1 |
|
А5 |
3 |
|
А15 |
1 |
|
А25 |
4 |
|
А6 |
3 |
|
А16 |
2 |
|
А26 |
1 |
|
А7 |
4 |
|
А17 |
1 |
|
А27 |
4 |
|
А8 |
1 |
|
А18 |
3 |
|
А28 |
4 |
|
А9 |
3 |
|
А19 |
2 |
|
А29 |
1 |
|
А10 |
1 |
|
А20 |
1 |
|
А30 |
4 |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А31 |
4 |
|
А32 |
1 |
|
А33 |
1 |
|
А34 |
1 |
|
А35 |
4 |
|
|
|
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность символов – число или последовательность букв.
За полный правильный ответ на задания В1 – В8 ставится 3 балла, за правильный неполный – 1 балл, за неверный ответ (или при его отсутствии) – 0 баллов.
|
№ |
Ответ |
|
В1 |
ЕГАБ |
|
В2 |
АВДД |
|
В3 |
ВБАБ |
|
В4 |
ДГЕБ |
|
В5 |
АГБВ |
|
В6 |
АБДЕ |
|
В7 |
АГ |
|
В8 |
БГЕ |
|
В9 |
3 |
|
В10 |
64 |
|
В11 |
11,6 |
|
В12 |
10 |
ЧАСТЬ 3
|
C1 |
Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 +
… + H2SO4 ![]() I2
+ Cr2(SO4)3 + … + H2O
I2
+ Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
||
|
Элементы ответа: 1) Составлен электронный баланс:
|
|
||
|
2) Расставлены коэффициенты в уравнении реакции: K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O |
|||
|
3) Указано, что иод в степени окисления – 1 является восстановителем, а хром в степени окисления + 6 (или дихромат натрия за счет хрома в степени окисления + 6) – окислителем. |
|||
|
Ответ правильный и полный, включает все названные выше элементы |
5 |
||
|
В ответе допущена ошибка только в одном из элементов |
3 |
||
|
В ответе допущены ошибки в двух элементах |
1 |
||
|
Все элементы ответа записаны неверно |
0 |
||
|
Максимальный балл |
|
|
C2 |
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Написаны четыре уравнения возможных реакций с участием указанных веществ: 1) S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O 2) S + 2H2SO4 (конц.) = 3SO2 + 2H2O 3) H2S + 2HNO3 (конц.) = S + 2NO2 + 2H2O 4) H2S + 3H2SO4 (конц.) = 4SO2 + 4H2O |
|
|
Правильно записаны 4 уравнения возможных реакций |
5 |
|
Правильно записаны 3 уравнения реакций |
3 |
|
Правильно записаны 2 уравнения реакций |
2 |
|
Правильно записано 1 уравнение реакции |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
|
|
|
|
C3 |
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение химической реакции между серной кислотой и карбонатом калия: К2CO3 + H2SO4 = К2SO4 + H2O + CO2↑
2) Рассчитаны количества веществ, вступивших в реакцию и полученных в ходе реакции: В каждых 100 г раствора серной кислоты содержится 5 г её или n(H2SO4) = 5/98 = 0,051 моль n(K2CO3) = n(H2SO4) = 0,051 моль, n(CO2) = n(H2SO4) = 0,051 моль, n(K2SO4) = n(H2SO4) = 0,051 моль,
3) Рассчитаны массы веществ: m(K2CO3) = nM = 0,051∙138 = 7,04 г m(K2SO4) = nM = 0,051∙174= 8,87 г m(CO2) = nM = 0,051∙44 = 2,24 г
4) Найдена масса раствора и определена массовая доля сульфата калия в нем: m(раствора) = 100 + 7,04 – 2,24 = 104,8 г w(K2SO4) = |
|
|
Ответ правильный и полный, включает все названные выше элементы |
5 |
|
В ответе допущена ошибка в одном из названных выше элементов |
4 |
|
В ответе допущена ошибка в двух из названных выше элементов |
2 |
|
В ответе допущена ошибка в трех из названных выше элементов |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
|
Депобразования и молодежи Югры бюджетное учреждение среднего профессионального образования Ханты-Мансийского автономного округа – Югры «Мегионский профессиональный колледж» (БУ «Мегионский профессиональный колледж») |
||
|
Материал рассмотрен и согласован на заседании ЦМК естественно- научных дисциплин |
|
УТВЕРЖДАЮ Заместитель директора по учебной работе |
|
Протокол № __ от «__» __________ 201__ г. |
|
________________________ Н.Е. Зябкина |
|
Председатель цикловой методической комиссии: ___________Т. А. Антоненко |
|
«____»____________________201__г. |
тесты для проведения дифференцированного зачета по химии
Курс:
Группа:
Специальность:
Вариант 3
Часть 1
При выполнении заданий этой части напротив номера выполняемого вами задания (А1 – А35) поставьте знак « ´ ».
|
A1 |
B ряду химических элементов
К ® Ca ® Ga® Ge
|
1) |
увеличивается число валентных электронов в атомах |
|
2) |
уменьшается число электронных слоев в атомах |
|
3) |
уменьшается число протонов в ядрах атомов |
|
4) |
увеличиваются радиусы атомов |
|
A2 |
В каком ряду простые вещества расположены в порядке усиления металлических свойств?
|
1) |
Ba, Cu, AL |
|
2) |
K, Rb, Cs |
|
3) |
Cr, Ca, Fe |
|
4) |
Fr, K, Mg |
|
A3 |
Вещество с ковалентной полярной связью имеет формулу
|
1) |
LiCl |
2) |
CI2 |
3) |
HF |
4) |
CuCl2 |
|
A4 |
В кремниевой кислоте
H2SiO3
кремний имеет степень окисления, соответственно равную:
|
1) |
+ 4; |
|
2) |
– 3; |
|
3) |
– 4; |
|
4) |
+ 3; |
|
A5 |
К веществам с атомной кристаллической решеткой относится
|
1) |
хром |
|
2) |
угольная кислота |
|
3) |
алмаз |
|
4) |
хлорид серебра |
|
A6 |
Только кислоты расположены в ряду
|
1) |
HNO3, Ca(NO3)2, NO2 |
|
2) |
KHCO3, Ba(HSO4)2, Zn(OH)Cl |
|
3) |
HСI, HNO3, H2CO3 |
|
4) |
H2S, Na2SO3, SO2 |
|
A7 |
Атом серы имеет заряд ядра:
|
1) |
+14 |
|
2) |
16 |
|
3) |
+16 |
|
4) |
+18 |
|
A8 |
Газообразный хлор состоит из…..
|
1) |
двухатомных молекул |
|
2) |
свободных атомов |
|
3) |
атомов, объединенных в кристаллическую решетку |
|
4) |
трёхатомных молекул |
Благородный металл?
|
1) |
медь |
|
2) |
цинк |
|
3) |
золото |
|
4) |
железо |
|
A9 |
|
A10 |
А. Оксид цинка (II) проявляет амфотерные свойства.
Б. Оксид цинка (II) проявляет только восстановительные свойства.
|
1) |
верно только А |
|
2) |
верно только Б |
|
3) |
верны оба суждения |
|
4) |
оба суждения неверны |
|
A11 |
Сера является окислителем в реакции с
|
1) |
кислородом |
|
2) |
металлами |
|
3) |
хлором и фтором |
|
4) |
азотной кислотой |
|
A12 |
С образованием щелочи с водой взаимодействует
|
1) |
алюминий |
2) |
литий |
3) |
медь |
4) |
ртуть |
|
A13 |
Гидролиз – это обменная реакция между веществом и…..
|
1) |
CaO |
|
2) |
Ba(OH)2 |
|
3) |
CaCO3 |
|
4) |
Н2О |
|
A14 |
Железо не взаимодействует с
|
1) |
HCl |
2) |
О2 |
3) |
Н2SО4(конц.) |
4) |
S |
|
A15 |
Раствор сульфата калия реагирует с веществом:
|
1) |
HCl |
|
2) |
КOH |
|
3) |
О2 |
|
4) |
К2SO4 |
|
A16 |
В схеме превращений
NН3 ![]() X
X ![]() NН4NO3
NН4NO3
веществом «X» является
|
1) |
N2 |
|
2) |
NН4ОН |
|
3) |
КNO3 |
|
4) |
NO2 |
|
A17 |
Коррозия металлов – это..
|
1) |
самопроизвольный окислительно-восстановительный процесс |
|
2) |
восстановительный процесс |
|
3) |
процесс, протекающий под действием электрического тока |
|
4) |
обменный процесс |
|
A18 |
К фенолам относится вещество, формула которого
|
1) |
C6H5 – O – CH3 |
|
2) |
C6H13 – O-С2Н5 |
|
3) |
C6H5 – OH |
|
4) |
C6H5 – CL |
|
A19 |
В молекулах какого вещества отсутствуют p-связи?
|
1) |
этина |
2) |
пропана |
3) |
этена |
4) |
гексена |
|
A20 |
Соляная кислота может реагировать с
|
1) |
гидроксидом лития |
|
2) |
уксусной кислотой |
|
3) |
золотом |
|
4) |
серебром |
|
A21 |
В схеме превращений
натрий ® X ® гидроксид натрия
веществом «Х» является
|
1) |
оксид натрия |
2) |
Хлорид натрия |
3) |
соляная кислота |
4) |
сера |
|
A22 |
К реакциям обмена относится соответственно
|
1) |
2Zn + O2 = 2ZnO |
|
2) |
C + O2 = CO2 |
|
3) |
K2SO4+ ZnCl2= 2KCl +Zn SO4 |
|
4) |
2Al + 3FeSO4 = Al2(SO4)3 + 3Fe |
|
A23 |
Газ, содержание которого в атмосфере составляет 79%:
|
1) |
O2 |
|
2) |
CO2 |
|
3) |
N2 |
|
4) |
CL2 |
|
A24 |
В какой системе повышение температуры смещает химическое равновесие в сторону продуктов реакции?
|
1) |
2SO2(г) + O2(г) |
|
2) |
N2(г) + О2(г) |
|
3) |
CO2(г) + 2C(тв.) |
|
4) |
2NH3(г) |
|
A25 |
В качестве катионов только ионы Н+ образуются при диссоциации
|
1) |
NaOH |
2) |
Nа3PO4 |
3) |
Na2SO4 |
4) |
HNO3 |
|
A26 |
Сокращенное ионное уравнение
Ba2+ + CO32– ® BaCO3
соответствует взаимодействию
|
1) |
хлорида бария и карбоната калия |
|
2) |
сульфида бария и углекислого газа |
|
3) |
гидроксида бария и угарного газа |
|
4) |
фосфата бария и карбоната калия |
|
A27 |
К сплавам железа относится:
|
1) |
бронза |
|
2) |
латунь |
|
3) |
дюралюминий |
|
4) |
чугун,сталь |
|
A28 |
Кислую среду имеет водный раствор
|
1) |
Na3PO4 |
|
2) |
KCl |
|
3) |
Na2CO3 |
|
4) |
ZnSO4 |
|
A29 |
Бутан горит :
|
1) |
голубоватым пламенем |
|
2) |
сильно коптящим пламенем |
|
3) |
с выделением пахучих веществ |
|
4) |
зеленоватым пламенем |
|
A30 |
При сжигании метана образуются
|
1) |
Этилен и вода |
|
2) |
Этан и водород |
|
3) |
этиловый спирт и азот |
|
4) |
углекислый газ и вода |
|
A31 |
Формула соединения углерода, проявляющего токсичные свойства,
|
1) |
NaHCO3 |
2) |
Na2CO3 |
3) |
CaCO3 |
4) |
CO |
|
A32 |
Реакции полимеризации пропилена соответствует схема
|
1) |
nCH2 = CH ® (– CH2 – CH2 – )n |
|
2) |
R× + CH2 = CHCl ® R – CH2 – CH× ÷ Cl |
|
3) |
2R× + CH2 = CH2 ® R – CH2 – CH2 – R |
|
4) |
CH2 = CH2 |
|
A33 |
Соединение состава С5Н12 относится к гомологическому ряду
|
1) |
алканов |
2) |
алкенов |
3) |
алкинов |
4) |
аренов |
|
A34 |
Пропилен является сырьем для получения полимера:
|
1) |
полипропилена |
2) |
полиэтилена |
3) |
каучука |
4) |
капрона |
|
A35 |
Гидролизу подвергаются:
|
1) |
алканы |
2) |
арены |
3) |
спирты |
4) |
белки |
В заданиях В1 – В4 на установление соответствия запишите в таблицу буквы выбранных вами ответов. (Буквы в ответе могут повторяться.)
|
B1 |
Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
|
НАЗВАНИЕ ВЕЩЕСТВА |
|
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
1) |
гидрокарбонат бария |
А) |
бескислородная кислота |
|
2) |
сероводородная кислота |
Б) |
щелочь |
|
3) |
бромоводородная |
В) |
основная соль |
|
4) |
гидроксид лития |
Г) |
кислородсодержащая кислота |
|
|
|
Д) |
амфотерный гидроксид |
|
|
|
Е) |
кислая соль |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
B2 |
Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней восстановителем.
|
|
СХЕМА РЕАКЦИИ |
|
ВОССТАНОВИТЕЛЬ |
|
1) |
Si + C ® SiC |
А) |
Si |
|
2) |
NO2 + Mg ® MgO + N2 |
Б) |
C |
|
3) |
SO2 + O2 ® SO3 |
В) |
Mg |
|
4) |
NO2 + SO2 ® SO3 + NO |
Г) |
NO2 |
|
|
|
Д) |
SO2 |
|
|
|
Е) |
O2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
B3 |
Установите соответствие между названием соли и типом гидролиза ее в водном растворе.
|
|
НАЗВАНИЕ СОЛИ |
|
ТИП ГИДРОЛИЗА |
|
1) |
сульфид марганца |
А) |
по катиону |
|
2) |
сульфид бария |
Б) |
по аниону |
|
3) |
нитрат цинка |
В) |
по катиону и аниону |
|
4) |
сульфит меди |
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
B4 |
Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
|
|
формулы веществ |
|
продукты электролиза |
|
1) |
LiCl |
А) |
Ca, O2 , Cl2 |
|
2) |
Fe(NO3)3 |
Б) |
Fe, H2, Cl2 |
|
3) |
Na2SO4 |
В) |
K, H2, SO3 |
|
4) |
FeCl3 |
Г) |
Fe, H2, O2 |
|
|
|
Д) |
H2, Cl2 |
|
|
|
Е) |
H2, O2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
Часть 2
|
B1 |
В соответствии с термохимическим уравнением
С6Н12О6 + 6О2 = 6СО2 + 6Н2О + 2816 кДж
выделится 1408 кДж теплоты, если в реакции участвует кислород количеством вещества
|
1) |
1,5 моль |
2) |
3 моль |
3) |
4,5 моль |
4) |
6 моль |
|
B2 |
Установите соответствие между формулой вещества и его названием.
|
|
ФОРМУЛА ВЕЩЕСТВА |
|
НАЗВАНИЕ |
|
А) |
СН3-СООН |
1) |
уксусная кислота |
|
Б) |
CH3CH2Cl |
2) |
этанол |
|
В) |
СН3СН2ОН |
3) |
хлорэтан |
|
Г) |
НСОН |
4) |
метаналь |
|
А |
Б |
В |
Г |
|
|
|
|
|
|
B2 |
Установите соответствие между схемой химической реакции и изменением степени окисления окислителя.
|
|
СХЕМА РЕАКЦИИ |
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
|
А) |
|
1) |
|
|
Б) |
|
2) |
|
|
В) |
|
3) |
|
|
Г) |
|
4) |
|
|
|
|
5) |
|
|
|
|
6) |
|
|
А |
Б |
В |
Г |
|
|
|
|
|
|
B3 |
Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора.
|
|
ФОРМУЛА ВЕЩЕСТВА |
|
ПРОДУКТ ЭЛЕКТРОЛИЗА |
|
А) |
AlCl3 |
1) |
алюминий |
|
Б) |
RbOH |
2) |
рубидий |
|
В) |
Hg(NO3)2 |
3) |
ртуть |
|
Г) |
AuCl3 |
4) |
водород |
|
|
|
5) |
кислород |
|
|
|
6) |
золото |
|
А |
Б |
В |
Г |
|
|
|
|
|
|
B4 |
Установите соответствие между формулой соли и средой ее водного раствора.
|
|
ФОРМУЛА СОЛИ |
|
СРЕДА РАСТВОРА |
|
А) |
K2SO4 |
1) |
нейтральная |
|
Б) |
CrCl3 |
2) |
кислая |
|
В) |
Li2CO3 |
3) |
щелочная |
|
Г) |
NH4Br |
|
|
|
А |
Б |
В |
Г |
|
|
|
|
|
В заданиях В5 – В8 на выбор правильных ответов из предложенного списка обведите цифры, под которыми обозначены правильные ответы
|
B5 |
Разбавленная серная кислота может реагировать с:
|
1) |
Ba(NO3)2 |
|
2) |
Fe2O3 |
|
3) |
Ag |
|
4) |
Zn(OH)2 |
|
5) |
SiO2 |
|
6) |
СН4 |
Ответ: ________________ .
|
B6 |
Для метана характерны:
|
1) |
реакция гидрирования |
|
2) |
тетраэдрическая форма молекулы |
|
3) |
наличие π- связи в молекуле |
|
4) |
sp3-гибридизация орбиталей атома углерода в молекуле |
|
5) |
реакции с галогеноводородами |
|
6) |
горение на воздухе |
Ответ: ________________ .
|
B7 |
Метаналь может реагировать с
|
1) |
HBr |
|
2) |
Ag[(NH3)2]OH |
|
3) |
С6Н5ОН |
|
4) |
С6Н5СН3 |
|
5) |
Na |
|
6) |
Н2 |
Ответ: _____________.
|
B8 |
Метиламин
|
1) |
газообразное вещество |
|
2) |
имеет окраску |
|
3) |
проявляет основные свойства |
|
4) |
является менее сильным основанием, чем аммиак |
|
5) |
реагирует с серной кислотой |
|
6) |
реагирует с водородом |
Ответ: _________________.
Ответом к заданиям В9, В10 является число. Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
|
B9 |
Масса фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12%-ного раствора гидроксида натрия, равна ___________ г.
(Запишите число с точностью до десятых.)
|
B10 |
При взаимодействии 56 л оксида серы (IV) и 48 л кислорода остается избыток кислорода объемом (н.у.) _________ л. (Запишите число с точностью до целых.)
Часть 3
|
Для записи ответов к заданиям этой части (С1 – С5) используйте выданный лист. Запишите сначала номер задания (С1 и т.д.), а затем полное решение. Ответы записывайте четко и разборчиво. |
|
C1 |
Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 +
… + H2SO4 ![]() I2
+ Cr2(SO4)3 + … + H2O
I2
+ Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
|
C2 |
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
|
C3 |
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
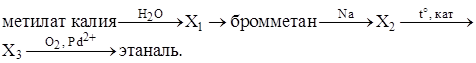
|
C4 |
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
|
C5 |
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного, или 101 г дибромпроизводного.
Инструкция по проверке и оценке работ учащихся по химии
ЧАСТЬ 1
Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается выполненным неверно.
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
№ задания |
Ответ |
|
А1 |
1 |
|
А11 |
3 |
|
А21 |
1 |
|
А2 |
1 |
|
А12 |
4 |
|
А22 |
3 |
|
А3 |
2 |
|
А13 |
4 |
|
А23 |
1 |
|
А4 |
2 |
|
А14 |
3 |
|
А24 |
3 |
|
А5 |
3 |
|
А15 |
3 |
|
А25 |
4 |
|
А6 |
3 |
|
А16 |
2 |
|
А26 |
1 |
|
А7 |
1 |
|
А17 |
1 |
|
А27 |
3 |
|
А8 |
2 |
|
А18 |
2 |
|
А28 |
4 |
|
А9 |
3 |
|
А19 |
1 |
|
А29 |
1 |
|
А10 |
2 |
|
А20 |
1 |
|
А30 |
2 |
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ на задания В1 – В8 ставится 2 балла, за правильный неполный – 1 балл, за неверный ответ (или при его отсутствии) – 0 баллов.
За правильный ответ на задания В9 и В10 ставится 1 балл, за неверный ответ – 0 баллов.
|
№ |
Ответ |
|
В1 |
4531 |
|
В2 |
3124 |
|
В3 |
4436 |
|
В4 |
1232 |
|
В5 |
124 |
|
В6 |
246 |
|
В7 |
236 |
|
В8 |
135 |
|
В9 |
11,6 |
|
В10 |
20 |
ЧАСТЬ 3
КРИТЕРИИ ПРОВЕРКИ И ОЦЕНкИ ВЫПОЛНЕНИЯ
ЗАДАНИЙ С РАЗВЁРНУТЫМ ОТВЕТоМ
Внимание! При выставлении баллов за выполнение задания в «Протокол проверки ответов на задания бланка № 2» следует иметь в виду, что если ответ отсутствует (нет никаких записей, свидетельствующих о том, что экзаменуемый приступал к выполнению задания), то в протокол проставляется «Х», а не «0» .
|
C1 |
Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 +
… + H2SO4 ![]() I2
+ Cr2(SO4)3 + … + H2O
I2
+ Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
||
|
Элементы ответа: 1) Составлен электронный баланс:
|
|
||
|
2) Расставлены коэффициенты в уравнении реакции: K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O |
|||
|
3) Указано, что иод в степени окисления – 1 является восстановителем, а хром в степени окисления + 6 (или дихромат натрия за счет хрома в степени окисления + 6) – окислителем. |
|||
|
Ответ правильный и полный, включает все названные выше элементы |
3 |
||
|
В ответе допущена ошибка только в одном из элементов |
2 |
||
|
В ответе допущены ошибки в двух элементах |
1 |
||
|
Все элементы ответа записаны неверно |
0 |
||
|
Максимальный балл |
3 |
|
C2 |
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Написаны четыре уравнения возможных реакций с участием указанных веществ: 1) S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O 2) S + 2H2SO4 (конц.) = 3SO2 + 2H2O 3) H2S + 2HNO3 (конц.) = S + 2NO2 + 2H2O 4) H2S + 3H2SO4 (конц.) = 4SO2 + 4H2O |
|
|
Правильно записаны 4 уравнения возможных реакций |
4 |
|
Правильно записаны 3 уравнения реакций |
3 |
|
Правильно записаны 2 уравнения реакций |
2 |
|
Правильно записано 1 уравнение реакции |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
4 |
|
Примечание. Дополнительно записанные (правильно или ошибочно) уравнения реакций не оцениваются. |
|
|
C3 |
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
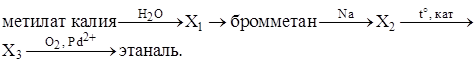
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: Написаны уравнения реакций, соответствующие схеме превращений: 1) CH3OK+ H2O 2) CH3OH + HBr 3) 2CH3Br + 2Na 4) С2H6 5) 2C2H4 + O2 |
|
|
Ответ правильный и полный, включает все названные выше элементы |
5 |
|
Правильно записаны 4 уравнения реакций |
4 |
|
Правильно записаны 3 уравнения реакций |
3 |
|
Правильно записаны 2 уравнения реакций |
2 |
|
Правильно записано одно уравнение реакции |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
5 |
|
C4 |
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Составлено уравнение химической реакции между серной кислотой и карбонатом калия: К2CO3 + H2SO4 = К2SO4 + H2O + CO2↑
2) Рассчитаны количества веществ, вступивших в реакцию и полученных в ходе реакции: В каждых 100 г раствора серной кислоты содержится 5 г её или n(H2SO4) = 5/98 = 0,051 моль n(K2CO3) = n(H2SO4) = 0,051 моль, n(CO2) = n(H2SO4) = 0,051 моль, n(K2SO4) = n(H2SO4) = 0,051 моль,
3) Рассчитаны массы веществ: m(K2CO3) = nM = 0,051∙138 = 7,04 г m(K2SO4) = nM = 0,051∙174= 8,87 г m(CO2) = nM = 0,051∙44 = 2,24 г
4) Найдена масса раствора и определена массовая доля сульфата калия в нем: m(раствора) = 100 + 7,04 – 2,24 = 104,8 г w(K2SO4) = |
|
|
Ответ правильный и полный, включает все названные выше элементы |
4 |
|
В ответе допущена ошибка в одном из названных выше элементов |
3 |
|
В ответе допущена ошибка в двух из названных выше элементов |
2 |
|
В ответе допущена ошибка в трех из названных выше элементов |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
4 |
|
C5 |
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного, или 101 г дибромпроизводного.
Ответ:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Элементы ответа: 1) Записаны уравнения реакций: CnH2n + Cl2 → CnH2nCl2 CnH2n + Br2 → CnH2nBr2
2) Указано, что n(CnH2n) одно и то же в двух реакциях (или что количества веществ галогеналканов равны друг другу): n(CnH2nCl2) = n(CnH2nBr2)
3) Найдена молекулярная формула алкена: 56,5/(14n+71) = 101/(14n+160) n = 3 Молекулярная формула С3Н6 |
|
|
Ответ правильный и полный, включает все названные выше элементы |
3 |
|
Правильно записаны два первых элемента из названных выше |
2 |
|
Правильно записан один из названных выше элементов (1-й или |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
3 |
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.