
1. Методы определения по характеру измеряемого свойства делятся на:
1. Химические, физические, физико-химические.
2. Титриметрические, гравиметрические.
3. Спектральные, оптические, электрохимические.
4. Потенциометрические, полярографические.
5. Кулонометрические, кондуктометрические
2. Для разделения и концентрирования применяет методы:
1. Экстракции, соосаждение, хроматографии.
2. Осаждения, титриметрия, перманганатометрия.
3. Титриметрия, комплексонометрия, аргентометрия.
4. Кулонометрия, кондуктометрия, полярография.
5. Потенциометрия, кондуктометрия, кулонометрия.
3. Аналитическая химия – это наука:
1. Об определении химического состава веществ и отчасти их химического строения.
2. Об определении химического состава.
3. Об определении химического строения.
4. Об определении химической структуры.
5. Об определении содержания составных частей сложного материала.
4. Методы основанные на измерении параметров в полученной системе химических реакций называются:
1. Физическими.
2. Химическими.
3. Физико-Химическими.
4. Кулонометрическими.
5. Потециометрическими.
5. Методы основанные на превращениях, протекающих в растворах с образованием осадков, окрашенных соединений, или газообразных веществ называются:
1. Физическими.
2. Химическими.
3. Физико-Химическими.
4. Кулонометрическими.
5. Потенциометрическими.
6. Изменение цвета, выделение газа, образование или растворение осадка в химических реакциях называется:
1. Аналитическим Сигналом.
2. Внешним Эффектом.
3. Качественным Анализом.
4. Внешним Наблюдением.
5. Качественным Показателем.
7. Реакции и реагенты, дающие возможность открывать данный ион в присутствии других ионов -
1. Избирательные;
2. Групповые;
3. Характерные;
4. Специфические;
5. Частные.
8. Прием связывания мешающих ионов в достаточно прочные комплексы -
1. Дробный ход анализа;
2. Систематический ход анализа;
3. Аналитическая «маскировка»;
4. Специфическая реакция;
5. Избирательная реакция.
9. Ход анализа, при помощи которого можно обнаружить интересующий ион в присутствии других ионов называется -
1. Дробным ходом анализа;
2. Систематическим ходом анализа;
3. Аналитической «маскировкой»
4. Избирательной реакцией;
5. Специфической реакцией.
10. Аналитические эффекты качественного анализа -
1. Изменение концентрации, температуры;
2. Изменение рН раствора;
3. Изменение окраски раствора, выделение газа;
4. Изменение объема, плотности;
5. Изменение массы, плотности.
11. Аналитическая реакция называется специфичной, если внешний эффект характерен:
1. нескольким ионам
2. только одному иону
3. всем ионам
4. одному катиону
5. нескольким веществам
12. Теория электролитической диссоциации предложена -
1. шведским ученым С. Аррениусом
2. американским ученым П. Дебаем
3. американским ученым Е. Гюккелем
4. Л.А. Чугаевым
5. С.Д. Бесковым
13. Процесс ионизации слабого электролита, на основе закона действующих масс.
1. Обратимый и к нему применим закон действия масс
2. Не обратимый и к нему применим закон действия масс
3. Не обратимый и к нему не применим закон действия масс
4. Не обратимый
5. Не рассматривается
14. Процесс диссоциации сильного электролита –
1. обратим, и к нему применим закон действия масс
2. необратим, и к нему не применим закон действия масс
3. обратим, и к нему не применим закон действия масс
4. не обратим, и к нему применим закон действия масс
5. сильные электролиты не диссоциируют
15. Коэффициенты активности могут принимать значения -
1. fa > 1
2. fa < 1
3. fa >> 1
4. fa > 1,5
5. fa > 2
16. Водородный показатель -
1. молярная концентрация ионов водорода в растворе
2. молярная концентрация ионов гидроксида в растворе
3. отрицательный логарифм молярной концентрации ионов водорода в растворе
4. отрицательный логарифм молярной концентрации ионов гидроксида
5. концентрация ионов водорода
17. Гидроксидный показатель
1. молярная концентрация ионов водорода в растворе
2. молярная концентрация ионов гидроксида в растворе
3. отрицательный логарифм молярной концентрации ионов водорода в растворе
4. отрицательный логарифм молярной концентрации ионов гидроксида
5. концентрация ионов водорода
18. Правильное выражение между водородным и гидроксидным показателем -
1. рН + рОН = 14
2. рН - рОН = 14
3. рН - рОН = 7
4. рН + рОН = 7
5. рН - рОН = 10
19. Ион водорода в нейтральном растворе -
1. [H+] = 10-7 моль/л
2. [H+] > 10-7 моль/л
3. [H+] < 10-7 моль/л
4. [H+] = 10-3 моль/л
5. [H+] = 10-1 моль/л
20. Значение рН более кислого раствора -
1. 6
2. 3
3. 2
4. 1
5. 7
21. Значение рН более щелочного раствора -
1. 8
2. 10
3. 12
4. 13
5. 7
22 . Вычислите молярную концентрацию ионов водорода в растворе при рН = 10.
1. 1*10-4
2. 1*10-10
3. 1*10-7
4. 1*10-8
5. 1*10-6
23. Какое вещество надо добавлять, чтобы величина рН раствора уменьшилась с 3 до 1?
1. кислоту
2. щелочь
3. уводу
4. буферный раствор
5. слабое основание
24. Реально действующая концентрация -
1. общая аналитическая концентрация
2. активность ионов
3. массовая доля
4. концентрация ионов
5. молярная концентрация
25. Диссоциация сильного электролита протекает -
1. полностью, процесс не обратимый
2. процесс обратимый
3. частично процесс обратимый
4. не диссоциируется
5. нет верного ответа
26. Буферный раствор -
1. CH3COOH + CH3COONa
2. HCl + HNO3
3. HCl + H2O2
4. NaOH + NaCl
5. HOH + HCl
27. Раствор какого из перечисленных веществ имеет рН больше 7?
1. СН3СООН
2. NH4OH + NH4Cl
3. СН3СООН + CH3COONa
4. НСООН
5. НСООН + НCOONa
28. Концентрация ионов водорода [Н+] в растворе равна 1*10-4 моль/л. Вычислить рН.
1. 10
2. 6
3. 5
4. 4
5. 3
29. Концентрация ионов водорода [Н+] в растворе равна 1*10-4 моль/л. Вычислить рОН.
1. 10
2. 6
3. 5
4. 4
5. 3
30. Активность ионов в растворе -
1.
![]() ;
;
2.
![]() ;
;
3.
![]() ;
+
;
+
4.
![]() ;
;
5.
![]() .
.
31. Ионное произведение воды -
1.
![]()
2.
![]() ;
;
3.
![]() +
+
4.
![]() ;
;
5.
![]() .
.
32. Буферный раствор -
1. Ch3COOH + CH3COONa;
2. NaOH + NaCl;
3. КОН + КСl
4. HCl+ H2SO4
5. NaOH + HCl.
33. Гомогенная система
1) Осадок – раствор.
2) Раствор – раствор.
3) Газ – раствор.
4) Газ – осадок.
5) Раствор – осадок.
34. Согласно закону действующих масс:
1) Скорость реакции равна сумме концентраций реагирующих веществ.
2) Скорость реакций равна произведению концентраций реагирующих веществ.
3) Скорость реакций не зависит от концентраций реагирующих веществ.
4) Скорость реакций равна концентраций исходного вещества.
5) Скорость реакций равна концентраций образующихся веществ.
35. Согласно теорий электрической диссоциаций Аррениуса к кислотам относятся соединения:
1) Диссоциирующие с отщеплением ионов водорода.
2) Диссоциирующие с отщеплением гидроксид-ионов.
3) Не диссоциирующие в водных растворах.
4) Диссоциирующие с отщеплением ионов водорода и гидроксид-ионов.
5) Диссоциирующие с отщеплением катионов металла.
36. Согласно теории электрической диссоциации Аррениуса к основаниям относятся соединения:
1) Диссоциирующие с отщеплением ионов водорода.
2) Диссоциирующие с отщеплением гидроксид-ионов.
3) Не диссоциирующие в водных растворах.
4) Диссоциирующие с отщеплением ионов водорода и гидроксид-ионов.
5) Диссоциирующие с отщеплением катионов метала.
37. Активность для бесконечно разбавленных растворов:
1. а=c.
2.
а #c.![]()
3. a<c.
4. a>c.
5. a=1.
38. Правильное выражение активности:
1. a=f 2 . C.
2. a=f .C.
3. a=f . C2.
4. a=f . √C
5. a=√f . C
39. Коэффициент активности (f) равен 1:
1) В концентрированных растворах электролитов.
2) В разбавленных растворах слабых электролитов.
3) В концентрированных растворах слабых электролитов.
4) В растворах сильных электролитов с концентрацией >10 -4 М.
5) В растворах сильных электролитов с концентрацией >10 -2 М.
40. Коэффициент активности учитывает -
1) Электростатическое ионное взаимодействие.
2) Химическое ионное взаимодействие.
3) Изменение активности воды.
4) Взаимодействие аниона с водой.
5) Взаимодействие катиона с водой.
41. Правильное выражение концентрационной константы гомогенного равновесия для реакции nA + mB ↔ pC + qD:
1.
Kc
= ![]() .
.
2.
Kc
= ![]() .
.
3.
Kc
= ![]() . +
. +
4.
Kc
= ![]()
![]() .
.
5.
Kc
= ![]() .
.
42. Правильное выражение концентрационной константы равновесия реакций CH3COOH↔ CH3COO- + H+
1.
![]()
2.
![]() +
+
3.
![]()
4.
![]()
5.
![]()
43. рН сильной кислоты учитывая Скисл.= [ H+]
1. рН= lg[ H+].
2. рН= - lg[ ОH-].
3. рН= - lg[ H+]2.
4. рН= - lgCк-ты..
5. рН = - lgC2к-ты..
44. Формула расчета рОН сильного основания учитывая Сосн.= [ ОH-]
1. рОН= lg[ ОH-]
2. рОН= - lg[ H+]
3. рОН= lg[ H+]
4. рОН= - lgCосн
5. рОН = √- lgC2осн
45. рН 0,1 М раствора HCl равен:
1.
2. 1.
3. 2 .
4. 4.
5. 3.
6. 5.
46. рОН 0,1 М раствора NaOH равен:
1. 4.
2. 2 .
3. 1.
4. 3.
5. 5.
47. Кислый буферный раствор -
1. СН3СООН + HCl.
2. СН3СООNa + NaCl.
3. СН3СООNa + СН3СООН.
4. СН3СООNa + NaOH.
5. СН3СООNa + Na2SO4.
48. Основной буферный раствор -
1. NaOH + NaCl.
2. NaCl + NH4OH.
3. NH4OH + NH4Cl.
4. NH4OH + HCl.
5. NH4OH + H2SO4.
49 . Ионная сила (μ) раствора NaCl с общей концентрацией С -
1. С.
2. 2С.
3. 6С.
4. 4С.
5. 8С.
50. Ионная сила 0,1М раствора NaCl равна:
1. 0,01.
2. 0,1.
3. 0,05.
4. 0,02.
5. 0,03.
51. Правильное выражение термодинамической константы равновесия для реакции
CH3COOH↔H+ + CH3COO-.
1.
Kт
= ![]() .
.
2.
Kт
= 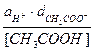 .
.
3.
Kт = 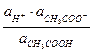 .
. ![]() +
+
4.
Kт = ![]() .
.
5.
Kт = ![]() .
.
52. Формула расчета [ H+] для разбавленного раствора НСl:
1.
![]() +
+
2.
![]()
3.
![]()
53. Формула расчета [ ОH-] для разбавленного раствора NaОН:
1.
![]()
2.
![]()
3.
![]()
4.
![]() +
+
5.
![]()
54. Правильное выражение термодинамической константы равновесия для реакции mA+nB↔pC+qD
1.
![]() +
+
2.
![]() .
.
3.
![]()
5.
![]() .
.
55. Фактор эквивалентности (fэкв.) Н3РО4 в реакции
NaOH+H3P04 ![]() NaH2PO4+H20?
NaH2PO4+H20?
56. Фактор эквивалентности (fэкв.) Н3РО4
в реакции 2NaOH+H3P04![]() Na2HP04+2H20 ?
Na2HP04+2H20 ?
57. Фактор эквивалентности (fэкв.) КМnО4 в реакции 2КМnO4+10FеSO4+8Н2SO4![]() 2МnS04+5Fе2(S04)з+K2SO4+8H2O
2МnS04+5Fе2(S04)з+K2SO4+8H2O
1. 1/2.
58. Правильное выражение массовой доли растворенного вещества ω(х)
1.
![]() .
.
2.
![]() .
.
3.
![]() +
+
59. Массовая доля растворенного вещества ω % (х) показывает:
1. Сколько граммов вещества растворено в 100 мл раствора.
2. Сколько граммов вещества растворено в 100 г вещества.
3. Сколько граммов вещества растворено в 1 л раствора.
60. Правильное выражение количества вещества:
1.
υ (х) = ![]() .
.
2.
υ (х) =![]() . +
. +
61. В химически чистой воде концентрация ионов водорода и гидроксида равны
1) ![]()
2) ![]()
3) ![]() +
+
4) ![]()
5) ![]()
62. В каком случае ![]() = Скисл ?
= Скисл ?
1) В коцентрированном растворе сильной кислоты;
2) В разбавленном растворе сильной кислоты;
3) В концентрированном растворе слабой кислоты;
4) В разбавленном растворе слабой кислоты;
5) правильного ответа нет.
63. В каком случае ![]() = Сосн?
= Сосн?
1) В коцентрированном растворе сильного основания;
2) В разбавленном растворе сильного основания;
3) В концентрированном растворе слабого основания;
4) В разбавленном растворе слабого основания;
5) правильного ответа нет.
64. При рОН=13, концентрация гидроксид ионов:
1) [ОН-] = 10-5
2) [OH-] = 0,1;
3) [OH-] = 10-7;
4) [OH-] = 10-13
5) [OH-] = 1.
65. Формула произведения растворимости малорастворимого соединения KaAb:
1. ПР KaAb = [K]a ∙ [A]b.
2. ПР KaAb =[K]a + [A]b.
3. ПР KaAb =a[K] ∙ b[A].
4. ПР KaAb =[K]a + [A]b.
5. ПР KaAb =a[K]a ∙ b[A]b.
66. Формула произведения растворимости малорастворимого соединения PbI2:
1. ПРPbI2 = [Pb2+] + [I-]2.
2. ПРPbI2 = [Pb2+] ∙ [I-]2.
3. ПРPbI2 = [Pb2+] ∙ 2[I-].
4. ПРPbI2 = [Pb2+] ∙ [I2].
5. ПРPbI2 = [Pb2+] ∙ [I-].
67. Формула произведения растворимости малорастворимого соединения Ca3(PO4)2:
1.
![]()
2.
![]()
3.
![]() +
+
4.
![]()
5.
![]()
68. Формула произведения растворимости малорастворимого соединения Ag3PO4:
1. ПРAg3PO4 = 3[Ag+] ∙ [PO43-].
2. ПРAg3PO4 = [Ag+]3 ∙ [PO43-].
3. ПРAg3PO4 = [Ag+]3 + [PO43-].
4. ПРAg3PO4 = 3[Ag+] + [PO43-].
5. ПРAg3PO4 = 3[Ag+]3 + [PO43-].
69. Наименее растворимым соединением является
1. AgBr(ПР = 5,3 ∙ 10-13).
2. CdS(ПР = 1,6 ∙ 10-28).
3. CuS(ПР = 6,3 ∙ 10-36).
4. BaCO3(ПР = 5 ∙ 10-19).
5. Ca(OH)2(ПР = 5,5 ∙ 10-6).
70. Наиболее растворимым соединением является
1. CaSO4(ПР = 2,37 ∙ 10-5).
2. MgCO3(ПР = 2,1 ∙ 10-5).
3. BaCO3(ПР = 1,1 ∙ 10-7).
4. AgCl(ПР = 1,8 ∙ 10-10).
5. CaCO3(ПР = 4,8 ∙ 10-9).
71. К малорастворимым относится
1. CaSO4(ПР = 2,37 ∙ 10-5).
2. MgCO3(ПР = 2,1 ∙ 10-5).
3. BaC2O4(ПР = 1,1 ∙ 10-7).
4. AgCl(ПР = 1,8 ∙ 10-10).
5. CaCO3(ПР = 4,8 ∙ 10-9).
72. Условия растворения осадка Сu(ОН)2 :
1.
[Cu2+]
[OH-]2 > ![]()
2.
[Cu2+]
[OH-]2 = ![]()
3.
[Cu2+]
[OH-]2 < ![]() . +
. +
4.
[Cu2+]
[OH-]2 ![]()
![]()
5.
[Cu2+]
[OH-]2 =![]() .
.
73. Условия динамического равновесия в гетерогенной системе
КА ![]() К++А-
К++А-
1.
K+] [A-]
= ![]() +
+
2.
[K+] [A-]
> ![]()
74. Условия ненасыщенного раствора в гетерогенной системе
КА ![]() К++А-
К++А-
1.
[K+]
[A-] = ![]() .
.
75. Условия динамического равновесия в гетерогенной системе
Ag2CrO4![]() 2Ag+ CrO
2Ag+ CrO![]()
1.
[Ag+]2[Cr042-]
= ![]() +
+
2.
[Ag+]2[Cr042-]
> ![]() .
.
3.
[Ag+]2[Cr042-]
< ![]() .
.
4.
[Ag+]2[Cr042-]![]()
![]() .
.
5.
[Ag+]2[Cr042-] =![]()
76. Условия выпадения осадка в гетерогенной системе
Ag2CrO4 ![]() 2Ag+ +CrO
2Ag+ +CrO![]()
1.
[Ag+]2[Cr042-]
= ![]() .
.
2.
[Ag+]2[Cr042-]
> ![]() . +
. +
3.
[Ag+]2[Cr042-]
< ![]()
4.
[Ag+]2[Cr042-]![]()
![]() .
.
5.
[Ag+]2[Cr042-]
=![]()
77. Объём осадителя рекомендуется брать для анализа
1. эквивалентный
2. произвольно избыточный
3. полуторократный
4. стехиометрический
5. меньше стехиометрического
78. ПР соединения AmBn которой образуется в результате реакции mA+nB![]() AmBn:
AmBn:
1.
![]() ;
;
2.
ПР = ![]() ; +
; +
3.
ПР = ![]() ;
;
4.
ПР = ![]() ;
;
5.
ПР = ![]() .
.
79. Гетерогенными системами называются системы
1. Состоящие из одной фазы
2. состоящие из 2 фаз
3. состоящие из 2 смешивающихся растворов
4. не имеющие границы раздела
5. имеющие границы раздела
80. Гетерогенная (не однородная) система состоит из двух фаз
1. насыщенного раствора электролита и осадка
2. раствор-раствор
3. смесь газов
4. смесь растворов
5. смесь труднорастворимых солей
![]()
![]() 81.
Mg(OH)2 Mg2+ + 2OH-
81.
Mg(OH)2 Mg2+ + 2OH-
Осадок раствор
Чтобы осадок растворить лучше прилить:
1. щелочь
2. кислоты
3. воду
4. гидроксид натрия
5. гидроксид аммония
82. Чтобы растворить сульфаты 3-й группы катионов их переводят
1. в карбонаты
2. в нитраты
3. в сульфаты
4. в фосфаты
5. в оксиды
83. Гидролизу не подвергается
1. Нитрит калия
2. Нитрат калия
3. Ацетат натрия
4. Хлорид аммония
5. Ацетат аммония
84. Причина гидролиза солей
1. Образование малоионизированных соединений
2. Образование малорастворимых соединений
3. Образование малоионизированных и малорастворимых соединений
4. Образование сильных электролитов
5. Образование растворимых соединений
85. Гидролизу не подвергается
1. Нитрит калия
2. Хлорид натрия
3. Ацетат натрия
1. Хлорид аммония
2. Ацетат аммония
86. Не подвергается гидролизу
1. Нитрит калия
2. Хлорид калия
3. Ацетат натрия
4. Хлорид аммония
5. Ацетат аммония
87. Подвергается гидролизу
1. хлорид натрия
2. хлорид калия
3. нитрат калия
4. нитрат натрия
5. ацетат натрия
88. Подвергается гидролизу
1. хлорид калия
2. хлорид натрия
3. нитрат натрия
4. нитрат калия
5. хлорид аммония
89. Гидролизу подвергается
1. хлорид калия
2. хлорид натрия
3. нитрат натрия
4. нитрат калия
5. ацетат аммония
90. Способность ряда электролитов проявлять (в зависимости от условий) как кислотные, так и основные свойства называется
1. амфотерностью
2.кислотностью
3.щелочностью
4.нейтральностью
5. основностью
91. Свойства амфотерность показывает
1. NaOH
2.Zn(OH)2
3.KOH
4. Mg(OH)2
5. Fe(OH)3
92. Указать правильное выражение уравнения Нернста:
1.
E = ![]() .
.
2.
E=E0 + ![]() . +
. +
3.
E=E0 – RTln - ![]() .
.
4.
E = E0 + ![]() .
.
5.
E = E0 + 2,3![]() .
.
93. Выделите более сильную восстановительную пару
1.
![]() . +
. +
2.
![]() .
.
3.
![]() .
.
4.
![]() .
.
5.
![]() .
.
94. Выделите более сильную восстановительную пару
95. Выделите более сильную восстановительную пару
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
4.
![]() .
.
5.
![]() . +
. +
96. Выделите более сильную окисьлительную пару
1.
![]()
2.
![]()
3.
![]() +
+
4.
![]()
5.
![]()
97. Выделите более сильную окисьлительную пару
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
4.
![]() .
.
5.
![]() . +
. +
98. ЭДС редокс реакций выражается формулой
1. ЭДС= Е0ох –Е0 red;
2. ЭДС= Е0 red– Е0ох;
3. ЭДС= Е0ох +Е0 red ;
4.
![]() ;
;
5.
![]()
![]() .
.
99. Групповой реагент на катионы II аналитической группы
1. NaOH.
2. NH4OH.
3. HCl.
4. H2SO4.
5. HNO3 .
100. Групповой реагент на катионы III аналитической группы
1. HCl.
2. NaOH.
3. H2SO4.
4. NH4OH.
5. HNO3.
101. Осаждается действием хромата калия в уксусной среде
1. Ca2+.
2. Ba2+.
3. K+.
4. NH4-.
5. Na+.
102. Образует малорастворимый сульфат катион
1. K+.
2. Ba2+.
3. Mn2+.
4. Co2+.
5. Fe3+ .
103. Аналитическая реакция называется специфической, если внешний эффект характерен:
1. Нескольким ионам.
2. Только одному иону.
3. Всем ионам.
4. Одному катиону.
5. Нескольким веществам.
104. Осадок AgCl растворяется в реагенте
1. HCl.
2. NH4OH.
3. H2O.
4. CH3COOH.
5. H2SO4.
105. В избытке NaOH растворяется
1.Zn(OH)2
2.Mg(OH)2
3.Fe(OH)3
4.Mn(OH)2
5.Ca(OH)2
106. В избытке NaOH растворяется
1. Mg(OH)2
2.Al(OH)3
3.Fe(OH)3
4.Mn(OH)2
5.Ca(OH)2
107. Методы количественного анализа подразделяются на:
1. химические
2. Физические
3. физико-химические
4. Полярографические
5. химические, физические, физико-химические
108. Гравиметрический анализ основан на:
1. Выделении определяемого компонента в виде малорастворимого соединения.
2. Выделении определяемого компонента в виде малорастворимого соединения в спирте.
3. Выделении определяемого компонента в виде достаточно растворимого соединения.
4. Выделении нескольких определяемых компонентов в виде малорастворимых соединений.
5. Взвешивание осадка.
109. Осаждаемая форма это:
1. Осадок малорастворимого соединения определяемого компонента.
2. Осадок малорастворимого соединения определяемого компонента, полученный после высушивания.
3. Осадок малорастворимого соединения определяемого компонента, полученный после прокаливания.
4. Осадок малорастворимого соединения определяемого компонента, полученный после перекристаллизации.
5. Осадок малорастворимого соединения, полученный при 100°С.
110. Гравиметрическая форма - это:
1. Осадок малорастворимого соединения определяемого компонента.
2. Осадок малорастворимого соединения определяемого компонента, полученный после высушивания или прокаливания.
3. Осадок малорастворимого соединения определяемого компонента, полученный после фильтрации.
4. Осадок малорастворимого соединения определяемого компонента, полученный после многократного промывания водой.
5. Осадок малорастворимого соединения, полученный при (
100°С.
111. Какой из гравиметрических факторов следует использовать при вычислении содержания железа в руде, если применить метод осаждения его в виде гидроксида?
1. ![]()
2. ![]() +
+
3. ![]()
4. ![]()
5. ![]()
112. Какой из гравиметрических факторов следует использовать при вычислении содержания бария, если применить метод осаждения его в виде сульфата бария?
1. ![]()
2. ![]()
3. ![]() +
+
4. ![]()
5. ![]()
113. Какой из гравиметрических факторов следует использовать при вычислении содержания ![]() , если применить метод осаждения его в виде сульфата бария?
, если применить метод осаждения его в виде сульфата бария?
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
114. Чему равен гравиметрический фактор при определении кальция в виде сульфата кальция?
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
115. Чему равен гравиметрический фактор
при определении ![]() , если гравиметрической
формой является
, если гравиметрической
формой является ![]() :
:
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
116. Чему равен гравиметрический фактор
при определения ![]() , если гравиметрической
формой является
, если гравиметрической
формой является ![]() :
:
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
117. Титриметрический анализ основан:
1. На точном измерении объёма титранта, расходуемого на реакцию с определяемым веществом.
2. На измерение массы титранта, расходуемого на реакцию с определяемым веществом.
3. На измерение количества титранта, расходуемого на реакцию с определяемым веществом.
4. На измерение объёма всех реагентов участвующих в реакции
5. На измерение объёма анализируемого вещества.
118. Что называется титром раствора?
1. Масса вещества в граммах, содержащаяся в 1 л раствора;
2. Масса вещества в граммах, содержащаяся в 1 мл раствора;
3. Количество эквивалентов вещества, содержащееся в 1 л раствора;
4. Масса вещества в граммах, содержащаяся в 1 мл растворителя;
5. Объём вещества в мл, содержащегося в 1000 г раствора.
119. Титр определяется формулой
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
120. Титр определяется формулой
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
121. Эквивалент в кислотно-основной реакции это:
1. Условная частица данного вещества, эквивалентная всем ионам водорода в данной реакции.
2. Условная частица данного вещества, эквивалентная одному гидроксид-иону в
данной реакции.
3. Условная частица данного вещества, эквивалентная одному иону водорода в данной реакции.
4. Условная частица данного вещества, эквивалентная всем гидроксид-ионам в данной реакции.
5. Условная частица, эквивалентная всем ионам в данной реакции.
122. Эквивалент в окислительно- восстановительной реакции это:
1. Условная частица данного вещества, эквивалентная одному электрону в данной реакции.
2. Условная частица данного вещества, эквивалентная общему числу электронов в данной реакции.
3. Условная частица данного вещества, эквивалентная одному иону водорода в данной реакции.
4. Условная частица данного вещества, эквивалентная одной молекуле воды в данной реакции.
5. Условная частица, эквивалентная одному гидроксид-иону в данной реакции.
123. Фактором эквивалентности (![]() ) называется:
) называется:
1. Число, показывающее какая доля частица (молекулы, атома, иона) эквивалентна в данной реакции одному иону водорода или электрону.
2. Число, показывающее какая доля частица эквивалентна в данной реакции общему числу ионов водорода.
3. Число, показывающее какая доля частица эквивалентна в данной реакции общему числу электронов.
4. Число, показывающее какая доля частица эквивалентна в данной реакции одной молекуле воды.
5. Число, показывающее какая доля частица эквивалентна всем ионам в данной реакции.
124. По какой формуле определяется титра ![]() ?
?
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
125. Указать правильное выражение основной формулы расчета в титриметрии:
1. ![]()
2. ![]() +
+
3. 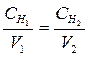
4. 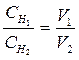
5. ![]()
126. 2,5 г. карбоната натрия растворено в колбе емкостью 500 мл. Каков титр раствора карбоната натрия?
1. 1г/мл.
2. 2 мг/мл.
3. 0,5 мг/мл.
4. 0,005 г/мл. +
5. 0,01 мг/мл.
127. Найти титр 0,1000 н раствора ![]() ,
, ![]() =
36,5 г/моль
=
36,5 г/моль
1. 0,00365 г/мл.
2. 0,00232 г мл.
3. 0,00325 г/мл.
4. 0,00152 г/мл.
5. 0,00115 г/мл.
128. Чему равен фактор эквивалентности (![]() )
)![]() в
реакции:
в
реакции:
![]()
1. 1
2. 1/3
3. 1/2
4. 3
5. 1/4
129. Чему равен фактор эквивалентности (![]() )
) ![]() в
реакции:
в
реакции:
![]() (нейтральная
среда)
(нейтральная
среда)
1. 2
2. 1/4
3. 1/3
4. 1
5.1/2
130. Чему равен фактор эквивалентности (![]() ) соляной кислоты в
реакции:
) соляной кислоты в
реакции:
![]()
1. 1
2. 2
3. 3
4. 4
5. 5
131. Чему равен фактор эквивалентности (![]() ) карбоната натрия в
реакции:
) карбоната натрия в
реакции:
![]()
1. 1
2. 1/3
3. 1/2
4. 1
5. 2
132. По какой формуле определяется ![]() ?
?
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
133. По какой формуле определяется ![]() ?
?
1. ![]() +
+
2. ![]()
3. ![]()
4. ![]()
5. ![]()
134. Чему равна молярная концентрация эквивалента (нормальная концентрация) 1м HNO3?
1. 0,5н
2. 1н
3. 2н
4. 3н
5. 4н
135. В основе метода кислотно-основного титрования положена реакция взаимодействия:
1. ионов гидроксония или водорода с ионами гидроксила
2. ионов водорода с кислотными остатками
3 ионов гидроксила с кислотными остатками
4. ионов гидроксила с ионами металла
5. ионов водорода с ионами галогенов
136. в основе метода кислотно-основного титрования положена реакция:
1. ![]()
2. ![]() +
+
3. ![]()
4. ![]()
5. ![]()
137. Метод кислотно-осного титрования основан на реакции:
1. нейтрализации
2. комплексообразования
3. окисления-востановления
4. реакция осаждения
5. реакция разложения
138. С помощью каких индикаторов фиксируется точка эквивалентности по методу кислотно-основного титрования?
1. адсорбционных индикаторов
2. редокс – индикаторов
3. pH – индикаторов
4. индикаторов – реагентов
5. индикаторов окисления-восстановления
139. Чему равен интервал перехода окраски индикатора
тимолового синего, ![]() которого равен 8,9
которого равен 8,9
1. 9,9
2. 7,9
3. 7,9 – 9,9
4. 5,8 – 7,8
5. 6 – 8
140. В эквивалентной точке потенциал системы определяется формулой
1. ![]() +
+
2. ![]()
3. Е=Е0
4. ![]()
5. ![]()
141. Молярная масса эквивалента тиосульфата натрия в методе иодометрии равна
1. ![]()
2. ![]() +
+
3. ![]()
4. ![]()
5. ![]()
142. Дифениламин NH(C6H5)2 относится к
1. рН – индикаторам
2. редокс – индикаторам
3. одноцветным рН – индикаторам
4. раегентам
5. титрантам
143. Как называется метод, основанный на реакциях осаждения ионов галогенидов в виде малорастворимых солей ртути (I)?
1. аргентометрией
2. меркурометрией
3. роданидометрией
4. алкалиметрия
5. ацидиметрией
144. Как называется метод, который в качестве рабочим раствором является соли ртути (II)?
1. аргентометрией
2. алкалиметрия
3. роданометрией
4. меркуриметрией
5. ацидиметрией
145. Как называется метод, основанный на реакциях осаждения ионов галогенидов нитратом серебра?
1. аргентометрией
2. меркурометрией
3. роданидометрией
4. меркуриметрией
5. ацидиметрией
146. По методу Фольгарда можно определить ион:
1. NO3-
2. Cl-
3. Na+
4. K+
5. NH4+
147. При аргентометрическом определении какой осадок образуется
1. AgCl
2. CaSO4
3. BaSO4
4. PbI2
5. Fe(OH)3
148. Какие индикаторы применяются в методах комплексонометрии?
1) Металло-хром индикаторы
2) рН-индикаторы
3) адсорбционные индикаторы
4) редокс индикаторы
5) индикаторы методов нейтрализации
149. Металло-хром индикаторы – это
1) органические красители, образующие с катионами окрашенные комплексные соединения
2) красители, образующие с катионами кристаллические осадки
3) красители, образующие с катионами аморфные осадки
4) органические красители, образующие с катионами бесцветные растворы
5) органические красители, образующие с катионами труднорастворимые соединения
150. Какие индикаторы применяются в методах комплексонометрии?
1) хромоген черный, мурексид
2) метиловый оранжевый, фенолфталеин
3) метиловый красный, фенолфталеин
4) эозин, флюоресцеин
5) хромат калия, железоаммонийные квасцы
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.