
|
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж»
Дисциплина «Химия» |
|
|
|
|
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ТЕМА «ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ: МЕТАЛЛЫ И НЕМЕТАЛЛЫ»
|
|
|
|
|
|
Торжок, 2019
|
|
|
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж» |
||
|
Рецензент должность,
место работы __. __. 2019 |
УТВЕРЖДАЮ зам. директора по УМР _____________ О.В.Гамелько __. __. 2019
|
|
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА «ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ: МЕТАЛЛЫ И НЕМЕТАЛЛЫ»
Составлена в соответствии с ФГОС СПО
|
||
Содержание
|
Пояснительная записка
|
3 |
|
Информационная карта урока
|
6 |
|
Задания проекта
|
9 |
|
Список литературы
|
12 |
Пояснительная записка
Урок организован в виде проекта – выпуск стенгазет по химии.
Метод проектов способствует активному вовлечению учеников в различные виды практической деятельности и позволяет развивать их творческие и индивидуальные способности.
В проектной работе студенты включаются в организуемую педагогом поисковую учебно-познавательную деятельность. Педагог опирается при этом на уже имеющиеся возможности, способности детей к творческому мышлению.
Проект – специально организованный учителем и самостоятельно выполняемый учащимися комплекс действий по решению значимой для учащегося проблемы, завершающихся созданием продукта. Карл Фрейд выделяет 17 отличительных черт проектного метода, среди которых наиболее значимые следующие:
- Участники проекта подхватывают проектную инициативу от кого-либо из жизни;
- Участники проекта договариваются друг с другом о форме обучения;
- Участники проекта развивают проектную инициативу и доводят её до сведения всех;
- Участники проекта организуют себя на дело;
- Участники проекта информируют друг друга о ходе работы;
- Участники проекта вступают в дискуссию.
При реализации стратегий личностно-ориентированного обучения и воспитания с использованием метода проектов, преподаватель становится организатором самостоятельной работы , используя разнообразные формы и методы учебной деятельности, позволяющие раскрыть субъектный опыт ученика, стимулирует учащихся к использованию различных способов выполнения заданий без боязни ошибиться, дать неправильный ответ, помогает ученикам выбирать наиболее значимые и интересные для них виды и формы работы поощряет стремления каждого находить свой способ решения проблемы.
Этапы работы на уроке
Первый этап – поисковый: предложение темы исследования. Выбор проблемы / проблем проекта
Следующей задачей является необходимость включения всех студентов в работу над самим проектом.
Первый этап призван заинтересовать каждого ученика в выполнении проекта. Он также важен и для самого учителя, так как на этом этапе происходит и его собственная презентация в глазах учеников, способность эффективно поддерживать их при разработке проекта, избегать осложнений, решать возникающие проблемы.
Разрабатывая тему проекта, преподаватель продумывает конкретные ситуации учебной деятельности для каждого ученика, в зависимости от его личного потенциала, интересов, темпа усвоения материала.
Второй этап – аналитический. Согласование общей линии разработки проекта. Формирование групп. Составление подробного плана работы над проектом. Обсуждение путей сбора информации и осуществление поисковой работы. Обсуждение первых результатов в группе.
Третий этап – практический: оформление работы над проектом. Презентация проекта. Обсуждение презентации и полученных результатов. На этом этапе происходит сбор всего материала, обсуждение итоговой презентации, подготовка к защите.
Четвёртый этап – презентационный. Один из важных этапов осуществления учебного проекта является презентация. Она завершает, подытоживает работу над проектом и важна как для учащихся, так и для учителя, которые должны планировать ход и форму проведения презентации уже с самого начала работы над проектом.
Информационная карта урока
ТЕМА: «ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ: МЕТАЛЛЫ И НЕМЕТАЛЛЫ»
Тип урока: изучение новых знаний
Вид урока: урок проект (выпуск стенгазеты)
|
ЦЕЛИ Изучить химические, физические свойства неорганических веществ. Организовать проектную работу над созданием стенгазеты по химии. |
Развить познавательный интерес, активность. Формировать навыки принятия самостоятельных и коллективных решений
|
Воспитать научное мировоззрение, умение работать в команде. |
|
СОДЕРЖАНИЕ 1. ОРГ.МОМЕНТ 2.АКТУАЛИЗАЦИЯ ЗНАНИЙ 3.УСВОЕНИЕ НОВЫХ ЗНАНИЙ -КЛАССИФИКАЦИЯ -РАСПРЕДЕЛЕНИЕ ПО ГРУППАМ -СОСТАВИТЬ ЭСКИЗ ГАЗЕТЫ: -Название -Распространение в природе -Применение -Кроссворд (из пяти слов) -Химические свойства -Физические свойства - ОФОРМЛЕНИЕ ГАЗЕТЫ |
МЕТОДИЧЕСКИЙ ИНСТРУМЕНТАРИЙ - видеосюжет -лист ватмана (3) - краски, фломастеры -ПСХЭ - задания группам -справочная литература - карточки с элементами
|
РЕЗУЛЬТАТЫ - Назвать классы неорганических веществ, - Распределять вещества по классам - Характеризовать свойства металлов и неметаллов -Организовывать совместное взаимодействие |
Приложение А
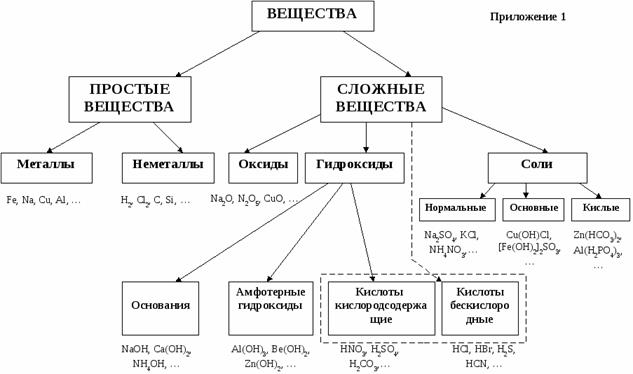
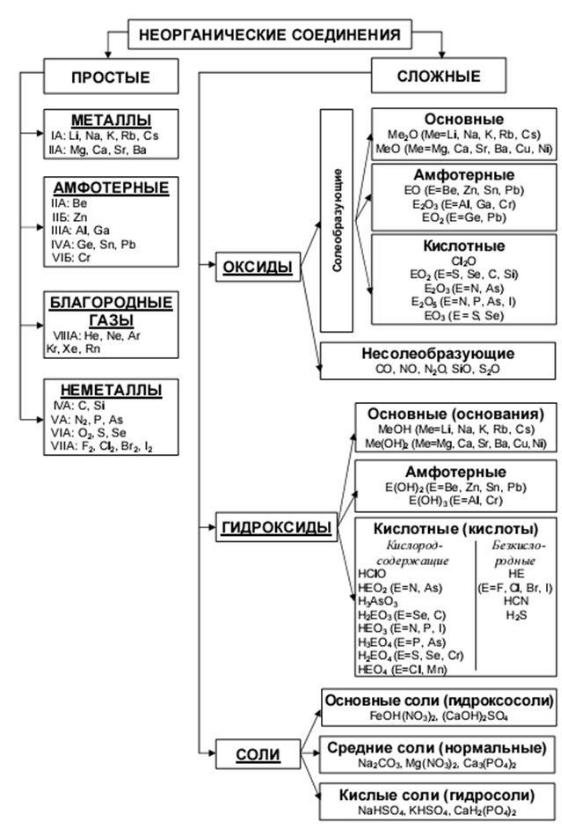
Приложение Б
Ход урока
1. Разделение на группы
2. Распределение элементов: железо, кальций, калий, натрий, алюминий, серебро, сера, углерод, кислород, водород , азот, фосфор
3. Название
4. Рамка
5. Эскиз
6. Химический символ и название элемента
7. Распространение в природе
8. Применение
9. Физические свойства
10. Химические свойства (3 УХР)
Объяснение целей и задач урока на примере элемента- золото.
Золото — один из самых тяжелых металлов, которые известны человеку. Металл относится к 11 группе таблицы им. Д.И. Менделеева. В настоящее время известно 37 изотопов элемента, из которых в природе можно найти только один — Au197. Золото во все века использовалось для изготовления различных изделий – украшений, посуды, статуэток. Подобное применение металла обеспечивают два важнейших свойства металла: ковкость и пластичность.
Желтый металл отличается от всех остальных наибольшей ковкостью. Его можно без нагрева расковать в тоненькие листочки толщиной до 0,1 мкм. Даже в таком «раскатанном» состоянии золото сохранит и цвет, и свои главные свойства. Примером подобного использования металла является сусальное золото для покрытия церковных куполов. Повышенная пластичность и тягучесть драгметалла также используется на благо промышленности: из золота растягивают тончайшие проволоки для микросхем.
Физические свойства золота обеспечивают металлу широкое применение в области микроэлектроники. Металл отличается низким сопротивлением, хорошими показателями теплопроводности и устойчивостью к окислительным процессам. Способность драгметалла отражать инфракрасный свет используют при остеклении высоток, при изготовлении стекол для морских судов, самолетов и вертолетов, визоров шлемов космонавтов.
Благодаря своим физическим свойствам желтый металл легко поддается самым разным видам обработки, включая полировку и пайку. Все эти качества наряду с легким вступлением в сплавы с другими металлами позволили золоту с древних времен занять лидирующее положение основного драгоценного металла и сырья большинства ювелирных изделий.
Характеристика химических свойств металла
Химическое обозначение желтого металла – Au, сокращение от «aurum», что с латыни означает «сияющая заря». Золото относится к инертным веществам. В стандартных условиях оно не вступают в реакции с природными веществами, единственное исключение – амальгама – соединение золота и ртути.
2Au + 3Cl2 =2AuC13
Распространённость золота
Среднее содержание золота в литосфере (земной коре) составляет 4,3·10-7% по массе, в воде морей и океанов менее 5.10-6 мг/л. Относится к рассеянным элементам. В магме и магматических породах золото рассеяно, но из горячих вод в земной коре образуются гидротермальные месторождения золота, имеющие важное промышленное значение (кварцевые золотоносные жилы и др.). В рудах золото в основном находится в свободном (самородном) состоянии и лишь очень редко образует минералы с селеном, теллуром, сурьмой, висмутом. Пирит и др. сульфиды часто содержат примесь золота, которое извлекают при переработке медных, полиметаллических и др. руд.
Известно более 20 минералов, из к-рых главный - самородное золото (электрум, медистое, палладистое, висмутистое 3. и др.), представляющее собой твердый раствор серебра (от следов до 43%) в золоте и содержащее также Сu, Fе, Рb, реже - металлы платиновой группы, Mn, Bi и др. Химические соединения золота в природе редки, в осн. это теллуриды - калаверит АuТе2, креннерит (Au,Ag)Te2, сильванит AuAgTe4, петцит Ag3AuTe2, мутманнит (Ag,Au)Te, монтбрейит Аu2Те3 и др. 3олото присутствует гл. обр. в кварце, карбонатах, пирите, арсенопирите, галените, сфалерите, халькопирите.
Золото в месторождениях
В рудах золото присутствует в виде вкраплений размерами б. ч. 0,1-1000 мкм, иногда находят самородки до неск. десятков кг. Разрушение эндогенных месторождений золота приводит к образованию россыпей золота, имеющих промышленное значение.
Генетические типы промышленных месторождений золота: гидротермальные высокотемпературные золото-арсенопиритовой формации; гидротермальные среднетемпературные кварц-сульфидной и золото-кварцевой формаций; гидротермальные низкотемпературные золото-серебряной формации; месторождения выветривания и метаморфизованные; аллювиальные россыпи.
11.Работа в группах
12. Презентация газет
Список литературы
1 Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2014.
2 Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2013.
3 Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2014.
4 Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. – М., 2014.
5 Габриелян О.С. Химия: орган. химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова – М., 2015.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.