
Тема урока: «Водород, его общая характеристика, получение, свойства и применение».
Цель урока: создать комфортные условия для изучения и систематизации материала по теме «Водород», а также для развития навыков самостоятельного познания школьников по указанной теме.
Планируемые результаты:
Предметные: создать условия для развития мотивации учащихся к изучению физических свойств и способов получения водорода; описывать и различать изученные газообразные вещества по физическим свойствам.
Метапредметные: создать условия для развития умений наблюдать, работать с дополнительной литературой, выделять главное, делать выводы, обобщать знания, работать в группах, уметь логически мыслить.
Личностные: создать условия для формирования умений управлять своей познавательной деятельностью, подготовиться к осознанию выбора дальнейшей образовательной траектории.
Тип урока: урок открытия новых знаний.
Методы обучения: проблемный, эвристический, экспериментальный.
Формы организации познавательной деятельности обучающихся: групповая, коллективная, индивидуальная.
Средства обучения: презентация к уроку «Водород», мультимедийный проектор и компьютер, учебник: Рудзитис Г. Е., Фельдман Ф. Г. «Химия», 8 класс, М., «Просвещение», 2008г., материалы для демонстрационного опыта (гранулы цинка, соляная кислота, магний, серная кислота, штатив с пробирками, спиртовка, спички, натрий, фенолфталеин, вода дистиллированная, аппарат Киппа, лабораторный штатив, кристаллизатор с водой, держатель для пробирок, предметное стекло, пипетка, ПСХЭ.
УМК:
1. Гара Н.Н., «Программы общеобразовательных учреждений. Химия. 8-9 классы, -
М., «Просвещение», 2009 .
2. Рудзитис Г. Е., Фельдман Ф. Г. «Химия». 8 кл. – М., «Просвещение», 2008.
3. Гара Н. Н. «Химия». Уроки в 8 кл. (пособие для учителя) – М., «Просвещение»,
2008.
4. Радецкий А. М. «Дидактический материал. Химия». 8 - 9. – М., «Просвещение»,2014 .
Структура урока
1.Организационный момент (его задача – подготовить учащихся к работе на уроке). Педагог и ученики приветствуют друг друга, в журнале отмечаются отсутствующие, затем учитель проверяет, готовы ли ребята к занятию.
2. Подготовка учащихся к активному и сознательному усвоению материала.
Учитель: В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснет солнце, не станет воды... Вещество, без которого жизнь невозможна, «сидит» в самом центре нашей планеты — в ядре и вокруг него, и оттуда «мигрирует» наружу. Этот газ — начало всех начал (слайд 1).
Определите, о каком веществе мы поговорим сегодня:
Вы со мною уже встречались -
Я космический скиталец,
Элементов прародитель
И отважный предводитель.
Я любитель кислорода,
Вместе с ним даю я воду.
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный. (Водород)
Учащиеся зачитывают данное стихотворение и называют тему урока “Водород” и
записывают её в рабочие тетради.
3. Повторение и закрепление пройденных знаний.
Перед тем, как преступить к изучению нового материала, вспомним ранее изученный материал.
К доске вызываются двое учащихся и выполняют задания по карточкам:
Карточка 1.
Выпишите формулы оксидов и обозначьте римскими цифрами валентности элементов в соединениях с кислородом, зная, что кислород двухвалентен:
III I II I IV
Al2O3, Na2O, MgO, H2O, Ag2O, CO2 Назовите соединения.
Карточка 2.
Напишите уравнения реакций, в результате которых получаются оксиды:
А) железа (III) Б) серы(II) В) цинка (II) Назовите соединения.
С классом провожу закрепление изученного материала, используя кроссворд (слайд 2).
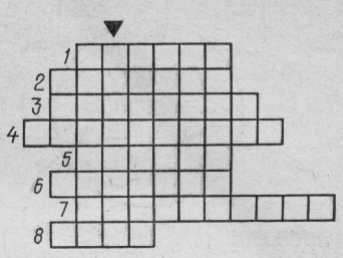 Ключевым словом является название самого распространенного
химического элемента в земной коре)
Ключевым словом является название самого распространенного
химического элемента в земной коре)
1. Вещества, которые получаются при горении разных веществ в кислороде.
2.Английский химик, открывший кислород.
3.Вещество, поддерживающее горение и дыхание.
4.Тип химических реакций, в результате которых получают кислород.
5.Простое вещество, при горении которого в кислороде образуется белое твердое вещество.
6.Процесс с участием кислорода, сопровождающийся выделением теплоты и света.
7.Тип реакции S + O2 = SO2.
8.Соединение кислорода, необходимое для процессов жизнедеятельности.
Затем проверяем учащихся у доски.
4. Изучение нового материала.
Учитель: Сегодня мы продолжим изучение химии элементов, которое мы начали со знакомства с кислородом. На сегодняшнем уроке мы познакомимся с химией водорода. При изучении курса химии мы уже неоднократно встречались с водородом. Пришло время обобщить и расширить знания об этом химическом элементе, познакомиться с областями и перспективами его производства. Мы с вами живём в 21 веке, в веке цифровых технологий, ноутбуков и сверхскоростных самолётов. Как вы думаете, сколько ещё тайн скрывает от нас с вами природа, а сколько их было много, много
лет назад. Посмотрите на девиз нашего урока: «Через тернии - к звёздам!» (на доске). О чём он предупреждает? – это пока тоже для вас тайна, которая будет раскрыта к концу нашего урока. Мы должны подняться на высоту звёзд в приобретении знаний о водороде.
Итак, напомню, тема нашего урока – «Водород»(слайд 3).
План урока (Записываю на доске).
1. Водород в природе.
2. Историческая справка.
3. Водород – химический элемент.
4. Водород – простое вещество.
5. Получение и собирание водорода.
6. Физические свойства водорода.
7. Применение водорода.
Учитель предлагает записать план урока в рабочие тетради.
Целеполагание учащимися после записи плана урока.
Учитель: переходим к изучению первого вопроса плана (слайд 4)
Первый я на белом свете:
Во вселенной, на планете.
Превращаюсь в лёгкий гелий,
Зажигаю Солнце в небе.
Гость из космоса пришёл.
В воде приют себе нашёл!
(Объясните смысл стихотворения, изучив материал учебника нахождение водорода в природе стр. 71)
Учащиеся работают с материалом учебника и рассказывают о нахождении водорода в природе.
Учитель дополняет ответы учащихся и демонстрирует (слайд 5) Водород самый распространённый элемент в космосе. Основная масса звёзд состоит из водорода. В условиях звёздных температур и межзвёздного пространства это элемент существует в виде отдельных атомов. Водород входит в состав основного компонента Земли – вода. Хоть доля водорода в земной коре около 1% от массы, однако, его роль в природе определяется не массой, а числом атомов, доля которых 17%. Многие органические вещества представляют собой соединения С,О, Н,: нефть, природный газ, углеводы, белки, жиры, нуклеиновые кислоты, витамины. В теле человека 10% атомов водорода.
Учитель: Обратимся к истории (слайды 6,7,8).
Водород был известен ещё в XVI в. Теофрасту Парацельсу, его получали также Ван-Гельмонт, Роберт Бойль, Николя Лемери, М.В.Ломоносов, Джозеф Пристли и другие учёные. В 1766 году известный английский учёный Генри Кавендиш получил “искусственный воздух” действием цинка на разведённую соляную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название “горючего воздуха”. Лишь в 1787 году Антуан Лавуазье доказал, что “горючий воздух”, открытый в 1766 году входит в состав воды и дал ему название “гидрогениум”, т.е. “рождающий воду”, “водород”.
(слайд 10). Учитель. Используя приобретённые вами знания по химии, дадим общую характеристику водороду.
Внимание на доску: заполним таблицу
Учащиеся: отмечают, что молекула водорода двухатомная,
Mr (H2) = 2 и одновременно заполняют таблицу сравнения химического элемента и простого вещества водорода.
Водород как простое вещество и как химический элемент.
|
Параметры сравнения |
Водород – химический элемент |
Водород – простое вещество |
|
Химическая формула |
|
|
|
Относительная атомная или молекулярная масса |
|
|
|
Свойства |
|
|
(Работа осуществляется в статистических парах) а затем, самоконтроль (слайд 11)
Учитель: Внимательно выслушайте предложения и определите, в каком из них речь идёт о химическом элементе, а в каком о простом веществе.
1. Водород входит в состав воды и нефти. 2. Водородом наполняют воздушные шары. 3 . Водород – самый лёгкий из всех газов. 4. Водород в земной коре в % по массе занимает 9-е место.
Учащиеся работают устно, отвечают на вопрос и делают выводы, чем отличается простое вещество и химический элемент.
(слайд 12). Учащиеся зачитывают проблемный вопрос на слайде и отвечают на него.
Учитель: Да, верно, вода – самый доступный источник водорода. В промышленности действительно водород получают из воды.
Сообщения учащихся.
1 учащийся. Эксперимент по получению водорода из воды с помощью солнечной энергии проводился в Университете Нового Южного Уэльса в Австралии. В этой технологии солнечный свет сначала преобразуется в электричество, которое уже разлагает воду на кислород и водород в присутствии катализатора (слайд 13)
2 учащийся. Вплоть до конца XIX века получение водорода было делом достаточно хлопотным. Его добывали в мизерных количествах, растворяя обычные металлы в кислотах, а также щелочные и щелочноземельные металлы в воде. Только после того, как электричество начали производить в промышленных масштабах, появилась возможность легко добывать его тоннами. Но этот способ сравнительно дорогой. Т.к. из воды водород можно получить, только разложив его электрическим током.
Учитель: В настоящее время его получают в промышленности из природного газа – метана. В лаборатории водород получают из соединений класса кислот: соляной, серной (слайды 14,15). Как же извлечь водород из кислот? Надо его в кислоте заместить металлом. Разберём способы собирания водорода (слайд 16) работа с материалом слайда.
Демонстрационный опыт. Получение водорода в лаборатории и наполнение водородом мыльных пузырей. Правила техники безопасности. Проверка водорода на чистоту. Демонстрация аппарата Киппа. Водород можно получать и в аппарате Киппа, если его необходимо получить в большом количестве. Своё название аппарат Киппа получил по названию голландской фирмы производителя.
Физминутка под музыку (слайд 17)
Учитель: При получении водорода необходимо соблюдать технику безопасности и обязательно проверять его на чистоту (слайд 18) Вот какая история произошла с французским химиком, директором парижского музея науки Пилатом де Розье. Как-то он решил проверить, что будет, если вдохнуть водород. До него никто такого эксперимента не проводил. Не заметив никакого эффекта, учёный решил убедиться, проник ли водород в лёгкие? Он ещё раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в лёгких экспериментатора смешался с воздухом и произошёл сильный взрыв. “ Я думал, что у меня вылетели все зубы вместе с корнями”, – так Розье характеризовал испытанные ощущения. Эксперимент чуть не стоил ему жизни.
Учитель: Познакомимся с физическими свойствами водорода (слайд 19)
Все области применения водорода основаны в основном на физических свойствах водорода (слайд 20). У водорода самая высокая теплопроводность среди всех газов и это свойство находит применение в современной энергетике для охлаждения электрических машин.
В 1783 г. французский физик Ж.Шарль совершил полёт на воздушном шаре, наполненном водородом. В 1794г. такие воздушные шары нашли широкое применение в военном деле. С 1932 – 1937гг. стали использовать дирижабли (слайд 21)
Сообщения учащихся (слайды 22,23)
3 учащийся. В 1944году американские военные попытались использовать водород в качестве ракетного топлива. Помешала делу высокая взрывоопасность газа: стоило совсем немного отклониться от нормальной работы двигателей или допустить малейшую протечку, и мирный водород мигом превращался в зловещий “гремучий газ”. В результате ракеты не долетали до цели, взрываясь прямо на старте. По той же причине американцам не удалось в 50-е годы прошлого века построить водородный самолёт, а в 70-е, во времена нефтяного кризиса, – водородный эсминец. В этом смысле дела в СССР, основном тогдашнем конкуренте Штатов в области водородной энергетики, были более успешны. Советские учёные решили добывать из водорода энергию в виде электричества, напрямую окисляя его в водной среде, а не поджигая в смеси с кислородом. Для этого они использовали топливные элементы, в которых водород на специальной ионообменной мембране соединялся с кислородом, в результате чего получались вода и электричество. Технология оказалась настолько удобной, что сейчас без участия топливных элементов не проходит ни одна серьёзная космическая экспедиция.
4 учащийся. Немного позже учёные всё же придумали, как использовать водород в качестве горючего и при этом не взорваться. В газ стали добавлять специальные присадки – ингибиторы. Например, пропилен. Всего 1% этого дешёвого газа – и водород из грозного оружия превращается в безопасный газ. В результате уже в 1979г. компания BMW выпустила первый автомобиль, вполне успешно ездивший на водороде, при этом не взрывавшийся и выпускавший из выхлопной трубы пар. Баварские автомобилестроители в рамках программы “Чистая энергия” приспособили под езду на водороде несколько “семёрок”. Оборудованная 4-литровым двигателем водородная «семёрка» развивает мощность в 184 лошадиные силы и проходит на одной заправке (170литров жидкого водорода) – 300 км.
5. Этап закрепления новых знаний.
Итог нашего урока: мы познакомились со вторым после кислорода элементом в химии – водородом. Вы узнали о нахождении водорода в природе, его свойства и уникальность, способы получения и применения. Мы поднялись на высоту звёзд.
Контрольный тест.
Необходимо выбрать правильные утверждения. В рабочей тетради в столбик проставьте цифры с 1 по 12. Если вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус. Учитель зачитывает утверждения.
1. Водород – самый распространённый элемент во Вселенной.
2. Водород – самый распространённый газ на Земле.
3. Основным соединением водорода на нашей планете является вода.
4. Большое количество атомов водорода входит в состав веществ, образующих живые организмы.
5. Валентность водорода равна 2.
6. Формула простого вещества водорода равна Н2.
7. Газ водород обладает наименьшей среди всех веществ молекулярной массой.
8. Газообразный водород хорошо растворим в воде.
9. Водород в смеси с кислородом взрывоопасен.
10. Чтобы собрать водород, пробирку надо держать отверстием вверх.
11. Водород можно собрать методом вытеснения воды.
12. Соединения водорода с металлами называются гидридами.
Обменяйтесь тестом с соседом по парте, сравните с ответами и оцените работы (слайд 24). Это ваша оценка за урок.
(слайд 25) Рефлексия.
6. Этап информации учащимся о домашнем задании и инструкции по его выполнению
(слайд 26) Подведение итогов урока. Оценивание. Домашнее задание.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.