
муниципальное бюджетное общеобразовательное учреждение
Мечетинская средняя общеобразовательная школа
Зерноградского района
Конспект
урока химии
в 9-м классе
на тему:
« Общая характеристика элементов VII группы - галогенов»
Подготовила
учитель химии
1 категории
Князева Ирина Викторовна.
2022
Цель урока:
Дать общую характеристику галогенов и рассмотреть их физические и химические свойства в сравнении.
Задачи урока:
1) Продолжить формирование умений сравнивать свойства простых веществ;
2) Закрепить общие представления о неметаллах и их свойствах;
3) Развивать умения и навыки в составлении уравнений химических реакций с участием неметаллов.
Тип урока: урок усвоения новых знаний
Методы урока: беседа, рассказ, самостоятельная работа
.
Методы обучения: сочетание репродуктивного и частично-поискового, исследовательского, использование элементов технологии проблемно-диалогического обучения.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, лабораторная посуда, алюминий (порошок), кристаллический йод, мультимедийная система, компьютер.
ХОД УРОКА:
1. Организационный момент. (1-2 мин)
Приветствие друг друга, настрой на работу, сообщение темы и целей сегодняшнего урока.
2. Проверка домашнего задания. (10-12 мин)
1) Вызвать по очереди учащихся, приготовивших сообщения, презентации о галогенах.
Все остальные приготовились заполнять таблицу, анализируя выступления своих товарищей и кратко конспектируя за докладчиками.
Что я знал? |
Что узнал? |
Что хочу узнать? |
|
|
|
|
3. Подготовка к объяснению нового материала
( Мотивация к изучению новой темы). (5 мин)
Вызвать двух желающих написать электронные формулы всех галогенов в столбик по возрастанию порядкового номера (групповая форма предлагается из-за сложности задания).
Формулировка темы и целей урока: опираясь на электронные формулы пяти галогенов на доске, где видно ступенчатое увеличение радиуса атомов, в форме беседы предложить проанализировать, как это отражается на химической активности элементов и их вытеснительной способности.
4. Изучение нового материала. (10 мин)
1. Положение в ПСХЭ и строение их атомов.
Галогены F, Cl, Br, I, At – элементы 7 группы главной подгруппы Периодической системы хим. элементов.
O ![]()
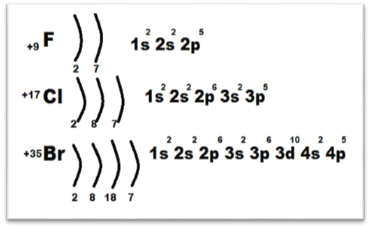 на внешнем уровне
7 электронов;
на внешнем уровне
7 электронов;
O увеличивается радиус атомов;
O ослабевают неметаллические свойства;
O окислительная способность уменьшается.
Фтор – самый сильный окислитель (с.о.-1)
У остальных: с.о. -1, +1, +3, +5, +7
Помимо фтора, хлора, брома и йода в этой группе есть еще один элемент, относящийся к галогенам – это астат. Он был предсказан самим Д.И. Менделеевым как эка-йод, он является радиоактивным элементом, поэтому в школьном курсе не изучается.
2. Галогены - простые вещества и нахождение их в природе.
Объяснение дополнять нарезкой роликов, показывающих, как выглядят простые вещества в лаборатории, и слайдов презентации, демонстрирующие природные минералы галогенов.
Раздать по рядам пробирки с кристаллическим йодом, пока ученики изучают внешние признаки галогена, приготовить в ступке измельченные кристаллы йода, порошок алюминия и задать вопрос, как они предполагают, будет протекать реакция между двумя этими простыми веществами? (направляя обсуждение в нужное русло). Продемонстрировать опыт взаимодействия, дать задание – составить уравнение соответствующей реакции:
Отвлекитесь от своих записей.
Физкультурная пауза на снятие мышечного спазма и расслабление глазных мышц. (1-3 мин.)
5. Первичное закрепление материала. (7 мин.)
Химические свойства галогенов.
а) взаимодействие с простыми веществами:
Так как из курса 8 класса учащиеся имеют представление о взаимодействии галогенов с газом водородом, в качестве смены вида деятельности вызвать
3 учащихся к доске с заданием написать уравнения взаимодействия галогенов
с водородом на скорость:
(с водородом Н2 общая формула всех реакций Н2 + Г2 = 2НГ)
Фтор взаимодействует с водородом в любых условиях со взрывом, хлор – со взрывом только при поджигании или облучении прямым солнечным светом, бром реагирует с водородом только при нагревании и без взрыва. Эти реакции экзотермические, реакция же йода с водородом слабо эндотермическая, она протекает медленно даже при нагревании.
б) с металлами – образуются соли – галогениды металлов.
Так фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании реагирует даже с Au, Ag и Pt, известными своей химической пассивностью.
Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы:
2Sb + 3Cl2 = 2SbCl3
(просмотр видеофрагмента опыта сурьмы с хлором)
2Sb + 5Cl2 = 2SbCl5
Самостоятельное задание – написать уравнения реакций взаимодействия железа с хлором, меди с бромом.
6. Рефлексия. Выставление оценок. (5-6 мин.)
Для чего нам нужны знания о свойствах галогенов в разных состояниях?
Для закрепления полученных понятий предложить обсудить слайд с « кейсом» с жизненной ситуацией на слайде презентации.
Оценить выступавших с сообщениями о галогенах, отвечавших у доски, составлявших электронные формулы, уравнения реакций, комментирующих и активно высказывающих версии.
7. Домашнее задание: (1мин.)
Записывают домашнее задание § 23.
Выполнить упр. 1-3 средний уровень; упр. 4 усложненное.
Творческое задание - составить учебный проект «Галогены в моём доме».
Спасибо за работу на уроке.
И поставьте смайлик о впечатлении от урока.
Учащиеся подают дневники для выставления оценок.
Литература:
Химия 9 класс (базовый уровень)
2. сайт school-collection.edu.ru
3. Канал молодых ученых: https://youtu.be/kCAbiSepFCI?feature=shared
https://youtu.be/SKiY37B4dOo?feature=shared
https://youtu.be/gU7FaA45vmU?feature=shared
https://youtu.be/inMs67xTfIo?feature=shared
4. Электронное издание "Химия. 8-11 класс. Виртуальная лаборатория"
5. http://ru.wikipedia.org/wiki/VX
ПРИЛОЖЕНИЕ №1
Физкультминутка
Вращательные движения кистями рук, предплечья, вращение и потягивание головы с целью восстановления мозгового кровообращения.
Два –три упражнения на снятие спазма глазных мышц.
Проводится на 15 минуте урока.
ПРИЛОЖЕНИЕ №2
Презентация «Галогены».
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.