
9- sinflarda ishqoriy yer metallari mavzusini o`qitishda zamonaviy pedago`gik texnologiyalar va AKT lardan foydalanish
Reja:
1. Kirish.
2. Asosiy qism.
2.1. Zamonaviy pedago`gik texnologiyalarning ta`limdagi ahamiyati.
2.2. Kimyo darslarida AKTdan unumli foydalanish.
2.3. 9- sinflarda ishqoriy yer metallari mavzusini o`qitishda zamonaviy pedago`gik texnologiyalar va AKT lardan samarali foydalanish.
3. Hulosa.
4. Foydalanilgan adabiyotlar.
5. Tavsiya va takliflar.
Kirish
Har bir jamiyatning kelajagi uning ajralmas qismi va hayotiy zarurati bo`lgan ta`lim tizimining qay darajada rivojlanganligi bilan belgilanadi. Bugungi kunda mustaqil taraqqiyot yo`lidan borayotgan mamlakatimizning uzluksiz ta`lim tizimini isloh qilish va takomillashtirish, yangi sifat bosqichiga ko`tarish, unga ilg`or pedagogik va axborot texnologiyalarini joriy qilish hamda ta`lim samaradorligini oshirish davlat siyosati darajasiga ko`tarildi. “Ta`lim to`g`risida”gi Qonun va “Kadrlar tayyorlash milliy dasturi”ning qabul qilinishi bilan uzluksiz ta`lim tizimi orqali zamonaviy kadrlar tayyorlashning asosi yaratildi.
Ta`limning barcha bosqichlariga oid umumiy pedagogik va didaktik talab o`quvchining dasturiy bilim, tasavvur va ko`nikmalari asosida mustaqil ishlash samaradorligini takomillashtirish, ilmiy fikrlashga, o`quv faniga qiziqishini kuchaytirish, kasbiy bilimlarini chuqurlashtirish, nazariy va amaliy mashg`ulot mobaynida ularning faolligini oshirishdan iboratdir. Jahon pedagogik tajribasi, zamonaviy pedagogik texnologiyalarining o`quvchilarni fanlarga qiziqtirishga, ularning mustaqil ishlashda faolliklarini oshirishga imkoniyati cheksiz ekanligini tasdiqlamoqda.
Ta`limning bugungi vazifasi o`quvchilarni kun sayin oshib borayotgan axborot – ta`lim muhiti sharoitida mustaqil ravishda faoliyat ko`rsata olishga, axborot oqimidan oqilona foydalanishga o`rgatishdan iboratdir. Buning uchun uzluksiz ravishda mustaqil ishlash imkoniyati va sharoitini yaratib berish zarur.
O`zbekiston
Respublikasi demokratik, huquqiy va fuqarolik jamiyatini qurish yo`lidan
borayotgan bir paytda ta`lim sohasida amalga oshirilayotgan islohotlarning bosh
maqsadi va harakatga keltiruvchi kuchi har tomonlama rivojlangan barkamol
insonni tarbiyashdan iboratdir. Bu barobarida darslarda yangi pedagogik
texnologiyalardan foydalanish yaxshi samara beradi.
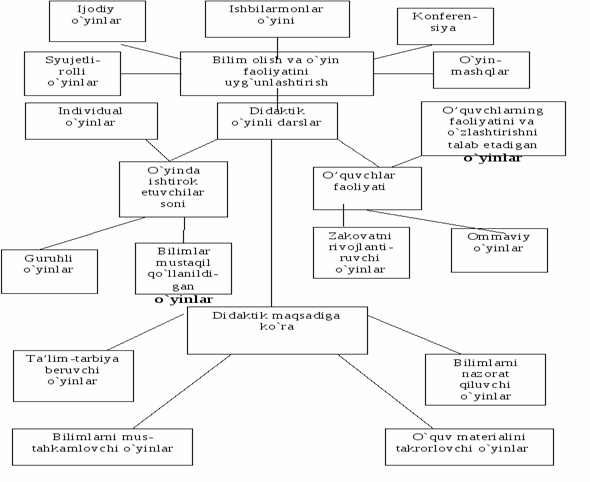
I. Didaktik o`yin texnologiyalari
Didaktika yunoncha “didaktikos” so`zidan kelib chiqqan bo`lib, o`qitish, o`rganish ma`nosini bildiradi. O`quvchilarga bilim berishda yangi inavatsion tehnalogiyalardan foydalanib darslarni olib borish yaxshi natija beradi.
So`ngi paytlarda
asosiy didaktik kategoriyalar sirasiga ta’limning didaktik tizimi va ta’lim
texnologiyasi kabi tushunchalarni ham kiritish taklifi ilgari surilmoqda.
Tadqiqotchilar mavjud didaktik konsepsiya (tizim)larni umumlashtirib quyidagi
guruhlarga ajratdilar.
Ushbu darslarda o`quvchilarning bilim olish jarayoni o`yin faoliyati orqali uyg`unlashtiriladi. Shu sababli o`quvchilarning ta’lim olish faoliyati o`yin faoliyati bilan uyg`unlashgan darslar, didaktik o`yinli darslar deb ataladi. Inson hayotida o`yin faoliyati orqali quyidagi vazifalar amalga oshiriladi
- o`yin faoliyati orqali shaxsning o`qishga va mehnatga bo`lgan qiziqishi ortadi.
- o`yin davomida shaxsning muloqatga kirishishi ya’ni komunativ – muloqat madaniyatini egallash uchun yordam beriladi.
- shaxsning o`z iqtidori, qiziqishi, bilimi va o`zligini namoyon etishiga imkon yaratiladi.
- hayotda va o`yin jarayonida yuz beradigan turli qiyinchiliklarni yengish va mo`ljalni to`g`ri olish ko`nikmalarni tarkib topishiga yordam beradi.
- o`yin jarayonida ijtimoy normalarga mos xulq – atvorni egallash, kamchiliklarga barham berish imkoniyati yaratiladi.
- shaxsning ijobiy fazilatlarini shakllantirishga zamin tayyorlaydi.
- insoniyat uchun ahamiyatli bo`lgan qadriyatlar tizimi ayniqsa ijtimoiy, manaviy – madaniy, milliy va umuminsoniy qadriyatlarni o`rganishga etibor qaratiladi.
- o`yin ishtirokchilarida jamoaviy muloqat madaniyatini rivojlantirish ko`zda tutiladi.
Didaktik o`yinlar texnologiyalari o`quvchi faoliyatining faollashtirish va jadallashtirishga asoslangan. Ular o`quvchiga ijobiy imkoniyatlarni ro`yobga chiqarish va rivojlantirishning amaliy yechimlarini aniqlash va amalga oshirishda katta ahamiyatga ega. Didaktik o`yinlar o`quvchilarda tahlil qilish, mantiqiy fikrlash, tatqiq qilish hisoblash, o`lchash, yasash, sinash, kuzatish, solishtirish, xulosa chiqarish, mustaqil qaror qabul qilish, guruh yoki jamoa tarkibida ishlash axloq – odob o`rgatish, nutq o`stirish til o`rgatish, yangi bilimlar o`rgatish va boshqa faoliyat turlarini rivojlantirishga yo`rdam beradi.
Didaktik o`yinlarning asosiy turlari intellektual (aqliy) va harakatli hamda aralash o`yinlardan iborat. Bu o`yinlar ishtirokchilarda aqliy – jismoniy, axloqiy, psixologik, estetik, badiiy tadbirkorlik, mehnat va boshqa ko`nikmalarni rivojlantirishga yordam beradi. Bularning orasida didaktik o`yinlar ta’lim – tarbiya vazifalarini amalga oshirish imkoniyatini oshirib borishi bilan alohida o`ringa ega.
Quyida kimyo
darslarida didaktik o`yinlar qo’llash haqida fikr yuritamiz.
Ishchanlik o`yin darsi – dars mavzusi bo`yicha masalalarni
hal etish jarayonida o`quvchilarning faol ishtirok etishini ta’minlash orqali
yangi bilimlarni o`zlashtirish mashqi.
Kimyoda “7-sinifda Suvning tarkibi va xossalari” mavzusida o`quvchilarni 3 ta kichik guruhlarga bo`lib xar bir guruhga sovollar beriladi.
Ro`lli o`yin darsi - dars mavzusi bo`yicha masalalarni o`rganishda o`quvchilarga oldindan ma’lum ro`llarni taqsimlash va dars jarayonida shu ro`lni bajarishlarini tashkil etish asosida bilimlarni mustaxkamlash darsi.
Masalan; 7-sinifda “Birikmalardagi elementlar atomlarining valentligi” mavzusida o`quvchilarga element belgilari berilib ularni valetlik asosida birikishi ko`rsatiladi.
H2 O
H-------O ----------H , N2 O N-------O--------N.
Teatrlashtirilgan dars – dars mavzusi bilan bog`liq sahna
ko`rinishlari tashkil etish orqali dars mavzusi bo`yicha chuqur, aniq
ma’lumotlar berish darsi.
8-sinif “Elektrolitlar va elektrolitmaslar ”mavzusiga sahna ko`rinishi tayyorlash mumkin
Kompyuter darsi
– tegishli o`quv fani bo`yicha dars mavzusiga doir
kompyuter materiallari ( multimediya, virtual o`quv kursi va shu kabilar )
asosida o`tiladigan dars.
Kim oshdi savdosi darsi – o`quv fani ayrim bo`limi bo`yicha
bilimlarni har bir o`quvchi qanchalik ko`p bilishini namoyish etish darsi.
Bunda o`quvchlarga sovollarni berib to`gri lavoblarni yutib olishini tashkil
qilinadi.
Yamarka darsi – dars mavzusini bo`laklar bo`yicha oldindan
o`zlashtirish o`quvchilarning o`zaro muloqat asosida sinfga qiziqarli
tushuntirish orqali o`tiladigan dars.
Formulalar darsi – o`quvchilarning formulalarni puxta
o`zlashtirishlari bo`yicha turli o`yinlar shaklidagi mashqlar o`tkazish darsi.
Bunda o`quvchilarga reaksiya tenglamalari yozilgan varaqlar beriladi va ularga
mos sherikni toppish aytiladi, natijada o`quvch bilimini tekshirish mumkin.
O`yin darsi – dars mavzusiga mos o`yin orqali
o`quvchilarning o`zlashtirishlarini tashkil etish darsi.
Tergovchi bilimdonlar olib boradigan darsi – dars mavzusini
oldindan puxta o`rgangan o`quvchilar yordamida qiziqarli savol – javoblar,
tahlillar asosida isbotlab, tushuntirish mashqlari bo`lib, bunda o`quvchilar
dars mavzusini o`zlashtirib eslab qolishlari uchun qulaylik yaratadilar.
Integral ( integratsiyalangan ) dars – bir nechta fanlarga
doir integratsiyalash uchun qulay bo`lgan mavzular bo`yicha tashkil qilingan
dars (5)
Umumta’lim maktablarida kimyo ta’limi samaradorligini oshirishda taklif
etilayotgan didaktik o’yinlar
O`qitishning individuallashuvi jamoa bilan yanada chuqur bog`lanishiga olib boradi, jamoadagi o`zining “men” ini namoyish qilishning, shaxsiga aylanishning yorqin istiqbollarini vujudga keltiradi. Shaxsni ta’sir ko`rsatishning jamoaviy vositasida tarbiyalash – unda jamiyatga to`g`ri munosabatni tegishli faoliyat bilan qo`shilishining axloqiy – estetik normalar haqidagi, ularga ongli yondashish to`g`risidagi tushunchalarni tarkib toptirishni bildiradi. Mustaqillik va faollikni, o`ziga xoslikni rivojlantirish esa ijtimoiy konstruktiv – ijodiy ishlarda o`zini yaqqol namoyon etishdir.
“Individuallik” – tushunchasi shaxsning boshqa kishilardan farqlanadigan alohida va yagona xususiyatini o`z ichiga oladiki, bu xususiyat shaxsga jamiyatda o`ziga xoslik va takrorlanmaslik baxsh etadi, yani kishi – kishini eksploatatsiya qilmaydigan tizimda jamiyat va shaxs o`zaro qarama–qarshi bo`lmaydi. Har qanday individullikning betakrorligi jamiyatdan ajralib qolmaydi, balki jamiyatning uzviy bog`liqligi uning manfaatlarini va harakat qonuniyatlarini tushinishdadir. Jamiyatsiz shaxs bo`lmaydi, individullik bo`lmaydi, chunki kamolatning manbai jamiyatdadir. Shaxsning kamol topishida o`zining kuch g`ayrati, bevosita faoliyati juda katta ro`l o`ynaydi. Bizning tarbiya va talim tizimimiz har bir bolada iste’dod, faollik, onglilik va ijodkorlikni rivojlantirishga qaratilgan.
Avval xususiyatlarni hisobga olib, umumiylikni, keyin umumiyni hisobga olib, alohidalikni rivojlantirish kerak. Respublikamizda ta’lim jarayonini takomillashtirish bo`yicha izlanishda o`qitishning yangi shakllari asta – sekin mustahkam o`rin olmoqda. Bular gimnaziya, ixtisoslashtirilgan sinflardir. Lekin ta’limning yangi shakllari asosan maktabning o`rta va yuqori bo`g`inlariga dahldordir. Ho`sh, boshlang`ich maktabda nimalar bo`lyapti? Boshlang`ich maktab har qanday holda ham o`quvchilardagi bilimlarni shakllantirishda va ularning qobilyatlarini aniqlashda asosiy rol o`ynaydi, keyin ham shunday bo`lib qoladi. Ammo boshlang`ich maktabdagi barcha o`quvchilar, bolalarning qobilyatlarini aniqlash va rivojlantirish uchun tegishli ishlarni amalga oshiryaptimi? Masalan : nima uchun yuqori sinflarda a’lo bahoga o`zlashtiradigan bolalar soni kamayib bormoqda? Maktabni bitta yoki ikkita o`quvchi imtiyozli bitirishini qanday tushinish kerak? Iste’dodli, qobilyatli bolalar yo`qmi yoki o`qitish jarayoni shunchalik samarasiz bo`lib qolganmi? Bularning sababi nima? Sababi ko`p. Birinchidan, boshlang`ich sinflar o`qituvchining bolalar bilan individual ish olib borish imkoniyati cheklangan. Sinflarda bo`sh o`zlashtiradigan o`quvchilarga e’tibor berish zarur.
Kimyoga oid qiziqarli mavzularga krossvord, rebus va ijodiy izlanishga undaydigan masalalarni kiritish mumkin. Bunday qiziqarli masalalar quyidagi didaktik talablarga javob berish kerak.
1.Qiziqarli masalalar tezkor va obrazli fikrlashni rivojlantirib, ularni yechish jarayonida ijodiy motivatsiya hosil qilishi.
2.Taqdim etilayotgan materialning o`quvchilar uchun yangi va qiziqarli bo`lishi.
3. O`quvchilarning o`quv-biluv faoliyati darajasini oshirish maqsadida topshiriqlarning mazmunida uni turli usullar bilan yechilishining ko`zda tutilishi.
4. Qiziqarli masalalarning yechish jarayonida bosqichma-bosqich o`quvchilarning ijodkorligini yuzaga chiqarishga yo`naltirilishi.
5. O`quvchilarning mustaqil ishlashini taminlash uchun topshiriqlarning variativ bo`lishi.
6. Topshiriqlarni o`quvchilarning fazoviy tasavvur va tafakkurini rivojlantirishga qaratilishi.
Kimyoni o`qitishda krossvord va rebuslardan foydalanish o`quvchilarni zeriktirmaslikka, kimyo atamalaridan so`z boyligini oshirish va tez fikrlashga o`rgatadi. Kimyoga oid rebursni tuzoishda turmushda uchraydigan va o`quvchilarga ma’lum bo`lgan obyektlar, shakllar yoki tajribalarni tanlash maqsadga muvofiq. Rebusda berilgan turli hil obyektlar, shakllar va tasvirlar o`quvchilarga ma’lum bo`lgani uni o`qitishning hamma bosqichida qo`llash mumkin. O`quvchilarni fanga qiziqtirish, darsda qiziqarli masalalar va didaktik o`yinlardan unumli foydalanib faol o`quv – biluv jarayonini vujudga keltirish orqali o`quvchilarning grafik tayyorgarligi darajasini oshirish va kasbiy shakllantirish mumkin. O`quv jarayonida didaktik o`yinlar o`quvchilarning oldiga qo`ygan maqsadidan kelib chiqib:
1. Yangi mavzular tushuntirishdan oldin (bunda o`yin muammoli vaziyat sifatida )
2.Yangi mavzuni tushuntirish vaqtida ( o`quvchilarning diqqatini jalb qilish maqsadida )
3.Mavzuni mustahkamlashdan oldin, shuningdek o`quvchilarning bilim, ko`nikma va malakasini tekshirish vaqtida ( o`quvchilarni o`ziga hos o`yinga jalb etib, kichik guruhlar xosil qilish va raqobatni yuzaga keltirish ) qo`llash mumkin.
Yuqoridagi fikrlar aosida kimyo fanidan didaktik o`yinlar ishlab chiqish va imkon qadar kompyuter o`yinlari tarzida yaratib, dars jarayonida foydalanish o`quvchilarning qiziqishini orttiradi. Kimyo fanidan yaratilgan o`yin dasturlari o`quvchilarda o`quv motivatsiyasini shakllantirishga, ijodiy fikrlashga, mustaqil ishlash va bilim boyligini oshirishga xizmat qiladi.
Kimyo fanida kompyuter o`yinlarini ishlab chiqish texnologiyalari quyidagi bosqichda amalga oshiriladi.
1.O`quvchilarni o`zlashtirishida murakkab bo`lgan mavzu tanlab olinadi.
2.O`yinning maqsadi va sharti tanlab olinadi.
Ta’limiy maqsad – o`yin davomida o`quvchi mavzuning mohiyatini to`liq tushunib oladi.
Tarbiyaviy maqsad-o’quvchilarda kuzatuvchanlik, ziyraklik, ogohlik, topqirlik va estetik did kabi fazilatlarni tarbiyalaydi.
Rivojlantiruvchi maqsad- o’quvchilarning fazoviy tasovvur qilish, mantiqiy fikrlashva ijodkorlik qobilyatlarini rivojlantirishga xizmat qiladi.
3.Tanlangan mavzu bo’yicha o’quvchini o’ylashga va fikr yuritishga majbur qiladigan, eng asosiysi, o’yinni o’ynashga ehtiyoj sezdiradigan qiziqarli dizayn va g’oya yaratiladi.
4.O`yinning tuzilishi va o’ynash bosqichlari ishlab chiqiladi.
5.O`yin metodi asosida o’quvchilarning tanlangan mavzu bo’yicha bilm ko’nikmalarini shakillanishini ta`minlovchi pedagogik talablar aniqlanadi.
6.O`quvchining boshlang’ich bilmini va o’zlashtirilishini nazorat qiluvchi masalalar tizimi ishlab chiqiladi.
7.O’yin
meto’dining samaradorligini aniqlovchi nazorat va kompleks topshiriqlar tizimi
ishlab chiqiladi.
"Bumerang” texnologiyasi
Texnologiyaning qo`llanilishi.
Amaliy mashg`ulotlar, seminar yoki laboratoriya mashg`ulotlari, hamda, suhbat – munozara shaklidagi darslarda yakka tartibda, kichik guruh va jamoa shaklida foydalanishi mumkin.
Mashg`ulotda foydalaniladigan vositalar:
O`quvchi dars jarayonida mustaqil o`qishlari, o`rganishlari va o`zlashtirib olishlari uchun mo`ljallangan tarqatma materiallar (o`tilgan mavzu yoki yangi mavzu bo`yicha qisqa matnlar, suratlar va ma`lumotlar.)
Mashg`ulotni o`tkazish tartibi: Ushbu texnologiya bir necha bosqichda o`tkaziladi;
Izoh: O`qituvchi darsni shu tartibda tugatishi yoki o`quv materialini o`quvchilar tomonidan yakka tartibda qanday o`zlashtirilganini yana bir bor o`z-o`ziga baho berish tartibida nazorat qilish uchun “Charxpalak” texnologiyasidan foydalangan holda, o`qilgan va o`zlashtirilgan matnlar asosida tayyorlangan tarqatma materiallarni o`quvchilarga tarqatib, o`z bilimlarini tekshirib olishga imkoniyat yaratishi mumkin.
“Rezyume”
texnologiyasi.
Texnologiyaning tavsifi: Bu texnologiya murakkab,ko’p tarmoqli,mumkin
qadar muammoli mavzularni o’rganishga qaratilgan. Texnologiyaning mohiyati
shundan iboratki, bunda bir yola mavzuning turli tarmoqlari bo’yicha axborot
beriladi. Ayni paytda ularning har biri alohida nuqtalardan muhokama qilinadi.
Masalan, ijobiy va salbiy tomonlari, afzallik va kamchiliklari, foyda va
zararlari belgilanadi.
Texnolgiyaning maqsadi: O’quvchilarni erkin, mustaqi, tanqidiy
fikrlashga, jamoa bo’lib ishlashga, izlanishga,fikrlarni jamlab taqqoslash
uslubi yordamida mavzudan kelib chiqqan holda o’quv muammosini yechimini
topishga hamda kerakli xulosa yoki qaror qabul qilishga, jamoaga o’z fikri
bilan ta’sir etishga, uni ma’qullashga, shuningdek, berilgan muammoni yechishga
o’rgatish.
Texnologiyani qo’llanilishi: Ma’ruza darslarida(imkoniyat va
sharoit bo’lsa), semenar, amaliy va laboratoriya mashg’ulotlarida yakka (yoki
kichik guruhlar ajratilgan tartibda o’tkazish, shuningdek uyga vazifa berishda
ham qo’llash mumkin.
Mashg’ulotda foydalanadigan vositalar: A-4formatdagi qog’ozlarida
(guruh soniga qarab) tayyorlangan tarqatma materiallar, flomaster yoki rangli
qalamlar.
Mashg’ulotlar o’tkazish tartibi:
Ilova (misol tariqasida)
|
O'quvchilar billimini nazorat qilish |
|||||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
"Muammo" texnologiyasi
Texnologiyaning maqsadi: O'quvchilarga o'quv predmetining mavzusidan
kelib chiqqan turli muammoli masala yoki vaziyatlarning yechimini to'g'ri
topishlariga o'rgatish ,ularda muammoni yechishning ba'zi usullari bilan
tanishtirish va muammoni yechishda mos uslublarni to'g'ri tanlashga
o'rgatish,muammoni kelib chiqish sabablarini va muammoni yechishdagi
xatti-harakatlarni to'g'ri aniqlashga o'rgatish.
Mashg'ulotning o'tkazish tartibi:
O'qituvchi o'quvchilarni guruhlarga ajratib, ularni mos o'rinlarga joylashtirgandan so'ng, mashg'ulotni o'tkazish tartib-qoidalarini va talablarini tushuntiradi, ya'ni u mashg'ulotni bosqichli bo'lishini va har bir bosqich o'quvchilarni maksimum diqqat-e’tibor talab qilishini, mashg'ulot davomida ular yakka,guruh va jamoa bo'lib ishlashlarini aytadi. Bunday kayfiyat o'quvchilarga berilgan topshiriqlarni bajarishga tayyor bo'lishlariga yordam beradi va qiziqish uyg'otadi. Mashg'ulot o'tkazish tartib-qoidalari va talablari tushuntirilgach, mashg'ulot boshlanadi.
- O'quvchlar tomonidan mashg'ulot uchun tayyorlangan kino lavhani diqqat bilan tomosha qilib,unda yoritilgan muammoni aniqlashga harakat qilish, xotirada saqlab qolish yoki daftarlariga belgilab qo'yish (agar kinofilm ko'rsatishning imkoniyati bo'lmasa, u holda o'qituvchi o'quv pretmetining mavzusi bo'yicha plakat, rasm, afisha yoki biror muammo bayon qilingan matn,kitobdagi o'quv materialidan foydalanishi mumkin);
- har bir guruh a'zolari tomonidan ushbu lavhadan (rasm,matn,hayotiy voqeadan) birgalikda aniqlangan muammolarni vatman yoki A-4 formatdagi qog'ozga flomaster bilan yozib chiqadi;
- berilgan vaqt tugagach, tayyorlangan ishni guruh vakili tomonidan o'qib eshittiriladi;
- o'qituvchi guruhlar tomonidan tanlangan va muammolar yozilgan qog'ozlarni almashtirgan holda guruhlarga tarqatiladi;
- tarqatilgan qog'ozlarda guruhlar tomonidan yozilgan muammolardan har bir guruh a'zosi o'zini qiziqtirgan muammoni birini tanlab oladi;
- o'qituvchi tomonidan tarqatilgan quyidagi chizmaga har bir guruh a'zosi tanlab olgan muammosini yozib, mustaqil ravishda tahlil etadi.
|
Muammoning turi |
Muammoni kelib chiqish sabablari |
Muammoni yechish yollari va sizning harakatlaringiz |
|
Toza ichimlik suvining kamligi |
Suvni toza saqlashga e'tiborning kamligi |
Tabiat va suvni saqlashga oid tadbirlar o'tkazish |
Masalan:
- yakka tartibdagi faoliyat tugagandan so'ng har bir o'quvchi bajargan tahliliy
ishini barchaga o'qib eshittiradi;
- muammolar va ularning yechimi bo'yicha jamoaviy fikr almashinadi;
- himoyadan so'ng o'qituvchi mashg'ulotga yakun yasaydi.
Kichik guruhlarga qiziqarli ishlari ushun minnatdorchilik bildiradi va uyga vazifa beradi.
Bunday texnologiya
bilan o'tkazilgan mashg'ulot natijasida o'quvchilar qaysidir muammoni
yechishdan avval uning sababini aniqlanishi kerakligini, keyin esa ularga zarur
bo'lgan uslub va usullarni tanlashi hamda o'z harakatlarini aniq belgilab
olishlari kerakligini bilib oladilar.
"Blits-so'rov" usuli
Usulning tavsifi: Ushbu usul o'quvchilarni harakatlar ketma-krtligini
to'g'ri tashkil etishga, mantiqiy fikrlashga, o'rganayotgan fani asosida
xilma-xil fikrlar, ma'lumotlar ichidan keraklisini tanlab olishni, shu bilan
bir qatorda,o'zgalar fikrini hurmat qilish va ularga o'z fikrini o'tkaza olish
hamda o'z faoliyati, kunini rejalashtira olishni o'rgatishga qaratilgan.
Usulning maqsadi: ushbu usul orqali o'quvchilarga tarqatilgan
qog'ozlarda ko'rsatilgan harakatlar ketma-ketligini avval yakka tartibda
mustaqil ravishda belgilash, kichik guruhlarda o'z fikrini boshqalarga o'tkaza
olish yoki o'z fikrida qolish, boshqalar bilan ham fikr bo'la olish kabi
ko'nikmalarni shakllantirish.
Mashg'ulotni o'tkazish tartibi.
- O'qituvchi o'quvchilarga ushbu mashg'ulot bir necha bosqichda o'tkazilishi haqida tushuncha beradi. Har bir bosqichga moljallangan vazifalarni bajarishga aniq vaqt berilishi, o'quvchilar esa shu vaqtdan unumli foydalanishlari kerakligi haqida ularni ogohlantiradi.
- Keyin hammaga alohida-alohida tarqatma material beradi va ushbu materialni sinchiklab o'rganishlarini so'raydi;
- o'qituvchi tarqatma material mazmuni va bajariladigan vazifani tushuntiradi va "o'quvchining ismi va familiyasi" va "sinfi" bo'limlarini to'ldirishni aytadi.
- tarqatma materialda berilgan vazifa dastlab yakka tartibda bajarilishini ta'kidlaydi;
- har bir o'quvchi o'zining shaxsiy fikri asosida tarqatma materialdagi "o'quvchi javobi" bo'limiga berilgan savollardan 3xil variantli javobdan bittasini yozadi, javoblar raqamlar yoki harflar bilan ko'rsatilishi mumkin.
- berilgan vaqt ichida yakka tartibdagi ishlar tugagach tarqatma materiallar o'zaro almashinadi.(almashtirishni turlicha tashkil qilish mumkin, masalan yonidagi o'quvchi bilan , kichik guruhlarda yoki orqadagi o'quvch bilan)
- tarqatma materiallar almashingach, oqituvchi to'g'ri javoblarni o'qiy boshlaydi, oquvchilar bir-birini ishini tekshira boshlaydi va "to'g'ri javob" bo'limiga "1" balldan, agar noto'g'ri bo'lsa "0" ball qo'yib chiqishadi.
- o'qituvchi baholash mezonini tushuntirib beradi va tarqatma materiallar qaytadan o'z egalariga almashtirilishi so'raydi,o'z xatolarini ko'rib olishlariga imkon beradi.
- o'qituvchi tarqatma materiallarni yig'shtirib olib baholaydi va e'lon qiladi.
Izoh: misol tariqasida "Metallar" mavzusidagi blits-so'rov jadvalini keltirish mumkin(har bir o'qituvchi o'z pretmeti bo'yicha o'tayotgan, avval o'tgan mavzu yoki umumlashtiruvchi darslarda usbu jadvaldan foydalanib blits-so'rov tuzishi mumkin).
|
|
|
|||||
|
|
Savol |
A |
B |
C |
O'quvchi javobi |
To'g'ri javob |
|
1 |
Natriy metali Ar-? |
23 |
22 |
11 |
||
|
2 |
Kumush metalining kimyoviy belgisi |
Au |
Ag |
Ar |
|
|
|
|
Suvda eriydigan metallarni toping |
Au,Na,Fe |
Ca, Cu, Mg |
Na,K,Li |
|
|
|
|
Eng oson suyuqlana- digan metall |
|
|
|
|
|
|
5 |
Eng qattiq metall |
Cu |
Al |
Cr |
||
Mavzuning
katta -kichikligiga qarab savollar sonini ko'paytirish mumkin.
Xulosa
Hozirgi zamon mutaxassislari , faoliyat doiralari qanday bo’lishidan qat’iy nazar yangi pedagogik texnologiyalar bo’yicha keng ko’lamdagi bilimlarga, zamonaviy hisoblash texnikasi informatsion aloqa va kommunikatsiya tizimlari, orgtexnika vositalari va ulardan foydalanish borasida etarli malakalarga ega bo’lishi kerak. Ayniqsa kimyo fanini o’qitishda amaliy mashg’ulotlar va laboratoriya jixozlari o’rni beqiyos bo’lib, shu darslarni olib borishda yangi metodlar o’qituvchiga qo’l keladi.
Yangi pedagogik texnologiyalar bilan o’tkazilgan darslar o’quvchini mustaqil fikrlashga, nutqi rivojlanishiga, o’zaro bir-biri bilan muloqatga va xatto o’zi xulosa chiqarishga o’rgatadi. Qo’llanmada keltirilgan interfaol dars usullar kimyo darslarini yanada qiziqarli o’kazishga va barcha o’quvchilarni dars davomida faol qatnashishiga undaydi. Bu usullar bilan dars olib borgan o’qituvchi sinflarda yuqori sifat ko’rsatgichiga erishadi. Bundan tashqari kimyo darslarida nafaqat didaktik materiallardan, balki axborot kommunikatsion texnologiya(AKT)laridan foydalanilsa maqsadga muvofiq bo’lar edi. Biz AKT dan o’qituvchilar va o’quvchilar o’rtasidagi kimyoning dunyoviy muammolari bilan bog’liq bo’lgan munozara yig’ilishladagi aloqalarga ko’maklashish maqsadida foydalanishimiz kerak. Huddi shunday laboratoriya tajribalarini modellashtirish o’quvchilarimuzga real maktab laboratoriyasida o’tkazilishi muammo bo’ladigan murakkab tajribalarni boshqarish imkonini beradi va moddalarni tejaydi. Darslarda elektron darsliklardan foydalanishimiz, kimyodagi qiyin atom (molekular) jarayonlarni, elektron bulut va elektronlar qo’zg’alishi, struktur izomeriya, gibrid orbitallar tushunchalarini osonlashtiradi.
Shunday ekan, biz o’quvchilarning fikrlash qobiliyati va fanning rivojlanishini ta’minlashimiz kerak.
Foydalanilgan
adabiyotlar ro`yxati
1.Karimov I.A.Yuksak ma’naviyat - yengilmas kuch.
Toshkent.Manaviyat,2008.61 b.
.2.Tolipov O’.,No’monova N.Ta’lim-tarbiya jarayonida zamonaviy pedagogik
texnalogiyalar.G’G’ Xalq ta’limi.-Toshkent,2002.-N 3.23-29b.
3.Zunnunov A.,Maxkamov U., Didaktika (Ta’lim nazaryasi).O.O’Yu uchun
qo’llanma.-Toshkent.Sharq,2006.-132 b.
4..Begmatov U.E.Umumiy o’rta maktablarda kimyodan darsdan tashqari ishlarni
dars bilan boqlashning nazariy-metodologik
asoslari.Diss...kand.ped.nauk.T.2004.- 152 b.
5..Pletner Yu. V. , Polosin V. S. , Ximiya o`qitish metodikasidan praktikum.
“O`qituvchi” Toshkent 1967.189 b.
6...Asqarov I.R.,To’xtaboyev N.X.,G’opirov K.G’.Kimyo. 7-sinf o’quvchilari
uchun darslik.-Toshkent 2010.47-49 b
1.
Каталог: upload -> book
book
-> Sana: 03. 04. 2015. Fan: Jahon tarixi Sinf
book
-> Tayyorlash va ularning malakasini oshirish instituti
book
-> Qayta tayyorlash va malakasini oshirish
book
-> Tayyorlash va ularning malakasini oshirish instituti
book
-> 6-sinf тарих (umumta’lim maktablari
uchun)
book
-> 6-§ Ilk sivilizasiyalarning vujudga kelish davri
book
-> Mavzu: Ishlab chiqarish asoslari mashg`ulotlarini o`tkazish metodikasi
Mehnat ta’limi jarayonida o`quvchilarga ishlab chiqarish to`g`risida quyidagi tushunchalar
beriladi
book
-> Uslubiy qo`llanma
book
-> Samarqand viloyati xalq ta’limi xodimlarini qayta tayyorlash va ularning
malakasini oshirish instituti maktabgacha, boshlang‘ich va maxsus ta’lim
kafedrasi kichik maktab yoshidagi oʻquvchilarni miqdorlar bilan
tanishtirish
book
-> Samarqand viloyati xalq ta’limi xodimlarini qayta tayyorlash va ularning
malakasini oshirish instituti maktabgacha, boshlang‘ich va maxsus ta’lim
kafedrasi savod oʻrgatish darslarida ta’limiy oʻyinlardan foydalanish
ru-ru.facebook.com › Mirziyoyev › posts
16 окт. 2018 г. - Кимё саноатини жадал ривожлантириш бўйича топшириқлар ... Шавкат Мирзиёев хакида кундалик ахборот бериб борувчи Норасмий сахифа. ... Шавкат Мирзиёев - Shavkat Mirziyoyev добавил(-а) 2 новых фото от ...
Кимё саноатини жадал ривожлантириш бўйича топшириқлар берилди
www.president.uz/uz/2092
Президент Шавкат Мирзиёев халқ билан мулоқот қилиб, шаҳар ва туманларда амалга оширилаётган бунёдкорлик ишларини кўздан кечириш мақсадида 22 июнь куни Фарғона вилоятига келди
Read more: https://sputniknews-uz.com/politics/20170622/5666554/Shavkat-Mirziyoyev-Fargonaga-keldi.html
Саноат маҳсулотининг 96 %дан ортиғи кимё, нефть-кимё, енгил саноат, озиқ-овқат саноати, машинасозлик ва қурилиш материаллари тайёрлаш каби замонавий тармоқларда ишлаб чиқарилмоқда. Фарғона нефтни қайта ишлаш заводи, "Фарғона азот", "Автоойна", Қўқон механика заводи, "ДЭУ текстиль Фарғона", "Қўқон Индорама текстиль" каби йирик саноат корхоналари нафақат вилоят, балки мамлакатимиз иқтисодиётида алоҳида ўрин эагаллайди.
Read more: https://sputniknews-uz.com/politics/20170622/5666554/Shavkat-Mirziyoyev-Fargonaga-keldi.htmlМирзиёевнинг 2017 йил 12 январдаги фармонига асосан ташкил этилаётган "Қўқон" эркин иқтисодий зонаси бу борадаги имкониятларни янада кенгайтиради.
Read more: https://sputniknews-uz.com/politics/20170622/5666554/Shavkat-Mirziyoyev-Fargonaga-keldi.html
Президент мактабларида математика, физика, кимё, биология ва ахборот технологиялари ҳамда хорижий тиллар чуқур ўргатилади
M U N D A R I J A
I bob. Kirish……………………………………….………………..………4
II bob. Adabiyotlar taxlili…………………………………………………8
2.1. Yangi axborot kommunikatsion texnologiyalar………….………8
2.2. Zamonaviy axborot texnologiyalari ta’lim tizimida………….…..12
2.3. OFFICE dasturlar paketi……………………………………….…..14
2.4. AKTga oid atama va tushunchalar…………………………….…..34
2.5. O‘qituvchilar uchun qo‘shimcha internet resurslar……………...44
III bob. Tajribaviy qism…………………………………………….…..52
3.1. “Bog‘langan azot” mavzusini kasb-hunar kollejlarida
o‘qitish bo‘yicha 1 soatlik dars ishlanmasi……………………....52
IV. Olingan natijalar va ularning taxlili………………………….……56
4.1. “Bog‘langan azot” mavzusini konspekti…………………..56
4.2. Kimyoni o‘qitishda AKT……………………………………69
V. Xulosa…………………………………………………………………75
VI. Adabiyotlar………………………………………………………….76
1. Umumiy xarakteristika
2. Berilliy olinishi, xossalari, birikmalari.
3. Magniy, olinishi, xossalari, birikmalari.
4. Kalsiy gruppacha elementlari, olinishi, xossalari, birikmalari.
5. Stronsiy olinishi, xossalari, birikmalari.
6. bariy va radiy olinishi, xossalari, birikmalari.
7. Kalsiy (lot. Calx, Calcis — ohak soʻzidan olingan; Calcium), Ca — Mendeleyev davriy sistemasining II guruhiga mansub kimyoviy element. Ishqoriy-yer metallariga kiradi; tartib raqami 20, at m. 40,08. Tabiiy Kalsiy oltita barqaror izotopdan tuzilgan: 40Ca (96,94%), 44Ca (2,09%), 42Ca(0,67%), 48Ca (0,187%), 43Ca (0,135%) va 46Ca (0,003%). Oksidlanish darajasi +2, goho + 1; ionizatsiya energiyasi Ca°—> Ca+—" Ca2+, tegishlicha 6,11308 va 11,8714 eV ga teng; Poling boʻyicha elektromanfiyligi 1,0; atom, radiusi 0,197 nm, ion radiusi (qavslarda koordinatsiyasi son keltirilgan) Ca2+ 0,114 nm (6), 0,126 nm ( , 0,137 nm (10), 0,148 nm (12).
8. Yer poʻstida tarqalganligi jihatidan beshinchi oʻrinda (O, Si, Al, Fe dan keyin) turadi, massasi jihatidan 3,38%ni tashkil qiladi. Tabiatda faqat minerallar (400 ga yaqin) holida uchraydi. Kalsiyning turli silikat va alyumosilikatlari, mas, anortit Ca[Al2Si208], diopsid CaMg[Si2O6], vollastonit Ca3[Si309] keng tarqalgan. Bulardan tashqari, kalsiy karbonat-CaCO3, (tabiiy shakllari — ohaktosh, boʻr, marmar), dolomit CaMg(CO3)2, fosforit Ca5(PO4)3 (OH2SO3),apatitlar Ca5(PO4)3(Gʻ, C1), gips CaSO4*2H2O, flyuorit CaGʻ2 va boshqa sanoat ahamiyatiga ega. Kalsiy birikmalari tabiatdagi togʻ jinslari, suvlar va tuproq, tarkibida ham bor. Kalsiy biogen elementyaardan biri boʻlib, oʻsimlik, odam va xayvonlar suyagining asosini tashkil etadi. CaCO3 — mollyuskalar, shilliqqurtlar va tuxum poʻstlogʻi tarkibida koʻp miqdorda boʻladi.
9. Katta yoshdagi odamlar vaznining 1,4—2%i Kalsiydan iborat. 12 yoshgacha boʻlgan bolalar organizmining Kalsiyga kundalik ehtiyoji 0,5—0,6 g , 12—18 yoshdagilarda 0,7—0,8 g , katta yoshdagilarda 0,5 g va homilador ayollarda 1 g . Kalsiy kumush kabi oq metall. Suyuqlanish temperaturasi 842°, qaynash temperaturasi 1495°; zichligi 1,54 g/sm3. Plastik, yumshoq, oson bolgʻalanadi, pichoq bilan kesish mumkin. Juda faol metall boʻlganligi sababli odatdagi temperaturadayoq havo kislorodi bilan reaksiyaga kirishib, oksid parda bilan qoplanadi. Shuning uchun u moyda yoki jips yopiluvchi idishda saqlanadi. Suv va kislotalar bilan reaksiyaga kirishib vodorod ajratib chiqaradi. Havoda qizdirilganda CaO (soʻndirilmagan ohak), suv taʼsirida Ca(OH)2 (soʻndirilgan ohak) hosil boʻladi. Vodorod bilan bevosita birikib, Kalsiy gidrid CaH2, azot bilan Kalsiy nitrid (Ca3N2), uglerod bilan Kalsiy karbid-CaC2 hosil qiladi, galogenlar bilan shiddatli reaksiyaga kirishadi. Birikmalarda II-valentli. Kuchli qaytaruvchi, metallarning oksidlari, sulfidlari va galogenidlaridan tegishli metallarni siqib chiqaradi. K, Al, Ag, Cu, Li, Mg, Pb, Sn va boshqa metallar bilan intermetall birikmalar hosil qiladi. Sanoatda Kalsiy CaCl2 (75-85%) + KC1 (15-25%) aralashmasini elektroliz qilib, shuningdek, kalsiy oksidi (CaO)ni alyuminiy kukuni ishtirokida termik qaytarish usuli bilan olinadi:bCaO + 2A1 -> ZCaO • A12O3 + ZCaK. metallurgiyada U, Th, Ti, Zr, Cs, Rb va baʼzi lantanoidlarni ularning birikmalaridan ajratib olishda, poʻlat, bronza va boshqa qotishmalarni tarkibidagi kislorod, azot, oltingugurt, fosfor kabi qoʻshimchalardan tozalashda, organik suyukliklarni suvsizlantirishda, vakuum qurilmalarida getter sifatida, alyuminiy va magniyning qotishmalariga qoʻshimcha sifatida qoʻllaniladi.
10. Kalsiy birikmalari. Kalsiy gidroksid, soʻndirilgan ohak, Ca(OH)2 — kuchli asos. Rangsiz kristall modda. Zichligi 2,34 g/sm3. Tabiatda portlantid minerali holida uchraydi. 1 va 0,5 molekula suvli kristallogidratlari maʼlum. Qizdirilganda suvini yoʻqotib, kalsiy oksid (CaO) ga aylanadi. Nam havoda karbonat angidrid bilan birikib kalsiy karbonat hosil qiladi. Qurilishda, kimyo sanoatida (xlorli ohak, soda olishda), metallurgiyada, qand va teri (koʻn) ishlab chiqarishda, q.x.da suvni tozalashda va boshqada ishlatiladi.
11. Kalsiy karbid, CaC2 — kalsiyning uglerod bilan hosil qilgan birikmasi. Kimyoviy sof holdagi Kalsiy — rangsiz kristall modda, texnikada qoʻllaniladigani kulrang yoki qora rangli. Suyuqlanish temperaturasi 2160°, qaynash temperaturasi 2300°; zichligi 2,22 g/sm3. Suv bilan shiddatli reaksiyaga kirishib atsetilen hosil qiladi. Kalsiy — kuchli qaytaruvchi; deyarli barcha metall oksidlarini karbidlar yoki erkin metallargacha qaytaradi. Soʻndirilmagan ohakni elektr pechlarida uglerod bilan qaytarib olinadi. Sanoatda kalsiy sianamid va atsetilen olishda ishlatiladi.
12. Kalsiy oksid, CaO — soʻndirilmagan ohak, CaO — kalsiyning kislorodli birikmasi. Rangsiz kristall modda. Suyuqlanish temperaturasi 2627°, qaynash temperaturasi 2850°; zichligi 3,37 g/sm3. Suv bilan nixryatda shiddatli reaksiyaga kirishib, soʻndirilgan ohak Ca(OH)2 hosil qiladi. Reaksiya natijasida koʻp miqdorda issiqlik ajralib chiqadi. Kalsiy karbonatni 900—1000° temperaturada kuydirib, oʻta sof holdagi Kalsiy esa yuqori temperaturalarda Ca(NO3)2 ni parchalash yoʻli bilan olinadi. Bog'lovchi materiallar (sement, gips, alebastr), xlorli ohak, soda, Ca(OH)2, CaC2 va kalsiyning b. birikmalarini olishda, metallurgiyada flyus, organik sintezda katalizator sifatida qoʻllaniladi.
13. Kalsiy sulfat, CaSO4 — sulfat kislotaning kalsiyli tuzi. Rangsiz kristall modda. Tabiatda digidrat CaSO42*H2O (gips, alebastr) va angidrit CaSO4 holida uchraydi. Suyuqlanish temperaturasi 1460°; zichligi 2,98 g/sm3. Ikkita bekaror geksagonal panjarali modifikatsiyasi maʼlum (a-va r-CaSO4 a — CaSO4 ning zichligi 2,587 g/sm3. (3-CaSO4 niki 2,484 g/sm3. Ikkala modifikatsiya ham suvda eriydi, gigroskopik, 0,5 va 2 molekula suvli kristallogidratlar hosil qiladi. Tabiiy suvlar tarkibida Kalsiy miqdori ortishi bilan ularning qattiqligi ham ortib boradi. Koʻmir bilan birga qizdirilganda CaS gacha qaytariladi. Kalsiy kalsiy xloridga kaliy sulfat taʼsir ettirish yoʻli bilan olinadi. Tabiiy Kalsiy boglovchi materiallar, sunʼiy usulda olingan Kalsiy esa termolyuminissent materiallar olishda qoʻllaniladi.
14. Kalsiy xlorid, CaC12 — xlorid kislotaning kalsiyli tuzi. Rangsiz kristall modda. Suyuqlanish temperaturasi 775°, qaynash temperaturasi 1957°; zichligi 2,512 g/sm3. Suvda yaxshi eriydi. Soda va bertolle tuzi olish jarayonida koʻp miqdorda hosil boʻladi. Yogʻoch va matolarga Kalsiy eritmasi shimdirilsa, oʻtga chidamliligi ortadi. Kalsiy kalsiy metali va uning tuzlarini olishda, gaz va suyuqliklarni quritishda, betonning qotish jarayonini tezlashtirishda, tibbiyotda asabni tinchlantiruvchi, qon toʻxtatuvchi dori sifatida, allergik kasalliklarni davolashda qoʻllaniladi.
15. Kalsiy fosfatlari —rangsiz kristallar. Ortofosfat Ca(PO4)2 — a (suyuqlanish temperaturasi 1200°; zichligi 2,81 g/sm3) va R (suyuqlanish temperaturasi 1670°; zichligi 3,07 g/sm3) modifikatsiyalarda mavjud. Suvda juda oz eriydi; kislotalar bilan oson reaksiyaga kirishib, gidrofosfatlar hosil qiladi. Fosforit, apatit, gidroksilapatit minerallari tarkibiga kiradi. Suyaklar tarkibida ham bor. Tabiiy hamda sintez yoʻli bilan olingan ortofosfat mol va qushlarning ozuqalariga qoʻshib beriladi. Kukun holidagi Ca3(PO4)2 — fosforit uni oʻgʻit sifatida, shakar qiyomini tozalashda, keramika va shisha, tish pastalari, yuvish vositalari va abraziv materiallar ishlab chiqarishda, fosfor va fosfat kislota olishda qoʻllaniladi. Gidroortofosfat CaHPO4 va digidrat CaHPO4*2H2O qoramolga qoʻshimcha ozuqa hamda fosforli oʻgʻit sifatida ishlatiladi. CaHPO4*2H2O ni 900° da kuydirib, tish poroshoklarini tayyorlashda yumshoq abraziv sifatida qoʻllaniladigan, yuvuvchi vositalar, tish sementlarining komponenti boʻlgan pirofosfat Ca2P2O7 olinadi.
16. Digidroortofosfat Ca(HPO4)2 — gigroskopik modda. Uning monogidrati Ca(H2PO4)2*H2O suvda oz (30° da 100 g da 1,8 g) eriydi. Kalsiy ohakka fosfat kislota taʼsir ettirib, Ca(H2PO4)*2H2O esa appatit yoki fosforitga fosfat yoki sulfat kislota taʼsir ettirib olinadi. Birinchi usulda qoʻsh superfosfat, ikkinchisida oddiy superfosfat, Ca(HPO4)2ni kuydirilsa, optik shisha ishlab chiqarishda qoʻllaniladigan polifosfat Ca(PO3)2 hosil boʻladi.
17. Magniy (Magnesium), Mg — Mendeleyev davriy sistemasining II guruhiga mansub kimyoviy element; ishkoriy - yer metallarga kiradi. Tartib rakami 12, atom massasi 24,305. Tabiiy Magniy 3 ta barqaror izotopdan iborat. 24Mg (78,60%), 25Mg (10,11%), 26Mg (11,29%). Uchta sunʼiy radioaktiv izotopi (23Mg, 27Mg, 28Mg) olingan. Magniyni 1808 i. dastlab ingliz fizigi Magniy Devi amalgama holida olgan. 1829 yilda fransuz kimyogari Magniy Byussi magniy xloridga kaliy bugʻi taʼsir ettirib, Magniyni metall holida ajratib olgan. Magniy massa jihatidan yer poʻstining 2,35% ni tashkil qiladi. Magniyning 100 dan ortiq minerallari boʻlib, ulardan dolomit, forsterit yoki olivin, magnezii, karnallit va boshqa ahamiyatlidir. Olivin jinslarining yuvilishidan ilonizi serpentin minerali hosil boʻladi. Uning tolasimon turi asbest deyiladi. Ilon-izisimonlar chuqur yer osti karbonat angidrid gazlarining taʼsirida parchalanishi natijasida talk jinslariga aylanadi. Tula parchalanganda esa magnezit (MgCO3)ra oʻtadi. Ohaktoshlar MgCl2 eritmalari taʼsirida dolomitga MgCa(CO3)2 aylanadi. Oʻzbekistondagi dolomit konlarining eng kattasi Samarqand viloyatida joylashgan.
18. Dengiz suvida 0,38%; baʼzi koʻllar suvida 30% magniy xlorid boʻladi. Magniy kumushdek oq, yumshoq, choʻziluvchan, yengil metall, havoda yupqa oksid parda bilan qoplanib, qoramtir tusga kiradi. Bu parda uni keyingi oksidlanishdan saqpaydi. Magniyning zichligi 1740 kg/m³, suyuqlanish temperaturasi 650°, kaynash temperaturasi 1105°. Magniy birikmalarida 2 valentli. Kimyoviy jihatdan juda faol metall. Havoda qizdirilganda koʻzni qamashtiruvchi oq shuʼla chiqarib yonadi va oq rangli magniy oksid MgO, qisman koʻkimtir magniy nitrit Mg3N2 hosil qiladi. Xona haroratida suv bilan reaksiyaga kirishmaydi. Qaynatilganda esa suvdan sekin-asta vodorodni ajratib chiqaradi. Suv bugʻi bilan 400° da shiddatli reaksiyaga kirishadi. Qizdirilganda azot, oltingugurt, galogenlar va boshqa metallmaslar bilan birikadi. Suyultirilgan kislotalarda oson erib, vodorod ajratib chikaradi. Oddiy sharoitda ishqorlarning suvdagi eritmasida erimaydi. Vodorodli muhitda 400—500° gacha qizdirilganda gidrid MgH2 hosil qiladi. Magniyni 500—600° gacha oltingugurt yoki SO2 va H2S bilan qizdirilganda sulfid MgS hosil boʻladi. MgF2 himoya pardasini hosil qila olishi sababli ftorid kislotada erimaydi. Ishqoriy bikarbonat va ammoniy tuzlari eritmalarida eriydi. Magniyning barcha tuzlari rangsiz, achchiq, suvda yaxshi eriydi. Magniy koʻpgina metallar bilan qotishmalar hosil qiladi.
19. Magniy oʻsimlik va hayvonlar organizmining ajralmas qismidir. Baʼzi suv oʻtlari, foraminiferalar, ohakli bulutlar Magniy konsentratlari hisoblanadi (ular tarkibida 3—4% gacha Magniy boʻladi). Magniy oʻsimliklarning yashil pigmenti — xlorofill tarkibiga kiradi.
20. Barcha oʻsimliklarning hujayra organellarida va barcha tirik organizmlarning ribosomshritsa Magniy borligi aniqlangan. Magniy fosfat kislota tuzlari shaklida fitin tarkibida boʻladi. Odam va hayvonlar organizmi Magniyni ovqatdan oladi. Odamning bir kecha-kunduzda Magniyga ehtiyoji 0,3—0,5 g . Ovqatda Magniy tuzlari yetarlicha boʻlmasa, nerv sistemasining normal qoʻzgʻaluvchanligi, muskullarning qisqarishi buziladi. Qoramollar yemida Magniy yetishmaganda muskullari tortishib, oyoqlari rivojlanmay qoladi.
21. Sanoatda Magniy elektrolitik, metallotermik va ugletermik usullar bilan, lekin, asosan, MgCl, KC1 va NaCl eritmalari aralashmasini elektroliz qilib olinadi. Metallotermik usulda xom ashyo boʻlib dolomit, qaytargich boʻlib ferrosilitsiy yoki silikoalyuminiy xizmat qiladi. Ugletermik usulda Magniy MgO bilan uglerod aralashmasini 2100° dan yuqori haroratda germetik pechlarda qizdirib olinadi.
22. Pirotexnikada, metallurgiyada qotishmalar, qiyin qaytariladigan metallar (vanadiy, titan, uran, sirkoniy), mustahkam choʻyan olishda, atom texnikasida, kino, fotografiya va yoritish texnikasida ishlatiladi.
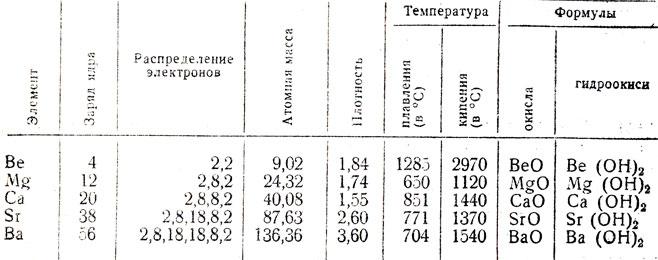
ISHQORIY-YER METALLAR
ISHQORIY-YER METALLAR — Mendeleyev davriy sistemasining ikkinchi guruhi berilliy guruhchasidagi magniy, kalsiy, stronsiy, bariy, radiy elementlari. Ular S-elementlar boʻlib, asl metallardir. Bu metallar atomlarining tashqi pogonasida ikkitadan elektron boʻlib, birikmalar hosil qilganda ularni berib, oksidlanish darajasi +2 ga teng boʻladi.
I.-ye. m. — kuchli qaytaruvchilar, lekin ishqoriy metallarga qaraganda birmuncha kuchsizroq. Ular kimyoviy jihatdan ancha faol boʻlib, havoda oson oksidlanadi. Bunda RO koʻrinishidagi asosli oksidlar hosil boʻladi, ularga (ROH)2 tuzilishidagi asoslar muvofiq keladi.
I.-ye. m. vodorod bilan birikib, umumiy formulasi RH2 boʻlgan gidridlar hosil qiladi. Ushbu metallardan magniy va kalsiy katta ahamiyatga ega.
Bariy – Mendeleyev kimyoviy elementlar davriy jadvalning VI davr II guruhga mansub, atom raqami 56 bo‘lgan element. Ba formulasi bilan belgilanadi. Oddiy modda shaklidagi bariy yumshoq, oq-kumush rangidagi ishqoriy yer metallidir.
Kashf etilishi tarixi va atama etimologiyasi.
Bariyni dastavval bariy oksidi – BaO ko‘rinishida 1774-yilda Karl Sheele va Yuxan Gadolin tomonidan kashf etilgan. 1808-yilda esa, ingliz kimyogari Gemfri Devi bariy gidroksidni elektroliz qilish usuli bilan, bariyning simob bilan qotishmasi – bariy amalgammasini olishga muvaffaq bo‘lgan. Ushbu qotishmadagi simobni bug‘latib yuborish orqali esa, olim sof metall holidagi bariyni ajratib olgan.
Elementga bunday nom berilishining sababi, uni birinchi marta, Skandinaviya taraflarda «og‘ir shpat» deb nomlanadigan mineral tarkibidan ajratib olingani sabab bo‘lgan. Ushbu mineral nomidagi «og‘ir» so‘zi yunon tilida «baros» deyiladi. Olimlar shundan kelib, yangi elementga bariy nomini berishgan, Ya’ni, uning nomi «og‘ir» degan ma’noni anglatadi.
Tabiatda tarqalganligi.
Yer qobig‘ida bariyning massa ulushi 0,05% ni tashkil etadi. Dengiz va okeanlar suvlarida esa, bariy miqdori 0,02 mg/l atrofida bo‘ladi. Bariy anchayin faol element bo‘lib, ishqoriy yer metallari tarkibiga kiradi va minerallar tarkibidagi bariy mustahkam bog‘langan bo‘ladi. Tarkibida bariy tutuvchi asosiy minerallar bu – barit (BaSO4) va viterit (BaCO3) bo‘ladi. Shuningdek, bariyning «bariyli dala shpati» deb nomlanuvchi (bariy alyumosilikati), hamda, gialofan, nitrobarit nomli nodir minerallari mavjud.
Mineral tarkibiga ko‘ra, bariy rudalari ikki xil bo‘ladi: monomineralli va kompleks rudalar. Kompleks rudalarda bariy, bariy sulfidli, bariy kalsitli, temir-bariyli, hamda, bariy-flyuoritli minerallar mavjud bo‘ladi. Ularning tarkibida bariyga yondosh ravishda, mis va temir kolchedani, qo‘rg‘oshin, nikel, oltin va kumush sulfidlari, simob va kvars mavjud bo‘ladi. Shu nuqtai nazardan ham, sanoat miqyosida olish uchun odatda kompleksli bariy rudalariga e’tibor qaratiladi.
Monomineral bariy rudalarida esa, odatda bariy faqat bariy sulfidi, yoki, bariy-flyuoriti ko‘rinishida mavjud bo‘ladi va bunday rudalar gidrotermal ko‘rinishda bo‘ladi.
Izotoplari.
Tabiatda bariyning 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba ko‘rinishidagi yetti xil barqaror izotopi mavjud. Ular ichida 138Ba eng keng tarqalgan bo‘lib, tabiatdagi umumiy bariy miqdorining 71,66 % ulushini tashkil qiladi. Shuningdek, bariyning uran, toriy, va plutoniyning radioaktiv parchalanishi natijasida paydo bo‘ladigan radioaktiv izotoplari ham ma’lum. Radioaktiv bariy izotoplari ichida nisbatan barqarori 140Ba bo‘lib, uning yarim yemirilish davri 12,7 sutkani tashkil qiladi.
Quyidagi jadvalda xlorning izotoplari haqida ma’lumot keltirilgan.
|
Izotop |
Atom massasi |
Yemirilish jarayoni |
Yarim yemirilish davri |
Yadroviy spini |
|
130Ba |
129,9063208 |
Qo‘shaloq β-yemirilish |
1,6(±1,1)⋅1021 yil |
0+ |
|
132Ba |
131,9050613 |
‒ |
Barqaror |
0+ |
|
134Ba |
133,9045084 |
‒ |
Barqaror |
0+ |
|
135Ba |
134,9056886 |
‒ |
Barqaror |
3/2+ |
|
136Ba |
135,9045759 |
‒ |
Barqaror |
0+ |
|
137Ba |
136,9058274 |
‒ |
Barqaror |
3/2+ |
|
138Ba |
137,9052472 |
‒ |
Barqaror |
0+ |
|
140Ba |
139,910605 |
β‒ |
12,752 kun |
0+ |
|
141Ba |
140.914411(9) |
β‒ |
18,27 daqiqa |
3/2− |
|
142Ba |
141.916453(7) |
β‒ |
10,6 daqiqa |
0+ |
Olinishi.
Bariy olishda asosiy xom-ashyo bu 80-95% li barit konsentrati bo‘lib, o‘z navbatida, uni ham barit mineralini flotatsiyalash usuli bilan olinadi. Keyin esa, bariy sulfatni koks, yoki tabiiy gaz orqali tiklanadi.
![]()
Keyin esa, qizdirish orqali sulfidni bariy gidroksid Ba(OH)2 gacha gidrolizlanadi, yoki, CO2 ta’sirida erimaydigan bariy karbonati BaCO3 ga aylantiriladi. Keyin esa, qizdirish yo‘li bilan, u bariy oksid – BaO ga aylantiriladi. Bunda, Ba(OH)2 ni 800 ℃ gacha; BaCO3 ni esa 1000 ℃ gacha qizdirish talab etiladi.
Metall bariyni erigan holdagi suvsiz bariy xloridni elektrolizlash usuli bilan olinadi.
![]()
Fizik xossalari.
Bariy – kumush rangli oq metall. Keskin zarba ta’sirida qizib ketadi. Bariyning ikki xil allotropik shakli mavjud. Birinchisi α-Bariy deyiladi va 375 ℃ haroratgacha barqaror chidaydi xolos; bariyning ikkinchi allotropik shakli β-Bariy esa, undan yuqori darajalarda ham barqaror bo‘la oladi. Moos shkalasi bo‘yicha qattiqlik ko‘rsatkichi 1,25 ga teng.
Metall bariyni havoda darhol kislorod bilan reaksiyaga kirishib ketadi. Buni oldini olish uchun, uni parafin qatlami ostida saqlanadi.
Kimyoviy xossalari.
Bariy – ishqoriy yer metalli. Havoda u tezkor oksidlanib, bariy oksidi – BaO hamda, bariy nitridi Ba3N2 dan iborat aralashma hosil qiladi. Sal qizdirilishi bilanoq tezkor alangalanib ketadi. Suv bilan juda shiddatli reaksiyaga kirishadi va bariy gidroksidi Ba(OH)2 hosil qiladi:
![]()
Bariyning aksariyat tuzlari suvda yaxshi erimaydi, yoki, umuman erimaydi. Lekin, kalsiy sulfid (CaS) dan farqli ravishda, bariy sulfid BaS suvda yaxshi eriydi. Bariyning suvda eriydigan tuzlari orqali, eritmada oltingugurt kislotasining mavjudligini aniqlash mumkin.
Bariy galogenlar bilan yaxshi reaksiyaga kirishadi va galogenidlar hosil qiladi.
Vodorod bilan qizdirilganda, bariy gidrid BaH2 hosil qiladi va o‘z navbatida, u litiy gidrid LiH bilan qo‘shilib, Li[BaH3] kompleksi yuzaga keltiradi.
Bariy orqali, ko‘plab metallarning oksidi, galogenidi va sulfididan, metallning o‘zini tiklab olish mumkin.
Qo‘llanishi.
Metall bariyni alyuminiy bilan qotishma shaklida asosan vakuumli asboblarda, gaz yutuvchi getter sifatida ishlatiladi. Sirkoniy bilan birgalikda bariy metallurgiyada, antikorrozion qo‘shimcha sifatida metallar tarkibiga qo‘shiladi. Bariy titanati esa keramik kondensatorlar tayyorlashda dielektrik sifatida, hamda, pyezoelektrik asboblar uchun ishchi material sifatida qo‘llaniladi. Bariy ftoridni optika sohasida, linza va prizmalar tayyorlashda ishlatiladi. Pirotexnik vositalarga mushakbozlikda yashil rang hosil qilish uchun, bariy peroksidi qo‘shiladi. Shuningdek, suvda erimaslik xossasiga ko‘ra, va odam organizmiga zararsizligi tufayli, bariy sulfat tibbiyotda oshqozon-ichak traktini rentgenoskopik tasvirini olishda qo‘llaniladi.
Biologik ahamiyati.
Bariyning biologik ahamiyati yaxshi o‘rganilmagan. Bu element inson hayot faoliyati uchun muhim bo‘lgan mikroelementlar tarkibiga kirmaydi. Bariyning suvda yaxshi eriydigan barcha tuzlari juda yuqori toksik moddalar bo‘lib, ichakda keskin o‘zgarishlarni keltirib chiqaradi va atiga bir necha soat ichida o‘limga olib kelishi mumkin.
Bariy tuzlari bilan o‘tkir zaharlanishda odam tanasida juda ko‘p so‘lak kelishi, jig‘ildon qaynashi va og‘izga ichkaridan achchiq suyuqlik chiqib kelishi kabi alomatlar kuzatiladi. Qorin sohasida kuchli og‘riq turadi. Qayt qilish, sanchiqlar, ich ketishi, qon bosimining ortishi, qaltiroq kabi yaqqol simptomlar biroz o‘tib yuzaga chiqadi. Keyinchalik, bemor qo‘l-oyoqlarini va hatto kallasini ham qimirlata olmay qolishi mumkin. Til ketib qolishi, nafas siqishi yuzaga keladi.
Bariyning suvda eriydigan tuzlari bilan o‘tkir zaharlanishda o‘lim bir sutka ichida sodir bo‘ladi. 0,2-0,5 gramm miqdorda bariy tuzlari og‘ir zaharlanishni keltirib chiqaradi. 0,8-0,9 gramm miqdordagi bariy tuzlari dozasi o‘limga sabab bo‘ladi.
Bariy haqida ma’lumotnoma jadval:
|
Umumiy ma’lumotlar |
|
|
Nomi |
Bariy; |
|
Formulasi |
Ba |
|
Raqami |
56, VI-davr, II guruh; |
|
Atom xossalari |
|
|
Atom massasi |
137,327(7) m.a.b. (g/mol); |
|
Elektron konfiguratsiyasi |
[Xe] 6s2 |
|
Atom radiusi |
222 pm; |
|
Kimyoviy xossalari |
|
|
Kovalent radiusi |
198 pm; |
|
Ion radiusi |
(+2e) 134 pm; |
|
Elektrmanfiyligi |
0,89 (poling shkalasi bo‘yicha); |
|
Elektrod potensiali |
−2,906 V; |
|
Oksidlanish darajasi |
+2 |
|
Ionizatsiya energiyasi (birinchi elektron) |
502,5 kJ/mol; (5,21 eV); |
|
Termodinamik xossalari |
|
|
Zichligi (m.sh.) |
3.5 g/sm3; |
|
Erish harorati |
728.85 °C, 1002 K; |
|
Qaynash harorati |
1636.85 °C; 1910 K; |
|
Erish issiqligi |
7,66 kJ/mol; |
|
Bug‘lanish issiqligi |
142 kJ/mol; |
|
Molyar issiqlik sig‘imi |
28,1 kJ/(K∙mol); |
|
Molyar hajmi |
39 mol/sm3; |
|
Issiqlik o‘tkazuvchanligi |
(300 K) 18,4 Vt/(m·K); |
|
Struktura panjarasi shakli |
Kubik, hajmiy markazlashgan; |
|
Panjara parametrlari |
5,020 Å |
Ishqoriy yer metallar davriy jadvalida ikkinchi guruhga tegishli bo'lgan elementlardir. Bu, masalan, kaltsiy, magniy, bariy, Berilyumdaki, strontsiy, va Radiy kabi moddalar kiradi. Bu guruh nomi, ular suvda ishqoriy reaktsiyaga bildiradi.
Ishqor va ishqoriy yer metallar, yoki aksincha, ularning tuzlari, tabiatda keng tarqalgan. Ular minerallar tomonidan taqdim etiladi. istisno bir nodir element hisoblanadi radiy, deb.
Yuqorida metallar barcha biri guruh ularni birlashtirish imkonini beradi, ba'zi bir umumiy sifatlarga ega.
Ishqoriy yer metallar va ularning jismoniy xususiyatlari
Deyarli bu elementlarning barcha (kamida normal sharoitda va ostida qattiq kul rang , muhit harorati). Aytganday, jismoniy xususiyatlari gidroksidi metallar ancha chidamli bo'lsa-da, bu moddalar, lekin osonlikcha fosh etiladi - oz farq qiladi.
Qizig'i shundaki, jadvalda natija raqami bilan o'sadi va zichligi sifatida metall qismi. temir o'xshash radiy zichligi esa, masalan, bu guruhda, kaltsiy eng past indeks ega.
Ishqoriy yer metallar: Kimyoviy xususiyatlari
Birinchidan, u kimyoviy faolligi ortadi davriy jadvalda seriya soniga ko'ra ta'kidlash joiz. Misol uchun, berilliy juda chidamli element hisoblanadi. kislorod va galogenlar bilan reaksiyaga faqat kuchli isitish bilan keladi. Shu magniy uchun amal qiladi. Lekin ega kaltsiy, hatto xona haroratida sekin oksidlamoq uchun. Qolgan uch vakili guruhi (radiy, bariy va strontsiy) tez, hatto xona haroratida havoda kislorod bilan reaksiyaga. kerosin qatlami o'z ichiga olgan, bu elementlar saqlash, shuning uchun.
Shu tarzda bu metallar ortadi faoliyati oksid va gidrokiyedlar. Misol uchun, berilliy gidroksidi suvda eruvchan emas va bir amfoterik modda hisoblanadi va bariy gidroksid juda kuchli ishqor bo'lgan.
Ishqoriy yer metallar va ularning qisqacha xususiyatlari
Berilliy yuqori zaharliligini ega bo'lgan metall chidamli engil kul rang hisoblanadi. Birinchi element bir kimyogar Vauquelin tomonidan 1798 yilda aniqlangan edi. berill, Phenacite, danalite va chrysoberyl: Tabiatda, qaysi eng mashhur quyidagi bir necha berilliy minerallar mavjud. Aytganday, Berilyumdaki ba'zi izotoplari yuqori radyoaktiviteyi bor.
Bu berill ayrim shakllari qimmatbaho zargarlik buyumlari toshlar ekanligini qiziq. Bu zumrad, Aquamarine heliodor o'z ichiga olishi mumkin.
Berilliy ba'zi qotishmalari qilish uchun ishlatiladi asosiy omili. Yilda atom elektr sanoati , bu element neytronlarni sekinlashtiruvchi uchun ishlatiladi.
Kaltsiy ishqoriy yer metallar eng mashhur biridir. sof shaklda u kumush oq rang bilan yumshoq material hisoblanadi. birinchi sof kaltsiy 1808 yilda ajratilgan qilindi. Tabiatda, bu element masalan, marmar, ohaktosh va gips kabi minerallar shaklida mavjud bo'ladi. Kaltsiy keng, zamonaviy texnologiyalar bilan ishlatiladi. Bu kimyoviy yonilg'i manbai, shuningdek, yong'in chidamli material sifatida ishlatiladi. Bu kaltsiy Murakkab qurilish materiallari va dori-darmon ishlab chiqarishda foydalaniladigan hech kimga sir emas.
Bu element, shuningdek, har bir tirik organizmda mavjud. Asosan, bu tayanch-harakat tizimi uchun javobgar bo'ladi.
Magniy xarakterli kul rang bilan engil va yetarlicha yumshoq metall hisoblanadi. uning sof shaklda u 1808 yilda izolyatsiya qilingan, lekin uning tuzlari ancha oldin ma'lum bo'ldi. Yilda tabiiy sharoitlarda, magniy kabi Kieserite magnezit, dolomit, karnallit, deb minerallar mavjud. Aytganday, magniy tuz beradi suv qattiqlik. Bu moddaning birikmalar katta miqdori dengiz suvi topish mumkin.
ishqoriy yer metallar kimyoviy xususiyatlarini ko'rib chiqaylik. , Ariza, qabul tabiatda bo'lish, ularning tuzilishi xususiyatlarini aniqlang.
Bu elementlarning start joyini aniqlash uchun davriy jadvalda Mendeleev. Ular asosiy kichik guruhlar ikkinchi guruhda joylashgan. Bu kaltsiy, stronsiyum, radiy, bariy, magniy, berilliy o'z ichiga oladi. tashqi energiya darajasi ikki valentli elektronlar o'z ichiga ulardan barcha mavjud. Umuman, berilliy, magniy va ishqoriy yer metallar tashqi NS2 elektronlar bor. kimyoviy moddalar, deb ular Oksidlanish davlatni +2 namoyish. boshqa moddalar bilan o'zaro davomida, ular tashqi energiya darajasidan elektronlar berib, xususiyatlarini kamaytirish namoyish.
XUSUSIYATLARINI O'ZGARTIRISH
oshirish asosiy berilliy atomining, magniy va ishqoriy yer metallar , ularning atomlarning radiusiga o'sish bor, chunki, ularning metall xususiyatlarini oshirish. ishqoriy-yer metallar jismoniy xususiyatlarini ko'rib chiqaylik. normal davlat po'lat kulrang ma'sumligi bilan bir metall bilan berilliy hisoblanadi. Bu qalin, olti burchakli billur panjara bor. kislorod bilan aloqada, berilliy, darhol shu tariqa uning reaktivligini, hosil Matt, qoplama kamaytirish, bir oksidi film hosil qiladi.
oddiy modda sifatida Magniy havoda oksidi qoplama tashkil oq metall hisoblanadi. Bu olti burchakli billur panjara bor.
ishqoriy yer metallar, kaltsiy, bariy, shunga o'xshash strontsiy jismoniy xususiyatlari. Ular havo kislorod sarg'ish film ta'siri ostida qamrab, kumush Sheen bilan tipik metallar ifodalaydi. kaltsiy va strontsiy yuz-markazli kub, katak da, bariy tana-markazli tuzilishga ega.
Ular munosabatlar metall tabiatiga ega ekanligini aslida asoslangan Kimyo ishqoriy yer metallar. Ular yuqori elektr va issiqlik o'tkazuvchanlik bilan ifodalanadi, shuning uchun. gidroksidi metallar ko'ra kattaroq erish va tiklanish nuqtalari haroratlar.
![]()
sanoat miqyosida berilliy ishlab chiqarish metall ftorli kamaytirish tomonidan amalga oshiriladi. kimyoviy reaktsiya oqimining holati isitish hisoblanadi.
Tabiatda ishqoriy yer metallar magniy, strontsiy, ularning tuzlari eritmalarning kaltsiy Boshlovchi elektroliz uchun birikmalar shaklida ekanligini hisobga olib.
![]()
ishqoriy yer metallar kimyoviy xossalari oldin ularning yuzasida bir oksidi kino qatlami uchun bartaraf qilish zarurati bilan bog'liq. Bu suv uchun bu metallarning ataleti belgilaydi. Kaltsiy, bariy gidroksid hosil qilish suvda erigan strontsiy, asosiy xususiyatlarini zikr etib.
ishqoriy yer metallar kimyoviy xususiyatlari kislorod bilan o'zaro taxmin. bariy peroksid reaktsiya mahsuloti uchun reaktsiya keyin hosil boshqa barcha oksidi, deb. oksidi bu sinfning barcha a'zolari asosiy xususiyatlarini, faqat berilliy oksid amfoterik xususiyati xususiyatlarini namoyish etadi.
ishqoriy yer metallar kimyoviy xususiyatlari ko'rsatilgan va oltingugurt, halojen, azot bilan reaksiyaga qilinadi. Bu elementlarning kislota tarqatib yuborish bilan reaktsiya kuzatiladi bo'lsa. berilliy amfoterik elementlar bilan bog'liq, deb hisobga olib, u kimyoviy alkaliler ega.
![]() SIFAT REAKSIYALARINI
SIFAT REAKSIYALARINI
tuzlari bilan bog'liq noorganik kimyo kursi ko'rish ishqoriy yer metallar asosiy formulalari. Boshqa elementlar bilan birga, bu sinf a'zolarini aniqlash uchun, siz sifatli qat'iyat foydalanishingiz mumkin. alkogol-chiroq olov ishqoriy yer metallar tuz qo'llashda, olov, binoni kationlari kuzatiladi. apelsin va yashil ohang bariy katyonun - stronsiy katyonun quyuq qizil rang, kaltsiy katyondur beradi.
sifatli tahlil sulfat anyonlardaki ishlatiladigan bariy kation aniqlash uchun. Bu reaktsiya mineral kislotalarda erimaydigan bo'lgan oq bariy sulfat natijasida.
Radiy kichik miqdorda tabiatda mavjud bo'lgan radioaktiv element hisoblanadi. kislorod bilan magniy bilan reaksiyaga bo'lsa, bir ajoyib flesh bor. qorong'i joylarda suratga olayotganida bu jarayon bir necha marta ishlatiladi. Endi magniy flesh elektr tizimini keldi o'zgartiring. ishqoriy yer metallar oila ko'p kimyoviy moddalar bilan reaksiyaga tiqiladi berilyum, degan ma'noni anglatadi. Kaltsiy va magniy alyuminiy Xuddi shunday, titan, volfram, molibden va niyobyum sifatida nodir metallar saqlab qolish mumkin. Bu jarayonlar olish metallar uchun kaltsietermiey va magnietermiey ataladi.
QO'LLASH XUSUSIYATLARI
ishqoriy yer metallar foydalanish qanday? Kaltsiy va magniy yengil qotishmalar va nodir metallar ishlab chiqarish uchun ishlatiladi.
Kabel sumkasi va yaratish konlarni tayyorlash uchun ishlatiladigan bir qismi qo'rg'oshin qotishmalar - Misol uchun, magniy Dural va kaltsiy tarkibi mavjud. Keng oksidi shaklida san'at ishqoriy yer metall foydalaning. Ohak (kaltsiy oksidi) va kuydiriladigan magniy (magniy oksidi) qurilish sektori uchun talab qilinadi.
suv bilan kaltsiy oksidi reaktsiya yilda issiqlik katta miqdorda ozod etiladi. Ohak (kaltsiy gidroksid) qurilishi uchun ishlatiladi. moddalar (ohak suti) oq ishlab chiqarish, lavlagi sharbati tozalash jarayoni uchun shakar sanoatida ishlatiladi.
![]()
magniy, Berilyumdaki, ishqoriy yer metallarning tuzlari tegishli oksidlarning kislotalari bilan reaksiyaga tomonidan tayyorlangan bo'lishi mumkin. Xloridlari, ftoridlar, yodidlar ma'lumotlar elementlari oq kristal aralashmalari, suvda, odatda, yaxshi eriydi. sulfat orasida piksellar faqat magniy va berilliy tarkibdan bor. Biz bariy sulfat uchun berilliy tuzlari bir pasayishiga kuzatish. Karbonatlar suvda deyarli erimaydigan yoki minimal o'lchamlari bor.
ishqoriy yer elementlari Sülfitler og'ir metallar kichik miqdorda mavjud. Agar nur ularni jo'natish bo'lsangiz, ranglarning turli olishingiz mumkin. Sülfitler lyuminessent kompozitsiyalar kiritilgan, fosfor chaqirdi. nuroniy teradi yo'l belgilari yaratish uchun ushbu ranglar qo'llaniladi.
Kaltsiy karbonat yer yuzasining eng ko'p element hisoblanadi. Bu, masalan, ohaktosh, marmar, bo'r sifatida birikmalar tarkibiga kiradi. Ular orasida, asosiy foydalanish ohaktosh hisoblanadi. Bu mineral qurilishida, ajoyib bino tosh hisoblanadi zaruriy hisoblanadi. Bundan tashqari, mazkur moddalar, noorganik so'ndirilmagan ohak va ohak, shisha va tsement bo'ladi.
ohaktosh shag'al foydalanish yo'l hissa qo'shadi, balki kukun tuproq kislotaliligi kamaytirish mumkin. Tabiiy bo'r bir qobiq eng qadimgi hayvonlar hisoblanadi. Bu aralashma maktab olib yozgan yaratish, rezina, qog'oz ishlab chiqarish uchun ishlatiladi.
me'morlar, haykaltaroshlar tomonidan marmar talab. Bu marmar qilingan Mikelanjelo ko'plab noyob asarlari yaratildi. Moskva metrosida stantsiyalaridan qismi marmar kafel bilan qoplangan, deb. Magniy karbonat g'isht, tsement, shisha ishlab chiqarishda katta miqdorda ishlatiladi. Bu chiqindilarni tosh olib tashlash uchun metallurgiya sanoatida talab qilinadi.
gips (kaltsiy sulfat kristal) shaklida tabiiy mavjud kaltsiy sulfat qurilish sohasida ishlatiladi. Tibbiyotda, Murakkab plastinalarni ishlab chiqarish uchun ishlatiladi, va gips bandajını ishlab chiqarish.
suv bilan reaksiyaga suvash (gips hemihidrat) issiqlik katta miqdorda oshkor bo'ladi. Bu, shuningdek, sanoatda ishlatiladi.
bir surgi sifatida tibbiyotda ishlatiladigan Epsom tuz (magniy sulfat). Bu modda u dengiz suvi topilgan, achchiq ta'mga ega.
(Bariy sulfat) "Barit bo'tqa" suvda eruvchan emas. Bu tuz radiologiya ishlatiladi, shuning uchun. Tuz oshqozon-ichak trakti kasalliklari aniqlash mumkin rentgen tutadi.
fosfat tosh (rock) va kaltsiy fosfat tarkibi alohida uchraydi. oksidlari, gidroksidlar: Ular kaltsiy birikmalar ishlab chiqarish kerak bo'ladi.
Kaltsiy alohida ahamiyatga ega, tirik organizmlarni uchun o'ynaydi. Bu metall suyak suyaklarni qurish uchun muhim ahamiyatga ega bo'lgan. Kalsiy ionlari yurak sozlash uchun zarur bo'lgan, qon ivishini oshirish. uning yo'qligi asab tizimi, bir ishlamay, ivishining yo'qotish, odatda qo'l unsurlar bilan har qanday saqlab qolish qobiliyatini yo'qotadi nima bo'ladi.
sog'liqni saqlash muammolarni oldini olish uchun, har kuni kaltsiy 1,5 gramm iste'mol qilishi kerak. Asosiy muammo organga yog '1 gramm yeb kerak kaltsiy 0,06 gramm shimib deb aslida yotadi. metall maksimal miqdori marul, petrushka, tvorog, pishloq tarkibidagi.
hayoti va zamonaviy insonning ishi uchun zarur bo'lgan asosiy guruhcha davriy jadvalida ikkinchi guruh barcha vakillari. Misol uchun, magniy organizmdagi metabolik jarayonlarni bir ogohlantiruvchidir hisoblanadi. Bu asab to'qimalarining, qon, suyak, jigar mavjud bo'lishi kerak. Bu klorofil qismi sifatida magniy, o'simliklar faol ishtirokchisi va fotosintez bo'ladi. Inson suyak umumiy og'irligi beshdan biri haqida. Ya'ni ular kaltsiy va magniy o'z ichiga oladi. Oksidlari, gidroksidi tuproq metall tuzlari, qurilish sanoati, farmatsevtika va tibbiyot turli dasturlar topdik.
|
Ca tuzlari. Calsiy barcha kislotalar bilan tuzlar hosil qiladi. Ularning barchasi suvda yaxshi eriydi hamda ulardan eng muhimlari–CaCO3 va CaSO4 hisoblanadi. CaCO3 eng ko`p uchraydigan foydali qazilmalar qatoriga kiradi. Binokorlik toshi sifatida, shuningdek, ohak, CO2 va sement ishlab chiqarishda, metallurgiyada, qishloq xo`jaligida tuproqlarni ohaklash (kislotaliligini kamaytirish va tuproq strukturasini yaxshilash maqsadida) ishlatiladi. CaSO4•2H2O ko`p uchraydi. Gipsni 150-1800C da kuydirish orqali oq kukun–kuydirilgan gips yoki alebastr CaSO4•0,5H2O olinadi. Agar alebastr suvga qorilsa, u tez orada qotib, yana qaytadan gipsga aylanadi: CaSO4•0,5H2O + 1,5H2O = CaSO4•2H2O Gips ana shu
xossasi tufayli binokorlikda to`siq plita va panellar tayyorlash, turli xil
buyumlardan quyma shakl va nusxalar olishda, tibbiyotda gipsli bog`lam,
suvoqchilikda ohak-gipsli qorishmalar tayyorlashda ishlatiladi. Bu binokorlik
mahsulotining kamchiligi suvda oz bo`lsa-da, erishidir. Tabiatda toza suv uchramaydi: uning tarkibida doimo biror moddalar aralashgan bo`ladi. Jumladan, suv yer qobig`idagi tuzlar bilan o`zaro ta`sirlashib, muayyan qattiqlikka ega bo`lib qoladi.
Agar suvda bu kationlarning konsentratsiyasi yuqori bo`lsa, u holda suv qattiq, agar kam bo`lsa–suv yumshoq deyiladi. Kalsiy kationlari Ca2+ kalsiyli qattiqlikni, magniy kationlari Mg2+ magniyli qattiqlikni keltirib chiqaradi. Umumiy qattiqlik kalsiy va magniyli qattiqliklardan, ya`ni suvdagi Ca2+ va Mg2+ kationlarining konsentratsiyalari yig`indisidan hosil bo`ladi. Suvni yumshatish jarayonlariga nisbatan olganda karbonatli va karbonatsiz qattiqliklar bo`ladi. Ca2+ va Mg2+ kationlarining suvdagi gidrokarbonat ionlari HCO3- ga ekvivalent bo`lgan qismi keltirib chiqargan qattiqlik karbonatli qattiqlik yoki muvaqqat qattiqlik deyiladi. Qaynatilganda Ca2+ CaCO3 holida cho`kmaga tushadi: Ca2+ + 2HCO3- = CaCO3↓ + H2O + CO2 Mg2+ esa gidroksikarbonat yoki Mg(OH)2 (pH>10,3 bo`lganda) holida cho`kmaga tushadi: Mg2+ + 2HCO3- + 2OH- = (MgOH)2CO3↓ + H2O + CO2 Qattiqlikning suv qaynatilgandan keyin ham qoladigan qismi karbonatsiz qattiqlik deyiladi. U suvda kuchli kislotalarning, asosan sulfatlar va xloridlarning kalsiyli va magniyli tuzlarining miqdori bilan aniqlanadi. K = Ca2+/20,04 + Mg2+/12,16 Bunda [Ca2+] va [Mg2+] - Ca2+ va Mg2+ ionlarining konsentratsiyasi, mg/l. Odatda suvning qattiqligini yo`qotish uchun suvga turli xil kimyoviy moddalar bilan ishlov beriladi. Masalan, karbonatli qattiqlikni so`ndirilgan ohak qo`shish yo`li bilan yo`qotish mumkin: Ca2+ + 2HCO3- + Ca2+ + 2OH- = 2CaCO3↓ + 2H2O Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓ + 2CaCO3↓ + 2H2O Ohak bilan soda bir vaqtning o`zida qo`shilganda karbonatli va karbonatsiz qattiqlikdan xalos bo`lish mumkin (ohak-sodali usul). Bunda karbonatli qattiqlikni ohak, karbonatsiz qattiqlikni soda yo`qotadi: Ca2+ + CO3- = CaCO3↓; Mg2+ + CO3- = MgCO3 MgCO3 + Ca2+ + 2OH- = Mg(OH)2 + CaCO3↓ Suvning qattiqligini yo`qotishning boshqa usullari ham qo`llaniladi, ulardan hozirgi vaqtda eng ko`p foydalaniladigani kationitlar ishlatishga asoslangan (kationitli usul). Tarkibida tashqi muhit ionlariga almashina oladigan harakatchan ionlar bor qattiq moddalar ionitlar deyiladi. Ionitlar ikki guruhga bo`linadi. Ulardan biri o`z kationlarini muhit kationlariga almashtiradi va kationitlar deyiladi, boshqalari o`zining anionlarini almashtiradi va anionitlar deyiladi. Ca2+ + Na2R = 2Na+ + CaR; Mg2+ + Na2R = 2Na+ + MgR CaR + 2Na+ = Na2R + Ca2+; MgR + 2Na+ = Na2R + Mg2+ Takrorlash uchun savollar.
Mavzuga oid tayanch iboralar. Ishqoriy metallar, ishqoriy-yer metallari, suvning qattiqligi, kalsiyli-, magniyli-, umumiy-, karbonatli-, karbonatsiz- qattiqliklar, kationitlar, anionitlar. Mavzuga oid adabiyotlar. 1. G. P. Xomchenko. Kimyo. Oliy o`quv yurtlariga kiruvchilar uchun, Toshkent, «O`qituvchi», 2001. 2. K. R. Rasulov va boshqalar. «Umumiy va anorganik kimyo», Toshkent, «O`qituvchi», 1996. 3. G. E. Rudzitis, F. G. Feldman. Anorganik kimyo. 8-9-sinf darsliklari, Toshkent, «O`qituvchi», 1992. 4. A. G. Muftaxov, H. T. Omonov, R. O. Mirzayev. Umumiy kimyo. Toshkent, «O`qituvchi», 2002. 5. M. M. Abdulxayeva, O`. M. Mardonov. Kimyo. Toshkent, «O`zbekiston», 2002. 6. S. Masharipov, I. Tirkashev. Kimyo. Toshkent, «O`qituvchi», 2002. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Natriy,
tabiatda uchrashi, fizik va kimyoviy xossalari, muhim birikmalari,
ishlatilishi.
Natriyning atom massasi 22,99 ga teng. Uning atom radiusi 0,189 va ion radiusi
0,098 nm ga teng bo’lib, ionlanish energiyasi esa, 5,14 eV ga teng. Natriy
tabiatda ko’p tarqalgan element, u yer po’stlog’ining 2,64% ini tashkil qiladi.
Quyoshda va yulduzlarda ham natriyning borligi aniqlangan. Natriy minerallari
qatoriga NaCl galit yoki toshtuz, Na2SO4∙H2O mirabilit yoki glauber tuzi, Na2AlF6 kriolit, Na2B4O7∙10H2O bura, Na2CO3∙10H2O soda, NaCl∙KCl silvinit, Na2SO4∙3K2SO4 glazerit, Na2SO4∙MgSO4∙4H2O astraxanit, NaNO3 chili selitrasi va boshqalar kiradi. Natriy
boshqa elementlar bilan birga silikat va alyumo-silikatlar tarkibida, o’simliklarda,
inson va hayvonlar organizmida, shuningdek, dengiz va tuzli ko’l suvlarida ko’p
miqdorda uchraydi.
Natriy osh tuzining suyuqlanmasini elektroliz qilish yo’li bilan olinadi. Katod
va anod bo’shlig’i diafragma bilan ajratilgan bo’ladi, natriyning musbat ioni
katoddan elektron biriktirib oladi ya’ni neytral atomga aylanadi. Natriyning
neytral atomlari katodda suyuqlangan metall holida yig’iladi. Anodda xlor
ionlari elektronlarini beradi, ya’ni oksidlanish sodir bo’ladi va gaz holida
erkin xlor ajralib chiqadi. Bu jarayonlarni quyidagicha tasvirlash mumkin:
NaCl = Na+ + Cl-
Na+ + e- = Na0 (katodda); Cl- - e- = Cl0; 2Cl0 = Cl2(anodda)
Natriy olish uchun soda bilan ko’mir aralashmasini qattiq qizdirish kerak:
Na2CO3 + 2C =2Na + 3CO
Hosil qilingan natriy kerosin ostida yoki berk metall idishlarda saqlanadi.
Natriy yumshoq pichoq bilan oson kesiladigan yengil metall, kub shaklida
kristallanadi. Natriy bug’i alangani sariq tusga kiritadi. Natriy kimyoviy
xossalari jihatidan juda aktiv havoda tez oksidlanadi, ftor va xlor
atmosferasida uy haroratida alangalanadi. Qizdirilganda brom, yod, oltingugurt,
vodorod va boshqa moddalar bilan reaktsiyaga kirishadi shuningdek, suv bilan
reaksiyaga kirishib, vodorodni ajratib chiqaradi: 2Na + 2H2O = 2NaOH + H2
Yonib ketgan ishqoriy metallni suv sepib o’chirib bo’lmaydi, balki uning
ustidan kalsinatsilangan soda kukuni sepish kerak.
Natriy oksid Na2O suv
bilan shiddatli reaksiyaga kirishib, o’yuvchi natriy hosil qiladi.
Na2O + H2O = 2NaOH
Natriy havoda yonganda asosan, natriy peroksid Na2O2(va juda oz
miqdorda Na2O) hosil
bo’ladi, Na2O bevosita
yo’llar bilan olinadi: 2Na + 2NaOH 2Na2O + H2
yoki 2Na + Na2O2 2Na2O
Agar natriy 1800C haroratda
ozroq miqdorda kislorod bilan oksidlansa Na2O hosil bo’ladi 4Na + O2 = 2Na2O
Natriy peroksid Na2O2 sarg’ish kukun
holidagi modda. Unga suv ta’sir ettirilganda ishqor va vodorod peroksid hosil
bo’ladi:
Na2O2 + 2H2O = 2NaOH+ H2O2
Agar reaksiya qizdirish bilan olib borilsa, vodorod peroksidning parchalanishi
natijasida kislorod ajralib chiqadi. Vodorod peroksid Na2O2 ga suyultirilgan kilota (H2SO4) ta’sir ettirib olinadi, natriy peroksid esa
havodagi karbonat angidrid bilan reaksiyaga kirishadi:
Na2O2 + 2HCl = 2NaCl+ H2O2 2Na2O2 + 2CO2 = 2Na2CO3+O2
Shu sababli Na2O2 nafas olish apparatlarida havoni
regenerasiyalab kislorod ajratib chiqarish uchun foydalaniladi. Na2O2 gazlamalar, suyak, soch va boshqalarni oqartirish
uchun ishlatiladi.
Natriy giperoksid NaO2 yuqori (300
atm) bosimda va 5000С da kislorod bilan Na2O2 ning o’zaro ta’siridan hosil bo’ladi:
Na2O2 + O2 → 2NaO2
bu moddaga suv ta’sir ettirilsa quyidagi reaksiya boradi.
2NaO2 + 2H2O = 2NaOH+ H2O2 + O2
Natriy gidrid NaH ni olish uchun natriy vodorod atmosferasida
qizdiriladi. NaH oq tusli qattiq moddadir, uning tarkibidagi vodorod manfiy bir
oksidlanish darajasiga ega. Agar natriy gidrid suyuqlantirilib elektroliz
qilinsa, vodorod anodga va natriy esa katodga boradi.
Natriy gidroksid NaOH o’yuvchi natriy yoki kaustik soda deyiladi. U
oq tusli qattiq moddadir. Uni laboratoriyada olish uchun natriy yoki natriy
peroksid suvda eritiladi. Texnikada sodani kaustiklash va osh tuzining suvdagi
eritmasini elektroliz qilish usuli bilan olinadi:
a) Na2CO3 + Ca(OH)2 = 2NaOH+CaCO3 b) NaCl = Na+ + Cl- H2O = H+ + OH-
Katodda: 2H+ + 2e- = 2H0 → H2 Anodda 2Cl- -
2e- = 2Cl0 → Cl2
Natriy gidroksidning suvdagi eritmasi kuchli ishqordir, terini
kuydiradi, ko’zga tushsa ko’r qiladi, shuning uchun u bilan ishlashda nihoyatda
ehtiyot bo’lib ishlash lozim. Natriy gidroksid sovun tayyorlashda,
to’qimachilik va ko’nchilik sanoatida, organik moddalar olishda, neftni
tozalashda, viskoza usulda sun’iy ipak hosil qilishda, kimyo laboratoriyalari
va boshqa ko’pgina sohalarda ishlatiladi.
Natriyning barcha tuzlari suvda yaxshi eriydi, Na[Sb(OH)4]esa suvda erimaydi. Analitik kimyoda ana
shu birikmani hosil qilish yo’li bilan Na+ ioni topiladi. NaCl oziq-ovqat sanoatida
ishlatiladi.
Natriy xlorid, gidrokarbonat, nitrat, arsenat, bromid, yodid, sulfat va
silitsilatlari tibbiyotda, shuningdek Na2CO3 shisha
ishlab chiqarishda ishlatiladi.
5. Kaliy, tabiatda uchrashi,fizik va kimyoviy xossalari muhim birikmalari,
ishlatilishi.
Kaliyning atom radiusi 0,236, ion radiusi 0,133 nm, ionlanish energiyasi 4,34
eV ga teng. Tabiatda uchraydigan izotoplarning massa sonlari 39, 40 va 41 ga
teng bo’lib, yer po’stlog’ining 2,6% ini tashkil qiladi. Kaliy, rubidiy, seziy
va fransiy elementlari kaliy guruhchasini tashkil qiladi. Bularning kimyoviy
xossalari natriy va litiynikidan farq qilishga sabab ularning atom
tuzilishlariga bog’liq. Kaliy faol bo’lganligidan tabiatda faqat birikmalar
holida (eng muhimlari dala shpati, slyuda) bo’lib, ularning nurashidan suvda
eriydigan tuzlar hosil bo’ladi. Kaliy tuzlari tuproqqa yaxshi shimilgani
sababli ko’pgina daryo va dengiz, ko’l suvlariga borolmaydi (kaliy tuzlari
dengizda 0,038%, natriy tuzlari esa 3,5% gacha bo’ladi).
Kaliy ham natriy kabi suyuqlantirilgan KCl yoki KOH ni elektroliz qilib
olinadi. Kaliy yumshoq va yengil metall, kuchli qaytaruvchi, suv bilan
reaksiyasi vaqtida ajralib chiqqan vodorod yonib ketadi. Havoda kaliy tez
oksidlanadi, xlor va ftorda o’z-o’zidan yonib ketadi, suyuq bromda esa
portlaydi. Kaliy juda ko’p metallar bilan intermetall birikmalar (KSn2, KSn kabi) ni hosil
qiladi. Kaliyni kesish vaqtida ham qattiq portlash sodir bo’lishi mumkin, shu
sababli nihoyatda ehtiyot bo’lish lozim.
Kaliy shu’lalantirilsa o’zidan elektron chiqargani uchun fotoelementlar
tayyorlashda ishlatiladi. Kaliy berk idish yoki kerosin ostida saqlanadi.
Kaliy gidrid (KH) hosil qilish uchun kaliy vodorod atmosferasida 2000C gacha qizdiriladi. Kaliy gidrid juda
faol, oq kristall modda, zichligi 1,52 g/sm3 ga teng, havoda yonadi, suv bilan shiddatli
reaksiyaga kirishadi, kuchli qaytaruvchi. Kaliy kislorod bilan oksid K2O, peroksid K2O2, giperoksid
KO2 va
ozonid KO3 hosil
qiladi. Kaliy havoda yonganda K2O2 va KO2 larning aralashmasi hosil bo’ladi, ular suv
va kislotalar ta’sirida parchalanadi. O’yuvchi kaliyga ozon ta’sir ettirilsa,
KO3 hosil
bo’ladi: 4KOH + 4O3 = 4KO3 + O2 + 2 H2O
Kaliyning kislorodli birikmalari (ayniqsa KO3) kuchli oksidlovchilardir. Kaliy gidroksid KOH
kaliyning suv bilan juda shiddatli reaksiyasidan hosil bo’ladi: 2K + 2H2O = 2KOH + H2
Kaliy gidroksid texnikada KCl yoki KOH ning suvdagi eritmasini elektroliz
qilish yo’li bilan olinadi, shuningdek K2CO3 ga ohak
ta’sir ettirib ham olinadi. O’yuvchi kaliy rangsiz kristall modda, 4100C da suyuqlanadi, qizdirilganda
parchalanmay bug’lanadi. Havodan o’ziga nam tortadi, suvda juda ko’p issiqlik
chiqarish bilan eriydi, eng kuchli ishqor, dissotsilanish darajasi qariyb 100%
ga teng KOH havodagi nam va CO2 bilan tez
reaksiyaga kirishadi, shuning uchun u berk idishlarda saqlanadi. Texnikada
o’yuvchi kaliy sovun tayyorlashda, laboratoriyalarda moddalarni quritishda
ishlatiladi. Kaliy tuzlarining ko’pi suvda yaxshi eriydi, tuzlari esa alangani
gunafsha tusga kiritadi. KHC4H4O6 va K3[Co(NO2)6] tuzlari
suvda erimaydi, analitik kimyoda, ko’pincha shu tuzlarning hosil bo’lishiga
qarab, kaliy topiladi. Kaliyning atsetat, gidrotartrat, bromid, yodid kabi
tuzlari tibbiyotda, K2CO3 shisha sanoatida
ishlatiladi. Kaliy o’simliklar uchun nihoyatda zarur elementdir, shu sababli
minerallardan to’g’ridan-to’g’ri o’g’it sifatida foydaniladi. Kaliyli o’g’itlar
(ko’pincha KCl, KNO3, K2SO4) qishloq xo’jaligida va kaliy nitrat qora porox
tayyorlashda ishlatiladi.
6. II guruh bosh guruhchasi elementlarining umumiy tavsifi
Davriy sistemaning ikkinchi guruhning asosiy guruhchasiga berilliy, magniy,
kalsiy, stronsiy, bariy va radiy elementlari kiradi. Asosiy guruhcha
elementlari bir-biridan xossalari bilan nihoyatda farq qiladi. Ular
atomlarining sirtqi qavatida ikkitadan elektron bo’lib, qaytaruvchilik
xossalari ishqoriy metallarnikiga qaraganda kuchsizroq ifodalangan. Kalsiy,
stronsiy va bariy ishqoriy-yer metallar deb ataladi, ular yengil metallardir,
faqat radiy radioaktiv xossaga ega bo’lgan og’ir metalldir. Yer qobig’ida Ca
ning 6 ta, Sr ning 4 ta, Ba ning 7 ta barqaror izotopi bor. Bulardan eng ko’p
tarqalganlari 40Ca
(96,97%), 88Sr
(8,56%), 138Ba (71,66%)
dir.
Bu elementlar suyuqlanish harorati va qattiqligining yuqoriligi bilan ishqoriy
metallardan farqlanadi, ularning faolligi kalsiydan bariyga tomon ortib boradi.
Berilliy va magniy gidroksidlari suvda qiyin eriganligi tufayli suv bilan sekin
reaksiyaga kirishadi. Ishqoriy-yer metallari havo kislorodi va azoti bilan
birikib, MeO va Me3N2 tipdagi birikmalarini hosil qiladi.
Bu guruh elementlarining peroksidlari Me2O2 ishqoriy
metallarnikiga qaraganda barqarordir. Bu elementlar oksidlarining suv bilan
birikishi va gidroksidlarining suvda erishi va ishqor xossasi berilliydan
bariyga tomon ortib boradi. Be(OH)2 amfoter gidroksid, Mg(OH)2 kuchsiz asos, Ca(OH)2 kuchli asos, Ba(OH)2 esa suvda yaxshi eriydigan kuchli
ishqordir. Ishqoriy-yer metallar aktiv metallmaslar bilan oddiy sharoitda reaksiyaga
kirishadi. Reaksiya natijasida issiqlik ajralib chiqadi, ya’ni ekzotermik
reaksiya sodir bo’ladi. Bu elementlar vodorod bilan MeH2 tipdagi gidridlarni hosil qiladi,
ko’pgina tuzlari, sulfat, karbonat, fosfat va ftoridlari suvda amalda eriydi;
xlorid, bromid, yodid va nitratlari yaxshi eriydi.
7. Magniy, tabiatda uchrashi, fizik-kimyoviy xossalari, muhim birikmalari,
ishlatilishi
Magniyning atom massasi 24,32 (Z = 12) ga teng. U tabiatda ko’p tarqalgan
metallardan biri bo’lib, Yer po’stlog’ining 2%ga yaqinini tashkil qiladi.
Magniyning 24Mg
(78,6%), 25Mg
(10,11%), 26Mg (11,29%)
kabi tabiiy va uchta sun’iy izotopi bor.
Tabiatda magniy silikatli, karbonatli va xloridli minerallar holida uchraydi,
shuningdek dengiz suvida (~4%) magniy tuzlari bo’lib, suvning taxirligi shu
tuzdandir. Magniy o’simliklardagi xlorofill tarkibiga kiradi va fotosintezda
ishtirok etadi. Magniy yetishmasa, odam va hayvonlarda turli kasalliklar paydo
bo’ladi. Buning sababi organizmdagi ko’pgina biokimyoviy jarayonlarda magniy qatnashadi.
Oq karlik yulduzlar asosan magniydan iborat ekanligi aniqlangan. Magniy
suyultirilgan MgCl2 ni yoki
karnallit (MgCl2 × KCl × 6H2O) ni ~750°C da
elektroliz qilish yo’li bilan olinadi. Bundan tashqari u metallotermik usulda
va magniy oksidini yuqori haroratda ko’mir bilan qaytarib ham olinadi. Juda
toza magniy olish uchun texnik magniy vakuumda bir necha marta sublimatlanadi.
Magniy kumushdek oq va yengil metall, havoda oksidlanadi va oksid pardani hosil
qiladi. Magniy havoda 550-600° C gacha qizdirilsa, ko’zni kamashtirarli
darajada oq shu’la bilan yonadi. Magniy sovuq suv bilan deyarli reaksiyaga
kirishmaydi, qaynoq suv va suyultirilgan kislotalarga ta’sir etib, vodorodni
ajratib chiqaradi. Magniy qizdirilgan metallmaslar va ayrim metallar bilan reaksiyaga
kirishib, birikmalar hosil qiladi. Magniydan yengil qotishmalar (Al, Zn, Mn
kabilar bilan) tayyorlanib, ular qattiq, puxta va korroziyaga chidamliligidan
samolyotsozlik va avtomobilsozlikda ishlatiladi. Magniydan fotografiyada,
pirotexnikada va shuningdek ba’zi sintez reaksiyalarda, rezina sanoatida,
tibbiyotda foydalaniladi.
Magniy gidrid MgH2 ni olish
uchun magniy dimetil 175°C da parchalanadi:
Mg(CH3)2 → MgH2 + C2H4
Magniy oksid MgO texnikada karbonatni va laboratoriyada magniy
gidroksidning parchalashidan olinadi: MgCO3 → MgO + CO2 Mg(OH)2 → MgO + H2O
MgO - 2800°C da suyuqlanadigan kristall modda bo’lib, undan
o’tga chidamli idishlar, tigel va boshqa buyumlar tayyorlanadi. Magniy oksid
suvda erimaydi, ammo kislota va kislotali oksidlarda yaxshi eriydi.
Magniy gidroksid Mg(OH)2 suvda kam eriydigan o’rtacha kuchga ega bo’lgan asos,
uning eruvchanlik ko’paytmasi (EK) 1,2×10-12 ga teng. U
quyidagicha olinadi:
MgCl2 + 2NaOH
= Mg(OH)2 + 2NaCl
MgCl2 + 2NH4OH = Mg(OH)2 + 2NH4Cl
Magniy xlorid MgCl2 ko’mir
bilan MgO aralashmasiga xlorni ta’sir ettirib olinadi, undan magnezial sement
tayyorlanadi, uni qipiq bilan aralashtirib, izolyatsiya materiali bo’lgan
ksilolit olinadi. Magniy sulfat MgSO4 tabiatda har xil minerallar shaklida
uchraydi, eritmada esa kristallogidrat monogidrat MgSO4 × H2O (kizerit minerali) va geptagidrat (MgSO4 × 7H2O) (taxir tuz minerali) holida
kristallanadi. Suvda eriydi, tibbiyotda surgi dori sifatida, qishloq
xo’jaligida o’g’it sifatida ishlatiladi. Magniy karbonat MgCO3 tabiatda magnezit va dolomit (MgCO3×CaCO3) holida uchraydi. MgCO3 suvda oz eriydi, uning suvdagi
eritmasiga ishqoriy metall karbonatlari ta’sir ettirilsa, Mg2(OH)2CO3 hosil
bo’ladi, uning aniq tarkibi 3MgCO3Mg(OH)2×3H2O bo’lib, oq magneziya (tabiatda kam
uchraydi) deb ataladi. Oq magneziya tibbiyotda, qog’oz va kauchuk sanoatida
ishlatiladi.
8. Сalsiy,
tabiatda uchrashi, fizik-kimyoviy xossalari, muhim birikmalari, ishlatilishi
Kalsiyning atom massasi 40,08 (Z = 20) ga teng. U tabiatda eng ko’p tarqalgan
metallardan biri bo’lib, Yer po’stlog’ining taxminan 3% ini tashkil etadi.
Tabiatdagi asosiy birikmalari ohaktosh, bo’r va marmar, shuningdek dolomit
(MgCO3×CaCO3), fosforit (Ca3(PO4)2), flyurit va
turli silikatlardir. Kalsiy o’simlik va hayvonlar organizmi uchun zarur
element. Odam suyagining 25% i qon va turli to’qimalarda oz miqdorda kalsiy
bo’ladi. Kalsiy suyuqlantirilgan CaCl2 ni elektroliz qilib (ozroq CaF2 qo’shiladi) olinadi.
Kalsiy kumushdek oq metall bo’lib, havoda tez oksidlanadi. Shuning uchun
kerosin ostida saqlanadi. Ochiq havoda qolsa, uning sirti oksid, peroksid,
nitrid qavatlari bilan qoplanadi. Kalsiy birmuncha qattiq bo’lishiga qaramay
yassilanuvchi metall, suv va kislotalardan vodorodni siqib chiqaradi. Kalsiy,
stronsiy va bariy aktiv metallmaslar bilan odatdagi sharoitda birikadi. U
kislorod bilan oksid CaO va peroksid CaO2, vodorod bilan gidrid, CaH2, azot bilan nitrid Ca3N2, uglerod bilan karbid CaC2, galogenlar bilan birikib, galogenid
CaHal2 larni
hosil qiladi.
Metall holidagi kalsiyning ishlatilishi uning yuqori kimyoviy aktivligiga
bog’liq, undan metall birikmalaridan (uran, xrom, sirkoniy, seziy, rubidiy
kabi) metallarni qaytarishda, po’lat va ayrim qotishmalardagi kislorod va
oltingugurtni yo’qotishda, organik suyuqliklarni suvsizlantirishda hamda vakuum
asboblaridagi qoldiq gazlarni yuttirishda foydalaniladi. Kalsiy faolligi past
bo’lgan metallarning oksidlaridan va galogenidlaridan kislorodni va galogenlarni
siqib chiqarib, qaytaruvchi xossasini namoyon qiladi.
Ca + TiO2 = 2CaO +
Ti ; 2Ca +TiCl4 = 2CaCl2 + Ti
Kalsiy gidrid CaH2 qattiq,
kristall modda, suv ta’sirida Ca(OH)2 ni hosil qiladi:
СaH2 + 2H2O = Ca(OH)2 + 2H2↑
Bu reaksiya natijasida ko’p issiqlik ajralib chiqib, vodorod yonib ketadi.
CaH2 ko’p
miqdorda vodorod ajralib chiqarish xususiyatiga ega bo’lgani uchun. vodorod
ajratib olish uchun ishlatiladi, hamda undan kristallogidratdan suvni tortib
oladigan juda samarali quritgich sifatida foydalaniladi.
Kalsiy oksid CaO ohaktoshning qizdirilishidan hosil bo’ladi:
CaCO3 →
CaO + CO2 - 178 kJ
Reaksiyani o’ng tomonga yo’naltirish uchun CO2 ning konsentratsiyasini kamaytirish yoki
haroratini ko’tarish lozim. CaO nihoyatda o’tga chidamli, taxminan 2600°C da
suyuqlanadigan oq modda, texnik CaO sarg’ish yoki bir oz kul rangroq bo’lib,
so’ndirilmagan yoki kuydirilgan ohak deb ataladi. CaO binokorlikda,
metallurgiyada, shisha ishlab chiqarishda va boshqa ko’pgina sohalarda
ishlatiladi. Agar ohakka suv ta’sir ettirilsa, shiddatli reaksiya sodir bo’lib,
ko’p issiqlik ajraladi, bunda suvning bir qismi bug’ga aylanadi:
CaO + H2O = Ca(OH)2 + 65 kJ
Hosil bo’lgan Ca(OH)2 so’ndirilgan
ohak deyiladi. Ca(OH)2 oq
kukun, suvda kam eriydi, ( 1 litr suvda 250C – 1,56 g Ca(OH)2 ) uning eritmasi esa kuchli asosdir. Ca(OH)2 ning tiniq eritmasi orqali CO2 o’tkazilsa yoki eritma ochiq
qoldirilsa, loyqalanib qoladi, demak, CaCO3 hosil bo’ladi: Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 ning
to’yingan eritmasi ohakli suv deyiladi.
Kalsiy oksid suv bilan so’ndiriladi va binolarni oqlash uchun ishlatiladi. Bino
devorlarida Ca(OH)2 havodagi
CO2 bilan
birikib, CaCO3 ga
aylanadi. Agar Ca(OH)2 ga qum
aralashtirilib suvga qorilsa, g’isht terishda ishlatiladigan qorishma olinadi,
bu qorishma qotganda CaCO3 va CaSiO3 hosil bo’ladi.
Kalsiy tuzlaridan CaCl2 bilan
Ca(NO3)2 suvda yaxshi eriydi, CaSO4 bilan CaSO3 oz eriydi, Ca3(PO4)2 va CaSO3 amalda erimaydi.
Tabiatda suv ohakli tog’ jinslaridan oqib o’tganda CO2 bilan birikib, kalsiy va magniy
karbonatlarni tegishli eruvchan bikarbonatlarga aylantiradi:
CaCO3 + H2O + CO2 = Ca(HCO3)2
MgCO3 + H2O + CO2 = Mg(HCO3)2
Bikarbonatlar suvda karbonatlarga qaraganda ancha yaxshi eriydi, ular eritmaga
o’tadi va natijada suv qattiq suvga aylanadi. Bunday suvda sovun yaxshi
ko’pirmaydi, sabzavotlar yaxshi rivojlanmaydi, bug’ qozonlarida quyqa hosil
bo’lib, u qozonning portlashiga sabab bo’ladi. Qattiq suvni ishlatishdan oldin
yumshatish lozim. Karbonatli suv muvaqqat qattiqlikka, xlorid va sulfatli suv
doimiy qattiqlikka ega. Suv har ikkala tuzlarning mavjudligi bilan bog’lik
bo’lgan aralash qattiqlikka ega. Qattiqlikni yo’qotishda Ca(HSO3)2 yoki Mg(HCO3)2 erimaydigan
holatga o’tkaziladi: Mg(HCO3)2 →
MgCO3↓ + H2O + CO2
Hosil bo’lgan karbonatlar cho’kmaga tushadi, natijada suvning qattiqligi
yo’qoladi. Qattiqlikni suvga ohakli suv qo’shish yo’li bilan ham oson yo’qotiladi:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O
Doimiy qattiqlikka ega bo’lgan suvni bu usullar bilan yumshatib bo’lmaydi, uni
yumshatish uchun soda qo’shiladi: MgSO4 + Na2CO3 = MgCO3¯ + Na2SO4
MgCl2 + Na2CO3 = MgCO3¯ + 2NaCl
Bu usulni karbonatli qattiqlikni ham, binobarin, aralash qattiqlikni ham
yo’qotish uchun bemalol tadbiq etish mumkin: Mg(HCO3)2 + Na2CO3 = 2NaHCO3 + MgCO3¯
Suvning qattiqligi graduslarda ifodalanadi. Suvning qattiqligi 1 l suvdagi
kalsiy va magniy ionlarining milligramm - ekvivalentlari yig’indisi bilan
o’lchanadi. 1 gradus qattiqlik 0,35663 mg-ekv kalsiy yoki magniy ionlariga
teng. Qattiqlikning har bir mg ekvivalenti suvda 20,04 mg/l Ca2+ yoki 12,16 mg/l Mg2+ bo’lishiga to’g’ri
keladi. Suvning qattiqligi 1,5 mekv/l dan kichik bo’lsa, juda yumshoq, 1,5-4
mekv/l bo’lsa, yumshoq, 4-8 mekv/l bo’lsa, o’rtacha qattiq, 8-12 mekv/l bo’lsa,
qattiq va 12 mekv/l dan katta bo’lsa, juda qattiq bo’ladi. Qora dengiz suvining
qattiqligi 65,5 mekv/l ga okean suvining qattiqligi 130,5 mekv/l ga teng.
Savollar
3.Magniy va kalsiy qanday usullar bilan olinadi?
4. Magniy va kalsiyning fizik-kimyoviy xossalarini taqqoslang.
5. Magniy va kalsiyning muhim birikmalarini sanab o’ting.
6. I guruh bosh guruhchasi elementlariga umumiy tavsif bering.
7. Natriy va kaliy tabiatda qanday birikmalar holida uchraydi? Formulalarini
yozing.
8. Natriy va kaliyning fizik hamda kimyoviy xossalari haqida nimalarni bilasiz?
9. Natriy va kaliyning ishlatilishi haqida nimalarni bilasiz?
Kimyo, ximiya — moddalarning tuzilishi va oʻzgarishini oʻrganadigan fan. Kimyo boshqa fanlar qatori inson faoliyatining mahsuli sifatida vujudga kelib, tabiiy ehtiyojlarni qondirish, zaruriy mahsulotlar ishlab chiqarish, biridan ikkinchisini xrsil qilish va, nihoyat, turli hodisalar sirlarini bilish maqsadida roʻyobga chiqdi. Odamlar qadimda rudalardan metallarni ajratib olish, turli xil qotishmalar tayyorlash va qoʻllash, jumladan, shisha tayyorlash va undan turli maqsadlarda foydalanishni bilganlar. Miloddan avvalgi Misrda kimyoviy jarayonlarga asoslangan hunarmandchilik rivojlanganligi maʼlum. Pishiq charm tayyorlash, uni boʻyash, rangli shisha olish, oʻsimliklardan dori-darmon va xushboʻy hidli moddalar tayyorlash, sopol buyumlar ishlab chiqarish yoʻlga qoʻyilgan. Oʻsha davrlarda kimyoviy mahsulotlar Hindiston, Xitoy va Oʻrta Osiyoda ham ishlab chiqarilgan. "Kimyoi hunar" sohibi boʻlgan kimyogar bir moddadan ikkinchi mahsulotni tayyorlash ishi bilan shugʻullangan. Oʻzbekistondan oʻtgan Buyuk ipak yoʻli orqali miloddan avvalgi 1-ming yillikning 2-yarmidan boshlab, mamlakatga savdo-sotiq bilan birga hunarmandchilik ham kirib keldi. Topilgan juda koʻp tarixiy buyum va yodgorliklar Oʻzbekiston hududida yashagan aholining kimyo hunaridan qadimdan boxabar ekanligidan darak beradi. Buxoro yaqinidagi Poykend manzilgohidan 8-asrga taalluqli kimyo lab. topilgan. Lab. jihozlari ichida turli idishlar, shisha asboblar, bolalar sumagi uchraydi.
Kimyoning fan sifatida shakllanishini tadqiqotchilar Misr bilan bogʻlashadi. Savdo-sotiq, xunarmandchilik va maaaniy alokalar juda rivojlangan bu mamlakatda ilm, falsafiy qarashlar, sanoat va qishloq xoʻjaligi yaxshi rivoj topali. Nil boʻyidagi Iskandariya shahrida 1-asrda yozilgan traktatlarda koʻpgina kimyoviy maʼlumotlar, jumladan, kimyoviy ji-hozlarning koʻrinishlari, kuydirish, pishirish, toblash, quruq haydash, eritish, kristallanish, ajratish va boshqa usullar haqida maʼlumotlar keltiriladi. Mazkur manbada oddiy metallardan oltin olish gʻoyasi ham ilgari surilgan boʻlib, mavhum bu izlanish fanning rivojlanishiga maʼlum darajada toʻsqinlik qildi, olimlar fikrini boshka — amalga oshmaydigan yoʻnalishga burib yubordi. Iskandariya traktatlari maʼlumotlaridan foydalangan arab olimlari tez orada bir nechta yangi moddalar, jumladan, nitrat kislota, tuzlar va boshqalarni olishni kashf qildilar. Misrlik olimlar tilidagi Kimyoga arablar "al" qoʻshimchasini qoʻshib mashhur "Alkimyo"ga asos soldilar. Natijada koʻpgina ilmiy asarlar, kitoblar, maqolalar va tajribalar ifodalari paydo boʻldi. Keyinchalik bu soʻz Yevropa mamlakatlarida "Ximiya" nomi bilan ommalashdi. Muhammad Xorazmiy 10-asrda "Kimyo" soʻzi arabcha "kamoyakmi", yaʼni "yashirmoq", "berkitmoq" ni anglatadi, deydi. Turk olimi Toshkoʻpir-zodaning fikriga koʻra, mazkur soʻz yahudiycha "kimyax" dan olingan. Baʼzi olimlar "Kimyo" soʻzi Misrning qad. nomi "Xem" yoki "Hame"dan olingan degan fikrni ilgari surishadi. Bu soʻz "qora" yoki "qoramtir" maʼnosini anglatib, manbalarda "Kimyo" "Misr fani" degan maʼnoda keladi. Boshqa bir guruh olimlar esa "Kimyo" soʻzi yunoncha "kimyo" iborasidan kelib chiqqan boʻlib, "suyuqlik", "eritilgan metall"ni anglatishiga ishora qiladilar. Ammo, qanday boʻlishidan qatʼi nazar, mazkur fanning Sharq mamlakatlarida bir kator rivojlanganligi, bu borada oʻrta osiyolik olimlarning xizmati katta ekanligi tarixiy manbalardan maʼlum.
"Alkimyo" asoschisi Jobir ibn Xayyom metallarning paydo boʻlishidagi oltingugurt-simob nazariyasini olgʻa surgan, yaʼni yer qaʼrida quruq bogʻlanishdan oltingugurt ("metallar otasi"), nam bugʻlanishdan esa simob ("metallar onasi") paydo boʻladi degan fikrni aytadi. Ularning turli xil nisbatlarda birikishidan oltin, kumush, mis, temir, qalay, qoʻrgʻoshin, shisha hosil boʻladi. Shu asnoda oddiy metallarni nodir metallarga oʻtkazish haqida maʼlumotlar beriladi. "Element" tushunchasiga koʻra, oltingugurt — yonuvchanlik, simob — uchuvchanlik, tuz esa eruvchanlikni bildiradi. Shoʻnga koʻra, bu moddalar turining kashf qilinishi asosiy fikr boʻldi. Olimning izdoshlaridan boʻlgan Abu Nasr Forobiy oʻzining "Us todi Soniy" asarida alkimyo ilmining yoʻnalishini maʼqullaydi. Sharq allomalaridan Abu Bakr ap-Roziy "Sirlar kitobi"da alkimyo maʼlum boʻlgan moddalarni oʻrganish, asbob-uskunalarni yigʻish va foydalanish hamda tajribalar oʻtkazishni keltiradi. Roziy oʻz asarida oʻngacha maʼlum boʻlgan moddalarni tasniflab, asbob va tajribalarni maʼlum bir tizimga solgan. Abu Abdullo al-Xorazmiyning "Bilimlar kaliti" kitobida Kimyoga alohida boʻlim ajratilib, unda turli moddalar, asboblar, tajribalar toʻgʻrisida mukammal maʼlumotlar keltirilgan. Abul Hakim al-Xorazmiy esa alkimyo fani tajribalarida qoʻllanilgan taroziga ahamiyat beradi. Al-Haziniy tomonidan 1125 yilda yozilgan "Dono tarozu haqida kitob"da turli koʻrinish va tuzilishdagi tarozilarda tortish usullari bayon qilinganligi manbalardan maʼlum. Abu Ali ibn Sino "Al-qonun" kitobida oʻsimlik, hayvonot, minerallar, tuzlar, kislotalar, ishqorlar, metallar, oksidlar va boshqa birikmalarning 750 dan ortiq turini yozadi. Ularning nomi, xossalari, ishlatilishini tula ifo-dalaydi. Uning "taboshir kulchalari"dan (Indoneziyada oʻsadigan bambukdan olib kulchaga qoʻshib oyoq-qoʻli singan bemorlarga beriladigan kremniy oksidi — inson organizmida tez erib singadigan modda) qanchadan-qancha odamlar shifo topgan. Ibn Sino Jo-birdan farqli ravishda metallarning xususiyatini chuqur va mukammal oʻrgan-di, uning xatolarini tuzatdi. Ibn Sino nafaqat Jobirning , balki barcha alkimyogarlarning xatolarini ilmiy jihatdan asoslab berdi. U oddiy metallardan nodir metallar, jumladan, oltin olib boʻlmasligini birinchi boʻlib amalda isbot etdi. Fransuz olimi M. Bertlo, rus olimi B. Menshutkin, akad. O. Soimovlarning fikricha, Abu Ali ibn Sino asarlarida hozirgi zamon anorganiq kimyo fanining ilk kurtaklari namoyon boʻlgan. Abu Rayhon Beruniyning "Mineralogiya"sida moddalarning moddalik xususiyatlari uz aksini topgan. Oʻzbekiston FA Sharqshunoslik in-ti fondida mineralogiyaga oid 18 ta, Kimyoga oid 31 ta qulyozma mavjud. Bular arab, fors, eski oʻzbek (turk) tillarida bitilgan "Hunarlar javohiri" kitobidagi marvarid, boʻyoqlar, sir, zaharga qarshi ishlatiladigan dorilar, upa-elik tayyorlash usullarini oʻz ichiga olgan manbalardir.
8-asrdan 17-asr oʻrtalarigacha davom etgan alkimyo bir tomondan fanni rivojlantirgan boʻlsa, ikkinchi tomondan uning tez qadamlar bilan oʻsishiga toʻsqinlik qildi. Ingliz kimyogari R. Boyl Kimyoni oʻrganishda yangicha yondoshish va faqat tajribalar yordamida olingan maʼlumotlarga ishonishga undadi. Uning fikricha, Kimyoning maqsadi jismlar tuzilishini aniqlash, shundan soʻng uni elementlarga ajratib, tahlilga oʻtishdan iborat boʻlishi kerak. Bunday ilgor ilmiy fikrlar paydo boʻlishiga qaramay Kimyoning haqiqiy yoʻlga tushishiga yana bir asr kerak boʻldi. Nemis kimyogari G.E. Shtal (1659—1734)ning flogiston nazariyasiga qarshi oʻlaroq, M. V. Lomonosov 1756 yilda yonish, yaʼni oksidlanish — oksidlovchi moddaning havo bilan birikishidan iborat ekanligini miqdoriy tajribalar asosida koʻrsatib berdi. Fransuz kimyogari A. Lavuazye esa 1772—77-yillarda turli moddalar ustida tajribalar oʻtkazib, ular yonganida kislorod bilan birikishini koʻrsatdi hamda kimyoviy reaksiyalarda moddalar ogʻirligining saqlanish qonunini isbotladi. Mazkur qonun tasdiqlangach, Kimyo sifat-tavsif ilmidan miqdoriy bilimga aylandi. Endilikda massaning saqlanish qonuni deb ataluvchi mazkur qonun muhim ahamiyat kasb etadi. Bir qancha gazlar kashf qilinishi natijasida pnevmatik kimyoga asos solindi. Flogiston nazariyasi tamomila rad etildi, kislorodli yonish nazariyasi oʻz tasdigʻini topdi. Natijada koʻpgina nazariy tasavvurlar oʻzgardi, yaʼni kimyoviy nomenklatura ishlab chiqildi. Mana shu davrda kimyoning analitik tahlil yoʻli shakllandi.
19-asr Kimyo fani tarixida nazariy asoslarni ishlab chiqish davri boʻldi. Natijada ato m - molekulyar taʼlimot maydonga keldi. Ingliz olimi Jon Dalton 1803 i. moddaning atom tuzilishi haqidagi tasavvurlarga suyangan holda tajribalar oʻtkazdi. Elementlarning muayyan bir miqdorda reaksiyaga kirishuvini ularning ayrim zarrachalardan, yaʼni boshqacha aytganda atomlardan tashkil topganligidan deb bildi. Karrali nisbatlar qonuni deb atalmish fikri asosida kimyoviy elementlarning bir-biri bilan maʼ-lum ogʻirlik nisbatlarida birikishini koʻrsatib, atom ogʻirliklariga alohida ahamiyat berdi. Nisbiy atom ogʻirlik tushunchasini fanga kiritib, eng yengil element sifatida vodorod atomi ogʻirligini birga teng deb qabul qildi va uni birlik sifatida taklif etdi. Dalton elementning atom ogʻirligi sifatida mazkur element atom ogʻirligining vodorod atomiga boʻlgan nisbatini oldi. Italiyalik olim A. Avogadro atom va molekula tushunchasining bir-biridan farq qilishini aniqlab berdi. U moddaning kichik zarrachasi molekula, elementlarning eng kichik zarrachasi esa atom deb taʼrifladi. Pekin uning bu fikri faqat oradan ancha vaqt oʻtgach, tan olindi. Gep-Lyussakning hajmiy nisbatlar qonuni (q. Gey-Lyussak qonunlari) eʼtirof etilgach, Avogadroning bir xil temperatura va bosimda olingan ixtiyoriy gazlarning teng hajmlaridagi molekulalar soni teng boʻlishi haqidagi qonuni (gipotezasi) amaliyotga kiritildi. Fransuz fizigi J. B. Perren (1870—1942) tajribalari asosida hisoblab topilgan 6,022SH23 soni Avogadro soni deb ataldi.
1852 yilda ingliz kimyogari E. Franklend fanga valentlik tushunchasini kiritdi. A. M. Butlerov tomonidan 1861 yil eʼlon qilingan tuzilish nazariyasi Kimyoning rivojida muhim bosqich boʻldi. Mazkur nazariya asosida organiq moddalarning molekulalardagi atomlar valentliklariga muvofiq bir-biri bilan birikishi, moddalarning xossalari kimyoviy tuzilishi (tarkibi)ga bogʻliqligi, atomlar bir-biri bilan qanday ketma-ketlikda birikkanligini aniqlash, kimyoviy tuzilish formulasi birikma xossasini ifodalashi, molekuladagi oʻzaro birikkan va birikmagan atomlarning bir-biriga boʻlgan taʼsirining borligi yotadi. Nazariya yangi moddalar sintez qilishni, ularning xossalarini oldindan aytib berishni va nazariy jihatdan muhim boʻlgan izomeriya hodisasini ilmiy nuqtai nazardan isbotlab berdi.
19-asrda fandagi tarixiy kashfiyotlardan biri 1869 yil D. I. Mendeleyev tomonidan ochilgan kimyoviy elementlar davriy qonuni va sistemasi boʻldi. Mendeleyev elementlarni ilmiy asosda sinflarga ajratdi, ular orasidagi ichki bogʻlanish qonuniyatlarini topdi, hali nomaʼlum boʻlgan elementlar mavjudligini oldindan bashorat qildi. Uch nomaʼlum elementning xossalarini oldindan aytib berib, ularga "ekabor", "ekaalyuminiy" va "ekasilitsiy" degan shartli nomlar berdi. Oradan 15 yil oʻtar-oʻtmas uning ba-shorati amalda tasdikdandi. Bu elementlar fransiyalik Lekok de Buabodran, shvetsiyalik Nilson va germaniyalik Vinklerlar tomonidan kashf etildi. Ekaalyuminiyga Fransiyaning eski nomi Galliyadan olinib "galliy" nomi, ekaborga "skandiy" (Skandinaviya nomidan) va ekasilitsiyga "germaniy" degan nomlar berildi. Mendeleyevning maʼlumotlari boshqa olimlar maʼlumotlariga juda yaqinligi bilan ilmiy tasdigʻini topdi. Uning yana 11 elementning tez orada ochilishini nazarda tutib boʻsh kataklar qoʻyganligi qonun va uning grafik ifodasi boʻlgan davriy sistemaning katta ilmiy gʻalabasi boʻldi. Sistemada davrlar va guruhdar shunday joylashtirildiki, bunda valentlik, atom massalari, atom radiuslarining oʻzgarishi va shahrik. xossalar oʻz ifodasini topdi. Natijada ilgari tasdikdanmagan kimyoviy elementlar sistemalaridagi xatolik va kamchiliklarga barham berildi, atom massalariga tuzatishlar kiritildi, nodir elementlar va asl gazlar xossalari toʻgʻri talqin qilindi. Davriy qonun nafaqat Kimyo uchun, balki boshqa tabiiy fanlar, falsafadagi miqdorning sifatga oʻtish qonuniyatlarini aks ettiruvchi tabiatning fundamental qonuni boʻlib qoldi. Buning isboti sifatida davriy qonun va sistema asosida kimyo qonunlari va tabiatning yuzlab boshqa qonunlari, jumladan, radioaktiv elementlarning kashf qilinishi, ingliz fizigi E. Rezerfordning atom tuzilishi modelini taklif qilishi, Daniya fizigi N.Borningatomlarda elektron qobiqlari va qobiqchalari ketma-ket joylashuvini topishi, atom energiyasining nihoyatda ulkan kuchidan foydalanish qabilarni koʻrsatish mumkin. Ayni vaqtda Kimyo fani Mendeleyev davriy qonuni va sistemasi asosida oʻqitiladi.
19-asr ning 70-yillaridan boshlab organiq kimyo tez rivojlana boshladi. Uglevodorodlar, spirtlar, aldegidlar, ketonlar, karbon kislotalari, galogenlar, nitrobirikmalarning muhim hosilalari olindi, xossalari oʻrganildi va bularning maʼlum qismi sanoat miqyosida ishlab chiqarila boshladi. 80-yillarda toʻyinmagan uglevodorodlar asosidagi sintezlarga asos solindi, purin moddalari, qandlar, tabiiy pigment va oqsillar oʻrganila boshlandi. Natijada stereokimyo tasavvurlari rivojlandi. Bu davrda elektrokimyoviy (M. Faradey) va termokimyoviy jarayonlar (G. I. Gess, M. Bertlo), elektrolitik dissotsiatsiya (S. Arrenius), kimyoviy reaksiyalar tezligi (Ya. Vant-Goff) oʻrganildi. Buning natijasida kimyoviy termodinamika faniga asos solindi.
19-asr oxiri va 20-asr boshlari fizikada atom tuzilishining oʻrganilishi, radioaktivlik hodisasining ochilishi, elektronning amaliyotdagi ahamiyati oʻrganilishi va kvant kimyosinit chuqur nazariy yutuqlaridan foydalanish Kimyo fanining olamshumul yutuqlaridan boʻldi. Mac, tabiiy hodisa — Adriatika dengizining fosforessensiyalanishini 1835 yildayoq fransuz fizigi A. [[Bekkerel sezganligi maʼlum. Ammo oradan 60 yil dan ortiqroq vaqt oʻtib uning nabirasi Anri [[Bekkerel 1896 yilning 1 martida uran hosilalari, bir oz keyinroq esa uranning oʻzi ham shunday xossaga egaligini aniq-ladi (q. [[Bekkerel). 1895 yili V. Rentgen tomonidan kashf etilgan nurlar ham shunday xossalarga ega ekanligini [[Bekkerel koʻrsatib oʻtgan edi. ʼL.Skladovskaya-Kyuri bu nurlarni radioaktiv nurlar, nurlanish hodisasini esa radioaktivlik hodisasi deb atadi. U bu hodisani shaxsan oʻzi toriy elementida uchratdi. U P. Kyuri bilan birgalikda uran minerallaridan 2 ta yangi radioaktiv element — poloniy va radiyni ajratib olishga muvaffaq boʻddi. Yangi elementlarning biri M. Skladovskaya-Kyurining vatani boʻlmish Polshaning eski nomi sharafiga poloniy deb nomlanadi. Shunday keyin aktinoidlar qatori tuzildi. Radioaktiv elementlarning yarim yemirilish davri, yaʼni har bir radioaktiv moddaning yarmisi parchalanishi uchun ketgan vaqtni belgiladilar. E. Rezerford, ingliz olimi F. Soddi, keyinroq Iren va Jolio-Kyurilar radioaktivlikni chukur oʻrganishdi, Kyurilar sunʼiy radioaktivlik hodisasini tadqiq qilishdi. Yadro reaksiyalari yordamida davriy sistemadagi barcha kimyoviy elementlarning sunʼiy radioaktiv izotoplarini olish mumkinligi ishlar koʻlamini fizika bilan bir qatorda Kimyoga ham olib kirdi. Natijada Kimyoning zanjir reaksiyalari mukammal oʻrganildi va amaliy ahamiyat kasb etdi. Pozitron chiqishi yoki (3+-yemirilish va K-zabt etish (yadroning yaqinida turgan K-qobiqchadagi elektronni yutishi) turli elementlar radioizotoplarini oʻrganishga yordam berdi. Hozirgigacha bunday radioaktiv izotoplardan 1500 dan ortigʻi olingan. Sunʼiy radioizotoplarni oʻrganish aylanishlarning yangi xillarini topishga imkon berdi. Radioaktiv moddalarning xossalarini oʻrganadigan, ularni ajratib olish, yigʻish va tozalash usullarini ishlab chiqadigan fan radiokimyo nomini oldi.
Kimyoning tez suratlar bilan rivojlanishi natijasida elektron va u haqsagi tushunchalar aniqlanib, kvant kimyosi hamda sunʼiy sintez qilingan transuran elementlar kimyosi shakllandi. Oqsillar kimyosida misli koʻrilmagan yangiliklar ochildi. Million atmosfera bosimda olib boriladigan kimyoviy jarayonlar oʻrganildi, sunʼiy olmos olishning nazariy yoʻllari koʻrsatildi, xilma-xil polimerlar sintez qilindi.
18-asr oxiri va 19-asr oʻrtalarida Gʻarb mamlakatlarida rivoj topa boshlagan Kimyo Rossiya orqali Oʻzbekistonga ham kirib keldi. Toshkentda 1869 yil kimyo lab. tashkil etildi. Keyin shu yerda koʻmirni gazlashtiruvchi moslama koʻrib ishga tushiriladi, lab.dagi xonalar gazlashtiriladi. Lab. xodimlari tomonidan mahalliy va olib kelinuvchi portlovchi moddalar tarkibi tekshiriladi. Qoʻqon xonligi va Buxoro amirligida zarb qilingan tangalar oʻrganiladi. Turli oʻsimliklardan alizarin boʻyogʻini ajratib olish, chigitni tozalash, tolani presslash, suv va tuproqni analiz qilish, oʻlkada sanoatni rivojlantirishga zarur boʻlgan togʻ jinslarini tadqiq qilish, sabzavot ekinlari tarkibidagi shakar miqdorini aniqlash, shisha uchun kerakli giltuproq va qumtuproq tarkibi hamda sifatini aniqlash, uzumni bijgʻitib spirt tayyorlash, anor poʻstlogʻidan oshlovchi moddalar tayyorlash, sement eritmalari va toshqol olish, don va dukkakli oʻsimliklardagi kraxmalni aniqlash, qamish, gʻoʻzapoya va daraxtlarning oʻtinlaridagi yonilgʻi birliklarini hisoblash kabi i.t. ishlari olib boriladi. 1913 yil yanv.gacha ishlab turgan mazkur lab. bajargan ishlari asosida Oʻzbekistonda bir necha sanoat tarmoqlarini tashkil qilish mumkin degan xulosaga kelinadi, lekin bu ishlarga amaliy yondoshilmaydi.
1918 yil Toshkentda Turkiston untining tashkil etilishi va uning tarkibida kimyo f-tining ochilishi Oʻzbekistonda Kimyo fanining rivojida yangi bosqich boʻldi.
Kimyo va uning sanoatiga yondosh boʻlgan qurilish, oziq-ovqat, neft, suv va boshqa tarmoqlar rivojlanishi bu ishlarga ijobiy taʼsir koʻrsatdi. Mahalliy aholi orasidan A. Shamsiyev, 3. Saidnosirova, M. Hakimov, M. Niyozov, M. Azizov kabi dastlabki kimyogarlar yetishib chiqsi. Ular yosh kadrlarni tayyorlashga katta hissa qoʻshdilar.
1920 yil Turkiston Respublikasi Markaziy xalq xoʻjaligi kengashida sanoat bilan bogʻlangan Kimyo boʻlimi tashkil qilinib, unda lab. ochiladi. Lab. Respublika xalq xoʻjaligining turli tarmoklari uchun zarur boʻlgan ilmiy muammolar bilan shugʻullana boshlaydi. 1921 yil esa i.t. institutlari Kengashi tashkil etilib, oʻnga prof. S.N. Naumov rais qilib tayinlanadi. Dorivor preparatlar tayyorlab, analitik tahlillar olib boriladi. Ishlar natijasi Xilkovo (hozirgi Bekobod) sement z-di va Ashxobod shisha z-dining ishga tushirilishida qoʻl keladi. Tez orada un-tda texnik kimyo kafedrasi ochiladi. Bu yerda N. L. Karavayev, M. S. Elgort, D. A. Alekseyev, Ye. I. Poznerlar tomonidan anorganiq va fizik Kimyo boʻyicha i.t. ishlari olib boriladi. V. A. Novikov bilan B. G. Zapromyotovlar ilmiy ishlar qatorida mahalliy kadrlar tayyorlash bilan ham shugʻullanadilar. 1927 yil Oʻzbekiston sanoat-iqtisod i.t. instituta (keyinroq Oʻzbekiston mahalliy sanoat i.t. instituta) tashkil qilinadi. In-t lab.larida keramika, bogʻlovchi materiallar, sellyuloza-qogʻoz va yoqilgʻi sektorlari ochiladi.
30-yillarda fanning rivojiga S. N. Naumov, M. I. Usanovich, A. P. Rostovskiy, S. M. Muqimov, I. S. Kansepolskiylar katta hissa qoʻshdilar. 1933 yil un-tning kimyo fti qoshida Kimyo tadqiqot instituti tashkil qilinadi. In-t lab.larida diketoefirlar kimyosi, gaz reaksiyalari kimyosi, elektr kimyosi, aralashmaydigan suyuqliklar kimyosi, tabiiy va sintetik kolloid sistemalar, alkillash reaksiyalari, kislota-ishqor nazariyasi, soz tuproq asosida keramik materiallar ishlab chiqarish kimyosi va texnologiyasi, chigitdan yogʻ olish kabi muhim i.t. ishlarini rivojlantirishda tadqiqotchilar sanoat bilan hamkorlikda ishladilar.
30- yil larda un-tning kimyo f-tida S. Yunusov, O. Sodiqov, K. Axmedov, Sh. Tolipov, H. Usmonov, A. Sultonov, H. Rustamov, Y. Toshpoʻlatov, A. Abdu-rasulova, F. Tojiyev, A. Murtazoyev, H. Rahimov kabi isteʼdodli yoshlar yetishib chikdi. 2-jahon urushi yillarida sharoit ogʻir boʻlishiga qaramay fan rivojiga ahamiyat berildi, tadqiqotlar kamroq boʻlsada davom ettirildi. 40-yillar boshida Ittifoq FA ning Oʻzbekiston filiali tashkil qilinib, uning tarkibiga A. S. Shamsiyev rahbarlik qilayotgan Kimyo in-ti ham kiritildi. S. Muqimov, F. Xoʻjayev va frontdan qaytgan S. Yunusov, K. Ahmedov, Sh. Tolipov, A. Sultonov, H. Rustamov, I. S. Kansepolskiy va boshqa olib borilayotgan i.t. ishlariga oʻzlarining munosib hissalarini qoʻshdilar. Ular Oʻzbekiston FAning i.t. institutlari tarkib topishi va rivojida ham ishtirok etishdi. Urush davrida Chirchiq elektr kimyo k-tining bosh muxandisi lavozimida ishlagan M. Nabiyev kimyo sanoatining rivojiga katta hissa qoʻshdi, keyinroq u mineral oʻgʻitlar kimyosi yoʻnalishining bosh mutaxassisi sifatida koʻp yillar faoliyat koʻrsatdi. Xalq xoʻjaligining eng asosiy tarmogʻi boʻlgan paxtachilik rivojlantirildi, oʻgʻitlar va mikroelementlarning yangi xillari topildi.
Umumiy va anorganiq Kimyoda tuzlar kimyosi, gidrolizi va eruvchanligi sohasidagi muammolar hal qilinib, yerga solinadigan oʻgʻitlar hamda ularning kimyosi chuqur oʻrganildi. Ekinga solinadigan mikroelementlar kimyosi M. Azizov tomonidan rivojlantirildi, ularning anchagina kompleks birikmalari sintez qilindi, bulardan dori-darmon tayyorlashda foydalanish ham oʻrganildi. Prof. H. Rahimov nodir va rangli metallarning kompleks birikmalari kimyosi ustida ish olib bordi. Polimetalli xom ashyolar kimyosi rivojlantirildi, ogʻir metallarning geterotsiklik birikmalari, ularning N-oksidlari, kompleksonlari aniqlandi. Suv-tuz sistemasi chuqur tahlil qilindi, ekstraksiya jarayonlari yaxshilandi. Kompleks birikmalar va kompleksonlar kimyosi chuqur oʻrganildi hamda xalq xoʻjaligining turli jabhalaridan keng oʻrin oldi.
Akad. N. Parpiyevning nodir va oʻtkinchi metallar kompleks birikmalari xossalarini oʻrganish, yangilarini sintez qilish va amaliyotda qoʻllash boʻyicha ishlari diqqatga sazovordir. Kremniy, germaniy, titan, sirkoniy, gafniy, molibden va vanadiy ftoridlarning vodorod ftorid kislo-tasi bilan taʼsiri oʻrganildi. Yuqori molekulali ftorli kompleks birikmalarning barqarorlik konstantalari topildi, anion almashishining mexanizmi tahlil qilindi. Qator komplekslarning IQ-spektrlari, termografiyasi, elektr oʻtkazuvchanligi, rentgen-fazaviy tahlili amalga oshirildi. Volfram ajratib olish ishi yoʻlga qoʻyildi. Yangi kompleks birikmalardan qishloq xoʻjaligida, tibbiyot va farmatsev-tikada foydalanish boʻyicha amaliy ishlar qilindi.
Analitik Kimyodagi dastlabki ishlar akad. Sh. Tolipov rahbarligida olib borildi. U shogirdlari bilan birga ftorli birikmalar kimyosini chuqur oʻrgandi, natijada qator elementlarni aniqlashning ogʻirlik, hajmiy va amperometrik usullari ishlab chiqildi. Bu ishlar "boʻysunmagan element" boʻlgan ftorning sanoat miqyosida ishlab chiqarilishini yoʻlga qoʻyishda muhim omillardan boʻldi. Anorganiq moddalarning lyuminessent tahlili boʻyicha R. Jiyanboyeva olib borgan ishlar oʻz vaqtida butifosning zararli xossalarini aniqlashda rol oʻynadi.
Kimyo fanining shon-shuhratini jahon miqyosiga olib chiqishda akad. S. Yunusovning alkaloidlar kimyosini rivojlantirishga oid ishlari muhim hissa boʻlib qoʻshildi. 4000 dan ortiq oʻsimlik alkaloidlari tadqiq qilinib, ulardan 600 dan ziyod muhim alkaloidlar ajratib olindi, ularning tarkibiy qismlari, tuzilishi va xossalari chuqur oʻrganildi. 50 dan ortigʻi tibbiyotga joriy etildi, olingan oqsillar qishloq xoʻjaligi va oziq-ovqat sanoati uchun taklif etildi. Vilt kasalligiga qarshi qoʻllaniladigan preparatlar kashf qilindi. Prof. F. Qoʻchqorov va uning shogirdlari tomonidan atsetilen kimyosi rivojlantirildi. Akad. I. P. Sukervaniq, A. Abdurasuleva va boshqa alkillash reaksiyalarini oʻrganib, fan rivojiga hissa qoʻshdilar. Dekarbonillash boʻyicha Yo. Aliyev tadqiqotlari u rahbarlik qilgan Kimyo in-tida karboksillash reaksiyalarini oʻrganishda qoʻl keldi.
Organiq kataliz neftni kayta ishlash in-ti (hozirgi A. Sultonov nomidagi Kataliz in-ti)da rivoj topdi. Intda koʻpgina yangi katalizatorlar kashf qilindi, aromatik uglevodorodlar kimyosi, qishloq xoʻjaligi va ipakchilikning rivojlanishi uchun amaliy ishlar olib borildi.
Akad. O. Sodiqov tomonidan bioorganiq kimyo faniga asos solindi. Olim tashkil etgan Bioorganiq kimyo in-tida (1973 yil) oʻsimliklarning ikkilamchi metaboliti, tibbiyot va qishloq xoʻjaligi uchun zarur preparatlarni olish usullari, hayvonlar va oʻsimliklardagi oqsil tabiatli zaharlarning taʼsir mexanizmi oʻrganildi. Ilon, chayon va boshqa zaharining sunʼiy analoglari olindi, taqribiy qismlari hamda xossalari tadqiq qilindi. N-oksidlar, anabazin, dipiridil, paxikarpin, morfin, sitazin va boshqa kimyosi chuqur oʻrganildi. Stereokimyo, konformatsion analiz, tabiiy birikmalarning elektron tuzilishi va reaksiyaga boʻlgan xususiyatlari tadqiq qilindi. Gossipol kimyosi oʻrganildi, gʻoʻzapoyadan turli mahsulotlar olish kimyosi va texnologiyasi ishlab chiqildi, viltga qarshi ishlatiladigan preparatlar kashf qilindi. Akad. A. Abduvahobov sintez qilgan feromonlar paxtachilik rivojiga muhim hissa qoʻshdi. Akad. Sh. Solihov rahbarligida olib borilayotgan i.t.lar, tibbiyot, qishloq xoʻjaligi, farmatsevtika va biokimyo ehtiyojlarini qondirishga qaratildi.
Fizik Kimyo 20- yil lar oxirlarida D. Alekseyevning portlash jarayonlari kinetikasini oʻrganish bilan boshlandi. Keyinroq N. A. Kolosovskiy. M. I. Usanovich va V. V. Udovenkolarning termodinamika hamda fizik-kimyoviy tahlil masalalarini bajarish bilan davom ettirildi. Polimerlarning fizik-kimyoviy xossalarini tekshirish (H. Usmonov), kimyoviy reaksiyalar kinetika-sini oʻrganish (H. Rustamov), elektr kimyoviy jarayonlarni tadqiq qilish (A. Murtazoyev) ustidagi ishlar kengaytirildi. Olimlar suyuq eritmalarning elektr oʻtkazuvchanligini oʻlchash, rangli va nodir elementlar hamda ular qotishmalarini elektr kimyoviy usulda choʻktirib ajratish, elektr kapillyar hodisalari oʻlchamini bilish bilan shugʻullandilar. Kislota-asos katalizatorlari ishtirokida oʻtadigan qator reaksiyalarning kinetik qonuniyatlari va mexanizmi oʻrganildi, ionitlardan foydalanish ishlari olib borildi. Koʻp atomli spirtlardan erituvchi sifatida foydalangan holda koʻpgina reaksiyalar kinetikasi va mexanizmi ravonlantirildi.
Fizik Kimyo bilan chambarmas bogʻliq boʻlgan kolloid Kimyo ustidagi tadqiqotlar B. G. Zapromyotov (30-yillar), urush davridan boshlab esa akad. K. Ahmedov boshchiligida olib borildi. Oʻsha davrlarda giltuproq, tabiiy mineral boʻyoqlar, loyqa suvlar va shahrik. boshqa dispers sistemalar; gidrolizlar, kolloid choʻkmalar hisoblangan koagulyantlar, koagel, kserogellar oʻrganildi. 50-yillardan boshlab esa polimerlar fizik kimyosi va termokimyosiga oid tabiiy gazlar hamda gaz kondensatlaridan sirt-faol moddalar olish, suvda eruvchan yuqori molekulali birikmalar sintez qilish, ularning xossalarini oʻrganish ishlari amalga oshirildi. Liofob gidrozollar, liofill polimerlarning kolloid xossalarini oʻrganish, ularning tuzilishini boshqarish va zarur xususiyatlarni singdirish, tabiiy mineral sorbentlardan amaliyotda foydalanishga doyr anchagina ishlar diqqatga sazovordir. K. Axmedov oʻz shogirdlari (E. Oripov va boshqalar) bilan hamkorlikda "K-4", "K-9", "PAA-1" kabi preparatlarni kashf qilib sanoatga tadbiq etdi. Endilikda bunday preparatlardan burgʻilashda, qishloq xoʻjaligida, yoʻl qurilishi va choʻllardagi uchuvchan qumlarni muqim holatga oʻtkazish ishlarida foydalaniladi. Mana shunday ishlar natijasi oʻlaroq choʻl zonalarida ekinzorlar barpo qilish, shahar va qishloqlar qurish ishi osonlashdi, sirt-faol moddalardan foydalanish turli sanoat korxonalari faoliyatini jadallashtirishga, ishlab chiqarish hajmini oshirishga olib keldi.
Yuqori molekula(polimer)li birikmalar kimyosi urushdan keyingi yillarda rivojlandi. 1946 yildan boshlab paxta sellyulozasi va uning turli efirlari ustida ilmiy izlanishlar olib borildi. Yangi monomerlar sintez qilish, ularni polimerlash, tola choʻzish kabi ishlar yoʻlga qoʻyildi.
H. Usmonov boshchiligida vinil monomerlari u-nurlari taʼsirida qator polimerlarga payvandlandi, ularning xossalari tadqiq qilindi, olingan birikmalarda fiziologik faollik borligi aniqlandi. Bu ishlarning natijalari olingan polimerlardan tibbiyotda foydalanishga yoʻl ochdi. Vinilftorid va shahrik. boshqa ftorid monomerlarini polimerlab olingan yangi xossalarga ega boʻlgan yuqori molekulali birikmalar sintez qilindi. Olingan sunʼiy tolalardan kord, polinoz tolalar, fortizanlar, sunʼiy ipak, yonmaydigan, chirimaydigan, oson boʻyaladigan hamda elektr tokini yaxshi oʻtkazadigan polimerlar olindi. Itakon kislotasi, uning qator hosilalari, ionitlar, polielektrolitlar va shahrik. moddalar akad. M. Asqarov tomonidan oʻrganildi. Polimerlarning stabillashuv jarayonlari chuqur tadqiq qilindi, sopolimerlar sintezining yangi usullari, ionlanuvchi polimerlar va sopolimerlar xususiyatlari tadqiqotlari nihoyasiga yetkazildi. Natijada qator stabilizatorlar, toʻldirgichlar, qotiruvchi moddalar va plyonkalar sanoatga tadbiq etildi. Armirlangan plyonkalardan ipak qurti boqishda foydalanish katta samara berdi.
Paxta va yogʻoch sellyulozasi kimyosi akad. T. Mirkomilov tomonidan rivojlantirildi. Sellyulozani modifikatsiyalab, olingan mahsulotlarning nurga chidamliligini oshirish, oʻtga chidamli qilish, ezilib mijgilanmaydigan boʻlishini taʼminlash, mexaniq jihatdan pishiq, chirimaydigan, kirishmaydigan va shahri k. boshka ijobiy xossalarni oʻzida mujassamlashtirgan mahsulotlar olish ustida tadqiqotlar olib borildi.
Respublikamizda kompozitsion materiallar kimyosi akad. S. Neʼmatov rahbardigida rivojlantirildi. Yangi xossalarga ega boʻlgan qoplama materiallar, sirlar, kremniy organiq suyuqliklar keramik materiallar ishlab chiqarishga tatbiq etildi. Bu materiallardan yoʻl qurilishlarida, avtomobil, qishloq xoʻjaligi mashinalari, turli beton plitalari ishlab chiqarish va boshqa sohalarda keng foydalaniladi.
Silikatlar Kimyosi va texnologiyasi sohasida I. S. Kansepolskiy tomonidan tabiiy kuygan tuproq (gliyej)larni portladsementga qoʻshimcha sifatida qoʻllash, sement korrozitsiyasi va oʻnga qarshi kurash choralarini izlashga doir tadqiqotlar olib borildi. Fosfogipsning kalsiy alyuminatlari bilan reaksiyalari oʻrganildi, mahalliy xom ashyolar asosida sulfoalyuminatbelitli sement olindi, kam energiya sarflab sement olish texnologiyasi ishlab chiqildi (T. A. Otaqoʻziyev). Ishqoriy-yer metallari silikatlari va alyumosilikatlari hamda ularning galliy va germaniyli analoglarining yuqori temperaturalarda oʻzaro birikishi, turli sharoitlarda bir-birida erish qonuniyatlari ilmiy jihatdan asoslab berildi. Sanoat chiqindilari va ikkilamchi xom ashyolardan foydalanib, xalq xoʻjaligi uchun zarur shisha va keramik buyumlar tayyorlash texnologiyalari ishlab chiqildi va amaliyotga tadbiq etildi (N. A. Sirojiddinov, A. P. Erkaxoʻjayeva). S. S. Qosimova va uning shogirdlari tomonidan yangi tarkibli, rangli, boʻgʻiq hamda maxsus optik shishalar olindi va ishlab chiqarishga tavsiya etildi.
Akad. S. Rashidova va uning shogirdlari tomonidan erkin radikallarni yutib, stabillash xususiyatiga ega boʻlgan funksional guruqchalarni oʻz ichiga olgan monomerlarning polimerlanish reaksiyalari oʻrganildi. Chigitning unib chiqishini boshqaradigan ishda qoʻl keladigan polimer qoplamalar kashf qilinib, qishloq xoʻjaligiga tatbiq etildi.
Kimyo texnologiyasining jarayon va uskunalari fani akad. 3. Salimoye va uning shogirdlari tomonidan oʻrganildi. Chigitni quritish, undan yogʻ olishni intensifikatsiyalash, ekstraksiya, gazlar adsorbsiyasi va shahrik. muhim jarayonlarni tadqiq qilishda yangi maʼlumotlar olindi. Bu maʼlumotlar asosida bir qancha korxonalar (Yangiyoʻl, Uchqoʻrgʻon yogʻ z-di) ishlari yaxshilandi.
Respublikamizda Kimyo fanining rivojlanishida Oʻzbekiston FA tarkibida hamda turli vazirliklar tarmoq intlari sifatida faoliyat koʻrsatib kelayotgan i.t. va loyiha in-tlari xizmati ham salmoqlidir. Kimyo in-ti (hozirgi Umumiy va noorganiq kimyo instituti), Oʻsimlik moddalari kimyosi instituti, Polimerlar fizikasi va kimyosi instituti, Kataliz instituti, OʻzMU, ToshTU, Toshkent kimyo-texnologiya instituti, Toshkent toʻqimachilik va yengil sanoat instituti va boshqa oliy oʻquv yurtlari kimyo lab.larida olib borilayotgan i.t. ishlari mamlakatimizda Kimyo fanini yuqori pogʻonalarga koʻtarishda muhim omillardan boʻldi.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.