
AMINO ACIDS
Plan:
1. nomenclature and isomerism of amino acids
2. Physical and chemical properties
3. methods of obtaining. Application.
Amino acids are called organic compounds that in a carboxylic acid molecule cover the place of hydrogen in hydrocarbons coated with amino acids.
Amino acids have a very physiological value, since their residues form proteins and they form enzymes, vitamins, hormones. Amino acids are often referred to by a trivial (by origin) name.
For example: NH2-CH2-COOH-glycine. In addition, for the name of amino acids in the name of the corresponding carboxylic acid adds the word "amino" and names the place of the Amine group with the Greek alphabet. For example:
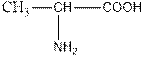 - alanine or α-aminopropionic acid
- alanine or α-aminopropionic acid
Isomerism
The amino acid isomerism depends on the functional group and carbon structure of the skeleton.
|
|
|
|
α-aminopropionic acid (α-alanine) |
β-aminopropionic acid (β-alanine) |
|
|
|
|
|
|
α-aminic acid |
β-aminic acid |
γ-aminic acid |
α – minismise acid
|
Classification of amino acids
Amino acids are divided into three groups according to the structure:
1. acyclic
2. Carbocyclic
3. heterocyclic
Acyclic amino acids are divided into the number of carboxyl-COOH and-NH2 groups:
1. Monoamincarboxylic acids: alanine CH3-CH (NH2) – COOH
2. Monoamindicarboxylic acids:
aspartic acid HOOC-CH2-CH(NH2) - COOH
3. Diaminocarbenes acid: Н2N (CH2)4 CH (NH2) COOH
Physical property
Amino acids-solid substances, increased tva, most of which are slightly soluble in water, do not dissolve in hydrocarbons and ether, do not fly.
Chemical property
Since amino acids are basic amino acids and acidic carboxyl groups, they exhibit amphoteric properties.
1.the reaction of formation of salts.Amino acids interact with both acids and bases to form salts.
|
|
the sodium salt of alanine |
|
alanine hydrochloric acid |
2.amino acids form esters such as acid chlorides.
а)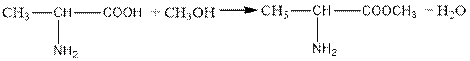
|
б) |
+ РСl5 → CH3 – CH − COCl + POCl3 + HCl | NH2 |
3. amino acids when heating Ba(OH)2 form decarboxylated and Amines.

4. when the amino acid is exposed to nitric acid, oxic acids and nitrogen are formed.
NH2 – СН2- СООН + НNО2 → НО - СН2- СООН + N2 + Н2О
5. amino acids enter the deamination reaction, which removes the amine group. This reaction occurs under the influence of enzymes in organisms.
enzymes

6. in the
composition of amino acids, there are amino acids that have a basic property,
an amine group and a carboxyl group that has acidic properties, whose molecules
interact and form polymers 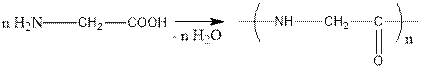
7.properties that are only characteristic of amino acids.
a) effect of amino acid heating: α-amino acids form diketopiperazine (intermolecular cyclic diamide))
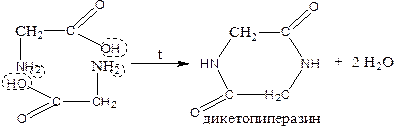
when β-amino acids are heated, ammonia is released and unsaturated acids are formed:
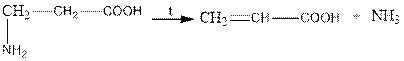
acrylic acid
gamma-amino acids undergo intramuscular dehydration, and cyclic Amines – lactams are formed - :
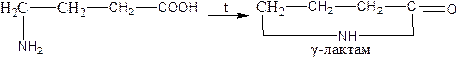
b) amino acids are characterized by the reaction of creating complex compounds with copper (II) ions:
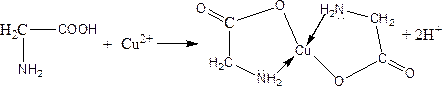
Peptides and peptide bonds. Squirrels
Amino acids are colorless crystalline substances that are highly soluble in water. Single-base amino acids show a neutral environment. When water is extracted from two or more amino acids, the resulting substances are called peptides. In this case, a peptide bond occurs between the amino acids.
peptide bond
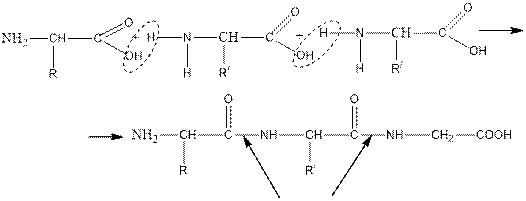
If peptides are formed from two amino acids, a dipeptide is formed from three a Tripeptide that is formed from many amino acids is called a polypeptide. The name of the peptides is called the name of the amino acids present and is added to the name of the first amino acid compound "il". The structure of polypeptides is consistent, any amino acids can be combined with each other in different ways.
Proteins (proteins) are called high-molecular compounds consisting of the remains of about 20 types of α-amino acids, the molecule of which is connected by a peptide bond to each other. Proteins are most important in the body, they are found in the protoplasm and nucleus of plant and animal cells. Where there is no protein, there is no life, this is the main symbol of life.
In nature, there are many types of proteins. Depending on their functions and properties, molecular weights range from several thousand to several million.
Methods of obtaining
I. preparation of α-amino acids
1. the effect of ammonia on Chloraminated acids:
NH3 + CL-CH2COON → HCl +NH2 – CH2COOH
2. to respond to aldehydes with ammonia and cyanic acid (the reaction of Striker)):
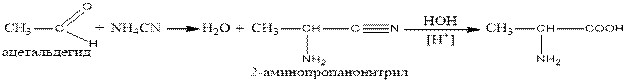
3. as a result of hydrolysis of proteins, 25 different amino acids are obtained.
II. production of β-amino acids
1. Adding ammonia to unsaturated acids and in the presence of a catalyst
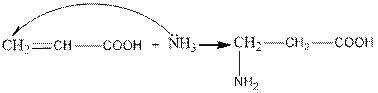
2. extraction from Malonic acid (V. M. Rodionov reaction):
СН3-СНО + СН2(СООН)2 + NH3 → СН3 –СНNH2 – CН2 СOOH +Н2О+СО2
АМИН ҚЫШҚЫЛДАРЫ
Жоспары:
1. Амин қышқылдарының номенклатурасы және изомериясы
2. Физикалық және химиялық қасиеттері
3. Алыну әдістері. Қолданылуы.
Амин қышқылдары деп - карбон қышқылының молекуласындағы көмірсутегідегі сутегінің орнын амин тобы басқан органикалық қосылыстарды айтады.
Амин қышқылдарының физиологиялық маңызы өте зор, өйткені олардың қалдықтарынан ақуыздар құрылады және олардан ферменттер, витаминдер, гормондар түзіледі. Амин қышқылдарын көбінесе тривиалды (шығу тегі бойынша) атаумен айтады.
Мысалы: NH2 – СН2 – СООН - глицин. Сонымен қатар, амин қышқылдарын атау үшін сәйкес карбон қышқылының атына «амино» деген сөз қосып, амин тобының орнын грек алфавитімен көрсетіп атайды.Мысалы:
|
|
- аланин немесе α- аминопропион қышқылы |
Изомериясы
Амин қышқылдарының изомериясы функционалды топ орнына және көміртегі скелеті құрылысына байланысты.
|
|
|
|
α – аминпропион қышқылы (α-аланин) |
β - аминпропион қышқылы (β-аланин) |
|
|
|
|
|
|
α – аминмай қышқылы |
β - аминмай қышқылы |
γ – аминмай қышқылы |
α – аминизомай қышқылы |
Амин қышқылдарының жіктелуі
Амин қышқылдары құрылысы бойынша үш топқа бөлінеді:
1. Ациклді
2. Карбоциклді
3. Гетероциклді
Ациклді амин қышқылдары карбоксил- СООН және - NH2 топтарының санына қарай бөлінеді:
1. Моноаминкарбон қышқылдары: аланин СН3- СН(NH2) – СООН
2. Моноаминдикарбон қышқылдары:
аспарагин қышқылы НООС- СН2- СН(NH2)- СООН
3. Диаминмонокарбон қышқылдары: Н2N (СН2)4 СН(NH2) СООН
Физикалық қасиеттері
Амин қышқылдары- қатты заттар болып келеді, Тбалқу жоғары, олардың көпшілігі суда аздап ериді, көмірсутектер мен эфирде ерімейді, ұшқыш емес.
Химиялық қасиеттері
Амин қышқылдарының құрамында негіздік амин және қышқылды карбоксил топтары болғандықтан, олар амфотерлік қасиет көрсетеді.
1.Тұздар түзу реакциялары.Амин қышқылдары қышқылдармен де, негіздермен де әрекеттесіп, тұздар түзіледі.
|
|
аланиннің натрий тұзы |
|
тұз қышқылды аланин |
2. Амин қышқылдары қышқылдар сияқты күрделі эфирлер, хлорангидридтер түзеді.
а)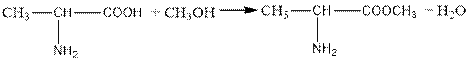
|
б) |
+ РСl5 → CH3 – CH − COCl + POCl3 + HCl | NH2 |
1. Амин қышқылдары Ва(ОН)2 -мен қосып қыздырғанда декарбоксилденіп, аминдер түзеді.

4. Амин қышқылына азотты қышқылмен әсер етсе, оксиқышқыл және азот түзіледі.
NH2 – СН2- СООН + НNО2 → НО - СН2- СООН + N2 + Н2О
5. Амин қышқылдары дезаминдеу реакциясына түседі, нәтижесінде амин тобы жойылады. Бұл реакция организмдерде ферменттердің әсерінен жүреді.
ферменттер

6. Амин қышқылдарының құрамында негіздік қасиет беретін амин тобы және қышқылдық қасиет беретін карбоксил тобы болғандықтан олардың молекулалары өзара әрекеттесіп, полимерлер түзіледі.
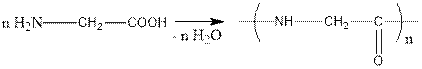
7. Амин қышқылдарына ғана тән қасиеттері.
а) Амин қышқылдарына қыздырудың әсері: α-амин қышқылдары дикетопиперазин түзеді (молекулааралық циклді диамид)
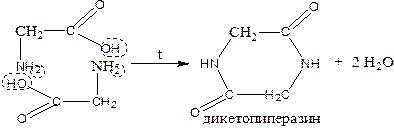
β-амин қышқылдарын қыздырғанда аммиак бөлінеді және қанықпаған қышқылдар түзіледі:
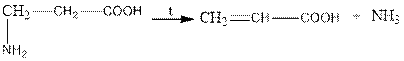
акрил қышқылы
γ-амин қышқылдары молекула ішіндегі дегидратацияға ұшырап, циклді аминдер – лактамдар - түзіледі:
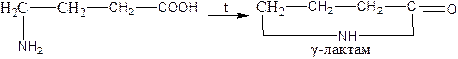
б) амин қышқылдарына мыс (ІІ) иондарымен комплекс қосылыстар түзу реакциясы тән:
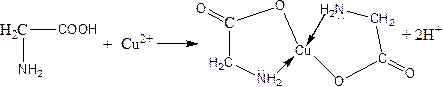
Пептидтер және пептидтік байланыстар. Ақуыздар
Амин қышқылдары-түссіз кристалды заттар, суда жақсы ериді. Бір негізді аминқышқылдары бейтарап орта көрсетеді. Екі немесе бірнеше амин қышқылдарынан су бөлінгенде, түзілетін заттарды пептидтер деп атайды. Бұл жағдайда амин қышқылдарының арасында пептидтік байланыс пайда болады.
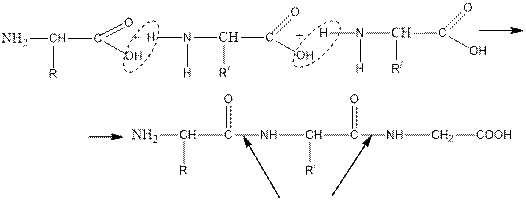
пептидтік байланыс
Егер пептидтер екі амин қышқылынан түзілсе дипептид, үшеуден түзілсе трипептид, ол көп амин қышқылдарынан түзілсе - полипептид деп аталады. Пептидтердің аталуы қатысқан амин қышқылдарының атымен аталады және бірінші амин қышқылының атына «ил» жалғауы қосылады. Полипептидтердің құрылысы тізбекті болады, кез келген амин қышқылдары бір - бірімен әр түрлі қосыла алады.
Ақуыздар (белоктар) деп молекуласы бір - бірінен пептидтік байланыспен қосылған α-амин қышқылдарының 20-ға жуық түрінің қалдықтарынан құралған жоғары молекулалы қосылыстарды атайды. Ақуыздар организм құрамының ең маңыздысы, олар өсімдіктер мен жануарлардың клеткаларының протоплазмасында және ядросында болады. Ақуыз жоқ жерде тіршілік жоқ, ол- тіршіліктің негізгі нышаны.
Табиғатта ақуыздардың көптеген түрлері кездеседі. Олардың атқаратын функцияларына және қасиеттеріне байланысты молекулалық массалары бірнеше мыңнан бірнеше миллионға дейін барады.
Алыну жолдары
I. α – амин қышқылдарын алу
1. Хлоралмасқан қышқылдарға аммиакпен әсер етіп:
NH3 + Сl – СН2СООН → НСl +NH2 – СН2СООН
2. Альдегидтерге аммиак пен циан қышқылымен әрекет етіп (Штрекер реакциясы):
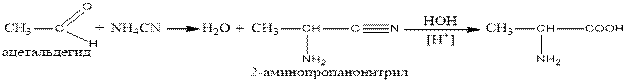
3. Ақуыздардың гидролизі нәтижесінде 25 әр түрлі аминқышқылдары алынады.
II. β – аминқышқылдарын алу
1. Қанықпаған қышқылдарға аммиак қосып, катализатор қатысында
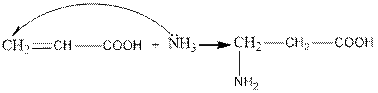
2. Малон қышқылынан алу (В.М. Родионов реакциясы):
СН3-СНО + СН2(СООН)2 + NH3 → СН3 –СНNH2 – CН2 СOOH +Н2О+СО2
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.