
|
Дата |
|
|
Завуч по УР |
|
Класс |
10а |
____________Р.С-С.Алиханова |
УРОК № 4
БЕЛКИ: СТРОЕНИЕ МОЛЕКУЛЫ, БИОЛОГИЧЕСКИЕ ФУНКЦИИ
Задачи урока:
- сформировать знания об особенностях строения молекул белков;
- углубить и расширить знания о важнейшей роли белков в жизнедеятельности живых организмов
- связать знания учащихся о белках с жизнью
- сформировать понятие о ферментах как биологических катализаторах.
Тип урока: комбинированный.
Методы, используемые на уроке: репродуктивные, частично - поисковые, проблемные.
Эпиграф на доске: «Жизнь есть способ существования белковых тел…» Ф. Энгельс.
ХОД УРОКА
1. Организационный момент.
2. Актуализация опорных знаний. Проверка домашнего задания.
Устные развернутые вопросы по теме домашнего задания:
1. Какие соединения называют углеводами?
2. Какова классификация углеводов? Назовите представителей каждой группы.
3. В составе, каких организмов (животных или растений) больше углеводов?
4. С каким процессом, протекающим в растительных организмах, связано большое содержание в них углеводов по сравнению с животными?
5. Какие углеводы служат энергетическим резервом у растений, какие у животных?
6. Назовите основные функции углеводов.
7. Функции липидов. Какие клетки и ткани наиболее богаты липидами?
3. Изучение нового материала.
Эпиграфом нашего урока является высказывание Ф. Энгельса: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природы, причем с прекращением обмена веществ, прекращается и жизнь, что приводит к разложению белка». Белков в клетках больше, чем каких бы то ни было других органических соединений: на их долю приходится свыше 50% общей сухой массы клеток
Аминокислоты, их строение и свойства
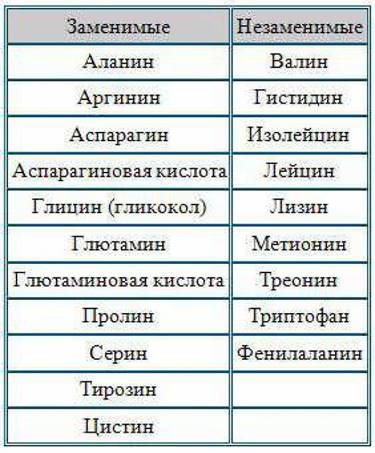
В клетках и тканях встречается свыше 170 различных аминокислот. В составе белков обнаруживаются лишь 26 из них; обычными же компонентами белка можно считать лишь 20 аминокислот. Они получили название «Волшебных».
В отличие от растений животные не могут синтезировать все аминокислоты, в которых они нуждаются; часть из них они должны получать в готовом виде, то есть с пищей. Эти последние принято называть незаменимыми аминокислотами.
Тот факт, что белки организмов построены из одних и тех же аминокислот – еще одно доказательство единства живого мира на земле. 20 разных аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены слова длиной в 300-500 букв. С помощью 20 букв можно написать безграничное множество таких длинных слов. Если считать, что замена или перестановка одной буквы в слове придаст ему смысл, то число комбинаций в слове длинной в 500 букв составит 20500 .
В каждой клетке содержится несколько тысяч разных видов белковых молекул и для каждой из них характерна строго определенная последовательность аминокислот. Именно порядок чередования аминокислот в данной белковой молекуле определяет ее особые физико-химические и биологические свойства. Для установления структуры белка прежде всего нужно знать какие из 20 аминокислот входят в его состав. Оказалось, что такие белки, как казеин молока, миозин мышц, альбумин яйца содержат набор всех 20 АК. В белке – ферменте инсулин – 18, в сальмине (белок из молок рыб) всего 7. в состав большинства белков входит 300-500 аминокислотных остатков, но есть и более крупные – 1500 и более АК.
Аминокислоты имеют биологические названия (таблица) и краткое обозначение) В настоящее время установлена последовательность АК в 500 белках. Первым на этом пути был английский ученый Фредерик Сенгер, который в 1955 году расшифровал строение белка инсулина, за что получил Нобелевскую премию и помог людям в борьбе с такой болезнью как сахарный диабет.
Учитель. Вопрос: А что вам известно об инсулине из материала «Анатомии человека»?
«Инсулин вырабатывается поджелудочной железой. Являясь гормоном, участвует в превращении избытка глюкозы в крови, в животный крахмал – гликоген. Тем самым, поддерживается гомеостаз - постоянство внутренней среды.»
Учитель. Вопрос: . А как же происходит присоединение АК при образовании белковой молекулы с химической точки зрения?
У большей части аминокислот имеются одна кислотная группа (карбоксильная) и одна основная (аминогруппа); эти аминокислоты называют нейтральными. Существуют и основные аминокислоты – с более чем одной аминогруппой, а также кислые аминокислоты – с более чем одной карбоксильной группой. Остальная часть молекулы представлена R-группой. Ее строение у разных аминокислот сильно варьирует, и именно она определяет уникальные свойства каждой отдельной аминокислоты.
В нейтральных водных растворах аминокислоты ведут себя как амфотерные соединения, то есть проявляются свойства и кислот, и оснований. Амфотерная природа аминокислот существенна в биологическом отношении, так как она означает, что аминокислоты способны в растворах действовать как буферы – препятствовать изменениям рН.
Благодаря взаимодействию аминогруппы одной аминокислоты с карбоксильной группой другой образуется пептидная связь. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот - углеродная связь – пептидной связью. Соединение, образующееся в результате конденсации двух аминокислот, представляет собой дипептид. На одном конце его молекулы находится свободная аминогруппа, а на другом – свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты. Если таким образом соединяется много аминокислот, то образуется полипептид. Белки это полипептиды, состоящие из сотен и тысяч аминокислот.

Аминокислота является мономером молекулы белка.
Строение белков
Белки – это сложные органические соединения, состоящие из углерода, водорода, кислорода и азота. В некоторых белках содержится еще и сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Поэтому белки можно классифицировать на:
— протеины – состоят только из белков
— протеиды – белок + небелковая часть:
а. гликопротеиды – аминокислоты + углеводы
б. липопротеиды – аминокислоты + жиры
в. нуклеопротеиды – аминокислоты + нуклеиновая кислота
г. металлопротеиды – аминокислоты + металлы (гемоглобин)
Молекулы белков – цепи, построенные из аминокислот, - очень велики; это макромолекулы, молекулярная масса которых колеблется от нескольких тысяч до нескольких миллионов. В природных белках встречаются двадцать различных аминокислот. Потенциально разнообразие белков безгранично, поскольку каждому белку свойственна своя особая аминокислотная последовательность, генетически контролируемая, то есть закодированная в ДНК клетки, вырабатывающей данный белок. Белков в клетках больше, чем каких бы то ни было других органических соединений: на их долю приходится свыше 50% общей сухой массы клеток. Они – важный компонент пищи животных и могут превращаться в животном организме как в жир, так и в углеводы. Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций, как структурных, так и метаболических.
Простые пептиды, состоящие из двух, трех или четырех аминокислотных остатков, называются соответственно ди-, три- или тетрапептидами. Полипептидами называют цепи, образованные большим числом аминокислотных остатков (до нескольких тысяч). Белковая молекула может состоять из одной или из нескольких полипептидных цепей.
Структура белков
Для более полной характеристики строения молекулы белка необходимо знать его структуры. Каждому белку свойственна своя особая геометрическая форма, или конформация. Выделяют 4 структуры белка: первичную, вторичную, третичную, четвертичную
Первичная структура
Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом пептидными связями в полипептидной цепи. Первый белок, для которого удалось выяснить аминокислотную последовательность, как мы уже говорили – это инсулин, аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность однозначно определяется нуклеотидной последовательностью ДНК. Замена одной-единственной аминокислоты в молекулах данного белка может резко изменить его функцию, как это наблюдается, например, при так называемой серповидноклеточной анемии.
Вторичная структура.
Для всякого белка характерна помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину. Это так называемая α-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка. Таким образом , вторичная структура представляет собой вид спирали, которая образуется в результате
Третичная структура
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается связями трех типов – ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями.
Четвертичная структура
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, удерживаемых в молекуле вместе за счет гидрофобных взаимодействий, а также при помощи водородных и ионных связей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка. Четвертичная структура имеется, например, у гемоглобина. Его молекула состоит из четырех отдельных полипептидных цепей.
Таким образом, белки имеют весьма сложное строение и характеризуются полифункциональностью, что отражается на их свойствах.
Свойства белка.
Постановка проблемного вопроса.
1. Почему врачи рекомендуют «сбивать» температуру больного, если она превышает 380С?
2. Почему из вареного яйца никогда не появится цыпленок?
· Природные белковые вещества очень разнообразны: некоторые белки – твердые вещества, нерастворимые в воде и солевых растворах; большинство белков жидкие, растворимые в воде
( например, альбумин – белок куриного яйца). Белки, растворяясь в воде, образуют коллоидные растворы. Добавление к раствору белка солей тяжелых металлов (ртути, свинца, меди) приводит к осаждении белка, не растворяющегося в воде. Поэтому для организма крайне вредны пары тяжелых металлов и их солей. Осаждение белка происходит так же кислотами (азотной, серной и др.), формалином и фенолом, а так же этиловым спиртом. При слабом нагревании белки тоже свертываются. Процессы осаждения и свертывания белков связаны с разрушением их вторичной, третичной структуры и четвертичной структуры, так как происходит разрыв связей, и белок при этом изменяет свое природное состояние. Эти процессы называют денатурацией белка.
Если под действием денатурирующего фактора не затрагивается первичная структура, то при возвращении белковых молекул в нормальные условия среды их структура полностью восстанавливается, т.е. происходит ренатурация. Способность белков к ренатурации лежит в основе раздражимости. При необратимой денатурации (разрушение первичной структуры) белки теряют свои свойства.
Учитель. Вопрос: А где можно использовать знания о свойствах денатурации белка?
1.Химическая завивка.
Белок волос состоит из полипептидных цепей, между которыми имеются дисульфидные мостики. Если волосы обработать каким либо восстановителем, то сульфидные мостики разрушаются. Волосы становятся мягкими, могут завиваться и их можно растянуть более чем в два раза. После завивки волосы обрабатывают окислителем. Дисульфидные мостики возникают вновь, закрепляя новую форму волос.
2.Обесцвечивание волос.
для обесцвечивания берут разбавленную перекись водорода, которая окисляет молекулы пигмента волос. Побочный эффект обесцвечивания заключается в образовании дополнительных дисульфидных мостиков. А это повышает хрупкость и ломкость волос.
3. Шерсть (белок кератин).
Если шерстяное изделие поместить в горячую воду, происходит разрыв дисульфидных связей, начинается свертывание полипептидных цепей в клубок. Говорят шерстяное изделие «садится».
4. Гемоглобин разрушается при температуре 400.
5. Свертывание крови.
Растворимый белок фибриноген превращается в нерастворимый белок фибрин.
6.Ренгеновские лучи, облучение, радиация, фенол в воде…
Вызывают различные заболевания: лейкопения, раковую опухоль и др.
· Белки способны гидролизоваться. Гидролиз происходит по месту пептидных связей при нагревании белка с раствором кислоты или щелочи. При гидролизе белков получаются различные аминокислоты, а при гидролизе полисахаридов образуется один продукт – глюкоза.
· Белкам свойственны некоторые цветные реакции, используемые для распознавания
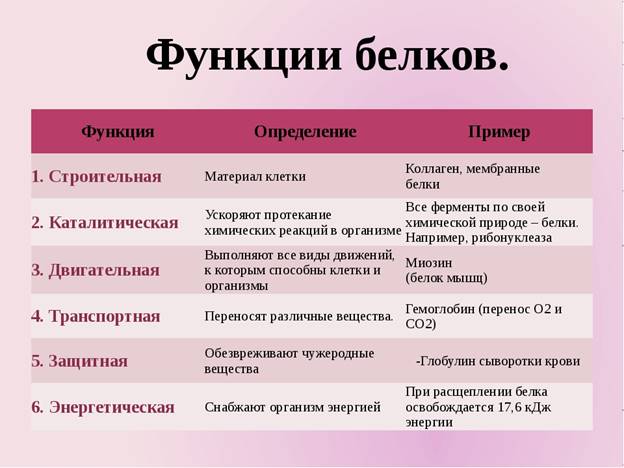
Каталитическая функция – одна из наиболее важнейших функций белков. Все биохимические реакции протекают с огромной скоростью благодаря участию в них биокатализаторов – ферментов.
Определение: ферменты – это белки, обладающие каталитической активностью, то есть ускоряющие протекание реакций.
Каждый фермент обеспечивает одну реакцию или несколько реакций одного типа. Например, жиры в пищеварительном тракте ( а также внутри клеток) расщепляются специальным ферментом, который не действует на полисахариды (крахмал, гликоген) или на белки. Каждая молекула фермента способна осуществлять от нескольких тысяч до нескольких миллионов одинаковых операций в минуту. В ходе этих реакций ферментный белок не расходуется. Он соединяется с реагирующими веществами, ускоряет их превращения и выходит из реакций неизмененным.
Процесс превращения или синтеза любого вещества в клетке, как правило, разделен на ряд химических операций. Каждую операцию выполняет отдельный фермент. Группа таких ферментов составляет своего рода биохимический конвейер.
5. Закрепление изученного материала
Почему белок относится к биополимерам?
Что является мономером белковой молекулы?
Как происходит образование пептидной связи
Какие структуры белка вам известны.
Какова роль белков ферментов в организме?
Что представляет собой денатурация белка?
Какие структуры белка сохраняются, а какие нарушаются при денатурации?
Охарактеризуйте функции белка.
6. Подведение итогов
Составить синквейн по теме.
Слово синквейн происходит от французского " пять". Это стихотворение из пяти строк, которое строится по правилам.
В первой строке тема называется одним словом (обычно существительным).
Вторая строка-это описание темы в двух словах (двумя прилагательными).
Третья строка-это описание действия в рамках этой темы тремя словами.
Четвертая строка-это фраза, показывающая отношение к теме.
Последняя строка-это синоним из одного слова, который повторяет суть темы.
 |
7. Домашнее задание: §,4 ответить на вопросы после параграфа
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.