
Муниципальное автономное образовательное учреждение «Бриентская средняя общеобразовательная школа»
Кваркенского района Оренбургской области

Дополнительная общеобразовательная общеразвивающая программа естественно- научной направленности
![]()
![]()
![]() «Мир химии»
«Мир химии»
Возраст учащихся 13-17 лет Автор -составитель
Срок реализации программы -1 год программы: Митрофанова Т.В., учитель химии
2023год
Паспорт программы
|
Полное название программы |
Дополнительная общеобразовательная общеразвивающая программа «Мир химии» |
|
Направленность программы |
Естественнонаучная |
|
Уровень программы |
Общекультурный |
|
Учреждение, реализующее программу |
Муниципальное автономное общеобразовательное учреждение «Бриентская средняя общеобразовательная школа» Кваркенского района Оренбургской области |
|
Разработчик |
Митрофанова Татьяна Владимировна |
|
Возраст учащихся |
Обучающиеся в возрасте 13-17 лет |
|
Сроки реализации (обучения) |
1 год |
|
С какого года реализуется программа, когда были утверждены новые редакции программы |
С 2023 года |
|
Использование технологий дистанционного и электронного обучения |
Нет |
|
Наличие внешних рецензий (для авторской программы) |
Нет |
Содержание.
|
РАЗДЕЛ № 1 |
КОМПЛЕКС ОСНОВНЫХ ХАРАКТЕРИСТИК ДОПОЛНИТЕЛЬНОЙ ОБЩЕОБРАЗОВАТЕЛЬНОЙ ОБЩЕРАЗВИВАЮЩЕЙ ПРОГРАММЫ |
3 |
|
|
|
1.1. |
Пояснительная записка |
3 |
|
|
1.1.1 |
Направленность дополнительной общеобразовательной общеразвивающей программы. |
3 |
|
|
1.1.2 |
Новизна, актуальность, педагогическая целесообразность программы. |
3 |
|
|
1.1.3 |
Отличительные особенности дополнительной общеобразовательной общеразвивающей программы. |
3 |
|
|
1.1.4 |
Возраст детей, участвующих в реализации данной программы. |
4 |
|
|
1.1.5 |
Сроки реализации дополнительной общеобразовательной общеразвивающей программы. |
4 |
|
|
1.1.6 |
Формы обучения. |
4 |
|
|
1.1.7 |
Режим занятий. |
4 |
|
|
1.2. |
Цель и задачи программы |
5 |
|
|
1.3. |
Содержание программы |
6 |
|
|
1.3.1 |
УЧЕБНО-ТЕМАТИЧЕСКИЙ ПЛАН |
9 |
|
|
1.3.2 |
СОДЕРЖАНИЕ УЧЕБНОГО ПЛАНА |
7 |
|
|
1.4. |
Планируемые результаты |
8 |
|
РАЗДЕЛ № 2 |
КОМПЛЕКС ОРГАНИЗАЦИОННО –ПЕДАГОГИЧЕСКИХ УСЛОВИЙ |
9 |
|
|
|
2.1. |
Календарный учебный график |
9 |
|
|
2.2. |
Условия реализации общеобразовательной общеразвивающей программы |
12 |
|
|
2.3. |
Формы аттестации |
12 |
|
|
2.4. |
Оценочные материалы |
14 |
|
|
2.5. |
Методические материалы |
15 |
|
|
2.6. |
Список литературы |
15 |
1. КОМПЛЕКС ОСНОВНЫХ ХАРАКТЕРИСТИК ДОПОЛНИТЕЛЬНОЙ
1.1. ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Знания, получаемые в школе по химии, мы не очень часто используем в повседневной жизни, конечно, если мы не связали свою жизнь с химией в профессиональном плане. Тем не менее, этот предмет может стать источником знаний о процессах в окружающем мире, так как только при изучении химии мы знакомимся с составом веществ на нашей Земле. Благодаря этому мы узнаем, каким образом эти вещества влияют на процессы жизнедеятельности организма, да и в целом на саму жизнь человека, что полезно нам и в каких количествах и, наконец, что вредно и до какой степени.
1.1.1. Направленность дополнительной общеобразовательной общеразвивающей программы. Предлагаемая программа имеет естественнонаучную направленность, которая является важным направлением в развитии и формировании у школьников первоначального целостного представления о мире на основе сообщения им некоторых химических знаний”.
Программа в школе имеет особое значение. Именно в начале обучения складывается отношение к новому предмету.
Актуальность. Изучение химии поможет обучающимся ответить на многие вопросы, имеющие отношение к жизни, к окружающим людям. По мере знакомства с основными химическими понятиями и принципами школьники постепенно начинают применять их в реальной жизни и понимать, что химия – это способ мышления, которому можно научиться. Педагогическая целесообразность. Педагогическая целесообразность Программы выражается во взаимосвязи процессов обучения, развития и воспитания. Формирование нового химического мышления у обучающихся имеет огромное значение для будущего России, ее процветания и участия в мировом хозяйстве. Полученные знания помогут ребятам преуспеть в жизни и внести вклад в науку ХХI века.
Новизна. Дополнительная общеобразовательная программа «Мир химии» составлена с учетом требований, предъявляемых к программам дополнительного образования, на основе последних достижений и исследований детского творчества, педагогической практики. Автор в создании программы использует современные методики и новации, опираясь на свой личный практический опыт работы в области химического образования и воспитания. Дополнительная программа призвана познакомить учащихся с химией в быту, правилами пользования лабораторным оборудованием, «домашней лабораторией».
Отличительными особенностями Программы является то, что программа включает в себя игры на развитие: повышение уровня интеллекта (умения последовательно, логично рассуждать); хорошей памяти; внимательности; усидчивости (контроль над своими чувствами, дисциплина и саморегуляция). Все эти качества важны не только будущему химику, но и любому школьнику. Программа преподносится в интересной для детей форме – настольных игр, деловых игр, упражнений, кроссвордов, тестов и т.д. Отличие программы от других в этой направленности в том, что в ее основу положена идея социализации учащихся, подготовки их к освоению социальных ролей.
1.1.4. Возраст детей, участвующих в реализации данной программы Программа разработана для обучающихся 13-17 лет. Наполняемость в группах составляет: 10-15 чел.- 1 группа
1.1.5. Сроки реализации программы.
Программа рассчитана на 1 год обучения, 34 часа.
Занятия проводятся 1 раз в неделю по 40 минут.
Для реализации программы используется очная, смешанная формы обучения.
При реализации программы частично применяется электронное обучение и дистанционные образовательные технологии.
Формы организации образовательного процесса: групповые, индивидуальные и занятия в микрогруппах.
Групповая форма работы включает беседы, опросы, обсуждение проектов, анализ практической работы.
Индивидуальная форма работы реализуется посредством включения учащихся в практическую деятельность по выполнению изделия, разработку и защиту творческого проекта.
При смешанной форме обучения применяются индивидуальные или групповые онлайн-занятия, онлайн-консультации; используются образовательные онлайн-платформы, цифровые образовательные ресурсы, социальные сети, электронная почта.
Обучение по дополнительной общеобразовательной общеразвивающей программе «Мир химии» ведётся на русском языке.
Занятия проводятся 1 раз в неделю по одному академическому часу.
занятия включает в себя по 40 минут учебного времени и обязательный в конце каждого часа 10- 15 минутный перерыв для отдыха и проветривания аудитории.
1.2. Цель программы:
Формирование у учащихся глубокого и устойчивого интереса к миру веществ и химических превращений, приобретение необходимых практических умений и навыков по лабораторной технике. Достижение этой цели обеспечено посредством решения следующих задач:
1. Дать ученику возможность реализовать свой интерес к предмету,
2. Уточнить готовность и способность ученика осваивать выбранный предмет на повышенном уровне,
3. Создать условия для подготовки ученика к экзаменам по выбору,
4. Создать базу для ориентации ученика в мире современных профессий,
5. Дать возможность ученику проявить творческую и интеллектуальную инициативу.
Задачи:
- формирование навыков и умений научно-исследовательской деятельности; - формирование у учащихся навыков безопасного и грамотного обращения с веществами;
- формирование практических умений и навыков разработки и выполнения химического эксперимента; - продолжить развитие познавательной активности, самостоятельности, настойчивости в достижении цели, креативных способностей учащихся;
- продолжить формирование коммуникативных умений;
- формирование презентационных умений и навыков;
1.3. Содержание программы первого года обучения.
1. Вводное занятие. Знакомство с учащимися, анкетирование: (что привело тебя в кружок “МИР химии”). Выборы совета, девиза, эмблемы кружка, знакомства кружковцев с их обязанностями и оборудованием рабочего места, обсуждение и корректировка плана работы кружка, предложенного учителем.
2. Ознакомление с кабинетом химии и изучение правил техники безопасности. Правила безопасной работы в кабинете химии, изучение правил техники безопасности и оказания первой помощи, использование противопожарных средств защиты. Игра по технике безопасности.
3. Знакомство с лабораторным оборудованием. Ознакомление учащихся с классификацией и требованиями, предъявляемыми к хранению лабораторного оборудования, изучение технических средств обучения, предметов лабораторного оборудования. Техника демонстрации опытов (на примерах одного - двух занимательных опытов)
Практическая работа №1. Ознакомление с техникой выполнения общих практических операций наливание жидкостей, перемешивание и растворение твердых веществ в воде.
4. Хранение материалов и реактивов в химической лаборатории. Знакомство с различными видами классификаций химических реактивов и правилами хранения их в лаборатории
Практическая работа №2. Составление таблиц, отражающих классификацию веществ , изготовление этикеток неорганических веществ, составление списка реактивов, несовместимых для хранения.
5. Нагревательные приборы и пользование ими. Знакомство с правилами пользования нагревательных приборов: плитки, спиртовки, газовой горелки, водяной бани, сушильного шкафа. Нагревание и прокаливание.
Практическая работа. Использование нагревательных приборов. Изготовление спиртовки из подручного материала.
6. Взвешивание, фильтрование и перегонка. Ознакомление учащихся с приемами взвешивания и
фильтрования, изучение процессов перегонки. Очистка веществ от примесей Практическая работа.
1. Изготовление простейших фильтров из подручных средств. Разделение неоднородных смесей.
2. Перегонка воды.
7. Выпаривание и кристаллизация
Практическая работа. Выделение растворённых веществ методом выпаривания и кристаллизации на примере раствора поваренной соли .
8. Основные приемы работы с твердыми, жидкими, газообразными веществами. Лабораторные способы получения неорганических веществ.
Демонстрация фильма.
Практическая работа. Опыты. иллюстрирующие основные приёмы работы с твердыми, жидкими и газообразными веществами.
Практическая работа. Получение неорганических веществ в химической лаборатории Получение сульфата меди из меди, хлорида цинка из цинка.
Наглядные пособия, схемы, таблицы, плакаты.
9. Приготовление растворов в химической лаборатории и в быту. Ознакомление учащихся с процессом растворения веществ. Насыщенные и пересыщенные растворы. Приготовление растворов и использование их в жизни.
Практическая работа. Приготовление растворов веществ с определённой концентрацией растворённого вещества. Получение насыщенных и пересыщенных растворов, составление и использование графиков растворимости.
10. Кристаллогидраты. Кристаллическое состояние. Свойства кристаллов, строение и рост кристаллов. Практическая работа. Получение кристаллов солей из водных растворов методом медленного испарения и постепенного понижения температуры раствора (хлорид натрия, медный купорос, алюмокалиевые квасцы)
Домашние опыты выращиванию кристаллов хлорида натрия, сахара.
11. Химия и медицина. Формирование информационной культуры учащихся. Составление и чтение докладов и рефератов.
Устный журнал на тему «Химия и медицина»
12. Занимательные опыты по теме: Химические реакции вокруг нас. Показ демонстрационных опытов.
· “Вулкан” на столе, [5] · “Зелёный огонь”,[5]
· “Вода-катализатор”, [5]
· «Звездный дождь» [4]
· Разноцветное пламя [4]
· Вода зажигает бумагу [4]
13. Подготовка к декаде естественных наук Игра «Счастливый случай».
Подготовка учащихся к проведению декады естественных наук. Изготовление плакатов с пословицами, поговорками, афоризмами, выпуск стенгазет с занимательными фактами.
Игра. «Счастливый случай»
14. Проведение игр и конкурсов среди учащихся
Составление кроссвордов, ребусов, проведение игр: · “Химическая эстафета” · “Третий лишний”.
15. Химия в природе. Сообщения учащимися о природных явлениях, сопровождающимися химическими процессами. Проведение занимательных опытов по теме «Химия в природе».
Демонстрация опытов: · Химические водоросли · Тёмно-серая змея.
· Оригинальное яйцо
· Минеральный «хамелеон»
16. Химия и человек. Чтение докладов и рефератов.
-Ваше питание и здоровье
-Химические реакции внутри нас
17. Проведение дидактических игр
Проведение конкурсов и дидактических игр:
· кто внимательнее
· кто быстрее и лучше
· узнай вещество
· узнай явление
19. Химия в быту. Ознакомление учащихся с видами бытовых химикатов. Разновидности моющих средств. Использование химических материалов для ремонта квартир.
Практическая работа. Выведение пятен ржавчины, чернил, жира.
Наглядные средства: плакаты, таблицы, образцы моющих средств.
20. Общий смотр знаний. Игра “Что? Где? Когда?”
Подведение итогов и анализ работы кружка за год. Отчет членов кружка, демонстрация изготовленных членами кружка наглядных пособий, простейших приборов, конкурсных газет, выращенных кристаллов, рефератов и т.д. Проведение заключительной игры.
Игра. «Что? Где? Когда?»
1.3. 1.Учебно-тематический план.
|
Тема |
Всего часов |
В том числе |
Форма занятий |
|
|
лекции и семинары |
практ ика |
|||
|
Вводное занятие. Знакомство с ТБ. |
1 |
1 |
|
Лекция
|
|
Ознакомление с кабинетом химии. |
1 |
1 |
|
Игра по технике безопасности |
|
Знакомство с лабораторным оборудованием. |
2 |
1 |
1 |
Ознакомление учащихся с классификацией и требованиями, предъявляемыми к хранению лабораторного оборудования |
|
Хранение материалов и реактивов в химической лаборатории. |
1 |
0 |
1 |
Практическая работа. Составление таблиц, отражающих классификацию веществ, изготовление этикеток неорганических веществ, составление списка реактивов, несовместимых для хранения. |
|
Нагревательные приборы и пользование ими. |
1 |
0 |
1 |
Практическая работа. Использование нагревательных приборов. Изготовление спиртовки из подручного материала. |
|
Взвешивание, фильтрование и перегонка. |
1 |
0 |
1 |
Практическая работа. Изготовление простейших фильтров из подручных средств. Разделение неоднородных смесей |
|
Выпаривание и кристаллизация
|
1 |
0 |
1 |
Практическая работа. Выделение растворённых веществ методом выпаривания и кристаллизации на примере раствора поваренной соли |
|
Основные приемы работы с твердыми, жидкими, газообразными веществами. Лабораторные способы получения неорганических веществ |
2 |
1 |
1 |
Лекция. Практическая работа. Опыты. иллюстрирующие основные приёмы работы с твердыми, жидкими и газообразными веществами. Практическая работа. Получение неорганических веществ в химической лаборатории Получение сульфата меди из меди, хлорида цинка из цинка.
|
|
Приготовление растворов в химической лаборатории и в быту. |
1 |
0 |
1 |
Практическая работа. Приготовление растворов веществ с определённой концентрацией растворённого вещества. |
|
Кристаллогидраты. |
2 |
1 |
1 |
Практическая работа. Получение кристаллов солей из водных растворов |
|
Химия и медицина. |
1 |
1 |
|
Лекция, сообщения учащихся |
|
Занимательные опыты по теме: «Химические реакции вокруг нас». |
1 |
0 |
1 |
Показ демонстрационных опытов |
|
Итоговое занятие Промежуточная аттестация |
1 |
|
1 |
Промежуточная аттестация “Химическая эстафета” “Третий лишний» |
|
Подготовка к декаде естественных наук. Игра «Счастливый случай». |
2 |
0 |
2 |
Изготовление плакатов с пословицами, поговорками, афоризмами, выпуск стенгазет с занимательными фактами Игра. «Счастливый случай» |
|
Проведение игр и конкурсов среди учащихся 8-9 классов членами кружка. |
2 |
0 |
2 |
Составление кроссвордов, ребусов, проведение игр: “Химическая эстафета” “Третий лишний”. |
|
Химия в природе. |
2 |
1 |
1 |
Сообщения учащимися о природных явлениях, сопровождающимися химическими процессами. Проведение занимательных опытов по теме «Химия в природе». |
|
Химия и человек. Чтение докладов и рефератов. |
2 |
2 |
0 |
Круглый стол, сообщения учащихся |
|
Проведение дидактических игр: • кто внимательнее • кто быстрее и лучше • узнай вещество |
4 |
2 |
2 |
Игры с учащимися кружка |
|
• узнай явление |
|
|
|
|
|
Химия в быту. |
3 |
1 |
2 |
Ознакомление учащихся с видами бытовых химикатов. Разновидности моющих средств. Использование химических материалов для ремонта квартир. Практическая работа. Выведение пятен ржавчины, чернил, жира |
|
Общий смотр знаний. Игра “Что? Где? Когда?” |
2 |
0 |
2 |
Подведение итогов и анализ работы кружка за год. Отчет о проведенной работе. |
|
Итоговое занятие |
1 |
1 |
0 |
Итоговая аттестация |
|
Всего |
34 |
12 |
22 |
|
1.4. Планируемые результаты
Личностные результаты:
• правила безопасности работы в лаборатории и обращения с веществами;
• правила сборки и работы лабораторных приборов;
• определение массы и объема веществ;
• правила экономного расхода горючего и реактивов;
• порядок организации своего рабочего места;
Метапредметные результаты:
- навыки контроля и самооценки процесса и результата деятельности;
- умение ставить и формулировать проблемы;
- навыки осознанного и произвольного построения сообщения в устной форме, в том числе творческого характера;
- установление причинно-следственных связей.
Предметные результаты:
• осуществлять с соблюдением техники безопасности демонстрационный и лабораторный эксперимент; • осуществлять кристаллизацию, высушивание, выпаривание, определять плотность исследуемых веществ;
• иметь необходимые умения и навыки в мытье и сушке химической посуды;
• получать растворы с заданной массовой долей и молярной концентрацией, работать с растворами различных веществ;
• находить проблему и варианты ее решения;
• определять цель, выделять объект исследования, овладеть способами регистрации полученной информации, ее обработки и оформления;
• организовать свой учебный труд, пользоваться справочной и научно- популярной литературой;
• писать рефераты, придерживаясь определенных требований;
• работать в сотрудничестве с членами группы, находить и исправлять ошибки в работе других участников группы;
• вести дискуссию, отстаивать свою точку зрения, найти компромисс;
• уверенно держать себя во время выступления, использовать различные средства наглядности при выступлении.
РАЗДЕЛ № 2. КОМПЛЕКС ОРГАНИЗАЦИОННО –ПЕДАГОГИЧЕСКИХ УСЛОВИЙ
|
№ п/п
|
Месяц |
Число |
Врем я прове дения занят ия |
Форма занятия |
Кол-во часов |
Тема занятия
|
Место проведен ия
|
Форма контроля |
|
1 |
сентябр ь |
|
15.30- 16.15 |
Вводное занятие. Знакомст во с ТБ. |
1 |
Вводное занятие. Знакомство с ТБ. |
Кабинет химии |
Беседа |
|
2 |
сентябр ь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Ознакомление с кабинетом химии. |
Кабинет химии |
Видео отчет, аудио запись. |
|
3 |
сентябр ь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Знакомство с лабораторным |
Кабинет химии |
Видео отчет, аудио запись. |
|
4 |
сентябр ь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Знакомство с лабораторным |
Кабинет химии |
Видео отчет, аудио запись. |
|
5 |
октярь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Хранение материалов и реактивов в химической лаборатории. |
Кабинет химии
|
Лекция |
|
6 |
октябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Нагревательные приборы и пользование ими. |
Кабинет химии
|
Беседа |
|
7 |
октябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Взвешивание, фильтрование и перегонка. |
Кабинет химии |
Опрос |
|
8 |
октябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Выпаривание и кристаллизация |
Кабинет химии
|
Видео отчет, аудиоз апись. |
|
9 |
ноябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Основные приемы работы с твердыми, жидкими, газообразными веществами. Лабораторные способы получения неорганических веществ |
Кабинет химии |
Беседа |
|
10 |
ноябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Основные приемы работы с твердыми, жидкими, газообразными веществами. Лабораторные способы получения |
Кабинет химии |
Лекция |
|
|
|
|
|
|
|
неорганических веществ |
|
|
|
11 |
ноябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Приготовление растворов в химической лаборатории и в быту. |
Кабинет химии |
Кругл ый стол |
|
12 |
ноябрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Кристаллогидраты. |
Кабинет химии |
Диску ссия |
|
13 |
декабрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Кристаллогидраты. |
Кабинет химии |
Опрос |
|
14 |
декабрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия и медицина. |
Кабинет химии |
Беседа |
|
15 |
декабрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Занимательные опыты по теме: «Химические реакции вокруг нас». |
Кабинет химии |
Тестов ое задани е |
|
16 |
декабрь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Занимательные опыты по теме: «Химические реакции вокруг нас». |
Кабинет химии |
Викто рина |
|
17 |
январь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Подготовка к декаде естественных наук. Игра «Счастливый случай». |
Кабинет химии |
Игра |
|
18 |
январь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Подготовка к декаде естественных наук. Игра «Счастливый случай». |
Кабинет химии |
Тестов ое задани е |
|
19 |
январь |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Проведение игр и конкурсов среди учащихся 8-9 классов членами кружка. |
Кабинет химии |
Беседа |
|
20 |
февраль |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Проведение игр и конкурсов среди учащихся 8-9 классов членами кружка. |
Кабинет химии |
Беседа |
|
21 |
февраль |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия в природе. |
Кабинет химии |
Кругл ый стол |
|
22 |
февраль |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия в природе. |
Кабинет химии |
Диску ссия |
|
23 |
февраль |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия и человек. Чтение докладов и рефератов. |
Кабинет химии |
Игра |
|
24 |
март |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия и человек. Чтение докладов и рефератов. |
Кабинет химии |
Лекци я |
|
25 |
март |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Проведение дидактических игр: • кто внимательнее • кто быстрее и лучше • узнай вещество • узнай явление |
Кабинет химии |
Лекци я |
|
26 |
март |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Проведение дидактических игр: • кто внимательнее • кто быстрее и лучше • узнай вещество • узнай явление |
Кабинет химии |
Диску ссия |
|
27 |
март |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Проведение дидактических игр: • кто внимательнее • кто быстрее и лучше • узнай вещество • узнай явление |
Кабинет химии |
Беседа |
|
28 |
апрель |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Проведение дидактических игр: • кто внимательнее • кто быстрее и лучше • узнай вещество • узнай явление |
Кабинет химии |
Кругл ый стол |
|
29 |
апрель |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия в быту. |
Кабинет химии |
Урок игра |
|
30 |
апрель |
|
15.30- 16.15 |
Комбинир ованное занятие. |
1 |
Химия в быту. |
Кабинет химии |
Видео отчет |
|
31 |
апрель |
|
15.30- 16.15 |
Ознакоми тельное занятие. |
1 |
Химия в быту. |
Кабинет химии |
Видео отчет |
|
32 |
май |
|
15.30- 16.15 |
Комбинир ованное занятие |
1 |
Общий смотр знаний. Игра “Что? Где? Когда?” |
Кабинет химии |
Беседа |
|
33 |
май |
|
15.30- 16.15 |
Комбинир ованное занятие |
1 |
Общий смотр знаний. Игра “Что? Где? Когда?” |
Кабинет химии |
Игра |
|
34 |
май |
|
15.30- 16.15 |
Комбинир ованное занятие |
1 |
Итоговое занятие. |
Кабинет химии |
Тестов ое задание |
2.2. Условия реализации программы
Практический опыт многолетней работы автора показывает, что педагогу в выборе методов обучения, в организации учебного процесса необходимо учитывать специфику данной программы, и для успешной ее реализации необходимо соблюдение следующих условий.
1. Кадровое обеспечение
Педагог, работающий по данной программе, должен соответствовать квалификационным требованиям, обладать достаточным практическим опытом, знаниями, умениями и навыками.
2. Материально-техническое обеспечение
![]() Наличие
кабинета с мебелью для теоретических и практических занятий. А также
компьютера, калькуляторов, наглядных пособий, задачников и разработок деловых
игр, ролевых игр и практикумов.
Наличие
кабинета с мебелью для теоретических и практических занятий. А также
компьютера, калькуляторов, наглядных пособий, задачников и разработок деловых
игр, ролевых игр и практикумов.
Для реализации электронного обучения и дистанционных образовательных технологий необходимо наличие компьютера с выходом в Интернет, соответствующего программного обеспечения.
Для педагога:
- наличие связей с учреждениями культуры и образования.
- привлечение к работе узких специалистов (работники библиотек, учителя школ и т.д),
- возможность подготовить и показать мультимедийные презентации по темам программы, выход в интернет.
2.3. Формы аттестации
Аттестация проводится с целью установления:
- соответствия результатов освоения программы заявленным задачам и планируемым результатам обучения;
- соответствия организации образовательного процесса по реализации программы установленным требованиям к порядку и условиям реализации программ
Отслеживание результативности осуществляется в форме собеседования, тестирования, при решении задач, в ходе деловых и ролевых игр, входе групповой и индивидуальной работе над проектами.
При этом проводятся:
• входная диагностика, организуемая в начале обучения (проводится с целью определения уровня развития и подготовки учащихся);
• текущая диагностика по завершении занятия, темы, раздела (проводится с целью определения степени усвоения учебного материала);
• итоговая, проводимая по завершении изучения курса программы с целью определения изменения уровня развития учащихся, их творческих и умственных способностей.
В ходе освоения программы применяются следующие методы отслеживания результативности:
педагогическое наблюдение, педагогический анализ результатов тестирования, опросов, выполнения заданий, практических занятий, и т.д.
Формы подведения итогов реализации программы: открытые занятия, решение задач, тестирования, ролевые и деловые игры и т.д.
2.4. Оценочные материалы
Перечень диагностических методик:
- анкета по мотивации выбора объединения;
- мониторинг результатов обучения по дополнительной общеобразовательной общеразвивающей программе;
- мониторинг личностного развития учащегося в процессе усвоения им дополнительной общеобразовательной общеразвивающей программы (диагностическая карта);
- зачетные задания для составления общей картины о знаниях учащихся.
2.5. Методическое обеспечение.
|
Тема |
Форма занятий |
Приемы и методы |
Методический и дидактический материал |
Техническое оснащение занятий |
Формы подведения итогов по теме |
|
Вводное занятие. |
Беседа |
Демонстрация |
Презентация |
Компьютер , проектор, экран. |
Круглый стол |
|
Ознакомление с кабинетом химии и изучение правил техники безопасности |
Практическая работа |
Практическая деятельность |
Набор посуды реактивов |
Компьютер , проектор, экран. |
Тестирование |
|
Знакомство с с лабораторным оборудованием. |
Практическая работа |
Практическая деятельность |
Набор посуды реактивов |
Компьютер , проектор, экран. |
Тестирование |
|
Хранение материалов и реактивов в химической лаборатории. |
Инструктаж по ТБ |
Практическая деятельность |
Набор реактивов |
Набор реактивов |
Правила ТБ |
|
Нагревательные приборы и пользование ими. |
Инструктаж по ТБ |
Практическая деятельность |
|
Работа со спиртовкой |
Практическая работа |
|
Взвешивание, фильтрование и перегонка. |
Практическое занятие |
Практическая деятельность |
|
Весы, фильтровальная бумага, прибор для фильтрования |
Приготовление раствора с массовой долей вещеста |
|
Выпаривание и кристаллизация
|
Практическое занятие |
Практическая деятельность |
|
Прибор для выпаривания и кристаллизации |
Отчет |
|
Основные приемы работы с твердыми, жидкими, газообразными веществами. |
Практическое занятие |
Практическая деятельность |
Презентации |
Мерный цилиндр, весы, прибор для получения и собирания газов |
Беседа |
|
Приготовление растворов в химической лаборатории и в быту. |
Практическое занятие |
Практическая деятельность |
Презентации |
Химический стакан, весы, разновесы, стеклянная палочка |
Практ работа |
|
Кристаллогидраты. |
Практическое занятие |
Практическая деятельность |
Презентации |
Кристаллы |
|
|
Химия и медицина. |
Беседа |
Рассказ, демонстрация |
Презентация, компьютер, проектор, экран |
|
Круглый стол |
|
|
Практическое занятие |
Практическая деятельность |
Набор посуды и реактивов |
Набор посуды и реактивов |
Практическая работа отчёт |
|
Подготовка к декаде естественных наук. Игра «Счастливый случай». |
Беседа |
Ознакомительная деятельность |
Презентация |
|
Круглый стол |
|
Проведение игр и конкурсов среди учащихся 8-9 классов членами кружка. |
Игра |
Практическая деятельность |
Презентация, занимательные опыты |
Компьютер, проектор, экран, химические наборы реактивов и посуды |
Круглый стол |
|
Химия в природе. |
Эвристическая беседа |
Экскурсия |
Окружающая среда, презентация |
Компьютер, проектор, экран, химические наборы реактивов и посуды |
тестирование |
|
Химия и человек. Чтение докладов и рефератов. |
Эвристическая беседа |
Рассказ, демонстрация |
Презентация, проектор, экран |
Компьютер, проектор, экран |
Реферат |
|
Проведение дидактических игр: • кто внимательнее • кто быстрее и лучше • узнай вещество узнай явление |
Игра |
Практическая деятельность |
Презентация, занимательные опыты |
Компьютер, проектор, экран |
Беседа |
|
Профориентационная лекция. |
Эвристическая беседа |
Рассказ, демонстрация |
Презентация, проектор, экран |
Компьютер, проектор, экран |
Круглый стол |
|
Химия в быту. |
Эвристическая беседа |
Рассказ, демонстрация |
Презентация, проектор, экран |
Компьютер, проектор, экран |
Тестирование |
2.6. Литература
1. Г.Е. Рудзитис, Ф.Г. Фельдман Химия. Учебник для 8 класса. – М.: Просвещение.2018
2. А.М Радецкий Дидактический материал Химия 8-9. М Просвещение 2017 год.
3. Боровских Т.А. Рабочая тетрадь по химии: 8 класс: к учебнику Г.Е.Рудзитиса., Ф.Г.Фельдмана.
4. Гара Н.Н. Химия: уроки в 8 классе: пособие для учителя. – М.: Просвещение
5. Радецкий, А.М. Химия. Дидактический материал. 8 - 9 классы: пособие для учителей
общеобразовательных учреждений. – М.: Просвещение
6. Занимательные задания и эффектные опыты по химии. Б.Д.Степин, Л.Ю.Аликберова. «ДРОФА», М., 2002
7. Нетрадиционные уроки. Химия 8-11 классы. Изд-во «Учитель», Волгоград, 2004.
8. Химия. Проектная деятельность учащихся. Составитель Н. В. Ширшина. Изд-во «Учитель», Волгоград, 2007
9. http://hemi.wallst.ru/ - Экспериментальный учебник по общей химии для 8-11 классов.
10. http://www.en.edu.ru/ – Естественно-научный образовательный портал.
11. http://www.alhimik.ru/ - АЛХИМИК.
12. http://www.chemistry.narod.ru/ - Мир Химии. Качественные реакции и получение веществ, примеры. Справочные таблицы. Известные ученые - химики.
13. http://chemistry.r2.ru/ – Химия для школьников.
14. http://college.ru/chemistry/index.php - Открытый колледж: химия. http://grokhovs.chat.ru/chemhist.html - Всеобщая история химии. Возникновение и развитие химии с древнейших времен до XVII века.
15. http://www.bolshe.ru/book/id=240 - Возникновение и развитие науки химии.
Приложение №1
Инструкция по правилам безопасности
для учащихся в кабинете химии
I. Общие требования безопасности
1. Соблюдение
требований настоящей инструкции обязательно для всех учащихся, работающих в
кабинете химии.
2. Спокойно, не торопясь, соблюдая дисциплину и порядок, входить и выходить из
кабинета.
3. Соблюдать требования инструкции по проведению лабораторно-практических
работ.
4. Не разрешается присутствие посторонних лиц при проведении этих работ без
ведома учителя.
5. Нельзя в кабинете принимать пищу и пить.
6. Не загромождать проходы портфелями, сумками и т.п.
7. Не передвигать учебные столы и стулья.
8. Не вставлять в электрические розетки какие-либо предметы.
9. Травмоопасность :
-поражение электротоком
-порезы разбившейся стеклянной посудой
-ожоги кислотой и др. органическими жидкостями
-ушибы при ударе об дверь.
II. Требования безопасности перед началом занятий
1. Входить в
кабинет после разрешения учителя.
2. Не включать электроосвещение и электроприборы.
3. Не открывать самостоятельно форточки, фрамуги, окна.
4. Подготовить рабочее место и учебные принадлежности к занятиям.
5. Одеть рабочую одежду и средства индивидуальной защиты по указанию учителя.
6. Перед выполнением работы изучить по учебнику, или пособию порядок её
проведения.
7. Прослушать инструктаж по ТБ труда при выполнении лабораторно-практической
работы.
III. Требования безопасности во время занятий
1. Выполнять
практические задания только в рабочей одежде.
2. Подготовленный к работе прибор показать учителю.
3. Приступать к работе и каждому её этапу, после указания учителя.
4. Не проводить самостоятельно опытов, не предусмотренных заданиями работы.
5. Не оставлять без присмотра нагревательные приборы.
6. Соблюдать порядок и чистоту на рабочем месте.
7. Не устранять самостоятельно неисправности в оборудовании.
8. Не вносить в кабинет, без указания учителя, любые вещества.
IV. Требования безопасности в аварийных ситуациях
1. При
получении травм (порезы, ожоги) сообщить учителю или лаборанту.
2. В случае возникновения аварийных ситуаций (пожар, появление сильных
посторонних запахов) по указанию учителя, быстро, без паники, покинуть кабинет
.
3. При внезапном заболевании, либо плохом самочувствии, сообщить учителю.
4. Обо всех разливах жидкостей, а также о рассыпанных твёрдых реактивах,
сообщить учителю, не убирать их самостоятельно.
V. Требования безопасности по окончании занятий
1. Уборку
рабочих мест производить по указанию учителя.
2. Не выносить из кабинета любые вещества без указания учителя.
3. Не сливать в канализацию растворы и органические жидкости .(только в
специальные сосуды)
4. Снять рабочую одежду и индивидуальные средства защиты, сдать лаборанту на
хранение.
5. После лабораторно-практических работ тщательно вымыть руки с мылом.
6. Обо всех неполадках в работе оборудования, электросети и т. д. сообщить
учителю.
Практическая работа
«Правила Т.Б. Приемы обращения с лабораторным оборудованием».
Цель: ознакомить с правилами техники безопасности. Научиться правильно, обращаться с лабораторным оборудованием.
Оборудование:
· инструкция «Правила техники безопасности при работы в химическом кабинете»;
· образцы химической
· 1. Организационный момент
2. Ознакомление с правилами техники безопасности.
Учитель представляем общие правила техники безопасности при работе в кабинете химии, учащиеся конспектируют положения.
3. Знакомство с лабораторным оборудованием.
Учитель демонстрирует образцы химической посуды и их назначение:
· Пробирки.
· Плоскодонные колбы.
· Круглодонные колбы.
· Химические стаканы.
· Воронки.
· Длительные воронки.
· Фарфоровые чашечки.
· Мерные цилиндры.
· Щипцы.
Учитель объясняет устройство лабораторного штатив, основные части.
4. Выполнение практической работы, оформление.
Учащиеся выполняют практическую работу (работа в парах) по инструкции и проводят оформление.
Практическая работа
Правила техники безопасности.
Приемы обращения с лабораторным оборудованием
ИНСТРУКЦИЯ. Порядок выполнения работы.
1. Каковы правила набора твердого вещества из склянки в пробирку?
2. Как правильно необходимо проводить перемешивание растворов в пробирке?
3. Как переливают жидкость из широкогорлой посуды в сосуд с узким горлом?
4. Какой объем жидкости должен быть в чашке для выпаривания?
7. Сделайте вывод по итогам работы.
Шаблон работы
ДАТА Практическая работа
Правила техники безопасности. Приемы обращения с лабораторным оборудованием.
Цель работы:
ü Изучите правила техники безопасности при работе в химическом кабинете
ü Познакомиться с разными видами химической посуды и возможностями ее использования в химической лаборатории, изучить устройство лабораторного штатива и отработать навыки работы с ним;
Оборудование:
ü Набор химической посуды: пробирки, колбы (коническая, плоскодонная), химические стаканы, мерные цилиндры, фарфоровые чашечки, держатели для пробирок, штатив для пробирок, ложечки и т.д.), лабораторный штатив
Оформление работы
Задание 1. Образцы химической посуды
 |
 |
||||
 |
|||||
Назначение: Назначение: Назначение:
 Задание 2.
Лабораторный штатив.
Задание 2.
Лабораторный штатив.
Основные детали:
1) __________________;
2) __________________;
3) __________________;
4) __________________;
5) __________________.
Задание 3. Ответы на вопросы.
1. ____________
Вывод:
_____________________________________________________________________________
Приведите рабочее место в порядок.
Правила оформление работы
Практическая работа
Правила техники безопасности. Приемы обращения с лабораторным оборудованием.
Цель работы:
ü Изучите правила техники безопасности при работе в химическом кабинете
ü Познакомиться с разными видами химической посуды и возможностями ее использования в химической лаборатории, изучить устройство лабораторного штатива и отработать навыки работы с ним;
Оборудование:
ü Набор химической посуды: пробирки, колбы (коническая, плоскодонная), химические стаканы, мерные цилиндры, фарфоровые чашечки, держатели для пробирок, штатив для пробирок, ложечки и т.д.), лабораторный штатив
Оформление работы
Задание 1. Образцы химической посуды
 |
 |
||||
 |
|||||
Назначение
Проведение опытов, смешивание малого количества вещества
Назначение
Для переливания жидкостей из
широкогорлой посуды в сосуд с узким горлом
Назначение
Для измерения объема жидкости
 Задание 2.
Лабораторный штатив.
Задание 2.
Лабораторный штатив.
1) стержень;
2) поставка;
3) муфта;
4) лапка;
5) кольцо.
Задание 3. Ответы на вопросы.
1. Твердые вещества из баночек необходимо
брать только сухой ложечкой или сухой пробиркой.
2. Перемешивание растворов в пробирке производят
быстрыми и энергичными движениями. Запрещено встряхивать пробирку, закрывая отверстие пальцем.
3.С помощью воронки
4.Не более 1\3 объема чашки
Вывод:
Изучили основные правила техники безопасности при работе в кабинете химии. Познакомились с различными образцами химической посуды и их назначением. Научились работать с лабораторным штативом.
Приведите рабочее место в порядок.
Практическая работа. «Составление таблиц, изготовление этикеток»
Классы неорганических соединений
|
Оксиды ЭаОb |
Основания М(ОН)а (гидроксиды) |
||||||||||||||||||
|
основные |
кислотные |
растворимые (щелочи) |
нерастворимые |
||||||||||||||||
|
|
|
|
||||||||||||||||
|
Кислоты HaX и HaЭОb |
Соли средние MaYb |
||||||||||||||||||
|
бескислородные |
кислородсодержащие |
||||||||||||||||||
|
|
|
|||||||||||||||||
|
Соли кислые MHaY |
Cоли основные M(OH)aY |
||||||||||||||||||
|
|
||||||||||||||||||
|
Схемы типичных реакций |
|||||||||||||||||||
|
Металл + кислород |
|||||||||||||||||||
Условные обозначения: Э – химический элемент, М – металл, а и b – индексы, Х и Y – кислотные остатки.
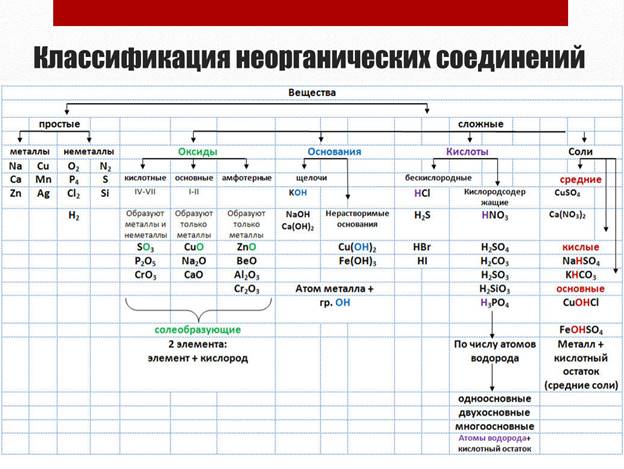
Практическая работа
ЛАБОРАТОРНЫЕ НАГРЕВАТЕЛЬНЫЕ ПРИБОРЫ
Цель работы: познакомиться с основными видами лабораторных нагревательных приборов.
Реактивы и материалы: денатурированный спирт, дистиллированная вода.
Оборудование: горелки (спиртовые, газовые Теклю и Бунзена), бани (песчаные, масляные, водяные), колбонагреватель, пробирконагреватель, электрическая плитка с закрытой спиралью, сушильный шкаф, муфельная печь.
Техника безопасности: следует соблюдать правила обращения с нагревательными приборами и технику безопасности при работе с открытым пламенем.
В лаборатории применяют различные нагревательные приборы: спиртовые и газовые горелки, электрические плитки, бани, муфельные печи и т. п.
Спиртовые горелки обычно бывают стеклянные с притертым колпачком (рис. 1). В них наливают денатурированный спирт и снабжают фитилем из некрученых ниток. Спиртовые горелки дают не очень горячее пламя. После окончания работы горелку закрывают колпачком, чтобы спирт не испарялся.
Газовые горелки. Наиболее часто применяют газовые горелки Бунзена и Теклю.
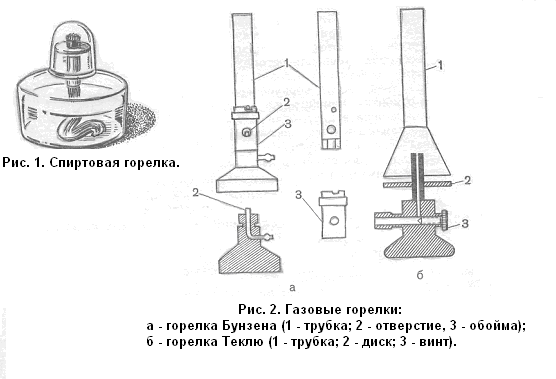 Для того чтобы ознакомиться с устройством горелки
Бунзена (рис. 2, а), нужно отвинтить трубку 1, тогда обнаружится
отверстие 2, через которое вытекает газ. Воздух в горелку поступает
через отверстия в трубке и обойме 3. Поворачивая обойму, можно
отверстие для воздуха либо закрыть, либо открыть в большей или меньшей степени,
регулируя тем самым доступ воздуха.
Для того чтобы ознакомиться с устройством горелки
Бунзена (рис. 2, а), нужно отвинтить трубку 1, тогда обнаружится
отверстие 2, через которое вытекает газ. Воздух в горелку поступает
через отверстия в трубке и обойме 3. Поворачивая обойму, можно
отверстие для воздуха либо закрыть, либо открыть в большей или меньшей степени,
регулируя тем самым доступ воздуха.
Горелка Теклю с регулировочным диском (рис. 2, б) — более совершенный прибор, так как в ней можно точнее регулировать не только доступ воздуха, но и приток газа.
Приток газа регулируют при помощи винта 3. Воздух в верхнюю трубку 1 поступает через щель между конусообразно расширенным основанием трубки и диском 2, насаженным на винтовую нарезку. Поворачивая диск, можно изменять ширину щели и тем регулировать приток воздуха в горелку. Наибольшее количество теплоты выделяется при полном сгорании газа, когда образуется несветящееся пламя. При недостатке воздуха светильный газ сгорает не полностью, при этом выделяется углерод, раскаленные частички которого и обусловливают свечение пламени. При прекращении доступа воздуха в горелку пламя становится коптящим.
 В несветящемся пламени (рис. 3) можно различить три
зоны конуса: внутреннюю а, где происходит смешивание воздуха с газом и
где нет горения; среднюю б, где сгорание газа происходит не полностью
(вследствие наличия продуктов распада составных частей природного газа эта
часть пламени имеет восстановительный характер); внешнюю в, где
происходит полное сгорание газа (эта часть пламени обладает окислительными
свойствами вследствие некоторого избытка кислорода воздуха). Приблизительные
температуры в различных местах газового пламени указаны на рис. 3.
В несветящемся пламени (рис. 3) можно различить три
зоны конуса: внутреннюю а, где происходит смешивание воздуха с газом и
где нет горения; среднюю б, где сгорание газа происходит не полностью
(вследствие наличия продуктов распада составных частей природного газа эта
часть пламени имеет восстановительный характер); внешнюю в, где
происходит полное сгорание газа (эта часть пламени обладает окислительными
свойствами вследствие некоторого избытка кислорода воздуха). Приблизительные
температуры в различных местах газового пламени указаны на рис. 3.
Зажигать газовую горелку нужно только через 1 - 2 с после пуска газа и при небольшом доступе воздуха. Затем следует отрегулировать доступ воздуха так, чтобы пламя стало несветящимся. Если пускать газ в горелку при полном доступе воздуха и зажженную спичку поднести к горелке одновременно с пуском газа, то иногда наблюдается так называемый проскок пламени: газ воспламеняется непосредственно у отверстия 2 (рис. 3, а), тогда как нормально он должен гореть при выходе из верхнего конца трубки 1, а не внутри ее.
Проскок пламени может получиться и в процессе работы. Обычно при проскоке слышится характерный хлопок, пламя делается узким, трубка горелки сильно нагревается и появляется неприятный запах продуктов неполного сгорания светильного газа. «Проскочившее» пламя нужно тотчас же погасить, повернув газовый кран, и вновь зажечь при закрытом поддувале через 1-2 с после пуска газа. Если проскок обнаружен не сразу и трубка горелки успела сильно нагреться, надо подождать, пока она охладится, и лишь затем вновь зажечь газ.
Для получения широкого и плоского пламени на газовую горелку надевают специальную насадку «ласточкин хвост».
В лабораторной практике иногда требуется более высокая температура, чем та, которую дают спиртовые или газовые горелки. В этом случае пользуются паяльными горелками. Паяльная горелка отличается от обычной газовой тем, что в нижней ее части имеются две трубки с кранами, по одной из которых подводится воздух, по другой подводится газ. При зажигании горелки открывают газовый кран трубки и поджигают газ, затем постепенно подают воздух. Путем регулировки поступления газа и воздуха получают пламя требуемой величины и температуры.
Необходимо помнить, что природный газ ядовит — нельзя допускать утечки газа!
Газовые краны должны быть плотно закрыты, когда не пользуются горелкой. Некоторые компоненты природного газа имеют запах, поэтому утечку газа можно обнаружить и принять соответствующие меры.
Бани. Для продолжительного нагревания в пределах температур 100-300 °С применяют бани: водяную, песчаную и др. Водяная баня представляет собой металлический сосуд, который закрывают несколькими концентрическими плоскими кольцами различного диаметра, налагающимися одно на другое (рис. 4). При пользовании баней ее заполняют водой на 2/3 объема, ставят на треножник и нагревают воду до кипения. При этом надо следить, чтобы вода полностью не выкипала. Для получения более высоких температур в сосуд заливают вместо воды масло или концентрированный раствор какой-нибудь соли (хлорида натрия, хлорида кальция и др.). Песчаная баня, также часто применяющаяся в лаборатории для медленного и постепенного нагревания, представляет собой металлическую чашу или сковородку, заполненную сухим чистым песком, прокаленным для удаления из него органических примесей. Нагревание песчаной бани проводят так же, как и водяной, пламенем газовой горелки. Используются также водяные и песчаные бани с электрообогревом (рис. 4, б).
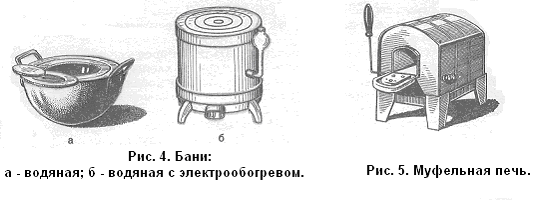
Печи. Для получения температуры 600-1000°С применяется электрическая печь — муфельная (рис. 5). Муфельная печь состоит из четырехугольного каркаса, открытого с одной стороны, изготовленного из огнеупорной глины или другого огнеупорного материала. Каркас снаружи обмотан проволокой с высоким сопротивлением для нагревания и изолирован асбестом. Каркас заключен в металлическую оболочку с дверкой также из огнеупорного материала. С помощью особого регулировочного устройства печь может нагреваться в определенных интервалах температур. Подключают муфельную печь в осветительную сеть. Перед этим следует проверить, соответствует ли напряжение сети напряжению, указанному на подводящих клеммах печи.
Электрические плитки. В лабораториях, в которых нет газа, или в тех случаях, когда требуется нагревание, а пользоваться горелками нельзя (например, при перегонке воспламеняющихся легколетучих жидкостей) применяют электрические плиты. Электроплитки бывают различного размера, с открытой или закрытой спиралью (рис. 6). Плитки с закрытой спиралью удобны и безопасны при работе с легковоспламеняющимися и летучими веществами. Они имеют поверх спирали пластинку — металлическую, асбестовую или талько-шамотную. Последние две устойчивее к действию химических реагентов.
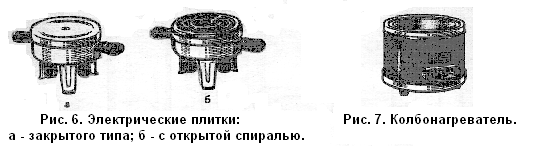
Плитки с открытой спиралью применяют в тех случаях, когда нет опасности попадания на спираль нагреваемого вещества. Они удобны тем, что при перегорании спирали ее легко можно заменить.
Для нагревания круглодонной стеклянной посуды применяют колбонагреватели (рис. 7). Они выше обычных плиток и имеют конусообразное углубление. Нагревательная спираль у колбонагревателей расположена по конусу керамики и почти полностью углублена в нее.
Для регулирования температуры в электронагревательных приборах их можно включать через реостат.
Контрольные вопросы и задания: предложенный набор лабораторных нагревательных приборов (рис. 1-7) зарисовать и определить назначение в лабораторной практике.
Контрольные вопросы:
1. Перечислите основные требования к технике безопасности при работе с нагревательными приборами.
2. На какие группы можно разделить нагревательные приборы, используемые в лаборатории?
3. Опишите устройство газовых горелок Бунзена и Теклю. С чем их сходство и различие?
4. Какие зоны различают в несветящемся пламени? Укажите, какие процессы протекают в этих зонах?
5. Сформулируйте правила включения газовых горелок.
6. Что такое проскок пламени? Какова его причина? Что необходимо предпринять в этом случае?
7. В химической лаборатории часто требуется использовать продолжительное нагревание. Какие приборы используются при этом?
8. Укажите основное назначение сушильного шкафа и муфельной печи.
9. Какая операция называется прокаливанием? С какой целью ее проводят в химической лаборатории?
10. Почему операции высушивания и прокаливания веществ проводят при определенной температуре и отклонения от заданных значений температуры не допускаются?
Практическая работа «Использование нагревательных приборов. Изготовление спиртовки из подручного материала»
Оборудование: флакон из-под антибиотика, горловая часть пластиковой бутылки, завинчивающаяся крышка, шерстяная нить, кусочек жести.
После проведения первого занятия, где велась речь о лабораторном оборудовании, его назначении и использовании, ребятам было сказано, что простейшее оборудование можно сделать и самим из вполне доступного и дешевого материала. А так как большинство химических реакций протекают очень быстро и бурно при нагревании, то первый предмет, который необходим будет юному исследователю, должен выполнять роль нагревателя.
Изготовить зтот прибор можно из следующих подручных средств:

Перед выполнением работы с ребятами проводится инструктаж по технике безопасности
Соблюдение правил т/б при работе с ножницами
Соблюдение правил т/б при работе со спиртовкой.
Последовательность действий при выполнении работы:

1. Подведение итогов.
Практическая работа ВЕСЫ. ВЗВЕШИВАНИЕ
ЦЕЛЬ: научить распознавать и правильно обращаться с основным лабораторным оборудованием
Оборудование: технические весы с набором разновесов, технохимические весы, аналитические весы; набор химических солей для взвешивания (поваренная соль, сода, ацетат натрия)
Задание 1. Составьте письменный конспект на тему «Весы и взвешивание»
Взвешиванием называют сравнение массы данного тела с массой, условно принятой за единицу. Весы являются важнейшим прибором в химической лаборатории.
Наиболее часто в практикуме используют технохимические весы, позволяющие определять массу с точностью до 0,02 г.
В аналитических лабораториях при выполнении различных анализов исследуемого вещества применяют преимущественно аналитические весы, которые позволяют производить взвешивание с точностью 0,0002 г.
Микро-, полумикро-, аналитические и прецизионные весы — это измерительные приборы высокой точности.
Весы – точный измерительный прибор, поэтому необходимы аккуратное обращение с ними и хороший уход. Все весы устанавливают только на ровной поверхности и обязательно проверяют по отвесу или по уровню горизонтально ли с стоят весы. Неправильность положения устраняется с помощью установочных винтов.
При взвешивании не должно быть превышения допустимой нагрузки. Обычно предельная масса указывается на весах.
Взвешиваемые сыпучие вещества недопустимо помещать непосредственно на чашки весов. Твердые вещества взвешивают на часовых стеклах, в бюксах, в тиглях.
Жидкости взвешивают в бюксах или химических стаканах. Нельзя ставить на чашки весов горячие, мокрые и грязные предметы. При взвешивании на аналитических весах необходимо следить, чтобы взвешиваемый предмет имел температуру такую же, как и весы. Для этого взвешиваемый предмет нужно выдерживать 30 – 40 минут в весовой комнате около весов.
При взвешивании на аналитических весах разрешается пользоваться только боковыми дверцами. Открывать и закрывать их надо осторожно, чтобы исключить влияние воздушных течений на точность взвешивания, поэтому боковые дверцы должны быть закрыты.
Считывание показаний
Задание 2. Ответьте на вопросы, выполните задания:
|
1. Что необходимо сделать перед тем, как проводить взвешивание реактива на электронных весах? А) обнулить весы Б) обнулить весы с пустой тарой Б) обнулить весы с навеской. Выбор ответа поясните. 2. Что нельзя использовать для точного взвешивания навески? А) фильтр Б) бюкс В) часовое стекло Г) поверхность чаши весов. Выбор ответа поясните. Добавьте в презентацию слайды с изображением данной посуды. 3. В каких местах нельзя устанавливать аналитическое весовое оборудование? А) под прямыми солнечными лучами Б) на втором этаже производственного здания В) на сквозняке Г) вблизи отопительных приборов Д) в местах с повышенным уровнем вибрации Е) в помещении с температурой ниже 250 С. Выбор ответа поясните. 4. Взвесьте на технохимических весах по 10 г двух предложенных преподавателем образцов. Сравните число структурных единиц в них. |
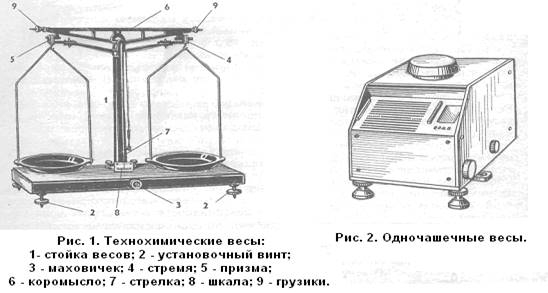
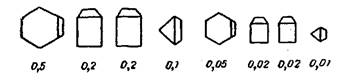
Рис. 3. Миллиграммовый разновес
Практическая работа «ФИЛЬТРОВАНИЕ»
Цель работы: очистить загрязненную поваренную соль от речного песка, используя, способы разделения смесей .
Оборудование и реактивы: стакан, воронка, стакан с водой, бумага фильтровальная, спиртовка, спички, держатель, предметное стекло, смесь соли с песком, палочка для размешивания.
Ход работы:
ТЕСТ на знание правил безопасного поведения во время проведения практической работы.
1. Как положено вести себя в школьной химической лаборатории?
А) можно перекусить; Б) можно смешивать реактивы, не пользуясь инструкцией
В) можно бегать и шуметь; Г) следует соблюдать на рабочем месте чистоту и порядок
2.Чего нельзя делать при работе со спиртовкой?
А) тушить огонь колпачком; Б) зажигать спичками; В) зажигать от другой спиртовки
Г) заполнять этиловым спиртом
3.Фарфоровую чашечку нагревают в пламени спиртовки, держа:
А) руками; Б) держателем; В) щипцами
4.Полученную в школьной лаборатории очищенную соль:
А) можно попробовать на вкус; Б) нельзя пробовать на вкус
5.Что нужно делать, если разлил раствор вещества:
А) сообщить учителю; Б) самостоятельно убрать разлитое вещество; В) сделать вид, что ничего не случилось.
Ход работы.
1. Растворите смесь песка и соли в воде;
2. Приготовьте фильтр, вставить его в воронку, воронку поместить в чистый стакан.
3. Отфильтруйте смесь.
4. Капните немного фильтрата на предметное стекло, проведите выпаривание, соблюдая осторожность;
5. Ответьте на вопросы:
а) каков характер разделяемой смеси?
б) на чем основаны методы разделения?
По итогам проведенных опытов заполните таблицу, сделайте вывод.
Образец оформления работы:
|
Что делали? |
Что наблюдали? |
Выводы |
|
1. Растворили смесь соли с песком в воде |
|
|
|
2. Приготовили фильтр и провели фильтрование |
|
|
|
3. Провели выпаривание |
|
|
Закончите фразы:
1. Неоднородную смесь можно разделить …
2. При выполнении практической работы были использованы следующие способы очистки соли …
3. Метод разделения песка и соли основан...
Вывод: очистить загрязненную поваренную соль от речного песка можно: растворением, фильтрованием, выпариванием. Данный метод основан на различной растворимости веществ.
Практическая работа «Получение сульфата меди из меди»
1. Получение раствора сульфата меди (II). Заполните пробирку на одну четверть выданным вам раствором серной кислоты. Поместите пробирку в держатель и аккуратно нагрейте раствор почти до кипения, сначала прогрев всю пробирку в пламени, а затем сконцентрировав нагревание в нижней части пробирки. Следите, чтобы отверстие пробирки во время нагревания было направлено в сторону от вас и соседей. Насыпьте в пробирку немного порошка оксида меди (II). Перемешайте раствор стеклянной палочкой. Что наблюдаете? Прибавьте следующую порцию оксида меди и снова перемешайте. Добавляйте оксид меди в раствор до тех пор, пока он не перестанет растворяться. Запишите уравнение реакции и наблюдения в тетрадь.
2. Фильтрование. Отделите непрореагировавший оксид меди фильтрованием. Закрепите воронку на кольце штатива, носик её опустите в чистый химический стакан. Приготовьте фильтр и, пользуясь стеклянной палочкой, перенесите на него раствор сульфата меди.
3. Упаривание фильтрата. Фильтрат перелейте в фарфоровую чашку и упарьте до появления плёнки на поверхности жидкости.
4. Кристаллизация медного купороса. Поставьте раствор, находящийся в фарфоровой чашке, кристаллизоваться в сосуд со льдом. Выделившиеся кристаллы отфильтруйте. Дополнительное количество кристаллов может быть получено при испарении оставшегося раствора, из которого уже выделились кристаллы. Какой цвет имеют кристаллы медного купороса? При наличии в кабинете химии микроскопа рассмотрите форму кристаллов и зарисуйте их.
Ответ 1 При добавлении порошка оксида меди (II) в раствор серной кислоты, наблюдается растворение оксида меди (II) и окрашивание раствора в синий цвет.
CuO + H2SO4 ⟶ CuSO4 + H2O
Кристаллы медного купороса имеют синий цвет.
Получение хлорида цинка из цинка
1.Промышленный метод получения – растворение цинка и его соединений в соляной кислоте. В качестве исходного материала может выступать обожженная руда. В дальнейшем полученный раствор выпаривают, т.к. конечным продуктом, кроме хлорида цинка, будет вода или летучие газы.
Zn + 2 HCl = ZnCl₂ + H₂↑
ZnO + 2 HCl = ZnCl₂ + H₂O
ZnS + 2 HCl = ZnCl₂ + H₂S↑
2.2Другой промышленный способ получения ZnCl₂ — нагревание жидкого цинка в токе хлора. Для этого гранулированный цинк расплавляют при температуре 419,6 °C (температура плавленияцинка).
Zn + Cl₂ =t= ZnCl₂
3.3В лаборатории хлорид цинка можно получить действием
чистого цинка на растворы хлоридов некоторых металлов. Те металлы,
которые стоят правее цинка в электрохимическом ряду напряжений, будут
вытесняться им из соединений. Наиболее распространенные металлы, входящие в
состав реактивов – железо, медь, ртуть и серебро. Для проведения реакции в
пробирку налейте небольшое количество раствора хлорида железа (меди, ртути или
серебра). Затем опустите в пробирку гранулы чистого цинка или
цинковую пластинку
.2 FeCl₃ + 3 Zn = 3 ZnCl₂ + 2 FeТ.к. раствор хлорида железа III имеет желтую окраску, то после проведения реакции раствор обесцветится, а чистое железо выпадет в осадок. Это будет визуальным подтверждением успешого проведения реакции.
CuCl₂ + Zn = ZnCl₂ + Cu
HgCl₂ + Zn = ZnCl₂ + Hg2
AgCl + Zn = ZnCl₂ + 2 Ag
4.Другой лабораторный метод получения хлорида цинка – действие
хлоридов металлов или соляной кислоты на соединения цинка. Для проведения
реакции налейте в пробирку рассчитанное количество гидроксида цинка,
добавьте эквивалентное количество соляной кислоты. После проведения реакции
нейтрализации образуется бесцветный раствор хлорида цинка. Если вам нужно
получить вещество в сухом виде, перелейте раствор в выпарительную чашку и
поставьте на электрическую плитку. После упаривания должен остаться белый
осадок или налет на стенках пробирки.
Zn(OH)₂ + 2 HCl = ZnCl₂ + 2 H₂O
Необходимое количество сульфата цинка налейте в пробирку и добавьте хлорид бария. При правильном расчете вещества прореагируют между собой полностью (без остатка) и конечные продукты разделятся. Сульфат бария выпадет в осадок, а хлорид цинка останется в растворе. Осадок можете отфильтровать, а раствор выпарить.
ZnSO₄ + BaCl₂ = ZnCl₂ + BaSO₄↓
·
Zn + 2 HCl
= ZnCl₂ + H₂↑
ZnO + 2 HCl = ZnCl₂ + H₂O
ZnS + 2 HCl = ZnCl₂ + H₂S↑
CuCl₂ + Zn = ZnCl₂ + Cu
HgCl₂ + Zn = ZnCl₂ + Hg
2 AgCl + Zn = ZnCl₂ + 2 Ag
Практическая работа «Приготовление раствора соли с определенной массовой долей растворенного вещества»
Цель работы: приготовление раствора соли заданной концентрации.
Оборудование и реактивы: стакан, стеклянная палочка, цилиндр (мензурка), весы с разновесами, кристаллический хлорид натрия, вода.
Ход работы:
1. Рассчитайте, какую массу хлорида натрия и какой объем воды надо взять для приготовления 50г 1,5% раствора хлорида натрия.
2. Приготовьте этот раствор:
а) приведите в равновесие чашечки весов;
б) отвесьте рассчитанную массу соли;
в) с помощью мензурки отмерьте рассчитанный объем воды;
г) в химическом стакане растворите соль в воде, перемешивая стеклянной палочкой.
3. Добавьте к полученному раствору еще 70г воды. Рассчитайте, как при этом изменится концентрация раствора (массовая доля растворенного вещества).
Запишите в тетрадь необходимые расчеты, сделайте вывод по итогам работы.
Образец выполнения работы
|
Дано: m(р-ра) = 50г w(NaCl) = 1,5%
|
Решение:
w(в-ва)
= отсюда m(соли) = w(в-ва)∙ m(р-ра)/100%
m(H2O)= m(р-ра) – m((NaCl) = 50г – 0,75г = 49,25г V(H2O) = m∙ρ = 49,25г ∙1г/мл = 49,25 мл
Ответ: m(NaCl)=0,75г; V(H2O) =49,25мл
m (р-ра) = 50г + 70г = 120г
тогда w(в-ва)=
w(в-ва)=
w(в-ва) = 0,625% Ответ: w2(NaCl) = 0,625% |
|
Найти: m(NaCl)=? V(H2O) =?
|
Вывод: научились обращаться с весами, приготовили раствор заданной концентрации.
Практическая работа «Выращивание кристаллов соли»
Цель: Вырастить кристалл соли из водных растворов
Решение:




Советы:
Предлагаемую лабораторную работу можно проводить в домашних условиях, так так выполняемые действия не являются опасными, но требуют длительного времени.
Практическая работа
Тема. Удаление загрязнений с поверхности тканей.
Цель: научиться удалять с поверхности ткани загрязнения (пятна) разного происхождения.
Оборудование и материалы: тигельные щипцы или пинцет, пипетки, кусочки тканей, загрязненные растительным или животным жиром, ягодами или фруктами, духами, ржавчиной, йодом, чаем, кровью, травой.
Реактивы: кристаллический натрий хлорид, глицерин, лимонная кислота (лимонный сок), этиловый спирт или ацетон, раствор аммиака (нашатырный спирт), салициловый спирт.
С правилами техники безопасности ознакомлен: ____________________
подпись
Ход работы:
Опыт 1. Выведение жирового пятна.
Жировое пятно на ткани посыпьте натрий хлоридом (поваренной солью). Возьмите тигельными щипцами или пинцетом кусок чистой ткани и потрите пятно. Процедуру повторите несколько раз.
Наблюдения. _________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
Опыт 2. Выведение пятен от духов.
Нанесите на пятно от духов несколько капель глицерина. Потрите пятно, как указано в предыдущем опыте.
Наблюдения.
Опыт 3. Выведение пятен от ржавчины.
Нанесите на пятно от ржавчины несколько капель лимонной кислоты (лимонного сока). Потрите пятно.
Наблюдения.
Опыт 4. Выведение пятен от йода.
Нанесите на пятно от йода несколько капель этилового спирта или ацетона. Потрите пятно.
Наблюдения. _________________________________________________________________________
Опыт 5. Выведение пятен от чая.
Нанесите на пятно от чая несколько капель смеси глицерина и раствора аммиака (нашатырного спирта), взятых в одинаковых количествах. Потрите пятно.
Наблюдения
Опыт 6. Выведение пятен от ягод и фруктов.
Нанесите на пятно от ягод или фруктов несколько капель лимонной кислоты (1 чайная ложка на стакан воды). Потрите пятно.
Наблюдения. _________________________________________________________________________
Опыт 7. Выведение пятен от крови.
Нанесите на пятно от крови несколько капель раствора аммиака (нашатырного спирта, 1 чайная ложка на стакан воды). Потрите пятно.
Наблюдения.
Опыт 8. Выведение пятен от травы.
Нанесите на пятно от травы несколько капель салицилового спирта. Потрите пятно.
Наблюдения. _________________________________________________________________________
Сделайте общий вывод:
Удаление загрязнений (пятен) с поверхности тканей основывается на:_________________________
Объясните, чем может отличаться друг от друга удаление с поверхности ткани свежих загрязнений и застаревших.
Приведите в порядок своё рабочее место.
Кроссворд «Химические элементы и вещества»
|
|
|
|
4 |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||
|
|
2 |
|
|
|
|
|
|||||||||||||||||||
|
|
13 |
|
|
3 |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
6 |
|||||||||||||||||
|
1 |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
14 |
|
|
|
25 |
|
|
|
|
|
5 |
26 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
15 |
|
|
|
|
10 |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
24 |
|
|
|
|
|
|||||||||||||||||
|
|
16 |
|
9 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
23 |
|
|
|
|
|
||||||||||||||
|
|
7 |
|
|
8 |
|
|
|
|
11 |
|
|
|
||||||||||||||
|
17 |
|
|
|
|
|
|
|
|
19 |
|
|
|
22 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
12 |
|
||||||||||||||||||
|
|
|
18 |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
21 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
По вертикали:
1) Газ с запахом свежести, аллотропная модификация кислорода (озон)
2) Сырье для получения натрия (галит)
3) Металл третьего периода, образующий амфотерные оксид и гидроксид (алюминий)
4) Химический элемент, названный в честь солнца (гелий)
5) Простое вещество, необходимое для дыхания (кислород)
6) Химический элемент, входящий в состав мрамора, мела и известняка (кальций)
7) Самое легкое газообразое простое вещество (водород)
8) Инертный газ, составляющий до 1% воздуха (аргон)
9) Химический элемент, названный в честь России (рутений)
10) Входит в состав около 300 минералов-железняков (железо)
11) Простое вещество, которое добавляют в каучук для получения резины (сера)
12) Наука о веществах (химия)
По горизонтали:
13) Химический элемент, обязанный своим названием скандинавской богине красоты (ванадий)
14) Биогенный химический элемент, входит в состав белков (азот)
15) Инертный газ, завершающий второй период (неон)
16) Химический элемент, впервые найденный в минерале берилле (бериллий)
17) Химический элемент, образующий красную, черную и белую модификации (фосфор)
18) Химический элемент, входящий в состав аметиста, цитрина и александрита (кремний)
19) Простое вещество, неметалл, образует темно-лиловые кристаллы с металлическим блеском (йод)
20) Щелочной металл хранимый под слоем керосина (натрий)
21) Металл, превосходящий по устойчивости к коррозии сталь в 10 раз (титан)
22) Редкоземельный металл, названный в честь Скандинавского полуострова (скандий)
23) Микроэлемент, важный для зубной эмали (фтор)
24) Химический элемент, начинающий второй период (литий)
25) Химический элемент, в название которого входят названия двух животных (мышьяк)
26) Аллотропная модификация углерода, самый твердый минерал (алмаз)
Интеллектуальная игра по химии «Счастливый случай»
Цели и задачи: создание условий для формирования и развития стойкого познавательного интереса обучающихся к химии, расширения кругозора школьников, активизации мыслительной деятельности учащихся, развития коммуникативных навыков работы в группе, создания положительного эмоционального настроя.
Оформление и оборудование: высказывания и портреты ученых-химиков М.В.Ломоносова, Д.И.Менделеева; мультивидеопроектор, экран, воздушные шарики; химические реактивы для демонстрационных опытов.
План проведения игры
Ход игры
Ведущий: Добрый день, дорогие участники интеллектуальной игры! Здравствуйте уважаемые педагоги, классные руководители. Сегодня у нас счастливый случай! Счастливый потому, что мы очень рады видеть здесь начинающих химиков, и еще потому, что мы начинаем игру «Счастливый случай»!
Ученица читает стихотворение Сергея Щипачева «Читая Менделеева»:
Другого ничего в природе нет
Ни здесь, ни там в космических глубинах:
Все – от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгой.
Вокруг тебя творится мир живой,
Входи в него, вдыхай, руками трогай.
Есть просто газ легчайший – водород,
Есть просто кислород, а вместе это –
Июньский дождь от всех своих щедрот,
Сентябрьские туманы на рассветах.
Кипит железо, серебро, сурьма
И темно-бурые растворы брома.
И кажется Вселенная сама
Одной лабораторией огромной!
Ведущий: Представляем наше уважаемое и мудрое жюри.
Ведущий: Проводим жеребьевку команд. Прошу капитанов подойти к столу. Выберите номер комплекта заданий.
Итак, мы начинаем. Первый конкурс «Приветствие». Учитывается организованность, оригинальность, дисциплина. Команды игроков, представьтесь, пожалуйста!
Гейм 1 «Дальше-дальше…»
Задается по 10 вопросов каждой команде, отвечать надо сразу. За каждый правильный ответ – 1 балл. В случае затруднения с ответом, капитан команды говорит ведущему: «Дальше».
Комплект № 1
1. Самый твердый металл. (хром)
2. Самый легкий элемент. (водород)
3. Кто открыл закон сохранения массы вещества? (Ломоносов Михаил Васильевич) – обратить внимание на портрет и высказывание.
4. Самый распространенный элемент на земле. (кислород)
5. Относительная молекулярная масса воды. (18)
6. Названия каких химических элементов связаны с астрономией? (Уран, нептуний, плутоний, селен, теллур, гелий) Балл ставится за 3 названия.
7. Какой элемент может назвать себя лесом? (бор).
8. Название какого элемента состоит из названий двух животных? (мышьяк).
9. Какие вещества называют сложными? (состоят из двух или нескольких элементов).
10. Чему равна относительная атомная масса углерода? (12)
Комплект № 2
1. Самый тугоплавкий металл. (вольфрам)
2. Какой элемент назван в честь России? (рутений)
3. Какое вещество используют во время тушения пожаров в пенных огнетушителях? (углекислый газ)
4. Как называется вещество, состоящее из одного вида атомов? (простое)
5. Относительная молекулярная масса углекислого газа? (44)
6. Названия каких веществ связаны с именами героев древних мифов? (Прометий, титан, тантал)
7. Самый пластичный металл? (золото)
8. Какой химический элемент был обнаружен сначала на Солнце, а потом на Земле? (гелий)
9. Относительная атомная масса кальция? (40)
10. К каким явлениям относят процесс горения древесины? (химическим)
Запасные комплекты заданий.
Комплект № 3
1. Назовите жидкий металл. (ртуть)
2. Число, которое пишется перед химической формулой. (коэффициент)
3. Вещество, в состав которого входит два или несколько видов атомов. (сложное)
4. Кто составил периодическую таблицу химических элементов? (Менделеев Дмитрий Иванович) – обратить внимание на портрет и высказывание.
5. Относительная молекулярная масса азота. (28)
6. Названия каких химических элементов связаны с именами ученых? (Менделевий, эйнштейний, кюрий, гадолиний, фермий, лоуренсий) Балл ставится за 3 названия.
7. В таблице Менделеева сколько малых и больших периодов? (3 и 4)
8. Относительная атомная масса фосфора? (31)
9. Металл с наивысшей электропроводностью. (серебро)
10. Почему жителям Ямала советуют употреблять в пищу йодированную соль? (В регионах, расположенных в центре материков, низкое содержание йода).
Комплект № 4
1. Самый активный неметалл. (фтор)
2. Какое вещество может находиться сразу в трех состояниях? (вода)
3. Относительная молекулярная масса аммиака. (17)
4. Названия каких химических элементов названы в честь различных государств (галлий, франций, скандий, германий, полоний, индий, рутений). Балл за 3 названия.
5. То, из чего состоят физические тела. (вещество).
6. Число, стоящее справа после знака химического элемента в формуле. (индекс).
7. Как называется в таблице Менделеева горизонтальный ряд химических элементов? (период).
8. Относительная атомная масса натрия. (23).
9. Какие химические элементы названы в честь городов? (дубний, гафний, лютеций, берклий; вблизи г. Иттерби (Швеция) был найден минерал, в котором обнаружены иттрий, тербий, эрбий, иттербий). Балл за 3 названия.
10. Конденсация пара относится к какому явлению? (физическому).
Комплект № 5
1. Назовите радиоактивные металлы (уран, цезий, плутоний).
2. В честь какого острова получила название медь? (Кипр – купрум)
3. Как называется десятипроцентный раствор аммиака в воде. (нашатырный спирт)
4. Какой металл убивает микроорганизмы? (серебро)
5. Относительная атомная масса кислорода. (16)
6. В названии, каких элементов отражены их свойства? (водород, кислород, фосфор, бром)
7. Мельчайшая, химически неделимая частица. (атом)
8. Какой химический элемент содержится в зубной пасте и укрепляет зубную эмаль? (фтор).
9. Относительная молекулярная масса угарного газа СО. (28).
10. К какому явлению относят гниение продуктов? (химическому)
Гейм 2 «Заморочки из бочки»
Каждой команде выдают по два рисунка с заданиями в виде анаграммы. Отгадав задания и переставив в словах буквы, должны получиться названия веществ. На выполнение заданий две минуты. За каждый правильный ответ 2 балла.
«1-я Заморочка из бочки»
В ярком пламени рождаясь,
Я невзрачна и сера.
Но если буквы переставить,
Гибким стеблем стану я. (зола-лоза)
«2-я Заморочка из бочки»
Горючий продукт я, и родом с болота.
Но есть одна буква в названье коротком.
Прыжок ее быстрый – и все изменилось:
Я стал элементом. Так чудо свершилось! (торф-фтор)
«3-я Заморочка из бочки»
Буквы лежат на столе перед вами.
Расставьте их так, чтобы стали словами.
Первое слово – фигура одна,
Всего в ней, заметьте, - четыре угла.
Слово второе сумейте собрать –
Красно-бурую жидкость вам надо назвать. (ромб-бром)
«4-я Заморочка из бочки»
Я противоречий порожденье
И возникаю всюду там,
Где материи движенье
С металлом сводит неметалл.
Но если буквы переставить,
То ищи меня в лесу.
Красуясь мощными рогами, я по поляне пробегу. (соль-лось)
Гейм 3 «Темная лошадка»
Задание на слайде. По описанию свойств, команда должна назвать вещество и его химическую формулу. На выполнение задания одна минута. За правильный ответ 3 балла.
Ответы: 1) углекислый газ, 2) вода, 3) кислород, 4) азот, 5) соль
Гейм 4 «Гонка за лидером» - конкурс капитанов
Капитаны получают одинаковые рассказы, в которых использованы названия химических элементов. В течение пяти минут они должны найти и выписать эти названия. Кто больше всех найдет, получает 5 баллов, кто меньше всех – 1 балл.
Химический рассказ – задача
Внимательно прочтите рассказ, найдите спрятанные названия химических элементов и выпишите названия всех химических элементов, которые были использованы.
«Дело было в Европии. Один очень знатный феодал господин Углерод решил заняться новым бизнесом. Он построил на территории Франций свою фермий и стал разводить там курчатовийских индюшек. Индийки приносили ему хороший доход. На полученные с продажи золото и серебро, Углерод купил
технику – новенький осмий-валентный гоночный «Уран». И решил тогда Углерод путешествовать. Гадолиний он гадолиний, куда бы ему поехать, и отправился он в Германий к своему давнему конкуренту маркизу Аргону. Приезжает Углерод в Германий, видит, а у Аргона дом платиновый, шикарный… взор так и примагний. Вокруг дома бор с никелями и озеро радоновое. Позавидовал Углерод Аргону: «Я-то по сравнению с ним совсем гольмий». И запала сера ему на душу. А Аргон Углерода встречает – радий! А у того в голове мысли титановые так и ренийются. Хотел, было, Углерод у маркиза диспрозий, откуда он богатство сберилий. Да добродушный Аргон сам сказал. Оказывается, Аргон свинециев откармливает и в Амерецию сбарийвает. За них он стербийет много рубидиев. Благородный Аргон и Углероду двух маленьких свинециев подарил. А чем их кормить - забыл сказать. Едет Углерод домой на «Уране», везет свинециев и думает: «Ну и цирконий! Аргон совсем йиод». А тем временем один свинеций подмарганец другому, накремнийлись они через край «Урана» и улитий. А завистливый Углерод ни с чем астат».
Примечание: у вас должно получиться 36 названий химических элементов.
Ведущий: Пока капитаны работают, проведем игру. Химические загадки. Поднимаете руку, говорите ответ, в случае правильного ответа, получаете жетон.
Через нос проходит в грудь, и обратный держит путь.
Он невидимый, но все же без него мы жить не можем. (Воздух).
Я – газ легчайший и бесцветный, не ядовитый и безвредный.
Соединяясь с кислородом, я для питья даю вам воду. (Водород)
Он прочен и упруг, строителям надежный друг:
дома, ступени, постаменты- красивы станут и заметны. (Гранит).
Он черный, блестящий, людям помощник настоящий.
Он несет в дома тепло, от него в домах светло.
Помогает плавить стали, делать краски и эмали. (Каменный уголь).
Если встретишь на дороге, то увязнут сильно ноги.
А сделать миску или вазу – она понадобится сразу. (Глина).
Он очень нужен детворе. Он на дорожках во дворе,
Он и на стройке, и на пляже, и он в стекле расплавлен даже. (Песок).
Одну ее не едят, а без нее мало что едят. (Поваренная соль).
На кухне у мамы помощник отличный.
Он синим цветком расцветает от спички. (Природный газ)
По доске он бегает, нужное дело делает.
Порешал, пописал, раскрошился и пропал. (Мел).
Я – металл серебристый и легкий, и зовусь самолетный металл.
И покрыт я оксидною пленкой, чтоб меня кислород не достал! (Алюминий)
Пока жюри готовится огласить конечные результаты, скажите, что такое химия? (наука о веществах, их превращениях и свойствах веществ). А во времена, когда химия только становилась самостоятельной наукой, произошла такая история.
Жители небольшого городка, в котором жил и работал знаменитый шведский химик Берцелиус, спросили однажды кухарку, чем собственно занимается ее хозяин.
- Не могу сказать в точности, - ответила кухарка. – Он берет большую бутылку с какой-то жидкостью и наливает из нее в маленькую, встряхивает, выливает в еще меньшую, опять встряхивает, перемешивает и выливает - в совсем маленькую.
- А потом?
- А потом выливает все вон.
Ведущий: Ребята, что вы знаете о Берцелиусе? (Создатель химического языка, он предложил давать названия химическим элементам по первым буквам латинских и греческих названий. Этот принцип до сих пор используется в химии).
Ведущий: Предоставляю слово жюри для подведения общего итога игры и награждения.
Игра закончена. Всем спасибо за игру!
Интеллектуальная игра «ЧТО? ГДЕ? КОГДА?» по теме «МЕТАЛЛЫ»
Цель: повышение устойчивого познавательного интереса учащихся к химии и развитие их творческих способностей.
Подготовка к игре:
Реквизиты: игровой стол, разделенный на сектора, волчок, секундомер, гонг, черный ящик, алюминиевая ложка, бумага, поваренная соль.
Эпиграф
Металлы
отверзают недро земное к плодородию; металлы служат нам в ловлении земных и
морских животных для пропитания нашего; металлы облегчают купечество удобною к
сему монетою... И кратко сказать, ни едино художество, ни едино ремесло простое
употребление металлов миновать не может.
М.В. Ломоносов
Правила игры: интеллектуальная игра «Что? Где? Когда?» проводится в рамках итоговой аттестации кружковой работы по химии . Из 8–9-х классов выдвигается лучшие ученики - команда 6 человек. На обдумывание каждого вопроса дается две минуты. За каждый правильный ответ команда получает соответствующее очко на который показала стрелка игрового барабана, Если правильного ответа нет, отвечает кто-нибудь из зрителей и получает соответствующее очко . Если ответа нет со стороны зрителей , то вопрос снимается . На игровом столе 15 вопросов, 16-й сектор – музыкальная пауза. В блиц–вопросе и супер- блице на обдумывание дается по 30 секунд на каждый вопрос. Играет вопрос, на который показала стрелка волчка.
Условия награждения
1)Если выигрывает команда знатоков по общим баллам, то получает грамоту каждый
2)Если выигрывает из зрителей опять же по общим баллам, то получает грамоту тот у кого большее количество очков
3)наградить призом самого лучшего игрока в игре со зрителями, которая проводится в промежутке
4)наградить призами команду знатоков
Проведение игры. Уважаемые коллеги! Учащиеся! Я приветствую вас на интеллектуальной игре «Что? Где? Когда?» Я желаю всем вам успехов в сегодняшней игре! Против Вас сегодня играет учитель химии. Ознакомление с правилами игры. И так, игра начинается. Гонг.
Содержание игры:
I. Вопросы
Ведущий:
1. Многие народы приписывают этому металлу целебные свойства. Непальцы, например, считают его священным металлом, который способствует сосредоточению мыслей, улучшает пищеварение и лечит желудочно-кишечные заболевания (больным дают пить воду из стакана, в котором лежат несколько монет из данного металла). Один из самых больших и красивых непальских храмов носит название в честь данного металла. Он встречается в природе как в соединениях, так и в самородном виде. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо.
Внимание вопрос, назовите металл? (Ответ: Медь).
2. Внимание мультимедийный вопрос
В древности у некоторых народов данный металл ценился дороже золота. Лишь представители знати могли украшать себя изделиями из него, причем нередко в золотой оправе. В Древнем Риме изготавливали даже обручальные кольца. Дошедшие до нас документы рассказывают, что один из египетских фараонов обратился к царю хеттов с просьбой прислать ему данный металл в обмен на любое количество золота. В египетских гробницах наряду с другими ценностями было найдено ожерелье, в котором бусы из этого металла чередовались с золотыми.
Внимание вопрос, назовите металл? (Ответ: Железо).
3. В переводе с испанского буквально означает «серебришко». Такое пренебрежительное название дали конкистадоры. Дело в том, что, будучи исключительно тугоплавкой, не поддавалась переплавке и ценилась вдвое ниже, чем серебро. Сейчас на мировых биржах она дороже серебра примерно в 100 раз.
Внимание вопрос, назовите металл? (Ответ: Платина По причине исключительной тугоплавкости металла, платина долгое время не находила применения и ценилась вдвое ниже серебра. И только к концу 18 века этот драгоценный металл стал олицетворять собой надёжность и неизменность. В 1780 году французский король Людовик XVI назвал платину единственным металлом, достойным королей. Сам Людовик XVI обладал богатейшей коллекцией платиновых украшений).
4. Музыкальный номер
5. Металл обладающий любопытнейшей способностью стерилизовать
воду. Причем требуется буквально крошечное количество – десять частей на
миллиард. Сей удивительный факт был известен еще с древнейших времен: так, в V
веке до н. э. Геродот писал о персидском царе Кире, который постоянно
возил с собой личный запас воды, взятой из особого источника, вскипяченной и
запечатанной в сосуды из этого металла.
И римляне, и греки не раз отмечали, что
еда и питье, помещенные в посуду из этого металла, сохраняются намного дольше.
Сильные бактерицидные качества его использовались за множество веков до того,
как были обнаружены сами бактерии. Этим можно объяснить, почему на дне древних
колодцев часто находят монеты из этого металла.
Внимание вопрос, о каком металле идет речь? (Ответ: О серебре Серебро же способно убивать микробов, находящихся в воде. Вода из серебряного сосуда имеет особые свойства: обладает повышенной бактерицидностью.)
6. Внимание! Блиц – вопрос.(30сек)
1.Этот металл известен человеку с древнейших времен, его широко применяют в технике, быту. Атомы этого металла входят в состав гемоглобина.
Внимание вопрос, о каком металле идет речь? (Ответ: О железе)
2.Металл, вызывающий лихорадку.
Внимание вопрос, о каком металле идет речь? (Ответ: Золото)
3.Металл, который используют служители церкви для получения «святой воды».
Внимание вопрос, о каком металле идет речь? (Ответ: Серебро)
7. Гуси спасли Рим, а погубил Рим, по мнению токсикологов, металл.
Внимание вопрос, какой это металл? (Ответ: Свинец. "Древний Рим отравился свинцом", - к такому выводу пришли некоторые американские и канадские ученые-токсикологи. По их мнению, использование свинцовой посуды (бутылей, бокалов, чаш) и косметических красок, содержащих соединения свинца, приводило к хроническому отравлению и вымиранию римской знати. Известно, что многие императоры, правившие Римом в первые столетия нашей эры, т.е. в последний период существования империи, страдали теми или иными психическими заболеваниями. Средняя продолжительность жизни римских патрициев не превышала 25 лет. Люди низших сословий в меньшей степени подвергались свинцовому отравлению, поскольку они не имели дорогой посуды и не употребляли косметических средств. Но и они пользовались знаменитым водопроводом, "сработанным еще рабами Рима", а трубы его, как известно, были сделаны из свинца)
8. Витамин А, находящийся в печени, действует только в присутствии этого элемента. Если его нет, то сколько бы мы ни принимали витамина А, мы не сможем восполнить его недостаток, так как витамин в этом случае не может высвободиться из печени, а кровь не в состоянии дать его коже, больным тканям или, скажем, глазам (при ксерофтальмии — «куриной слепоте»). Так что лечение многих болезней следует начинать, по мнению науки, с назначения больным с содержанием этого элемента. Особенно при анемии, язве желудка, опухоли предстательной железы, различных кожных заболеваниях, а также при ожогах
Кроме всего
прочего он по праву считается элементом красоты. В Древнем Китае (около 1500 г
до н. э.) женщины втирали в кожу лица жемчуг, который очень богат этим
микроэлементом. Такая косметическая процедура придавала коже здоровый вид и
неповторимый блеск. Это не удивительно, ведь он улучшает вид и цвет кожи,
принимает активное участие в переработке жирных кислот, влияя тем самым на
процессы регенерации. Измельченный жемчуг использовался для изготовления
косметики — теней, пудры, помады. Невероятно, но многие китаянки по сегодняшний
день едят порошок из жемчуга или пользуются косметикой с его экстрактом
Внимание вопрос, какой это металл? (Ответ: Цинк)
9. Инки называли этот металл
«Слезы Солнца». Считалось, что этот металл – подарок людям от Бога Солнца.
Тогда украшения из этого металла носили чисто эстетическое и религиозное
значение, финансовой силы они не имели. В
древнем Египте его считали кожей/плотью Богов. В частности, Бога Солнца Ра. По
этой причине данный металл был доступен только фараонам, членам их семьи и
священнослужителям. Камеры, в которых располагали саркофаг царя, называли «дом
….» Греки считали, что этот металл – плотное сочетание воды и солнечного
света.
Внимание вопрос, какой это металл? (Ответ: Золото)
10.Внимание! Черный ящик.
В России с 1818 г. по 1881 г. существовал налог на хлорид этого металла. После его отмены стоимость его в течение нескольких лет снизилась втрое, а потребление увеличилось в несколько раз
В средние века цена его была настолько высока, что она играла роль денег, как и другие ценные предметы. До XIX века в России существовал обычай «угощения водяного». Его задабривали для того, чтобы он стерег рыбу в реке, не рвал сетей, обеспечивал хороший улов и спасал утопающих. Угощением служила лошадь — ее голову натирали медом и данным соединением, вывозили на середину реки и сбрасывали в воду
Внимание, вопрос, о соединении, какого металла идет речь? Что в черном ящике? (Ответ: Хлорид натрия или пищевая соль.
11. Известно, что некоторые цыганки для запугивания своих жертв используют белый порошок, который дают подержать в кулаке человеку. Через несколько минут этот порошок становиться голубым, что должно убедить клиента, что на нем порча.
Внимание вопрос, о соли какого металла идет речь? (Ответ: Медь. Это простая химическая реакция превращения безводного сульфата меди в гидрат. Безводный сульфат меди-белый порошок, который от влаги на руках становиться гидратом голубого цвета. И никакой порчи!)
12. Внимание! Черный ящик.
Первым изделием, сделанным из этого металла, была погремушка, изготовленная для французского императора Наполеона III в 50-х годах 19 столетия. Кроме того, Наполеон очень часто даровал своим самым почетным гостям ножи и вилки, сделанные из этого металла. В те времена он был столь редок, что его цена превышала цену золота.
В 1860-е годы каждая парижская модница непременно должна была иметь в своем наряде хотя бы одно украшение из этого металла, ценившегося выше серебра и золота.
Внимание, вопрос, что за металл находится в черном ящике? (Ответ: Алюминий, алюминиевая ложка)
13. Понижает кровяное давление, способен снижать стресс и значительно улучшает сон. также очень важен в метаболизме жиров, поэтому люди сильно ошибаются, когда утверждают, что молоко способствует ожирению ведет к уменьшению отложения жиров и лучшему использованию питательных веществ, содержащихся в крови. постоянная нехватка может вызвать остеопороз. У молодежи последствием станет недостаточный прирост костной ткани, а у взрослых нехватка может привести к значительному уменьшению уже имеющейся костной массы.
Внимание вопрос, о каком металле идет речь? (Ответ: Кальций)
14. Опыты, проведенные венгерскими учеными на животных, показали, что недостаток этого элемента в организме повышает предрасположенность к инфарктам. Одним собакам давали пищу, богатую солями этого элемента, другим — бедную. К концу эксперимента те собаки, в рационе которых было его мало, "заработали" инфаркт миокарда.
Внимание вопрос, о каком металле идет речь? (Ответ: Магний)
15.Выражение
«сумасшедший как шляпный мастер» объясняется тем, что шляпные мастера постоянно
подвергались воздействию соединений этого металла , использовавшихся при
изготовлении фетровых шляп, и впоследствии часто сходили с ума
Древние врачеватели при завороте кишок
больному вливали в желудок некоторое количество этого металла (200-250
граммов). Считалось, что она благодаря большому весу и подвижности должна была
пропутешествовать по хитросплетениям кишок и расправить своей тяжестью их
перекрутившиеся части
Внимание вопрос, о каком металле идет речь? (Ответ: О ртути)
16. Внимание суперблиц (один участник)
1. Он идет на сковородки, да узорные решетки, он совсем-совсем неловок, невоспитан и нековок… Он ломается, как лед и тяжел, как бегемот. Но не врун и не болтун работяга наш - ...
2. Иду на мелкую монету, в колоколах люблю звенеть, мне ставят памятник за это и знают: имя мое - ...
3. Из глины я обыкновенной, но я на редкость современный. Я не боюсь электротока, бесстрашно в воздухе лечу; служу на кухне я без срока - мне все задачи по плечу. Горжусь своим я именем: зовусь я ...
Ответы : Чугун, медь, алюминий
Дополнительный вопрос Какое вещество и почему стало причиной гибели одной из арктических экспедиций?
Внимание вопрос, О каком веществе идет речь и что это за экспедиция? (Ответ: Олово, так как им были запаяны емкости с горючим. При температуре ниже ~14°С белое олово, обладающее физическими свойствами металлов, переходит в другую аллотропную модификацию, представляющую собой порошок. Это явление называют «оловянной чумой» оно и сыграло роковую роль в судьбе экспедиции. Экспедиция английского полярного исследователя Роберта Скотта к Южному полюсу)
Игра со зрителями во время обдумывания знатоками ответа над вопросами
1) 1.Газ, без которого человечество «загнется».(кислород)
2. Основа горячительных напитков.(спирт)
3.Мы его выдыхаем (углекислый газ)
4.Его куют, пока горячо и не отходя от кассы (железо)
5.Приправа, которую просят не сыпать на раны (соль)
2)1.Из него делают кастрюли (алюминий)
2.Применяется в кондитерской промышленности (пищевая сода
3.Белим стены (известковое молоко)
4.Металл, попадающий в банковские подвалы (золото)
3) 1.Оказывается, из нее и сухим можно выйти (вода)
2.Химический элемент, в таблице Д.И.Менделеева что в переводе с латинского языка означает — «сияющий свет».(золото)
4) Центральная часть атома (ядро)
Какой газ является самым легким? (водород)
Какая формула у негашеной извести?( CaO)
Почему срез яблока постепенно начинает желтеть? (происходит процесс окисления содержащегося в яблоке железа)
5) Как называется неделимая частица? (атом)
В какой воде меньше содержание примесей: дождевой, морской, минеральной?(дождевой)
Какой элемент используется при отбеливании белья? (хлор)
Какой химический элемент преобладает в составе каменного угля? (Углерод)
6) Металл, вызывающий лихорадку. (Золото)
Самый распространённый элемент в земной коре.(Кислород)
Какой камень искали алхимики? (Философский)
Металл, который используют служители церкви для получения «святой воды». (Серебро)
7) Самое распространённое вещество на земле. (Вода)
Самый распространённый химический элемент во Вселенной.(Водород)
Самый лёгкий газ. (Водород)
При Петре I вручалась медаль за пьянство. Из чего она была сделана?(Из чугуна)
8) Из какого сплава отлиты знаменитые царь – колокол и царь – пушка в Московском Кремле? (Из бронзы)
С какой планетой связывали наши предки железо? (С Марсом)
С каким металлом наши предки связывали Солнце? (С золотом)
Какой газ используется в производстве газированной воды и при тушении пожаров. (Углекислый газ)
9) Какой главный металл электротехники? (медь).
Какой металл человек обработал первым? (медь).
10) Я дружу с человеком очень давно. Я красив, больше всего мне идёт жёлтый цвет. Меня легко повредить, так как характер у меня очень мягкий, но многие ругают меня, называют кровожадным. Никто не может обойтись без меня, когда совершает покупки, строит храмы, запускает искусственные спутники Земли. Мой небесный покровитель – Солнце. Меня называют царём металлов и металлом царей. Кто я? (Золото)
11) Я не менее красива, чем золото. Мой род древний, ему примерно 7 тыс. лет. С моей помощью 5 тыс. лет назад соорудили 147-метровыю пирамиду Хеопса. Из меня изготовили щит герою Троянской войны Ахиллу. Я очень музыкальна, у меня прекрасный голос. Я умею исцелять, без меня у человека развивается малокровие, слабость. Кто я? (Медь)
12) В древности некоторые народы ценили меня больше, чем золото.Считается, что я пришелец из космоса. Я и воин, и труженик. У меня настоящая мужская работа. Без меня человек слаб и немощен. Мой покровитель – бог войны.Кто я? (Железо)
13) В газообразном виде я оказываю сильное раздражающее действие на глаза и дыхательную систему. Я вхожу в состав некоторых гербицидов, инсектицидов и других пестицидов. Главным образом я появляюсь на свет в результате электролиза солей. Меня используют для дезинфекции воды в плавательных бассейнах. Кто я? (Хлор)
14) Я аналог азота и у нас сходные электронные конфигурации.Живу я на Кольском полуострове в залежах минералов. У меня есть несколько братьев – аллотропных модификаций. Один брат принимает активное участие при изготовлении спичек. Меня постоянно приглашают поучаствовать в получении дымовых завес. Кто я? (Фосфор)
15) Если отбросить первую букву в названии химического элемента, то он превращается в напиток; если изменить первую – в другой химический элемент; а если изменить третью букву – в церковь. Назовите эти элементы, напиток и церковь. Бром-ром-хром-храм
II .Музыкальная пауза
Во время музыкальной паузы зрители участвуют в тайном голосовании на номинацию «Лучший игрок ».
III. Награждение победителя
IV.Подведение итогов игры
Учитель: Благодарю всех за работу! Надеюсь, полученные знания пригодятся вам в дальнейшей учебе и в повседневной жизни.
Спасибо за внимание!
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.