
Электролиз
 Электролиз – это окислительно-восстановительная
реакция, которая протекает под действием электрического тока на
электродах, погруженных в раствор или расплав электролита.
Электролиз – это окислительно-восстановительная
реакция, которая протекает под действием электрического тока на
электродах, погруженных в раствор или расплав электролита.
Существует два типа электродов.
Анод – это электрод, на котором происходит окисление.
Катод – это электрод, на котором происходит восстановление.
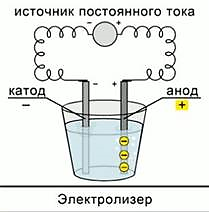
К аноду стремятся анионы, так как он имеет положительный заряд. К катоду стремятся катионы, потому что он заряжен отрицательно и, согласно законам физики, разноименные заряды притягиваются. В любом электрохимическом процессе присутствуют оба электрода. Прибор, в котором осуществляется электролиз, называется электролизер (рис. 1).
Рис. 1. Электролиз расплава
Процессы, происходящие при электролизе расплавов электролитов
В расплавах электролиты диссоциируют на ионы. Это термическая диссоциация электролитов. При пропускании электрического тока катионы восстанавливаются на катоде, так как принимают от него электроны. Анионы кислотного остатка и гидроксид-анионы окисляются на катоде, так как отдают ему свои электроны.
Пример № 1. Электролиз расплава хлорида натрия
При термической диссоциации хлорида натрия образуются ионы натрия и хлора.
NaCl → Na+ + Cl−
· на катоде выделяется натрий: 2Na+ + 2e− → 2Na
· на аноде выделяется хлор: 2Cl− − 2e− → Cl2
· суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2)
2Na+ + 2Cl− → 2Na0 + Cl02
·
суммарная
реакция: 2NaCl ![]() 2Na
+ Cl2
2Na
+ Cl2
Пример № 2. Электролиз расплава гидроксида калия
При диссоциации гидроксида калия образуются ионы калия и гидроксид ионы.
КОН → К+ + ОН−
· на катоде выделяется калий: К+ + 1e− → К
· на аноде выделяется кислород и вода: 4ОН− − 4e− → О2 + 2Н2О
· суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 4)
4К+ + 4ОН− → 4К0 + О2 + 2Н2О
·
суммарная
реакция: 4КОН ![]() 4К0 +
О2 + 2Н2О
4К0 +
О2 + 2Н2О
Пример № 3. Электролиз расплава сульфата натрия
При диссоциации расплава сульфата натрия образуются ионы натрия и сульфат-ионы.
Na2SO4 → 2Na+ + SО42−
· на катоде выделяется натрий: Na+ + 1e− → Na
· на аноде выделяется кислород и оксид серы (VI): 2SО42− − 4e− → 2SО3 + О2
· суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 4)
4Na+ + 2SО42− → 4Na 0 + 2SО3 + О2
·
суммарная
реакция: 2Na2SO4 ![]() 4Na0 +
2SО3 + О2
4Na0 +
2SО3 + О2
Закономерности электролиза расплавов электролита
1. При электролизе расплавов щелочей и солей на катоде осаждается металл.
2. Анионы бескислородных кислот окисляются на аноде, давая соответствующее соединение, например, хлорид-анионы образуют хлор.
3. Анионы кислородсодержащих кислот образуют соответствующий оксид и кислород.
Электролиз раствора
Процессы, происходящие при электролизе растворов электролитов
При электролизе растворов электролитов, кроме интересующих нас соединений есть еще и вода, которая также может подвергаться электролизу. Поэтому, исходя из строения соединения, электролиз может протекать либо с ионами соли, либо с водой.
Процессы, происходящие на катоде
1. Катионы активных металлов, стоящие в ряду напряжений до алюминия, не разряжаются на катоде (см. рис. 2). В этом случае происходит только восстановление воды: 2Н2О + 2e− → Н2 + 2ОН−

Рис. 2
2. Катионы металлов, расположенных в ряду напряжений от алюминия до водорода, разряжаются в той или иной степени одновременно с молекулами воды. При этом одновременно происходят следующие процессы:
Men+ + ne- → Me 2Н2О + 2e− → Н2 + 2ОН−
3. При наличии в растворе катионов металлов, расположенных в ряду напряжений после водорода, на катоде, прежде всего, происходит восстановление катионов этих металлов: Men+ + ne- → Me
Процессы, происходящие на аноде
Различают два типа анодов: инертный и активный. Инертный анод – это анод, материал которого не окисляется в процессе электролиза (Pt). Активный анод – это анод, который окисляется в процессе электролиза. Например, графит.
Электролиз с инертным анодом
В анодном процессе могут принимать участие анионы некоторых бескислородных кислот Cl-, Br-, I-, S2- и гидроксид-ионы ОН- (разряжаются только эти анионы), например:
2Br- − 2е- → Br2; 4ОН− − 4e− → О2 + 2Н2О (в щелочной среде)
Если в растворе присутствуют анионы F-, SO2-4, NO-3, PO43-, CO32- и некоторые другие, то окислению подвергается только вода: 2Н2О - 4e− → О2 + 4Н+ (в нейтральной и кислой среде)
Электролиз с активным анодом
В случае с активным анодом, число конкурирующих окислительных процессов увеличивается до трех:
· Электрохимическое окисление материала анода
· Окисление воды с выделением кислорода
· Окисление анионов растворенного соединения
Написание таких процессов рассматривается в высшей школе.
Примеры написания уравнений электролиза
Пример № 1. Электролиз раствора хлорида натрия
При диссоциации хлорида натрия образуются ионы натрия и хлора: NaCl → Na+ + Cl−
· Катодный процесс: 2Н2О + 2e− → Н2 + 2ОН−
· Анодный процесс: 2Cl− − 2e− → Cl2
· суммарное ионное уравнение реакции: 2Н2О + 2Cl− → Н2 + 2ОН−+ Cl02
·
суммарная
реакция: 2Н2О +2NaCl ![]() 2NaОН
+ Cl2↑ + Н2↑
2NaОН
+ Cl2↑ + Н2↑
По этой реакции получается гидроксид натрия и хлор.
Пример № 2. Электролиз раствора сульфата меди (II).
· на катоде выделяется медь: Сu2+ + 2e− → Cu0
· на аноде выделяется кислород: 2Н2О - 4 e− → О2 + 4Н+
· суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2)
2Сu2+ + 2Н2О → 2Cu0+ О2 + 4Н+
·
суммарная
реакция: 2CuSO4 + 2Н2О ![]() 2Cu0 +
О2 + 2H2SO4
2Cu0 +
О2 + 2H2SO4
Пример № 3. Электролиз раствора нитрата калия
При диссоциации нитрата калия образуются ионы калия и нитрат-ионы: КNO3 → К+ + NО3−
· Катодный процесс: 2Н2О + 2e− → Н2 + 2ОН−
· Анодный процесс: 2Н2О - 4e− → О2 + 4Н+
· суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2)
2Н2О ![]() О2↑
+ 2Н2↑
О2↑
+ 2Н2↑
Это один из способов получения водорода.
Электролиз находит применение во многих отраслях промышленности: химической, металлургии, для изготовления деталей требуемой формы, для электрохимического покрытия металлов.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.