
федеральное государственное бюджетное образовательное учреждение
высшего образования
«Мичуринский государственный аграрный университет»
Центр – колледж прикладных квалификаций
Утвержден
Решением учебно-методической
комиссии центра - колледжа
прикладных квалификаций
ФГБОУ ВО Мичуринский ГАУ
протокол № 8
от «21» апреля 2021г
Фонд оценочных средств
дисциплины
ЕН.03 ХИМИЯ
программы подготовки специалистов среднего звена (ППССЗ)
по специальности 19.02.05 Технология бродильных производств и виноделие
Базовая подготовка
Мичуринск- 2021
1. Паспорт фонда оценочных средств3
2. Результаты освоения учебной дисциплины, подлежащие проверке6
3. Оценка освоения учебной дисциплины……15
3.1. Формы и методы оценивания15
3.2. Типовые задания для оценки освоения учебной дисциплины.. 23
4. ФОС для итоговой аттестации по учебной дисциплине37
5. Методические указания по выполнению самостоятельных работ………..57
6. Приложения. Задания для оценки освоения дисциплины……………… 108
1. Паспорт фонда оценочных средств
В результате освоения учебной дисциплины ЕН.03Химия обучающийся должен обладать предусмотренными ФГОС по специальности СПО 19.02.05 Технология бродильных производств и виноделие следующими умениями, знаниями, которые формируют профессиональные и общие компетенции:
У1. Применять основные законы химии для решения задач в области профессиональной деятельности;
У2. Использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса; У3. Описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов;
У4. Проводить расчеты по химическим формулам и уравнениям реакции;
У5. Использовать лабораторную посуду и оборудование;
У6. Выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру;
У7. Проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений;
У8. Выполнять количественные расчеты состава вещества по результатам измерений;
У9. Соблюдать правила техники безопасности при работе в химической лаборатории.
З1. Основные понятия и законы химии;
З2. Теоретические основы органической, физической, коллоидной химии;
З 3. Понятие химической кинетики и катализа;
З4. Классификацию химических реакций и закономерности их протекания;
З5. Обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов;
З 6. Окислительно-восстановительные реакции, реакции ионного обмена;
З7. Гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах;
З8. Тепловой эффект химических реакций, термохимические уравнения;
З9. Характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции;
З10. Свойства растворов и коллоидных систем высокомолекулярных соединений;
З11. Дисперсные и коллоидные системы пищевых продуктов;
З12. Роль и характеристики поверхностных явлений в природных и технологических процессах;
З13. Основы аналитической химии;
З14. Основные методы классического количественного и физико-химического анализа;
З15. Назначение и правила использования лабораторного оборудования и аппаратуры;
З16. Методы и технику выполнения химических анализов;
З 17. Приемы безопасной работы в химической лаборатории.
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес;
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество;
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность;
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития;
ОК 5. Использование информационно - коммуникационных технологий в профессиональной деятельности;
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями;
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения заданий;
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации;
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности;
ОК 10. Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей)
ПК 1.1. Проводить подготовительные работы в производстве спирта и ликероводочной продукции.
ПК 1.2. Вести технологический процесс производства этилового спирта из пищевого сырья.
ПК 1.3. Вести технологический процесс производства ликероводочных изделий.
ПК 1.4. Контролировать параметры и качество технологического производства спирта и ликероводочных изделий.
ПК 1.5. Эксплуатировать оборудование для производства спирта и ликероводочных изделий.
ПК 2.1. Проводить подготовительные работы в виноделии.
ПК 2.2. Вести технологический процесс производства виноматериалов.
ПК 2.3. Вести технологические процессы производства готовой продукции виноделия (виноградных, шампанских и плодово-ягодных вин, коньяков, соков, концентратов).
ПК 2.4. Контролировать параметры и качество технологического производства продукции виноделия.
ПК 2.5. Фасовать и транспортировать готовую продукцию виноделия.
ПК 2.6. Эксплуатировать оборудование для виноделия.
ПК 3.1. Проводить подготовительные работы в производстве пива и безалкогольных напитков.
ПК 3.2. Вести технологический процесс производства пива.
ПК 3.3. Вести технологический процесс производства безалкогольных напитков.
ПК 3.4. Контролировать параметры и качество технологического производства пива и безалкогольных напитков.
ПК 3.5. Эксплуатировать оборудование для производства пива и безалкогольных напитков.
Формой аттестации по учебной дисциплине является экзамен.
2. Результаты освоения учебной дисциплины, подлежащие проверке
2.1. В результате аттестации по учебной дисциплине осуществляется комплексная проверка следующих умений и знаний:
Таблица 1.1
|
Результаты обучения: умения, знания |
Показатели оценки результата
|
Форма контроля и оценивания |
|
Уметь: |
|
|
|
У1. Применять основные законы химии для решения задач в области профессиональной деятельности |
Выполнение упражнений на составление структурных формул изомеров и названий их по номенклатуре ИЮПАК в органических веществах. Решение расчетных задач по выходу продукта. Нахождение эмпирических формул. Определение массовой доли вещества. Осуществление генетической цепочки превращений классов органических веществ. |
устный опрос, письменная проверка, практическая проверка, контрольная работа, экзамен |
|
У2. Использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса |
Определение углерода и водорода в органическом веществе. Исследование свойств непредельных углеводородов, кислородосодержащих и биоорганических соединений. Выполнение экспериментальных задач по распознаванию и получению веществ. Определение вязкости и поверхностного натяжения жидкостей. Исследование кинетики набухания полимеров. Получение коллоидных систем. |
Устный опрос, тестирование, практическая проверка, контрольная работа, экзамен |
|
У3. Описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов |
Вычисление тепловых эффектов химических реакций по технохимическому уравнению. Составление термохимического уравнения. Систематизация знаний получения кислородосодержащих и биоорганических веществ. |
устный опрос письменная проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, практическая проверка, контрольная работа ,экзамен |
|
У4. Проводить расчеты по химическим формулам и уравнениям реакции |
Решение расчетных задач на установление формулы и строения вещества по продуктам его сгорания. Вычисление массы продукта реакции при условии, что одно вещество взято в избытке. Вычисление величины произведения растворимости и растворимости для бинарных соединений. Решение задач на определение концентрации растворов. Вычисление водородного показателя, концентрации ионов водорода и гидроксид-ионов. |
устный опрос письменная проверка, практическая проверка, тестирование, контрольная работа , экзамен |
|
У5. Использовать лабораторную посуду и оборудование |
Пользование лабораторной посудой и оборудованием согласно их назначению.
|
устный опрос систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
У6. Выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру |
Применение различных приёмов и способов титрования. Подбор реактивов и аппаратуры для титрования: прямого, обратного и титрования заместителем. |
устный опрос, письменная проверка, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
У7. Проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений |
Определение бинарных соединений. Анализ соли, растворимой в воде. Выполнение аналитических реакций катионов и анионов. Проведение качественных реакций на многоатомные спирты, альдегиды, оксикислоты, белки, алкены.
|
устный опрос, письменная проверка, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, тестирование, экзамен. |
|
У8. Выполнять количественные расчеты состава вещества по результатам измерений |
Взвешивания на аналитических весах. Определение влажности и зольности. Приготовление растворов заданной концентрации. Определение массовой доли элемента в составе комплексной соли. Определение кислотности сырья. Определение жёсткости воды из различных источников трилонометрическим методом. Статистическая обработка результатов анализа.
|
устный опрос, письменная проверка, практическая проверка, наблюдение за деятельностью обучающегося в процессе лабораторной работы, тестирование, экзамен. |
|
У9. Соблюдать правила техники безопасности при работе в химической лаборатории |
Соблюдение тишины, порядка, аккуратное проведение лабораторных работ. Аккуратное обращение с химическими реактивами и химической посудой. Экономное расходование электроэнергии, воды, реактивов. Проведение опытов с ядовитыми веществами в вытяжном шкафу. Соблюдение мер предосторожности при работе со взрывоопасными и легковоспломеняющимися веществами.
|
Устный опрос, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы |
|
Знать: |
|
|
|
З1. Основные понятия и законы химии |
Определение основных понятий и законов. Понимание основных понятий: моль, химические элементы, валентность. Воспроизведение основных законов: закон сохранения массы при химических реакциях, закон постоянства, закон эквивалентов, закон Авогадро.
|
устный опрос, письменная проверка, практическая проверка, экзамен |
|
З2. Теоретические основы органической, физической, коллоидной химии |
Доказательство влияния строения молекул на свойства органических соединений. Воспроизведение теории химического строения органических соединений А.М. Бутлерова. Описание алгоритма номенклатуры органических соединений. Определение органических веществ по функциональным группам. Понимание значения физических и коллоидных законов в развитии пищевых технологий и в осуществлении мероприятий по охране окружающей среды.
|
устный опрос, письменная проверка, практическая проверка тестирование, контрольная работа, экзамен |
|
З 3. Понятие химической кинетики и катализа |
Воспроизведение понятия химической кинетики. Объяснение факторов влияющих на скорость химической реакции. Перечисление видов катализа. Понимание ферментативного катализа. |
устный опрос, письменная проверка, тестирование, экзамен |
|
З4. Классификацию химических реакций и закономерности их протекания |
Понимание классификации химических реакций: по степени окисления, по числу и составу исходных и образующих веществ, по тепловому эффекту. Написание уравнений химических реакций. |
устный опрос, письменная проверка, практическая проверка, тестирование, экзамен |
|
З5. Обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов |
Понимание различий химических реакций по признаку обратимости. Объяснение смещения равновесия в зависимости от условий определяемых принципом Ле Шателье. Понимание значения константы равновесия. Обоснование факторов влияющих на скорость химической реакции: от природы реагирующий веществ, от концентрации, от поверхности реагирующих веществ, температуры, от присутствия некоторых веществ ( катализаторов или ингибиторов).
|
устный опрос, письменная проверка, практическая проверка, тестирование, экзамен |
|
З 6. Окислительно-восстановительные реакции, реакции ионного обмена |
Воспроизведение понятий: окислитель, восстановитель, процесс окисления и восстановления. Понимание механизма окислительно-восстановительных реакций. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Написание полных и сокращенных ионных реакций.
|
устный опрос, письменная проверка, практическая проверка тестирование, контрольная работа, зачет |
|
З7. Гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах |
Определение гидролиза солей. Сравнение гидролиза солей, образованных слабой кислотой и сильным основанием, гидролиза солей сильной кислотой и слабым основанием, гидролиза слабых кислот и слабых оснований. Объяснение их диссоциации. Определение сильных и слабых электролитов. Определение кислотности среды индикаторами. |
устный опрос, письменная проверка, практическая проверка тестирование, контрольная работа, экзамен |
|
З8. Тепловой эффект химических реакций, термохимические уравнения |
Понимание термохимического закона Гесса. Обоснование принципа составления термохимических уравнений и расчёты по ним. Вычисление тепловых эффектов химических реакций. Определение направления самопроизвольного протекания процессов. |
устный опрос, письменная проверка, практическая проверка, контрольная работа, экзамен |
|
З9. Характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции |
Определение гомологического ряда, изомерии, номенклатуры, свойств, применения, значения различных классов органических веществ. Понимание значения белковых веществ, липидов, углеводов, витаминов, пищевых добавок, входящих в состав сырья пищевой продукции.
|
устный опрос, письменная проверка, практическая проверка, контрольная работа, экзамен |
|
З10. Свойства растворов и коллоидных систем высокомолекулярных соединений |
Определение растворам диффузии и осмоса. Воспроизведение формулы вычисления температуры замерзания и кипения.
|
устный опрос, письменная проверка, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
З11. Дисперсные и коллоидные системы пищевых продуктов |
Воспроизведение классификации дисперсных систем. Перечисление способов получения, очистки и свойства коллоидных систем. Понимание электрокинетических явлений. Строение двойного электрического слоя. Воспроизведение понятий коагуляция золей, порог коагуляции. Понимание строения мицеллы гидрозоля. Составление формул и схем мицелл. |
устный опрос, письменная проверка, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
З12. Роль и характеристики поверхностных явлений в природных и технологических процессах |
Воспроизведение свойств растворов коллоидных поверхностно-активных веществ. Понимание практического значения растворов коллоидных ПАВ. Перечисление различных видов адсорбции. |
устный опрос, письменная проверка, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
З13. Основы аналитической химии
|
Применение закона действующих масс к аналитическим реакциям. Обоснование химико-аналитических свойств ионов и их соединений периодическим законом и периодической системой элементов Д.И. Менделеева. Воспроизведение классификации ионов по группам. Использование в целях анализа реакции кислотно-основных взаимодействий, окислительно-восстановительных реакций, реакций комплексообразования. Понимание химического равновесия в гомогенных и гетерогенных системах. Вычисление молярной массы эквивалента окислителей и восстановителей. Воспроизведение состава, строения, номенклатуры комплексных соединений. |
устный опрос, письменная проверка, практическая проверка, тестирование, экзамен. |
|
З14. Основные методы классического количественного и физико-химического анализа |
Изложение классификации методов классического количественного анализа. Описание операций гравиметрического метода. Выделение основных положений титриметрического анализа. Приготовление стандартных и рабочих растворов. Перечисление способов выражения концентрации растворов в титриметрическом анализе. Вычисление навески для приготовления раствора заданной концентрации, титра и молярной концентрации эквивалента рабочих растворов. Обоснование выбора индикатора для кислотно-основного титрования. Определение эквивалента перманганата калия в различных средах. Экспериментальное изучение окислительно-восстановительных свойств веществ. Определение восстановителя и окислителя в методах редоксиметрии. Воспроизведение условий определения общей жесткости воды трилонометрическим методом. Понимание значения инструментальных и физико-химических методов анализа. Объяснение устройства и принципа действия рефрактометра и поляриметра и работа на них. Обоснование сущности потенциометрического метода анализа, области применения. Понимание теоретических основ хроматографии и овладение техникой ионообменной хроматографии.
|
устный опрос, письменная проверка, тестирование, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, контрольная работа, экзамен |
|
З15. Назначение и правила использования лабораторного оборудования и аппаратуры |
Понимание назначения и правил использования лабораторного оборудования и аппаратуры: бюретки, сушильного шкафа, рН-метра аналитических весов, поляриметра-сахариметра, рефрактометра, вискозиметра.
|
устный опрос, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
З16. Методы и технику выполнения химических анализов |
Сравнение методов химического анализа: макро-, полумикро-, микрометоды. Обоснование наиболее приемлемого метода анализа в лаборатории. Понимание значения ультромикрометода химических, физико-химических и физических методов анализа.
|
устный опрос, письменная проверка, практическая проверка, систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы, экзамен |
|
З 17. Приемы безопасной работы в химической лаборатории |
Понимание и воспроизведение приемов безопасности в химической лаборатории.
|
устный опрос, практическая проверка систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы. |
2.2. В результате аттестации по учебной дисциплине осуществляется проверка динамики формирования общих компетенций:
Таблица 1.2
|
Общие компетенции, которые возможно сгруппировать для проверки |
Показатели оценки результата |
|
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес |
– участие во внеурочной деятельности (олимпиадах, конкурсах, неделях ПЦК, празднике «Студенческая весна»); – систематическая подготовка к практическим занятиям; – оформление портфолио |
|
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество |
– точное выполнение требований преподавателя; – рациональное планирование этапов деятельности; – оптимальный выбор методов и способов выполнения практических и самострельных работ |
|
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность |
– объективная оценка деятельности обучающихся в процессе учебной деятельности; – проведение своевременного контроля и корректировки деятельности в соответствии с методическими указаниями |
|
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития |
– целесообразное использование разнообразных источников информации, включая Интернет, при подготовке к практическим занятиям, написании докладов, сообщений и т.д. |
|
ОК 5. Использование информационно - коммуникационных технологий в профессиональной деятельности |
– подготовка презентаций к теоретическим и практическим занятиям; – оформление результатов деятельности с применением ИКТ в соответствии с нормативными документами, использование портфолио; – разработка проектов, связанных с профессиональной и учебной деятельностью обучающихся; – участие обучающихся в учебной исследовательской деятельности |
|
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями |
– корректное взаимодействие с обучающимися, коллегами в процессе учебной деятельности; – соблюдение норм этикета и профессиональной деятельности; – оценка презентации проекта; – самостоятельное групповое оценивание; – рейтинговая система оценки; – открытая защита творческих работ; – лабораторно – практический контроль; – использование портфолио |
|
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения заданий |
– контроль результатов работы обучающихся в малых группах; – рефлексия и саморефлексия обучающихся |
|
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации |
– лист индивидуальных достижений; – презентации исследовательских проектов; – оформление презентаций; – оформление результатов работы в виде газет, сборников задач; – открытые защиты творческих и проектных работ; – взаимооценка и самооценка работ обучающимися |
|
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности |
– разработка и защита докладов, сообщений, презентаций в соответствии с изменяющимися технологиями; – участие в фестивалях творческих проектов; – участие в конкурсах, олимпиадах; – участие в предметных неделях |
|
ОК 10. Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей) |
– подготовка презентаций, видеороликов ко Дню защитников отечества, Дню победы с использованием портфолио; – конкурс творческих работ, посвящённых Дням воинской славы |
3. Оценка освоения учебной дисциплины:
3.1. Формы и методы оценивания
Предметом оценки служат умения и знания, предусмотренные ФГОС СПО специальности 19.02.05 Технология бродильных производств и виноделие по дисциплине ЕН.03Химия, направленные на формирование общих и профессиональных компетенций.
Текущий контроль знаний и промежуточная аттестация является основным механизмом оценки качества подготовки обучающихся. Текущий контроль успеваемости обучающихся представляет собой объективную оценку степени и качества освоения программы дисциплины. Цель текущего контроля успеваемости:
- обеспечение максимальной эффективности образовательного процесса;
- оценка уровня освоения дисциплин, междисциплинарных курсов;
- оценка компетенций обучающихся;
- стимулирование деятельности обучающихся;
- систематизация контроля за качеством подготовки специалистов;
- подготовка к промежуточной аттестации.
Текущий контроль успеваемости проводится на любом из видов учебных занятий, в пределах учебного времени, отведенного на дисциплину.
Основными формами текущего контроля являются:
устный опрос на теоретических, практических и лабораторных занятиях;
проверка выполнения письменных домашних заданий и расчетно-графических работ;
контрольные и самостоятельные работы;
тестирование по разным уровням сложности;
контроль самостоятельной работы (в письменной или устной форме);
другие активные и интерактивные формы и методы контроля.
Формы текущего контроля выбираются, исходя из специфики учебной группы, темы и типа занятия.
Результаты оцениваются по 5-бальной системе: 5 (отлично), 4 (хорошо), 3 (удовлетворительно), 2 (неудовлетворительно).
Оценка освоения дисциплины предусматривает использование рейтинговой системы оценивания. Модульно-рейтинговая система обучения и оценки успеваемости обучающихся представляет собой комплексную систему поэтапного оценивания уровня освоения основной образовательной программы по специальности. При функционировании модульно-рейтинговой системы обучения проводится регулярная оценка знаний и умений обучающихся в течение семестра. При функционировании модульно-рейтинговой системы обучения все знания, умения и навыки, приобретаемые обучающимися в процессе изучения дисциплины, оценивается в рейтинговых баллах. Рейтинговые баллы набираются в течение всего периода обучения по дисциплине и фиксируются путем занесения в единую экзаменационно - зачетную ведомость при рубежном и итоговом контроле. Промежуточный рейтинг дисциплины составляет 50 баллов.
Промежуточный рейтинг включает в себя:
1) рейтинг обучающихся за 1 модуль – 20 баллов;
2) рейтинг обучающихся за 2 модуль – 20 баллов;
3) рейтинг поощрительный (творческий балл) – 10 баллов.
Рубежный (модульный) контроль по дисциплине проводится в форме тестовых заданий и контрольной работы.
По окончании каждого семестра на основании оценок текущего контроля знаний и умений по учебной дисциплине выставляются итоговые оценки успеваемости, которые являются основанием для допуска к экзамену.
|
Контроль и оценка освоения учебной дисциплины по темам (разделам) Таблица 2.2 |
||||||
|
Элемент учебной дисциплины |
Формы и методы контроля |
|||||
|
Текущий контроль |
Рубежный контроль |
Промежуточная аттестация |
||||
|
Форма контроля |
Проверяемые ОК, У, З |
Форма контроля |
Проверяемые ОК, У, З |
Форма контроля |
Проверяемые ОК, У, З |
|
|
Раздел 1 Органическая химия |
|
|
Контрольная работа №1/тестовые задания Контрольная работа №2/тестовые задания
|
У1, У2,У4, У8 З1, З2, З 4,З9, ОК 1, ОК 2, ОК 3, ОК5, ОК6, ОК7, ОК8 |
Экзамен
|
У1, У2,У3, У4, У7,У8, З1, З2, З3, З4, З5, З6, З7, З8, З9, З10, З11, З12, З15,З17 ОК 1, ОК 2, ОК 3 ОК4, ОК5, ОК6, ОК7, ОК8, ОК9. |
|
Тема 1.1. Углеводороды |
Устный опрос Лабораторная работа №1 Лабораторная работа №2 Письменная проверка Практическая проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Тестирование Самостоятельная работа |
У1, У2,У3, У5, У9, З1, 32, 39,315,316, ОК 1, ОК 2, ОК3, ОК6,ОК7 |
|
|
|
|
|
Тема 1. 2.Производные углеводородов |
Устный опрос Лабораторная работа №3 Лабораторная работа №4 Лабораторная работа №5 Лабораторная работа №6 Лабораторная работа №7 Лабораторная работа №8 Лабораторная работа №9 Письменная проверка Практическая проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Тестирование Самостоятельная работа |
У1, У2,У3, У4,У6, У7,У9, З1, 32, З4,39,315,317, ОК 1, ОК 2, ОК3, ОК5ОК6,ОК7 |
|
|
|
|
|
Тема1.3. Биоорганические соединения |
Устный опрос Лабораторная работа №10 Лабораторная работа №11 Лабораторная работа №12 Лабораторная работа №13 Лабораторная работа №14 Лабораторная работа №15 Лабораторная работа №16 Лабораторная работа №17 Письменная проверка Практическая проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Тестирование Самостоятельная работа |
У1, У2,У3, У4,У7, У8,У9, З1, 32, 39,315,316, ОК 1, ОК 2, ОК4, ОК5ОК6,ОК7 |
|
|
|
|
|
Раздел 2 Физическая и коллоидная химия |
|
|
Контрольная работа №2/тестовые задания
|
У1, У2,У4, У8 З1, З2, З 4,З9, ОК 1, ОК 2, ОК 3, ОК5, ОК6, ОК7, ОК8
|
Экзамен |
У1, У2,У3, У4, У7,У8, З1, З2, З3, З4, З5, З6, З7, З8, З9, З10, З11, З12, З15,З17 ОК 1, ОК 2, ОК 3 ОК4, ОК5, ОК6, ОК7, ОК8, ОК9. |
|
Тема 2.1. Молекулярно-кинетическая теория агрегатного состояния вещества. Растворы |
Устный опрос Лабораторная работа №18 Лабораторная работа №19 Письменная проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Практическая проверка Самостоятельная работа |
У1, У2,У3, У4,У5, З1, 32, З3,З4З9,315, 316, З17 ОК 1, ОК2 ОК3, ОК4, ОК8 |
|
|
|
|
|
Тема 2.2 Основы химической термодинамики |
Устный опрос Письменная проверка Самостоятельная работа Практическая проверка
|
У1, У4,У8, З 1,З2,З3, ОК 1, ОК 2, ОК4, ОК8,ОК9 |
|
|
|
|
|
Тема 2.3. Химическая кинетика. Катализ |
Устный опрос Письменная проверка Самостоятельная работа |
У1, У4,У8 З 1,З2,З3, ОК 1, ОК2, ОК 4, ОК8, |
|
|
|
|
|
Тема 2.4. Растворы высокомолекулярных соединений
|
Устный опрос Лабораторная работа №20 Лабораторная работа №21 Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Письменная проверка Практическая проверка Самостоятельная работа |
У1, У2,У3, У4, З1, 32, З9,315, 316, З17 ОК 1, ОК2 ОК3, ОК4, ОК8 |
|
|
|
|
|
Тема 2.5. Дисперсные и коллоидные системы пищевых продуктов |
Устный опрос Лабораторная работа №22 Лабораторная работа №23 Лабораторная работа №24 Лабораторная работа №25 Письменная проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Самостоятельная работа |
У1, У2,У3, У4,У5, З1, 32, З3,З10, З11,315, 316, З17 ОК 1, ОК2 ОК3, ОК4, ОК6,ОК8 |
|
|
|
|
|
Тема 2.6.Роль и характеристики поверхностных явлений в природных и технологических процессах
|
Устный опрос Лабораторная работа №26 Лабораторная работа №27 Письменная проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Самостоятельная работа |
У1, У2,У3, У5,У6, З1, 32,З5,З7,315, 316, З17 ОК 1, ОК2 ОК3, ОК4, ОК6, Ок7,ОК8 |
|
|
|
|
|
Раздел 3 Аналитическая химия
|
|
|
Контрольная работа №3 Контрольная работа №4 |
У1, У2,У4, У8 З1, З2, З 4,З9, ОК 1, ОК 2, ОК 3, ОК5, ОК6, ОК7, ОК8
|
Экзамен |
У1, У2,У3, У4, У7,У8, З1, З2, З3, З4, З5, З6, З7, З8, З9, З10, З11, З12, З15,З17 ОК 1, ОК 2, ОК 3 ОК4, ОК5, ОК6, ОК7, ОК8, ОК9.
|
|
Тема 3.1. Теоретические основы аналитической химии |
Устный опрос Письменная проверка Практическая проверка Тестирование Самостоятельная работа |
У1, У4,У8 З1, З3,З4,З5,З6, З7, З13 ОК 1, ОК2, ОК3, ОК4,,ОК5, ОК6, ОК7, ОК8, ОК 9 |
|
|
|
|
|
Тема 3.2 Качественный анализ |
Устный опрос Лабораторная работа №28 Лабораторная работа №29 Лабораторная работа №30 Лабораторная работа №31 Лабораторная работа №32 Лабораторная работа №33 Лабораторная работа №34 Лабораторная работа №35 Лабораторная работа №36 Лабораторная работа №37 Тестирование Письменная проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Самостоятельная работа |
У1,У4,У5,У6,У7,У8,У9 З 1, З6, З7,З14,З15,З16, З17 ОК 1, ОК 2, ОК 3, ОК 4, ОК5, ОК6, ОК 8, ОК 9 |
|
|
|
|
|
Тема 3.3. Количественный анализ |
Устный опрос Лабораторная работа №38 Лабораторная работа №39 Лабораторная работа №40 Лабораторная работа №41 Лабораторная работа №42 Лабораторная работа №43 Лабораторная работа №44 Лабораторная работа №45 Лабораторная работа №46 Лабораторная работа №47 Лабораторная работа №48 Лабораторная работа № 49 Лабораторная работа № 50 Лабораторная работа №51 Лабораторная работа № 52 Лабораторная работа №53 Лабораторная работа № 54 Лабораторная работа № 55 Лабораторная работа № 56 Лабораторная работа № 57 Лабораторная работа № 58 Лабораторная работа № 59 Лабораторная работа № 60 Лабораторная работа №61 Лабораторная работа №62 Тестирование Письменная проверка Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Самостоятельная работа |
У1,У4,У5,У6,У7,У8,У9 З 1, З6, З7,З14,З15,З16, З17 ОК 1, ОК 2, ОК 3, ОК 4, ОК5, ОК6, ОК 8, ОК 9 |
|
|
|
|
|
Тема 3.4. Физико-химические методы анализа |
Устный опрос Лабораторная работа №63 Лабораторная работа №64 Лабораторная работа № 65 Лабораторная работа № 66 Лабораторная работа № 67 Лабораторная работа № 68 Лабораторная работа № 69 Лабораторная работа № 70 Лабораторная работа №71 Систематическое наблюдение за деятельностью обучающегося в процессе лабораторной работы Самостоятельная работа
|
У1,У4,У5,У6,У7,У8,У9 З 1, З6, З7,З14,З15,З16, З17 ОК 1, ОК 2, ОК 3, ОК 4, ОК5, ОК6, ОК 8, ОК 9 |
|
|
|
|
3.2. Типовые задания для оценки освоения учебной дисциплины
3.2.1. Типовые задания для оценки знаний З1, З2, З 4,З9
умений У1, У2,У4, У8 (рубежный контроль).
1) Тестовые задания М-1
Вариант 1
1. Вещество состава С2Н6 относится к
а) аренам б) алкинам в) алканам г) алкенам
2. Гомологом этилена является
а) пропан б) пропен в ) пропин г) пропанол
3. Изомером 2, 2-димитилпропана является
а) 2,2-димитилбутан б) 2-метилбутан в) н-пентан г) циклопропан
4. С каким из веществ хлор вступает в реакцию замещения только на свету
а) этилен б) бензол в) метан г) ацетилен
5. Уксусный альдегид НЕ вступает в реакцию с
а) H2O б) Ag2O в) H2 г) NaOH
6. Гидроксид (II) меди является реактивом на
а) уксусную кислоту б) глицерин в) фенол г) диэтиловый эфир
7. Следующие признаки: sр-гибридизация, длина углерод-углеродной связи 0,120 нм, угол связи 180° характерны для молекулы:
а) Бензола б) Этана в) Этина г) Этена
8. Установите соответствие между структурной формулой вещества и названием гомологического ряда, к которому оно принадлежит
ФОРМУЛА ВЕЩЕТВА ГОМОЛОГИЧЕСКИЙ РЯД
А) НС≡СН 1) алкадиены
Б) СН3=СН-СН=СН2 2) алканы
В) СН3-СН2-СН2-СН3 3) арены
Г) С6Н6 4) алкены
5) алкины
9. Сложный эфир можно получить взаимодействием
1) муравьиной кислоты и бензола 2) серной кислоты и ацетальдегида
3) азотной кислоты и щелочи 4) бутановой кислоты и этанола
10. Число и вид
химических связей в молекуле этана С2Н6:
А. 1б и
6π В. 6б и 1π
Б. 7б Г. 2б и 6π
11. Название вещества, формула которого СН2—СН—СНз
│ │
СН3 СНз
А.3-Метилбутан В. 1,2-Диметилпропан
Б. 2-Метилбутан Г. 2,3-Диметилпропан
12.Вещество,
для которого не характерна реакция гидрирования:
а) Пропен б) Пропан в)
Этин г) Этен
13.Формула вещества X в цепочке превращений
t +Н2,Ni
СН4 → X ---→ С2Н4
а) С02 б) С2Н2 в)С3Н8 г)С2Н6
14. Для получения углеводорода с более длинной углеродной цепью применяют реакцию:
а) Вюрца в) Кучерова
б) Зайцева г) Марковникова
15. Формулы
веществ, вступающих в реакцию друг с другом:
а) С2Н4 и СН4 в) СбН6
и Н20 б) С3Н8и Н2 г) С2Н4 и Н2
16. Молекулярная
формула углеводорода с относительной молекулярной массой 58:
а) С4Н10 б)
С5Н10 в)С5Н12
г)С4Н8
17.Общая формула СnН2n соответствует:
А.
Алканам В.Алкинам
Б. Алкенам Г. Аренам
18. Установите соответствие между исходными веществами и продуктом реакции
ИСХОДНЫЕ ВЕЩЕСТВА ОСНОВНОЙ ПРОДУКТ РЕАКЦИИ
А) CH2 = CH – CH3 + НBr → 1) CH2Br – CH2 – CH3
Б) C2H5Br + NaOH(спирт.р.) → 2) CH3 – CHBr – CH3
B) CH3Br + Na → 3) CH2Br – CH2Br 5) C2H4
Г) C2H4 + Br2 → 4) CHBr2 – CH3 6) C2H6
Вариант 2
1. Общей формуле СnH2n-2 соответствует состав вещества
а) метан б) ацетилен в) этилен г) бензол
2. Гомологом бензола является
а) толуол б) глицерин в) анилин г) фенол
3. Изомером бутановой кислоты является
а) бутанол б) пентановая кислота в) бутаналь г) 2-метилпропановая кислота
4. При гидрировании алкенов образуются
а) алканы б) алкены в) алкадиены г) спирты
5. Уксусная кислота вступает в реакцию с
а) Na2CO3 б) C2H4 в) AgNO3 г) NaCl
6. Раствор перманганата калия обесцвечивается при взаимодействии с
а) этиленом б) метанолом в) бензолом г) метаном
7. Структурная формула вещества 2 – метилпентен – 1 - это
1) СН3 – СН(СН3) – СН2 – СН = СН2 2) СН3 – СН2 – СН2 – С(СН3) = СН2
3) СН2 = С(СН3) – СН2 – СН(СН3) – СН3 4) СН2 = С(СН3) – СН3
8. Установите соответствие между названием вещества и классом органических соединений, к которому оно относится
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) гексан 1) углеводы
Б) глюкоза 2) альдегиды
В) глицерин 3) ароматические углеводороды
Г) бензол 4) многоатомные спирты
5) предельные углеводороды
9. В результате гидролиза жиров можно получить
1) этиленгликоль 2) глюкозу 3) глицерин
4) стеариновую кислоту 5) пропанол-1 6) бутановую кислоту
10. Электронная
конфигурация наружного электронного слоя атома углерода в стационарном
состоянии:
А.2s22р2 В.2 s12р3 В.2s22р3 Г. 2s 22р4
11. Число и вид
химических связей в молекуле ацетилена С2Н2:
А.
1б и 4 π В. 2 б и 3 π Б. 3б и 2 π Г. 5 б
12. Следующие
признаки: sр2-гибридизация, длина углерод-углеродной
связи 0,134 нм,
угол
связи 120° характерны для молекулы:
А. Бензола Б. Этана В. Этина Г. Этена
13.Тип химической связи между атомами углерода в молекуле
вещества, формула которого
С2Н6:
А. Одинарная Б. Двойная В. Тройная
14. Термин
«органическая химия» ввел:
А. И.
Берцелиус В. А. Кекуле
Б. А. Бутлеров Г. Д. Менделеев
15. Молекулярная
формула углеводорода с относительной молекулярной массой 56:
А.С4Н10
Б.С4Н8 В.С4Н6 Г.С3Н8
16. Вещество X в цепочке превращений
Рt, t +НС1
С3Н8 → СН2=СН-СН3 → X:
А. 1,2-Дихлорпропан В. 2- Хлорпропан Б. 2,2-Дихлорпропан Г. 1-Хлорпропан
17. Вещество состава CH3-COOH относится к
а) спиртам в) альдегидам в) простым эфирам г) карбоновым кислотам
18. Установите соответствие между типом реакции и исходными веществами
ТИП РЕАКЦИИ ИСХОДНЫЕ ВЕЩЕСТВА
А) реакция замещения 1) С6Н6 + Br2 → (в присутствии FeBr3)
Б) реакция присоединения 2) C3H6 + Br2 →
В) реакция окисления 3) C3H8 →
Г) реакция дегидрирования 4) C6H5CH3 + KMnO4 → (при нагревании)
Вариант 3
1. Вещество состава C2H2 относится к
а) алканам б) алкенам в) циклоалканам г) алкинам
2. Гомологом пропаналя является
а) пропан б) уксусная кислота в) уксусный альдегид г) бутанол
3. Изомером бутанола-1 является
а) пропанол-1 б) бутанол-2 в) 2-метилбутанол-1 г) пентанол-2
4. При дегидратации спиртов образуются
а) альдегиды б) алкены в) алканы г) карбоновые кислоты
5. Фенол вступает в реакцию с
а) NaCl б) NaOH в) Na2CO3 г) H2CO3
6. Оксид серебра в растворе аммиака является реактивом на
а) фенолы б) спирты в) альдегиды г) карбоновые кислоты
7. Этаналь и формальдегид
1) изомеры 2) гомологи 3) одно и тоже вещество 4) разные спирты
8. Установите соответствие между структурной формулой вещества и названием гомологического ряда, к которому оно принадлежит
ФОРМУЛА ВЕЩЕТВА ГОМОЛОГИЧЕСКИЙ РЯД
А) НСНО 1) спирты
Б) СН3СООСН3 2) альдегиды
В) С6Н5ОН 3) простые эфиры
Г) СН3СН2СООН 4) фенолы
5) сложные эфиры
6) карбоновые кислоты
9.Электронная конфигурация наружного электронного слоя
атома углерода в возбужденном
состоянии:
А.3s23р2 В.3s13рЗ Б. 2 s 22р2 Г. 2 s12р3
10. Формула вещества X в цепочке превращений
С2Н5ОН → Х → СН3 -СН2 -Cl
А. С2Н2 В. С2Н6 Б. С2Н4 Г. С3Н6
11. Присоединение воды к
ацетилену называется реакцией:
А.
Вюрца В. Кучерова Б. Зайцева Г.
Марковникова
12. Формулы веществ, вступающих в реакцию
друг с другом:
А.С2Н6 и НCl В. С6Н6 и Н2О Б. С2Н4 и Cl2 Г.
С2Н6 и Н2О
13. Вещество, для
которого характерна реакция гидратации:
А. Бутан В. Циклопентан
Б. Полипропилен
Г. Этилен
14.Структурная формула вещества 2 – метилпропен - это
1) СН3 – СН(СН3) – СН2 – СН = СН2 2) СН3 – СН2 – СН2 – С(СН3) = СН2
3) СН2 = С(СН3) – СН2 – СН(СН3) – СН3 4) СН2 = С(СН3) – СН3
15.Следующие признаки: sр-гибридизация, длина углерод-углеродной связи 0,154 нм, угол связи 109°281 характерны для молекулы:
А. Бензола Б. Этана В. Этина Г. Этена
16. Функциональная
группа —NН2, характерна для класса
соединений:
А.
Альдегидов В. Карбоновых кислот
Б. Аминов Г. Спиртов
17.Молекулярная формула углеводорода с относительной
молекулярной массой 54:
А.С4Н10
Б.С4Н8 В.С4Н6 Г.С3Н8
18. Установите соответствие между исходными веществами и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) С2Н6 → 1) → СО2 + 2Н2О
Б) С2Н6 + Cl2 → 2) → CH3Cl + HCl
B) CH4 + 2Cl2 → 3) → C2H4 + H2 5) → C2H5Cl + HCl
Г) C4H10 → 4) → CH2Cl2 + 2HCl 6) → C2H6 + C2H4
Вариант 4
1. Общей формуле Сn H2n+1 OH соответствует состав вещества
а) этаналь б) этанол в) этановая кислота г) этиленгликоль
2. Гомологом этанола является
а) пропанол б) метаналь в) глицерин г) толуол
3. Изомером 2-метилпропана является
а) 2-метилппропен-1 б) бутадиен-1,3 в) н-бутан г) н-пентан
4. И бутан, и бутен-1 реагируют с
а) хлороводородом б) раствором KMnO4 в) водородом г) хлором
5. Этаналь вступает в реакцию с
а) CuSO4 б) Cu(OH)2 в) CuO г) CuCl2
6. Бромную воду обесцвечивает
а) метанол б) этан в) бензол г) ацетилен
7. Этин и ацетилен – это
1) гомологи 2) изомеры 3) одно и тоже вещество
8. Установите соответствие между названием вещества и общей формулой его гомологического ряда
НАЗВАНИЕ ВЕЩЕСТВА ОБЩАЯ ФОРМУЛА
А) метилбензол 1) CnH2n+2
Б) 2, 2-диметилпентан 2) CnH2n
В) циклогексан 3) CnH2n-2
Г) бутадиен-1,3 4) CnH2n-1
5) CnH2n-6
9.Молекулярная формула углеводорода с
относительной молекулярной массой 40:
А.С2Н2 Б.СзН4 В.С4Н6
Г. С5Н8
10.Формула вещества X в цепочке превращений
СН4 → С2Н2 →Х
А. Бензол В. Толуол Б. Гексан Г. Циклогексан
11.При составлении
уравнения реакции отщепления галогеноводорода используют правило:
А.
Вюрца В. Кучерова Б. Зайцева Г.
Марковникова
12. Функциональная группа — СООН соответствует классу соединений:
А. Альдегидов В. Карбоновых кислот Б. Аминов Г. Спиртов
13. Уксусная кислота образуется при взаимодействии этаналя с
1) этанолом 2) аммиачным раствором оксида серебра 3) водородом 4) водой
14 Вещество СН2 – СН2 – СН2 – СН – СН2 – СН2 называется
│ │ │
СН3 СН3 СН3
1) 1,4,6 – тримемилгексан 2) 1,3,6 – триметилгексан
3) 1,3 – диметилгептан 4) 4 – метилоктан
15. Алкины не вступают в реакцию
1) гидрирования 2) галогенирования 3) дегидратации 4) гидратации
16. В схеме превращений СН4 → Х → С6Н6 веществом Х является
1) С2Н6 2) С2Н4 3) С2Н2 4) С6Н12
17. Этиловый спирт вступает в реакцию с
а) NaOH б) NaCl в) Cu(OH)2 г) Na
18. Установите соответствие между типом реакции и исходными веществами
ТИП РЕАКЦИИ ИСХОДНЫЕ ВЕЩЕСТВА
А) реакция замещения 1) С6Н6 + Br2 → (при условии hν)
Б) реакция присоединения 2) C3H6 →
В) реакция окисления 3) C3H8 + Br2 →
Г) реакция дегидрирования 4) C4H8 + KMnO4 + Н2О →
Бальная оценка заданий
Задания с №1- №7, №9-№17 оцениваются в 1 балл
Задание №8 и №18 оцениваются в 2 балла
Итого: 20 баллов
Таблица перевода баллов в оценки:
|
Баллы |
Оценка |
|
1 – 8 |
2 (неудовлетворительно) |
|
9 – 12 |
3 (удовлетворительно) |
|
13 – 17 |
4 (хорошо) |
|
18 – 20 |
5 (отлично) |
3.2.2. Типовые задания для оценки знаний З1, З2, З 4, З9, умений У1, У2,У4, У8 (рубежный контроль).
3.2.2. Типовые задания для оценки знаний З1, З2, З 4, З9, умений У1, У2,У4, У8 (рубежный контроль).
Тестовые задания М-2
Вариант 1.
1. Молекулярная формула крахмала
1) С 6Н 12О 6 2) С 12Н 22О11 3) (С 6Н10О5)n 4) С 2Н 5ОН
2. При полном гидролизе крахмала образуется:
1) фруктоза 2) рибоза 3) галактоза 4) глюкоза
3. Какое из веществ не подвергается гидролизу
1) крахмал 2) сахароза 3) глюкоза 4) целлюлоза
4. Вещество с наивысшим содержанием крахмала
1) картофель 2) рис 3) мед 4) древесина
5. Жир образуется в результате взаимодействия
1) стеариновой кислоты и метанола 2) глицерина и пальмитиновой кислоты
3) ацетальдегида и глицерина 4) олеиновой кислоты и этиленгликоля
6. Качественной реакцией на глюкозу является реакция с:
1) Cu(OH)2 2) FeCl3 3) I2(спирт раствор) 4) CuO
7. Фруктозу иначе называют:
1) молочным сахаром 2) фруктовым сахаром 3) инвертным сахаром г) тростниковым сахаром.
8. Гидролизу не подвергается углевод:
1) сахароза 2) лактоза 3) фруктоза 4) крахмал.
9. В состав углеводов входят функциональные группы:
1) –СООН и – NH2 2)–СОН и –ОH 3)–СООН и – NО2 4) – NH2 и - ОН
10. Среди перечисленных моносахаридов укажите альдогексозу:
1) глюкоза 2) фруктоза 3) рибоза 4) дезоксирибоза.
11.Образование пептидной связи происходит при взаимодействии глицина с …
1) гидроксидом калия 2) пропанолом 3)аланином 4) хлороводородом
12. Количество теплоты, которое
выделяется или поглощается в результате протекания химической реакции при
постоянной температуре, называется …
1) тепловым эффектом 2) энергией активации 3)теплотой
сгорания 4) энергией химической связи
13. Метод исследования жидких растворов нелетучих веществ, основанный на понижении температуры замерзания раствора по сравнению с чистым растворителем, называется …
1)эбуллиоскопией 2) хроматографией 3) потенциометрией 4) криоскопией
14. Согласно правилу Вант-Гоффа,
при повышении температуры на 10 °C скорость большинства
химических реакций …
1) уменьшается в 2–4 раза 2) увеличивается в 2–4 раз
3) уменьшается в 3–6 раз 4) увеличивается в 3–6 раз
15. Вещества, которые увеличивают скорость реакции называются …
1)катализаторами 2)ингибиторами 3)активаторами 4)промоторами
16. Во сколько раз возрастет скорость химической реакции при повышении температуры на 60°С, если температурный коэффициент γ=2?
1) в 12 раз 2) в 32 раза 3) в 64 раза 4) в 84 раза
17.Односторонний переход растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется …
1) осмосом 2) диффузией 3) электрофорезом 4) сольватацией
18. Термохимическое уравнение C6H12O6+6H2O=6CO2+6H2O +2800 кДж соответствует процессу:
1) эндотермическому 2)экзотермическому
3)политермическому 4)экстенсивному
19. Согласно термохимическому уравнению: СН4 + 2О2 → СО2 + 2Н2О +893кДж
для получения 1786 кДж теплоты необходимо затратить ______ литров метана (н.у)
1)22,4 2) 66 3)44,8л 4) 11,2
20. Соотнесите:
углевод: : формула:
1) пентоза 1) (С6Н10О5)n
2) альдогексоза 2) С6Н12О6
3) кетогексоза 3) С12Н22О11
4) дисахарид 4) С5Н10О5
5) полисахарид
Вариант 2.
1. Молекулярная формула целлюлозы
1) С 6Н 12О 6 2) С 12Н 22О11 3) (С 6Н10О5)n 4) С 2Н 5ОН
2. При гидролизе целлюлозы образуется
1) сахароза С 12Н 22О11 2) крахмал (С 6Н10О5)n
3) глюкоза С 6Н 12О 6 4) оксид углерода(IV) CO2
3. Вещество с наибольшим содержанием целлюлозы
1) солома 2) мед 3) дерево 4) хлопок
4. Чем отличаются α- и β- формы глюкозы
1) наличием цикла 2 ) размером цикла
3) расположением гидроксильной группы при С 1 4) числом атомов кислорода в цикле
5. Жир образуется в результате взаимодействия
1) стеариновой кислоты и метанола 2) олеиновой кислоты и этиленгликоля
3) ацетальдегида и глицерина 4) глицерина и олеиновой кислоты
6. Качественной реакцией на крахмал является реакция с:
1) Cu(OH)2 2) FeCl3 3) I2(спиртраствор) 4) CuO
7. Сахарозу иначе называют:
1) молочным сахаром 2) фруктовым сахаром 3) инвертным сахаром
4) тростниковым сахаром.
8. Среди перечисленных моносахаридов укажите кетогексозу:
1) глюкоза 2) фруктоза 3) рибоза 4) дезоксирибоза.
9. Вещество, формула
которого С6Н5-СН2-СН(СООН)- NH2 относится к
классу …
1)аминокислот 2)фенолов 3) карбоновых кислот 4)
ароматических аминов
10.К синтетическим волокнам относится …
|
1)капрон 2)
хлопок 3)вискоза 4) шерсть 1) возрастает 2)понижается 3) остается неизменным 4) и понижается, и возрастает |
|||||||
|
12. Метод исследования жидких растворов нелетучих веществ, основанный на повышении температуры кипения раствора по сравнению с чистым растворителем, называется … 1) эбуллиоскопией 2)криоскопией 3) хроматографией 4)спектроскопией 13. Вещества, которые замедляют скорость реакции, называются … 1) активаторами 2) катализаторами 3)ингибиторами 4)промоторами 14.Скорость реакции 2А+Б = В+Г можно записать выражением, если считать, что реакция идет в одну стадию: 1)v =k [Б] 2) v = k[А]²*[Б] 3) v = k [А]*[Б] 4)v = k[А]² 15. Согласно термохимическому уравнению С + 2Н2 → СН4 – 147,8кДж для получения 10 л метана
необходимо затратить ______ кДж теплоты.
16. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 30 °C до 50 °C скорость реакции … 1)увеличивается в 4
раза 2) уменьшается в 2 раза 3) уменьшается в 4 раза 4) увеличивается
в 2 раза 17.Укажите вид данной реакции: NH3(r)+HCI(r)=NH4CI(т), ∆H > 0 1) ионная 2) гетерогенная 3) каталитическая 4) гомогенная 18. Термохимическое уравнение С + 2Н2 → СН4 – 147,8кДж соответствует процессу: 1) эндотермическому 2)экзотермическому 3)политермическому 4)экстенсивному 19. Природным полимером является: а) полиэтилен б) сахароза в) глюкоза г) крахмал |
|||||||
20 . Соотнесите:
название: формула:
1) лактоза 1) С5Н10О5
2) фруктоза 2) С6Н12О6
3) рибоза 3) С12Н22О11
4) крахмал 4) (С6Н10О5)n
5) глюкоза
Вариант 3.
1. Молекулярная формула сахарозы
1) С 6Н 12О 6 2) С 12Н 22О11 3) (С 6Н10О5)n 4) С 2Н 5ОН
2. Изомером глюкозы является:
1) фруктоза 2) рибоза 3) крахмал 4) целлюлоза
3. При полном гидролизе крахмала образуется:
1) фруктоза 2) рибоза 3) галактоза 4) глюкоза
4. Какое из веществ не подвергается гидролизу
1) крахмал 2) сахароза 3) глюкоза 4) целлюлоза
5. Вещество с наивысшим содержанием крахмала
1) картофель 2) рис 3) мед 4) древесина
6. Жир образуется в результате взаимодействия
1) стеариновой кислоты и метанола 2) олеиновой кислоты и этиленгликоля
3) глицерина и стеариновой кислоты 4) ацетальдегида и глицерина
7. Качественной реакцией на глюкозу является реакция с:
1) CuO 2) FeCl3 3) I2(раствор) 4г) Ag2O(амм)
8. Глюкозу иначе называют:
1) молочным сахаром 2) виноградным сахаром 3) инвертным сахаром
4) тростниковым сахаром.
9. Гидролизу не подвергается углевод:
1) сахароза 2) лактоза 3) глюкоза 4) крахмал.
10. Общая формула углеводов условно принята:
1) СnH2nOn 2) СnH2nOm 3) СnH2mOm 4) Сn (H2O)m
11. К невосстанавливающим дисахаридам относится:
1) мальтоза 2)целлобиоза 3)лактоза 4) сахароза
12. Искусственное волокно,
получаемое из целлюлозы, называется …
1) вискозой 2) лавсаном
3) лайкрой 4) нитроном
13. Для аминокислот характерны функциональные группы …
1) –СООН и – NО2 2) –СООН и –ОH 3)–СООН и – NH2 4) – NH2 и – ОН
14. При увеличении температуры
скорость большинства химических реакций …
1)увеличивается 2) уменьшается 3) остается
неизменной 4) может и уменьшаться, и увеличиваться
15. При понижении температуры растворимость газообразных веществ в воде, как правило, …
1) не изменяется 2) изменяется незначительно 3) понижается 4) повышается
16. Укажите вид данной реакции: 4AI(т)+3O2(r)=2AI2O3(т), ∆H<0
1) гомогенная 2) гетерогенная 3) каталитическая 4) ионная
1) в 12 раз 2) в 6 раз 3) в 9 раз 4) в 18 раз
18. Для реакции А2(г) + В2(г) → 2АВ2(г) зависимость скорости реакции от концентрации реагентов описывается уравнением …
1) υ = к*[А2]*[В2] 2) υ = к*[А2]2*[В2]2 3)υ = к*[А2]2 4)υ = к*[А2]2*[В2]
19. Согласно закону Гесса теплота химической реакции не зависит от путей перехода, а зависит только от:
1)начального и конечного состояния в-в 2)агрегатного состояния в-в
3)условий протекания реакций 4)изменения внутренней энергии
20. Установите соответствие между формулой и названием органического вещества.
ФОРМУЛА ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА
А) С5Н10О5 1) глюкоза
Б) (С6Н10О5)n 2) сахароза
В) С12Н22О11 3) целлюлоза
Г) СН2ОН(СНОН)4СОН 4) рибоза
Бальная оценка заданий
Каждое задание оценивается в 1 балл
Итого: 20 баллов
Таблица перевода баллов в оценки:
|
Баллы |
Оценка |
|
1 – 8 |
2 (неудовлетворительно) |
|
9 – 12 |
3 (удовлетворительно) |
|
13 – 17 |
4 (хорошо) |
|
18 – 20 |
5 (отлично) |
3.2.3. Типовые задания для оценки знаний З1, З2, З 4,З9, умений У1, У2,У4, У8, (рубежный контроль).
Контрольная работа М-3
Вариант 1
1. Предмет и методы аналитической химии.
2. Напишите уравнение гидролиза для Na2S и укажите реакцию среды.
3. Расставьте коэффициенты в уравнении реакции. Определите окислитель и восстановитель:
Cu + HNO3(конц) = Cu(NO3)2 + NO2 + H2O
4. Напишите какая будет среда раствора (нейтральная, кислая или щелочная), если в растворе рН= 3,0; рОН= 13,0; рН = 7,0; рН = 10,0; рОН = 5,0
5. Выбор величины навески для анализа вещества.
Вариант 2
1. Степень электролитической диссоциации. От каких факторов она зависит? Сильные и слабые электролиты.
2. Расставьте коэффициенты в уравнении реакции. Определите окислитель и восстановитель:
PbO2 + HCl = PbCl2 + Cl2 + H2O
3. Назовите комплексное соединение [Cr(H2O)6]Cl3 и укажите: комплексообразователь, лиганды, координационное число, внутреннюю сферу, ионы внешней сферы, константу нестойкости комплексного иона.
4. Особенности гидролиза. Напишите уравнение гидролиза для К2СО3, укажите реакцию среды.
5. Перечислите условия осаждения кристаллических веществ.
Вариант 3.
1. Что называется константой диссоциации? Напишите выражение константой диссоциации для следующих электролитов: H2SO4, NH4OH
2. Концентрация ионов водорода в растворе 0,001 г-ион/л. Чему равен гидроксидный показатель?
3. Какие соли подвергаются гидролизу? Напишите уравнение гидролиза для FeCl2.
4. Расставьте коэффициенты в уравнении реакции. Определите окислитель и восстановитель
Cu + HNO3(разб) = Cu(NO3)2 + NO + H2O
5. Отбор средней пробы вещества и подготовка ее к анализу.
Вариант 4.
1. Требования предъявляемы к аналитическим реакциям.
2. Что такое рН и что характеризует эта величина? Чему равна [H+] раствора, если [OH-] равна 10-11 г-ион/л.
3. Назовите комплексное соединение Na3[Co(NO2)6] и укажите: комплексообразователь, лиганды, координационное число, внутреннюю сферу, ионы внешней сферы, константу нестойкости комплексного иона.
4. Произведение растворимости BaSO4 1*10-10. Вычислить растворимость соли в воде в моль/литр и г/литр.
5. Сущность гравиметрического анализа, область его применения.
Вариант 5.
1. Особенности аналитических реакций и способы их выполнения.
2. Назовите комплексное соединение [Cr(H2O)6]Cl3 и укажите: комплексообразователь, лиганды, координационное число, внутреннюю сферу, ионы внешней сферы, константу нестойкости комплексного иона.
3. Что такое гидролиз? Напишите уравнение гидролиза для (NH4)2SO4, укажите реакцию среды.
4. Расставьте коэффициенты в уравнении реакции. Определите окислитель и восстановитель:
P + HNO3(конц) = H3PO4 + NO2 + H2O
5. Произведение растворимости. Условия образования осадков.
Бальная оценка заданий
1. 3 балла
2. 4 балла
3. 4 балла
4. 5 баллов
5. 4 баллов
Итого: 20 баллов
Таблица перевода баллов в оценки:
|
Баллы |
Оценка |
|
1 – 8 |
2 (неудовлетворительно) |
|
9 – 12 |
3 (удовлетворительно) |
|
13 – 17 |
4 (хорошо) |
|
18 – 20 |
5 (отлично) |
|
|
3.2.4. Типовые задания для оценки знаний З1, З2, З 4,З9, умений У1, У2,У4, У8 (рубежный контроль).
Контрольная работа М-4
Вариант 1
1. Как приготовить рабочий раствор для метода перманганатометрии?
2. Сколько миллилитров НNO3 с r= 1,246 необходимо взять для приготовления
250 мл 0,1 н раствора?
3. Найти титр 0,05 н раствора КОН.
4. Составьте уравнение реакции и вычислить по нему эквиваленты окислителя и восстановителя:
КMnO4 + КJ + HCl ®
5. Определить ТКMnO4/Fe, если на титрование 20 мл 0,1 н щавелевой кислоты пошло 24 мл КMnO4.
Вариант 2
1. Что такое стандартные растворы? Приведите примеры. Каковы требования предъявляют к исходным веществам?
2. Вычислите титр и нормальность раствора серной кислоты с r = 1,395.
3. Какую навеску щавелевой кислоты следует взять для приготовления 25 мл 0,05 н раствора?
4. Составить уравнение реакции и вычислить эквиваленты окислителя и восстановителя:
КMnO4 + КNO2 + H2SO4 ®
5. Сколько % Fe содержит железная проволока, если по растворении 1,4 г ее без доступа воздуха в H2SO4 и разбавлении до 250 мл водой на титрование 25 мл полученного раствора FeSO4 пошло 24,85 мл 0,1 н раствора КMnO4?
Вариант 3
1. В чем отличия титриметрического анализа от гравиметрического?
2. Найти титр 0,02 н раствора соляной кислоты.
3. Что такое точка эквивалентности и как ее определяют?
4. Составить уравнение реакции взаимодействия Na2C2O4 c KMnO4 в кислой среде. Определить эквивалент Na2C2O4.
5. На титрование 10 мл раствора соли Мора израсходовано 12 мл KMnO4 , титр которого по железу равен 0,005585 г/мл. Определить %-ное содержание железа в соли Мора, если была взята навеска соли Мора 3,351 г и растворена в колбе на 100 мл.
Вариант 4
1. Как приготовить рабочий раствор щелочи?
2. Сколько миллилитров КОН с r = 1,176 необходимо взять, чтобы приготовить 250 мл 0,1 н раствора?
3. Сколько граммов карбоната натрия потребуется для приготовления 500 мл 0,1 н раствора?
4. Определить г-эквивалент окислителя и восстановителя, расставить коэффициенты в уравнении реакции:
КMnO4 + НNO2 + H2SO4 ® НNO3 + MnSO4 + K2SO4 + H2O
5. Для установки титра раствора KMnO4 взята навеска 1,654 г (NH4)2C2O4*H2O и растворена в мерной колбе на 250 мл. На титрование 25 мл этого раствора израсходовано 23,85 мл KMnO4. Определить нормальность раствора KMnO4.
Бальная оценка заданий
1. 2 балла
2. 4 балла
3. 3 балла
4. 5 балла
5. 6 баллов
Итого: 20 баллов
Таблица перевода баллов в оценки:
|
Баллы |
Оценка |
|
1 – 8 |
2 (неудовлетворительно) |
|
9 – 12 |
3 (удовлетворительно) |
|
13 – 17 |
4 (хорошо) |
|
18 – 20 |
5 (отлично) |
4. ФОС материалов для итоговой аттестации по учебной дисциплине
Предметом оценки являются умения и знания. Контроль и оценка осуществляются с использованием следующих форм и методов: устный опрос, систематическое наблюдение за деятельностью обучающегося в процессе практической работы, практическая проверка, письменная проверка, тестирование, контрольная работа, проверка выполнения расчетно-графических работ, экзамен.
Оценка освоения дисциплины предусматривает использование рейтинговой системы оценивания и проведение экзамена.
Начисление баллов итогового рейтинга осуществляется по результатам сдачи обучающимся экзамена. При выставлении балла экзаменационного рейтинга преподаватель руководствуется следующей шкалой соответствия:
0 – 17 баллов соответствуют 0 - 34% положительного ответа на предложенное задание (билет);
18 – 24 балла соответствуют 35% - 49% положительного ответа на предложенное задание (билет);
25 – 37 балла соответствуют 50% - 74% положительного ответа на предложенное задание (билет);
38 – 50 баллов соответствуют 75% - 100% положительного ответа на предложенное задание (билет).
Итоговая оценка знаний обучающихся по дисциплине определяется на основании перевода итогового рейтинга (сумма промежуточного и экзаменационного рейтингов) в 5-балльную оценку по следующей шкале:
· оценка «удовлетворительно» - от 35 до 49 баллов;
· оценка «хорошо» - от 50 до 74 баллов;
· оценка «отлично» - от 75 до 100 баллов.
Получение обучающимся итогового рейтинга ниже 35 баллов соответствует оценке «неудовлетворительно».
I. ПАСПОРТ
Назначение:
ФОС предназначен для контроля и оценки результатов освоения учебной дисциплины ЕН.03Химия по специальности СПО 19.02.05 Технология бродильных производств и виноделие.
Умения
У1. Применять основные законы химии для решения задач в области профессиональной деятельности;
У2. Использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса; У3. Описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов;
У4. Проводить расчеты по химическим формулам и уравнениям реакции;
У5. Использовать лабораторную посуду и оборудование;
У6. Выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру;
У7. Проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений;
У8. Выполнять количественные расчеты состава вещества по результатам измерений;
У9. Соблюдать правила техники безопасности при работе в химической лаборатории.
Знания
З1. Основные понятия и законы химии;
З2. Теоретические основы органической, физической, коллоидной химии;
З 3. Понятие химической кинетики и катализа;
З4. Классификацию химических реакций и закономерности их протекания;
З5. Обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов;
З 6. Окислительно-восстановительные реакции, реакции ионного обмена;
З7. Гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах;
З8. Тепловой эффект химических реакций, термохимические уравнения;
З9. Характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции;
З10. Свойства растворов и коллоидных систем высокомолекулярных соединений;
З11. Дисперсные и коллоидные системы пищевых продуктов;
З12. Роль и характеристики поверхностных явлений в природных и технологических процессах;
З13. Основы аналитической химии;
З14. Основные методы классического количественного и физико-химического анализа;
З15. Назначение и правила использования лабораторного оборудования и аппаратуры;
З16. Методы и технику выполнения химических анализов;
З 17. Приемы безопасной работы в химической лаборатории.
Дисциплина изучается в течение двух семестров, по окончании каждого из которых предусмотрена промежуточная аттестация в форме экзамена.
II. ЗАДАНИЕ ДЛЯ ЭКЗАМЕНУЮЩЕГОСЯ. Вариант № 1 – 25
1 семестр
Вариант 1
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Краткий исторический очерк развития органической химии. Классификация органических соединений. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2.Общая характеристика основных агрегатных состояний вещества. (ПК 1.1-1.5; ПК 2.1-2.4, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.При брожении глюкозы образовалось 133 г этилового спирта. Сколько литров СО2, измеренного при н.у. при этом образовалось? (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 2
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Теория строения органических веществ А.М. Бутлерова. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2.Предмет физической и коллоидной химии. Значение ее в развитии технологии пищевых производств и в осуществлении мероприятий по охране окружающей среды (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.При какой, приблизительно, температуре будет замерзать водный 15 %-ный раствор метанола СН3ОН? ККр=1,86. (ПК 1.1-1.5; ПК 4.1-4.4, ОК 1-9)
Вариант 3
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Предельные углеводороды (алканы): строение, общая формула, гомологический ряд, изомерия и номенклатура. Получение, физические и химические свойства. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Газообразное состояние вещества. Идеальные и реальные газы. Сжижжение газов. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Написать уравнение реакции, взаимодействия глюкозы с этиловым спиртом, используя формулу Хеуорса. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9 )
Вариант 4
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Алкены: строение, общая формула, гомологический ряд, изомерия и номенклатура. Получение, физические и химические свойства(ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Жидкое состояние вещества. Общая характеристика. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Определите выход молочной кислоты, если при брожении 200 г глюкозы образовалось 120 г. кислоты. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 5
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Алкины: строение, общая формула, гомологический ряд, изомерия и номенклатура. Получение, физические и химические свойства. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Поверхностное натяжение жидкости и методы его определения. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Вычислите осмотическое давление при 250С водного раствора, содержащего 225 г сахара в 5 л раствора. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 6
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Ароматические углеводороды ряда бензола. Гомологический ряд, строение, изомерия и номенклатура. Получение, физические и химические свойства. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Вязкость жидкостей. Методы определения вязкости жидкости. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Определите, сколько граммов этилового спирта образуется при брожении 90 г. глюкозы? (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 7
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Спирты. Классификация спиртов. Одноатомные спирты: общая формула, гомологический ряд, изомерия и номенклатура. Способы получения. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2Твердое состояние вещества. Кристаллические и аморфные тела. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3. Сколько энергии необходимо затратить для получения 10л метана согласно термохимическому уравнению: C + 2H2 → CH4 – 147кДж(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 8
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Одноатомные спирты. Физические и химические свойства одноатомных спиртов. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2.Основные понятия термодинамики. Первое начало термодинамики. Энтальпия. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Определить теплоту сгорания этилена, исходя из следующих данных:
QобрС2Н4 = - 62,01 кДж/моль; QобрСО2 = 394 кДж/моль ; QобрН2О = 285 кДж/моль
(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 9
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Многоатомные спирты. Свойства многоатомных спиртов. Отдельные представители: этиленгликоль, глицерин, ксилит, сорбит. Их применение в производстве пищевых продуктов. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Второе начало термодинамики (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Сколько граммов муравьиной кислоты надо взять для получения 150 г этилформиата?
(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 10
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Фенолы, их изомерия и номенклатура. Физические и химические свойства. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Термохимия. Закон Гесса. Теплоты образования и сгорания химических соединений. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.На сколько градусов повысится температура кипения, если в 100 г воды растворить 11 г мочевины СО (NH2)2? Кэб = 0,52. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 11
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Альдегиды: строение, общая формула, гомологический ряд, изомерия и номенклатура. Получение, физические и химические свойства. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Растворы. Общая характеристика. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Сколько килограммов сахарозы надо взять для получения 30 г инвертного сахара, если выход его равен 70% от возможного теоретически? (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 12
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Кетоны: строение, общая формула, гомологический ряд, изомерия и номенклатура. Получение, физические и химические свойства. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Растворы газов в жидкостях. Закон Генри. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Определите, во сколько раз увеличится скорость при повышении температуры от 300С до 500С, если температурный коэффициент реакции равен 2. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 13
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Карбоновые кислоты: классификация. Одноосновные карбоновые кислоты: общая формула, гомологический ряд, изомерия и номенклатура. Получение, физические и химические свойства. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Взаимная растворимость жидкостей. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3,ПК 4.1-4.4,ОК 1-9)
3.Какой объем водорода (н.у) может быть выделен при взаимодействии металлического натрия с 2 молем этанола?
(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 14
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Сложные эфиры. Получение. Физические и химические свойства. Пищевые эссенции. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Растворы твердых веществ в жидкостях. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.При какой температуре будет замерзать раствор, содержащий 3 г нафталина С10Н8 в 40 г бензола. Температура замерзания бензола 5,5°С. Ккр=5,1. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 15
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Оксикислоты, строение их молекул, номенклатура. Физические и химические свойства. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Диффузия и осмос в растворах. Закон Вант-Гоффа. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Осуществите превращения:
С2Н5ОН → СН3 - СОН → СН3 –СООН(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 16
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Пищевые добавки, их классификация и значение. Красители, вкусовые добавки, подслащивающие вещества, ароматизаторы; вещества, изменяющие структуру и физико-химические свойства пищевых продуктов. Представители и значение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Осмос. Практическое значение осмоса. (ПК1.1-1.5,ПК 2.1-2.3,ПК 3.1- 3.3,ПК4.1-4.4,ОК1-9)
3.Определите осмотическое давление водного раствора, содержащего 25 г глюкозы в 6 л раствора, при температуре 250С. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 17
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Аминокислоты: строение молекул, классификация. Физические и химические свойства аминокислот. Понятие о незаменимых и заменимых аминокислотах. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Катализ, его виды. Ингибиторы. Автокатализ. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Определите, какой объем углекислого газа (н.у) образуется при спиртовом брожении 300 г глюкозы? (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 18
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Состав и строение белков: первичная, вторичная, третичная и четвертичная структура белков. Свойства белков. Классификация. Биологическая ценность белков. Полноценные и неполноценные белки. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Гомогенный катализ, его стадии. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Осуществите превращения: глюконовая кислота ← глюкоза → этиловый спирт(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 19
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Ферменты, их классификация. Факторы, влияющие на активность ферментов. Роль ферментов в технологии производства продовольственных продуктов и сырья. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Гетерогенный катализ, его стадии. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Найти температуру замерзания 7%-ного водного раствора глицерина С3Н8О3.Ккр= 1,86. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 20
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Жиры. Получение. Жидкие и твердые жиры. Химические изменения в жирах, происходящих при хранении и переработке. Химические свойства жиров. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Ферментативный катализ. Значение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3,ПК 4.1-4.4,ОК 1-9)
3.Сколько граммов этилового спирта нужно взять для получения 90г. диэтилового эфира? (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 21
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Углеводы, их распространение в природе и биологическое значение. Моносахариды, их строение, таутомерия. Физические и химические свойства на примере глюкозы. Применение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2.Скорость химической реакции. Факторы, влияющие на скорость химической реакции. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Напишите схему щелочного гидролиза олеопальмитостеарина. Назовите полученные продукты. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 22
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Дисахариды, их строение. Восстанавливающие и невосстанавливающие дисахариды. Физические и химические свойства. Инверсия сахарозы. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Высокомолекулярные соединения. Природные и синтетические ВМС. Строение молекул. Свойства. Эластичность и пластичность (ПК 1.1-1.5,ПК 2.1-2.3,ПК 3.1- 3.3,ПК 4.1-4.4,ОК1-9)
3.Определить, сколько литров метана (н.у) необходимо затратить для получения 1786 кДж теплоты согласно термохимическому уравнению: СН4 + 2О2→ СО2 +2Н2О +893кДж. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 23
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Крахмал, его распространение в природе, биологическое значение, строение. Физические и химические свойства. Гликоген и инулин. (ПК1.1-1.5,ПК2.1-2.3,ПК3.1-3.3,ПК 4.1-4.4,ОК 1-9)
2. Набухание полимеров, его стадии. Набухание в технологии пищевых производств. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Сколько литров кислорода (н.у.) потребуется для полного сгорания 200г пентана? (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 24
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.Клетчатка, строение молекулы, распространение в природе. Гидролиз клетчатки. Эфиры клетчатки, их значение. Искусственные волокна.( ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Студни. Методы получения студней. Студнеобразование в биологии, пищевой промышленности. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.При какой температуре будет замерзать водный 15%-ный раствор метанола? Ккр = 1,86. (ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Вариант 25
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1.История открытия витаминов. Классификация витаминов по растворимости, основные источники витаминов. Отдельные представители и их значение. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
2. Высокомолекулярные электролиты. Белки и свойства их растворов. Изоэлектрическая точка. (ПК 1.1-1.5, ПК 2.1-2.3, ПК 3.1- 3.3, ПК 4.1-4.4,ОК 1-9)
3.Осуществите превращения: этилен →этиловый спирт → диэтиловый эфир(ПК 1.1-1.5; ПК 4.1-4.4,ОК 1-9)
Литература для обучающихся: Использование литературы на экзамене не предусматривается.
2 семестр
Вариант 1
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. История развития коллоидной химии. Коллоидные системы, их основные признаки. (ПК 1.1,ОК 1-9)
2. Приведите формулу и схему мицеллы бромида серебра, полученного при взаимодействии KBr с избытком Ag NO3. (ПК 1.1,ОК 1-9)
Вариант 2
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Предмет аналитической химии. Методы анализа вещества: физические, химические, физико-химические. (ПК 1.1,ОК 1-9)
2. На титрование 10мл 0,1н раствора щавелевой кислоты H2C2O4 пошло 9,8 мл раствора перманганата калия. Вычислите нормальность раствора перманганата калия. (ПК 1.1,ОК 1-9)
Вариант 3
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Классификация дисперсных систем: по дисперсности, межфазному взаимодействию, агрегатному состоянию. (ПК 1.1,ОК 1-9)
2. Чему равна [H+] раствора, если [OH-] равна 10-11 г-ион/л. (ПК 1.1,ОК 1-9)
Вариант 4
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Качественный химический анализ. Методы. Аналитические реакции и способы их выполнения. (ПК 1.1,ОК 1-9)
2. Составьте электронный баланс и определите эквивалент окислителя в реакции:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
(ПК 1.1,ОК 1-9)
Вариант 5
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Методы получения коллоидных систем. Стабилизаторы. (ПК 1.1,ОК 1-9 )
2. Сколько перманганата калия KMnO4 нужно взять, чтобы приготовить 0,5л 0,05н раствора,для проведения реакции в кислой среде. (ПК 1.1,ОК 1-9 )
Вариант 6
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Задачи и методы количественного анализа. Метрологические характеристики измерений (правильность, воспроизводимость и точность анализа). (ПК 1.1,ОК 1-9)
2. Напишите молекулярные и ионные уравнения реакций между растворами нитратом меди Cu(NO3)2 и гидроксидом натрия NaOH. (ПК 1.1,ОК 1-9)
Вариант 7
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Методы очистки коллоидных систем. (ПК 1.1,ОК 1-9)
2.
Приведите формулу
и схему строения мицеллы карбоната кальция,
образованного при взаимодействии Na2СО3 с избытком СаСl2. (ПК 1.1,ОК 1-9)
Вариант 8
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Сущность и операции гравиметрического (весового) анализа. Применение весового анализа в технохимическом контроле пищевых производств. (ПК 1.1,ОК 1-9)
2. Вычислить нормальность серной кислоты, если титр равен 0,0036 г/мл
(ПК 1.1,ОК 1-9)
Вариант 9
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Оптические и молекулярно-кинетические свойства коллоидных систем. (ПК 1.1,ОК 1-9)
2. Плотность раствора соляной кислоты 1,057 г/см3. Вычислите нормальность и титр этого раствора. (ПК 1.1,ОК 1-9)
Вариант 10
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Влажность. Определение влажности сырья методом высушивания.( ПК 1.1,ОК 1-9)
2. Приведите формулу и схему строения мицеллы хлорида серебра, полученного при взаимодействии NaСl с избытком AgNО3. (ПК 1.1,ОК 1-9)
Вариант 11
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Электрокинетические явления в коллоидных системах. Опыт Рейса. Электрофорез, электроосмос. (ПК 1.1,ОК 1-9)
2. Концентрация ионов водорода в растворе 10-2 г-ион/л. Чему равен водородный показатель? (ПК 1.1,ОК 1-9)
Вариант 12
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Сущность титриметрического анализа. Титрование. Точка эквивалентности. Методы анализа. Стандартные и стандартизированные растворы. (ПК 1.1,ОК 1-9)
2. Составьте электронный баланс и определите эквивалент окислителя и восстановителя в реакции:
PbO2 + HCl → PbCl2 + Cl2 + H2O
(ПК 1.1,ОК 1-9)
Вариант 13
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Коагуляция золей электролита. Правила. Применение. (ПК 1.1,ОК 1-9)
2. Напишите молекулярные и ионные уравнения реакций между растворами карбонатом натрия и соляной кислотой. (ПК 1.1,ОК 1-9)
Вариант 14
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Сущность метода нейтрализации. Индикаторы. Теория индикаторов. (ПК 1.1,ОК 1-9)
2. Приведите формулу и схему строения мицеллы карбоната кальция, полученного при взаимодействии СаС12 с избытком Na2C03. (ПК 1.1,ОК 1-9)
Вариант 15
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Суспензии, особенности, применение. (ПК 1.1,ОК 1-9)
2. Назовите комплексное соединение Fe3[Fe(CN)6] и укажите: комплексообразователь, лиганды, координационное число, внутреннюю сферу, ионы внешней сферы, константу нестойкости комплексного иона. (ПК 1.1,ОК 1-9)
Вариант 16
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Мерная посуда объемного анализа, ее назначение и правила работы с ней. Порядок титрования. (ПК 1.1,ОК 1-9)
2. Приведите формулу и схему строения мицеллы иодида серебра, полученного при взаимодействии NaI с избытком AgNO3. (ПК 1.1,ОК 1-9)
Вариант 17
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Эмульсии, их классификация, особенности, применение.( ПК 1.1,ОК 1-9)
2. Найти титр 0,02н раствора соляной кислоты.( ПК 1.1,ОК 1-9)
Вариант 18
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Приготовление 0,1 н рабочего раствора NaOH. (ПК 1.1,ОК 1-9)
2. На титрование 25 мл 0,05 н раствора NaOH пошло 24,5 мл раствора НСl. Вычислите нормальность НСl и количество НСl в 1 л. раствора.( ПК 1.1,ОК 1-9)
Вариант 19
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Пены. Пенообразование. Разрушение пен. Применение. (ПК 1.1,ОК 1-9)
2. Напишите уравнения реакций гидролиза NН4Cl и определите реакцию среды. (ПК 1.1,ОК 1-9)
Вариант 20
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Приготовление 0,1н исходного стандартного раствора на примере щавелевой кислоты. (ПК 1.1,ОК 1-9)
2. Составьте электронный баланс и рассчитайте эквивалент окислителя и восстановителя в реакции: (ПК 1.1,ОК 1-9)
H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O
Вариант 21
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Аэрозоли, их общая характеристика и свойства. Применение. (ПК 1.1,ОК 1-9)
2. Приведите формулу и схему строения мицеллы сульфата бария, полученного при взаимодействии ВаС12 с избытком Na2S04.( ПК 1.1,ОК 1-9)
Вариант 22
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Методы редоксиметрии. Перманганатометрия. Сущность метода.( ПК 1.1,ОК 1-9)
2. На нейтрализацию 25,0 мл 0,1125 н раствора серной кислоты израсходовано 28,5 мл раствора едкого калия. Какова нормальность раствора едкого калия? (ПК 1.1,ОК 1-9)
Вариант 23
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Порошки, их основные свойства, применение.( ПК 1.1,ОК 1-9)
2. На титрование 10,00 мл 0,1н раствора щавелевой кислоты Н2С2О4*2Н2О израсходовано 12,20 мл. KMnO4.Определить титр KMnO4 по железу. ЭFe= 55,85г. (ПК 1.1,ОК 1-9)
Вариант 24
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Приготовление рабочего раствора перманганата калия. Применение перманганата калия. (ПК 1.1,ОК 1-9)
2. Составьте электронный баланс и рассчитайте эквивалент окислителя и восстановителя в реакции: (ПК 1.1,ОК 1-9)
HCl + MnO2 → Cl2 + MnCl2 + H2O
Вариант 25
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Поверхностно-активные вещества, их свойства, строение.( ПК 1.1,ОК 1-9)
2. Назовите комплексное соединение Na3[Co(NO2)6] и укажите: комплексообразователь, лиганды, координационное число, внутреннюю сферу, ионы внешней сферы, константу нестойкости комплексного иона. (ПК 1.1,ОК 1-9)
Вариант 26
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Теоретические основы колориметрии. Визуальные методы колориметрии. Определение содержания меди в растворе сульфата меди методом стандартных серий. (ПК 1.1,ОК 1-9)
2. Концентрация ионов водорода в растворе 0,001 г-ион/л. Чему равен гидроксидный показатель? (ПК 1.1,ОК 1-9
Вариант 27
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Строение мицелл коллоидных ПАВ. Практическое значение коллоидных ПАВ. Моющее действие мыла. (ПК 1.1,ОК 1-9)
2. Чему равен водородный показатель, если [OH-] равна 10-6 г-ион/л. (ПК 1.1,ОК 1-9)
Вариант 28
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Рефрактометрический метод. Устройство лабораторного рефрактометра, принцип работы. Применение. (ПК 1.1,ОК 1-9)
2. Напишите уравнения реакций гидролиза Na2CO3 и определите реакцию среды. (ПК 1.1,ОК 1-9)
Вариант 29
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Сорбция и её виды: адсорбция, абсорбция, хемосорбция, десорбция. Адсорбент. Адсорбтив. Особенности адсорбции и ее значение. (ПК 1.1,ОК 1-9)
2. Растворимость хлорида серебра при 200С равна 1,25*10-5 моль/л. Вычислите произведение растворимости AgCl. (ПК 1.1,ОК 1-9)
Вариант 30
Инструкция для обучающихся
Внимательно прочитайте задание.
Время выполнения задания – 0,3 часа
Задание
1. Сущность поляриметрического метода анализа. Устройство поляриметра, правила работы Применение. (ПК 1.1,ОК 1-9)
2. Вычислите растворимость углекислого бария BaCO3, выраженную в моль/л и в в г/л, если произведение растворимости BaCO3 8*10-9. (ПК 1.1,ОК 1-9)
III. ПАКЕТ ЭКЗАМЕНАТОРА
III а. УСЛОВИЯ
Экзамен проводится в устной форме. Количество обучающихся в аудитории при проведении экзамена не должно превышать 6 человек. Уровень подготовки обучающихся оценивается в баллах: 5 (отлично), 4 (хорошо), 3 (удовлетворительно), 2 (неудовлетворительно).
Количество вариантов задания в 1 семестре для экзаменующегося – 25; во 2-ом семестре - 30
Время выполнения задания – 0,5 часа, в том числе на подготовку – 0,3 часа, на ответ – 0,2 часа.
IIIб. КРИТЕРИИ ОЦЕНКИ
В критерии оценки уровня подготовки обучающихся входят:
- Уровень освоения обучающихся материала, предусмотренного учебной программой дисциплины;
- Умение обучающихся использовать теоретические знания при решении практических задач;
- Обоснованность, четкость, краткость изложения ответа.
Начисление баллов итогового рейтинга осуществляется по результатам сдачи обучающимся экзамена. При выставлении балла экзаменационного рейтинга преподаватель руководствуется следующей шкалой соответствия:
0 – 17 баллов соответствуют 0 - 34% положительного ответа на предложенное задание (билет);
18 – 24 балла соответствуют 35% - 49% положительного ответа на предложенное задание (билет);
25 – 37 балла соответствуют 50% - 74% положительного ответа на предложенное задание (билет);
38 – 50 баллов соответствуют 75% - 100% положительного ответа на предложенное задание (билет).
Итоговая оценка знаний обучающихся по дисциплине определяется на основании перевода итогового рейтинга (сумма промежуточного и экзаменационного рейтингов) в 5-балльную оценку по следующей шкале:
· оценка «удовлетворительно» - от 35 до 49 баллов;
· оценка «хорошо» - от 50 до 74 баллов;
· оценка «отлично» - от 75 до 100 баллов.
Получение обучающимся итогового рейтинга ниже 35 баллов соответствует оценке «неудовлетворительно».
5.Методтческие указания для выполнения самостоятельных работ
Методические указания по выполнению самостоятельных работ по учебной дисциплине ЕН.03Химия для обучающихся специальности 19.02.05 Технология бродильных производств и виноделие составлены в соответствии с рабочей программой учебной дисциплины ЕН.03 Химия, предусматривающей согласно ФГОС самостоятельную работу обучающихся по изучению данной дисциплины.
В результате освоения дисциплины обучающийся должен уметь:
- применять основные законы химии для решения задач в области профессиональной деятельности;
- использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса;
- описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов;
- проводить расчеты по химическим формулам и уравнениям реакции;
- использовать лабораторную посуду и оборудование;
-выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру;
- проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений;
- выполнять количественные расчеты состава вещества по результатам измерений;
- соблюдать правила техники безопасности при работе в химической лаборатории.
В результате освоения дисциплины обучающийся должен знать:
- основные понятия и законы химии;
- теоретические основы органической, физической, коллоидной химии;
- понятие химической кинетики и катализа;
- классификацию химических реакций и закономерности их протекания;
- обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов;
- окислительно-восстановительные реакции, реакции ионного обмена;
- гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах;
- тепловой эффект химических реакций, термохимические уравнения;
- характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции;
- свойства растворов и коллоидных систем высокомолекулярных соединений;
- дисперсные и коллоидные системы пищевых продуктов;
- роль и характеристики поверхностных явлений в природных и технологических процессах;
- основы аналитической химии;
- основные методы классического количественного и физико-химического анализа;
- назначение и правила использования лабораторного оборудования и аппаратуры;
- методы и технику выполнения химических анализов;
- приемы безопасной работы в химической лаборатории.
Целью создания методических рекомендаций является оказание помощи обучающимся в закреплении полученных знаний, руководство по выполнению и оформлению самостоятельной работы.
В указания включены тематические планы самостоятельной работы по дисциплине для специальности 19.02.05 Технология бродильных производств и виноделие, предложенные задания рассчитаны на 130 часов самостоятельной работы.
Методические указания содержат перечень и видов самостоятельной работы. Обучающийся имеет полное право самостоятельно выбрать вид работы по каждой теме. Для обучающихся, кто выбрал в качестве самостоятельной работы форму реферата или доклада, пособие содержит краткие рекомендации для написания доклада, реферата.
Обучающиеся, решившие провести исследовательскую работу или подготовить проект по определенной теме, освобождаются от выполнения самостоятельных работ по остальным темам рабочей программы.
Дополнительные задания для самостоятельной работы обучающихся довольно разнообразны по своему содержанию. Они необязательны для выполнения и рассчитаны на сильного, интересующегося дисциплиной обучающегося. Выполнив данные задания, обучающийся набирает определенное количество баллов, которые могут стать определенным «бонусом» при итоговой аттестации по дисциплине ЕН.03Химия.
Все задания для самостоятельной работы по дисциплине оформляются согласно приведенным методическим рекомендациям в виде портфолио.
При выполнении заданий, входящих в данное учебное пособие, рекомендуется пользоваться источниками, приведенными в списке рекомендуемой литературы.
Тематический план самостоятельной работы обучающихся
по дисциплине ЕН.03Химия для специальности
19.02.05 Технология бродильных производств и виноделие
|
Наименование разделов и тем |
Максимальная учебная нагрузка, обучающихся, час |
Количество аудиторных часов при очной форме обучения |
Самос тоятельная работа обучающихся |
||
|
Всего |
Теория |
Лаб.- практ. работ |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Введение |
|
|
|
|
|
|
Раздел 1. Органическая химия |
124 |
83 |
49 |
34 |
41 |
|
Раздел 2.Физическая и коллоидная химия |
102 |
68 |
48 |
20 |
34 |
|
Раздел 3. Аналитическая химия |
165 |
110 |
22 |
88 |
55 |
|
Итого: |
391 |
261 |
119 |
142 |
130 |
Перечень тем сообщений, рефератов, творческих
заданий для самостоятельной работы обучающихся
|
№ п/п |
Раздел, тема программы |
Кол-во часов |
Задание для сам.работы обучающимся |
Вид контроля |
|
|
Введение |
|
|
|
|
1 |
Раздел 1. Органическая химия |
41 |
|
|
|
|
|
|
Выполнение упражнений, решение расчетных задач по химическим формулам и уравнениям. Составление структурных формул изомеров веществ различных классов органических соединений. Создание алгоритма номенклатуры органических соединений: алкенов, алкинов, спиртов, альдегидов, карбоновых кислот, оксикислот, аминокислот. Составление таблиц: «Сравнительная характеристика углеводородов», «Сравнительная характеристика кислородосодержащих соединений», «Сравнительная характеристика углеводов» Осуществление генетической связи между классами органических соединений. Изучение материала о пищевых добавках, красителях и их роли в промышленности, используя дополнительные информационные источники. Составление схемы: «Классификация витаминов и нахождение их в продуктах питания»
|
Систематическая проработка конспектов занятий, учебной и справочной литературы; подготовка к лабораторным занятиям с использованием методических рекомендаций преподавателя, оформление лабораторных практических работ; отчета и подготовка к защите; выполнение расчетно-графических работ. |
|
2
|
Раздел 2. Физическая и коллоидная химия |
34 |
|
|
|
|
|
|
Решение задач и упражнений, составление персоналия. Подготовка сообщений, докладов и рефератов. Графическое оформление отклонения в поведении реальных газов от идеальных. Графическое изображение структуры текста. Составление термохимических уравнений. Составление формулы и схемы строения мицелл гидрозолей. Составление схем: «Классификация дисперсных систем», «Классификация коллоидных систем». Изучение материала о применении микрогетерогенных систем: эмульсий, пен, суспензий, аэрозолей, порошков в с/х, промышленности, медицине, используя дополнительные информационные источники.
|
Систематическая проработка конспектов занятий, учебной и справочной литературы; подготовка к лабораторным занятиям с использованием методических рекомендаций преподавателя, оформление лабораторных работ; отчета и подготовка к защите; выполнение расчетно-графических работ. |
|
3 |
Раздел3. Аналитическая химия |
55 |
|
|
|
|
|
|
Решение расчетных задач по химическим формулам и уравнениям. Написание уравнений реакций в молекулярном, ионном полном и сокращенном видах. Написание уравнений реакций гидролиза с определением реакции среды. Расстановка коэффициентов методом электронного баланса для окислительно-восстановительных реакций. Определение эквивалента окислителя и восстановителя. Изучение выбора индикатора для различных случаев сочетания кислот и оснований при титровании по кривым титрования. Изучение материала о применении перманганата калия в с/х, промышленности, медицине, используя дополнительные информационные источники. Изучение материала о жесткости воды и способах ее устранения. Составление схемы: «Классификация хроматографических методов анализа».
|
Систематическая проработка конспектов занятий, учебной и справочной литературы; подготовка к лабораторным занятиям с использованием методических рекомендаций преподавателя, оформление лабораторных работ; отчета и подготовка к защите; выполнение расчетно-графических работ. |
Дополнительные задания для самостоятельной работы
Контрольные вопросы.
Раздел 1. Органическая химия
Тема 1.1 Углеводороды
Предмет органическая химия
1. Что изучает органическая химия?
2. Укажите основные положения теории А. М.Бутлерова.
3. Как можно объяснить многообразие органических соединений?
4. Что такое изомеры? Приведите примеры.
5. Какой атом углерода называется первичным, вторичным, третичным и четвертичным? Приведите примеры.
6. Что такое гомологический ряд, гомологическая разность, гомологи? Приведите примеры.
7. На какие три больших ряда делятся органические вещества?
8. По какому признаку вещества подразделяются на классы.
Алканы
1. Какие углеводороды называются предельными? Приведите примеры.
2. Почему углеводороды ряда метана называют парафинами?
3. Какова общая формула алканов.
4. Какая связь называется σ–свяь и в чем ее особенность?
5. В какие реакции могут вступать алканы? Напишите уравнения этих реакций для бутана.
6. Приведите уравнения реакция замещения, в которые могут вступать алканы.
7. В чем заключается реакция радикального замещения? Приведите пример такой реакции.
8. Где применяются алканы?
Непредельные углеводороды
1. Какие углеводороды называются непредельными?
2. Какие углеводороды называются алкенами, алкинами, диенами? Приведите примеры.
3. Напишите общие формулы гомологических рядов этиленовых, ацетиленовых и диеновых углеводородов.
4. При помощи каких реакций можно отличить этилен от этана?
5. Как получают в технике этилен, ацетилен, бутадиен - 1,3?
6. Каково промышленное применение этилена, ацетилена, бутадинена-1,3?
7. Какая реакция называется реакцией полимеризации? Напишите схему реакции полимеризации трех молекул дивинила.
8. При помощи каких реакций можно отличить этилен от этана?
9. Какая реакция называется реакцией полимеризации? Приведите примеры.
Ароматические углеводороды
1. Что такое ароматические углеводороды?
2. Какую структурную формулу бензола предложил Кекуле? Что не могла объяснить эта формула?
3. Каковы современные представления об электронном строении молекулы бензола?
4. Что называется ароматической связью?
5. Что называется бензольным кольцом (ядром)?
6. Какие типы реакций характерны для аренов?
7. Какие заместители являются орто- и пара-ориентирами? Приведите примеры.
8. Какие заместители являются мета-ориентирами? Приведите примеры.
9. Какие способы получения бензола вы знаете?
Тема 1.2. Производные углеводородов
Спирты и фенолы
1. Какие соединения называют спиртами? Приведите примеры.
2. Как классифицируются спирты по строению углеводородного радикала?
3. Что такое атомность спирта? Как классифицируются спирты по атомности? Приведите формулы простейших представителей одно-, двух-, трехатомных спиртов.
4. Какую общую формулу имеют предельные одноатомные спирты?
5. Какие спирты называются первичными, вторичными, третичными?
6. Как изменяются физические свойства в гомологическом ряду алканолов?
7. Что такое реакция этерификации?
8. Чем объясняется большая реакционная способность глицерина по сравнению с алканолами?
9. Какая реакция является качественной на многоатомные спирты?
10. Что такое фенолы? Чем фенолы отличаются от ароматических спиртов по химическому строению?
11. Чем отличаются химические свойства фенола от свойств спиртов?
12. В каких реакциях проявляются слабокислотные свойства фенола?
Альдегиды и кетоны
1. Какие соединения называются альдегидами и кетонами? Приведите примеры.
2. Какую общую формулу имеют насыщенные альдегиды?
3. Как составляют названия альдегидов и кетонов по международной номенклатуре?
4. Чем отличается двойная связь карбонильной группы >С=О от двойной связи >С=С < в алкенах?
5. Какие вещества являются продуктами окисления альдегидов и кетонов?
6. Какие реакции используются для качественного определения альдегидов? Приведите примеры.
7. Что такое реакции поликонденсации? Приведите примеры.
8. Что такое формалин и для чего он используется?
Карбоновые кислоты
1. Что такое карбоновые кислоты? Общая формула предельных одноосновных кислот.
2. Как классифицируются карбоновые кислоты? Приведите примеры.
3. В чем проявляется взаимное влияние карбонильной и гидроксильной групп в составе молекул карбоновых кислот?
4. Каковы особенности строения и свойств муравьиной кислоты?
5. Какие вещества называются сложными эфирами? Напишите общую формулу сложных эфиров.
6. Назовите важнейшие области применения сложных эфиров.
Оксикислоты
1. Какие кислоты называются оксикислотами? Приведите примеры.
2. Чем определяется основность и атомность оксикислот?
3. Каковы способы получения оксикислот? Приведите примеры.
4. Каковы химические свойства оксикислот? Приведите примеры.
5. Какой углеродный атом в молекуле называется асимметричным?
6. Какие изомеры называются оптическими антиподами?
7. Какая смесь называется рацемической смесью?
Аминокислоты
1. Какие соединения называют аминокислотами? Приведите примеры.
2. Что такое полипептиды и как их получают?
3. Какая связь в полипептидах называется пептидной связью?
4. Каково пищевое и биологическое значение аминокислот?
5. Какие аминокислоты называются « заменимыми» и « незаменимыми»?
6. Из какой аминокислоты получают капрон?
Тема 1.3. Биоорганические соединения
Белки
1. Что такое белки?
2. Из каких веществ и в каких организмах синтезируются белки в природе?
3. Каковы важнейшие общие свойства белков?
4. Как можно вызвать гидролиз белка? Какие продукты получаются при гидролизе белка?
5. Приведите классификацию белков.
6. Что подразумевается под понятием «первичная», «вторичная», «третичная» и
« четвертичная» структура белка?
7. Что такое денатурация белка и каково значение этого процесса для пищевых производств?
8. Какой белок считают полноценным, а какой - неполноценным?
9. Каково пищевое и техническое значение белков?
10. Охарактеризуйте функции белков в организме.
Липиды
1. Что такое липиды и как их классифицируют?
2. Что такое жиры? Приведите примеры.
3. Чем отличаются по составу твердые жиры от жидких?
4. Что называется йодным числом, кислотным числом и что они характеризуют?
5. Что называется числом омыления и что оно характеризует?
6. Как проводится реактивное и безреактивное расщепление жиров?
7. Как производится гидрогенизация жиров?
8. Для чего применяется гидрожир?
9. Что такое фосфолипиды и каково их значение для пищевой промышленности?
10. Какова роль жиров в живых организмах и где они используются?
11. Какие процессы протекают в жирах при хранении и их кулинарной обработке?
Углеводы
1. Какие соединения называются углеводами?
2. На какие группы делятся углеводы?
3. Чем доказывается присутствие в глюкозе альдегидной группы? Приведите примеры.
4. Чем доказывается присутствие в глюкозе гидроксильной группы? Приведите примеры.
5. В чем заключается таутомерия моносахаридов?
6. Каким видам брожения подвергается глюкоза? Приведите примеры.
7. Каково различие в строение молекул сахарозы и мальтозы?
8. Как отличить сахарозу от мальтозы при помощи химических реакций?
9. Что такое инверт? Какое он находит применение?
10. Какова общая формула высших полиоз?
11. Каково строение крахмала, клетчатки?
12. Как отличается по свойствам клетчатка от крахмала?
13. Какие продукты получаются при кислотном и ферментативном гидролизе крахмала? Каково их использование?
14. Как получить спирт из крахмаласодержащего сырья, из клетчатки?
15. Какие эфиры клетчатки находят большое применение в промышленности?
Витамины и ферменты
1. Какова роль витаминов в питании человека и животных?
2. Какие витамины относятся к жирорастворимым, к водорастворимым?
3. С какой целью проводится витаминизация пищевых продуктов?
4. Что такое ферменты?
5. Каковы общие свойства ферментов?
6. Как используются ферментные препараты в пищевой промышленности?
Пищевые добавки
1. Какие требования предъявляются к пищевым красителям?
2. Как получают естественные красители?
3. Как получают синтетические красители?
4. Какое назначение имеют антиоксиданты и консерванты?
5. Что представляют собой эфирные масла и для чего они используются?
6. Что представляют собой эссенции?
7. Как классифицируют эссенции?
8. Как хранят эссенции?
9. Что представляет собой ванилин, для чего он используется?
Раздел 2. Физическая и коллоидная химия
Тема 2.1. Молекулярно-кинетическая теория агрегатного состояния вещества
1. Что изучает физическая и коллоидная химия?
2. Охарактеризуйте газообразное, жидкое и твердое состояние вещества.
3. Что такое идеальные и реальные газы?
4. Напишите уравнение газового состояния Менделеева— Клапейрона.
5. Какова разномерность универсальной газовой постоянной и ее величина?
6. Напишите уравнение Ван-дер-Ваальса. Объясните физический смысл поправок в этом уравнении.
7. Что такое критическая температура для газов?
8. Что такое вязкость? В каких единицах она измеряется?
9. Как отличить кристаллическое вещество от аморфного?
10. Что называется раствором?
11. Что называется диффузией?
12. От чего зависит осмотическое давление раствора? Как оно рассчитывается?
13. В чем сущность закона Рауля?
14. Какова зависимость повышения температуры кипения и понижения температуры замерзания от изменения концентрации раствора?
Тема 2.2. Химическая кинетика. Катализ.
1. Что понимают под скоростью реакции?
2. Какие факторы влияют на скорость реакции?
3. Что называется катализом и катализатором?
4. Как классифицируются каталитические реакции?
5. Что такое ингибиторы, антиоксиданты, синергисты?
6. Из каких стадий состоит реакция при гомогенном катализе и чем объясняется увеличение скорости?
7. В чем особенности гетерогенного катализа.
8. Что такое ферментативный катализ? Каково его значение?
9. Что такое ферменты? В чем заключается специфичность их действия?
Тема 2.3. Основы химической термодинамики
1. Как формулируется первое начало термодинамики?
2. Что такое энтальпия?
3. Каково содержание второго закона термодинамики?
4. Что изучает термохимия?
5. Как читается закон Гесса?
6. Какие уравнения называются термохимическими?
7. Дайте определение теплоты сгорания и образования?
8. Что называется теплотой сгорания?
Тема 2.4. Растворы высокомолекулярных соединений.
1. Приведите примеры природных и синтетических высокомолекулярных соединений.
2. Каковы особенности строения молекул высокомолекулярных соединений?
3. Что такое набухание? Каково его значение?
4. Укажите стадии набухания.
5. Что такое коацервация?
6. Что называется студнями?
7. Какие существуют методы получения студней?
8. В чем проявляется сходство раствором ВМС с коллоидными растворами? В чем различие?
9. По каким признакам растворы высокополимеров можно отвести к истинным растворам?
10. Что такое изоэлектрическая точка?
11. В чем защитное действие ВМС?
Тема 2.5. Дисперсные и коллоидные системы пищевых продуктов.
Дисперсные и коллоидные системы
1. Что называется дисперсной системой, дисперсной фазой, дисперсионной средой?
2. Какие признаки характерны для дисперсных систем?
3. Приведите классификацию дисперсных систем.
4. Каковы основные признаки коллоидных систем?
5. Какими методами получают коллоидные системы? Укажите их сущность.
6. Какие методы очистки золей вы знаете?
7. Какими оптическими свойствами обладают коллоидные системы?
8. В чем сущность броуновского движения?
9. Что понимают под кинетической устойчивостью коллоидных систем?
Микрогетерогенные системы
1. Что такое эмульсии и как их классифицируют?
2. Что называется прямыми и обратными эмульсиями?
3. Какие вещества применяются в качестве эмульгаторов и каков принцип их действия?
4. Как можно разрушить эмульсию?
5. Какие дисперсные системы называются пенами?
6. От чего зависит устойчивость пены? Как можно разрушить пену?
7. Какие вещества относятся к пищевым пенообразователям?
8. Что представляют собой суспензии?
9. Какие дисперсные системы называются аэрозолями? Дайте их классификацию.
10. Какие существуют методы разрушения аэрозолей?
11. Какие дисперсные системы называются порошками, чем они отличаются от аэрозолей?
12. В чем промышленное значение микрогетерогенных систем?
13. Какие пищевые продукты можно считать пенами, эмульсиями, порошками, суспензиями?
Электрокинетические явления
1. Какие явления называются электрокенетическими? Приведите примеры практического использования этих явлений.
2. Что такое электрофорез? Электроосмос? Укажите практическое применение.
3. Какое строение имеет двойной электрический слой?
4. Чем отличаются поверхностный и электрокенетический потенциалы?
5. Какие ионы называются потенциалопределяющими и противоионами?
6. Какой слой ионов называют адсорбционным и какой — диффузным?
7. Что такое коагуляция и какие факторы ее вызывают?
8. Что такое порог коагуляции?
9. Какой ион электролита обладает коагулирующим действием и как коагулирующая способность связана с зарядом ионов?
10. Какое состояние золя называется изоэлектрическим?
11. Каково практическое значение коагуляционных процессов?
Тема 2.6. Роль и характеристика поверхностных явлений в природных и технологических процессах.
Структурообразование в дисперсных системах
1. Какие системы относятся к свободно- и связанодисперсным?
2. В чем сущность структурообразования в дисперсных системах?
3. При коагуляции каких систем образуются гели?
4. Чем объясняется синерезис гелей?
5. Что называется тиксотропией?
6. Что такое пептизация?
7. Как изменяется вязкость структурированной жидкости от концентрации?
8. Какие свойства дисперсных систем относятся к реологическим?
Коллоидные поверхностно-активные вещества.
1. Какие вещества относятся к коллоидным поверхностно-активным?
2. Объясните строение мицеллы мыла в водной среде.
3. Каковы факторы устойчивости коллоидных поверхностно-активных веществ?
4. Что такое критическая концентрация мицеллообразования ?
5. Чем объясняется моющее действие мыл?
6. Что называется солюбилизацией?
Адсорбция
1. Что называется сорбцией?
2. Какая разница между адсорбцией и абсорбцией?
3. От каких факторов зависит адсорбция?
4. Чем отличается адсорбция паров на пористых адсорбентах от адсорбции газов?
5. Как влияет на молекулярную адсорбцию из растворов природа растворителя, адсорбента, растворенного вещества?
6. Почему при некоторых пищевых отравлениях рекомендуется принимать таблетки активного угля?
7. В чем особенность ионообменной адсорбции? Что такое иониты и где их можно применять?
8. На каком принципе основан хроматографический метод анализа? Каковы преимущества этого метода анализа?
9. Какие вещества называются поверхностно-активными? Приведите примеры.
10. Укажите области применения ПАВ в пищевой промышленности.
11. В чем состоит гидрофибизация и гидрофилизация поверхности?
Раздел 3. Аналитическая химия
Тема 3.1. Теоретические основы аналитической химии
1. Что изучает аналитическая химия?
2. Какие методы анализа аналитической химии вы знаете?
3. Какова эффективность применения физических и физико-химических методов анализа?
4. Каково значение аналитической химии для пищевых производств?
5. Как формулируется закон сохранения массы веществ?
6. Как формулируется закон Авогадро?
7. Как формулируется первое следствие из закона Авогадро?
8. Как формулируется закон постоянства состава веществ?
Химические реакции и закономерности их протекания.
1. Как классифицируются химические реакции? Приведите примеры.
2. Какие реакции называются: а)гомогенными; б)гетерогенными?
3. Как называется раздел химии, в котором изучаются скорости и механизмы химических реакций?
4. Что понимают под скоростью химической реакции?
5. От каких факторов зависит скорость химической реакции?
6. Как формулируется закон действующих масс?
7. Как формулируется правило Baнт-Гоффа?
8. Какие реакции называются необратимыми и обратимыми?
9. Что называется химическим равновесием?
10. Что называется константой химического равновесия?
11. От чего зависит и от чего не зависит константа равновесия?
12. Как формулируется принцип подвижного равновесия Ле-Шателье?
13. Какие внешние факторы влияют на смещение химического равновесия?
Электролитическая диссоциация
1. В чем сущность теории электролитической диссоциации?
2. Как диссоциируют в растворах соли, кислоты, основания? Приведите примеры.
3. Как диссоциируют в растворах многоосновные кислоты и основания? Приведите примеры.
4. Составьте выражения константы диссоциации СН3СООН.
5. Что называется степенью диссоциации? От чего она зависит?
6. Какие электролиты называются сильными, а какие – слабыми? Приведите примеры сильных и слабых электролитов.
7. Какая зависимость существует между константой диссоциации и степенью электролитической диссоциации?
Произведение растворимости.
1. Что называется произведением растворимости? Приведите примеры.
2. Как определить растворимость по произведению растворимости и наоборот?
3. Каковы условия образования и растворения осадков?
4. Как следует назвать раствор СаSO4, если значение его ПР: а)не достигнуто;
б) достигнуто; в) превышено?
Ионное произведение воды.
1. Что называется ионным произведением воды?
2. Какова концентрация ионов водорода в нейтральной, щелочной и кислой средах?
3. Что такое водородный показатель? Для каких целей он служит?
4. Какие растворы называются буферными?
Гидролиз
1. Что называется гидролизом?
2. Какие соли подвергаются гидролизу?
3. Какова реакция растворов следующих солей: нитрата аммония NH4NO3, хлорида меди CuCl2, фосфата калия К3РО4?
4. Что такое амфотерность?
Окислительно-восставновительные реакции
1. Какие реакции называются окислительно – восстановительными?
2. Почему металлы в соединениях проявляют только положительные степени окисления, а неметаллы – как положительные,так и отрицательные?
3. Какие вещества называются окислителями и какие восстановителями?
4. Для каких сложных веществ характерны только окислительные свойства?
5. В каких случаях сложные вещества могут выступать в роли окислителей и восстановителей?
6. Как называется: а)процесс отдачи электронов; б) процесс присоединения электронов?
7. Какое правило лежит в основе метода электронного баланса?
Тема 3.2. Качественный анализ
Общие принципы качественного анализа
1. В чем заключается задача качественного анализа?
2. Какие методы используются в качественном анализе?
3. В чем сущность «сухого» и «мокрого» способов выполнения аналитических реакций?
4. Какова роль периодического закона и периодической системы Д.И. Менделеева в аналитической химии?
5. Что положено в основу классификации катионов?
6. На какие группы подразделяются анионы?
7. Как обнаружить в растворе сульфат-, карбонат-, хлорид-ионы?
Тема 3.3. Количественный анализ.
Гравиметрический (весовой) анализ
1. Что изучает количественный метод анализа?
2. Перечислите важнейшие методы количественногоанализа.
3. Каково применение количественного анализа в ТХК пищевых производств?
4. В чем сущность гравиметрического анализа?
5. Какие определения можно проводить при помощи гравиметрического анализа?
6. Устройство аналитических весов, степень их точности и основные правила взвешивания.
7. Как проводится определение влажности вещества?
8. Как проводится определение зольности вещества?
9. Как проводятся определения III типа?
10. Какие операции различают в ходе гравиметрического определения?
Титриметрический (объемный) анализ
1. В чем сущность титриметрического (объемного ) анализа?
2. Перечислите методы титриметрического анализа.
3. Что такое концентрация раствора и как ее выражают?
4. Как вычисляют грамм-эквивалент кислот, оснований и солей?
5. Что называется тиром раствора?
6. Что такое титр рабочего раствора по определяемому веществу?
7. Что такое точка эквавалентности и как она определяется?
8. Что такое рабочий раствор?
9. В чем отличие стандартных и стандартизированных растворов?
10. Какие требования предъявляют к исходным веществам?
11. Какую мерную посуду применяют в титриметрическом анализе?
Методы кислотно-основного титрования
1. В чем сущность кислотно-основного титрования?
2. Какие рабочие растворы и индикаторы применяются в кислотно-основном титровании?
3. Что такое индикаторы?
4. Как правильно выбрать индикатор для различных случаев титрования?
5. Для каких определений применяется метод нейтрализации в лабораториях предприятия?
Методы окисления-восстановления (оксидиметрии)
1. Что такое методы оксидиметрии?
2. Приведите классификацию методов оксидиметрии.
3. Как определяется грамм-эквивалент окислителя и восстановителя?
4. Как приготовить рабочий раствор перманганата калия?
5. Как вычисляется эквивалент KMnO4 в различных средах?
6. Какие условия нужно соблюдать при титровании щавелевой кислоты перманганатом калия?
7. Какие рабочие растворы и индикаторы применяют в иодометрии?
8. Каковы условия проведения иодометрических определений? Какие методы титрования вы знаете?
Метод комплексообразования
1. В чем сущность трилонометрического метода анализа?
2. Какие соединения называются комплексонами?
3. Какое соединение называют трилоном Б?
4. Какие индикаторы используются в трилонометрическом методе?
5. Что такое жесткость воды? Чем она обусловлена?
6. В каких единицах выражается жесткость воды?
7. Какие вы знаете виды жесткости воды и способы их устранения?
8. Из чего складывается общая жесткость воды?
9.Как определяется общая жесткость воды трилонометрическим способом?
Тема 3.4. Физико-химические методы анализа
1. В чем сущность физико-химических методов анализа?
2. Приведите классификацию физико-химических методов анализа.
3. Каково применение физико-химических методов анализа в ТХК пищевых производств?
Колориметрия
1. В чем сущность колориметрического метода анализа?
2. Сформулируйте основной закон светопоглощения.
3. Каково применение колориметрического метода анализа в ТХК пищевых производств.
Рефрактометрия
1. На чем основан рефрактометрический метод анализа?
2. Что называется показателем преломления?
3. От каких факторов зависит показатель преломления?
4. Каково устройство лабораторного прецизионного рефрактометра?
Поляриметрия
1. Какова сущность поляриметрического метода определения углеводов?
2. Что представляет собой поляризованный луч?
3. Какие вещества называются оптически активными? Приведите примеры.
4. Какие поляриметры вы знаете, как устроен поляриметр?
5. Как градуирована шкала сахариметра и как проводится отсчет показаний?
Потенциометрический метод анализа
1. В чем сущность потенциометрического метода анализа?
2. Что называется нормальным потенциалом?
3. Какова методика определения кислотности среды на рН-метрах?
Хроматография
1. Какова сущность хроматографического метода анализа?
2. Приведите классификацию хроматографических методов анализа.
3. Какова область применения хроматографических методов анализа?
Дополнительные задания для самостоятельной работы
Раздел 1. Органическая химия
Тема 1.1. Углеводороды
Органическая химия – это химия соединений углерода. Углерод обладает способностями:
1) Соединяться друг с другом в разнообразные цепи: прямые, замкнутые, разветвленные;
2) Образовывать простые и кратные связи (двойные, тройные и ароматические).
3) Во всех органических соединениях валентность углерода равна 4. При написании веществ используют молекулярные формулы С4Н10
и сокращенные структурные формулы: СН3-СН2-СН2-СН3.
Алканы (предельные или насыщенные УВ, парафины)
Общая формула предельных углеводородов СnH2n+2, где n – число углеродных атомов в молекуле. Это ациклические соединения, все связи простые (σ-связи), углерод находится в sp3 – гибридизации, угол связи 109028¢, длина связи углерод-углерод 0,154 нм, углеродная цепь зигзагообразная, связи С-Н малополярные. Характерна изомерия углеродной цепи, начиная с бутана. Общая формула предельного радикала CnH2n + 1. Например: СН3 – метил, С2Н5 – этил и т.д. Условное обозначение - R.
При изучении номенклатуры необходимо пользоваться алгоритмом составления названия органических соединений, алгоритмом изображения структурной формулы вещества по его названию и алгоритмом составления формул структурных изомеров. Детально знакомимся с правилами номенклатуры ИЮПАК, дополняя и конкретизируя правила по мере изучения последующих классов веществ. Рассматриваем общие положения, например:
«Алгоритм называния веществ ациклического строения».
1. Выбрать самую длинную углеродную цепь.
2. Пронумеровать ее с той стороны, к которой ближе радикалы, или старший заместитель, или кратная связь, или функциональная группа.
3. Указать в префиксе положение (номер атома углерода) и название радикала, заместителя, функциональной группы в алфавитном порядке.
4. Записать корень, соответствующий числу атомов углерода в главной цепи.
5. Если есть двойная связь, то после корня поставить суффикс –ен с указанием положения связи в цепи, для тройной связи использовать суффикс –ин. Если кратных связей нет – суффикс –ан.
6. После этого указать суффикс, соответствующий спирту, альдегиду, кетону или кислоте, если есть соответствующие функциональные группы.
7. Если в веществе несколько одинаковых радикалов, заместителей, связей или функциональных групп, то они называются вместе, с использованием числительных: 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д.
8. При написании названия все цифры отделяются друг от друга запятыми, а от букв – дефисами.
Пример:
СН3
½
НО - СН2- С – СН2 – СН3 СН2=СН-СН2-СН2-СН3
ï пентен-1
СН3
2,2 – диметилбутанол- 1 СН3-СН2-СН3
пропан
Алгоритм изображения структурной формулы вещества по его названию (для алканов)
1. В названии вещества выделить корень. Обвести его значком корня.
2. Изобразить углеродный скелет в соответствии с наименованием корня.
3. Пронумеровать атомы углерода в углеродном скелете (с любой стороны).
4. Проставить символы радикалов у соответствующих атомов углерода.
5. Дополнить свободные валентности атомов углерода символами атомов водорода (учитывая, что углерод четырехвалентен).
Например, построить структурную формулу
2,2-диметил-3-этилгексан. 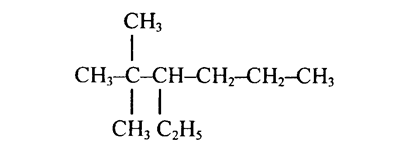
По мере изучения последующих классов веществ мы дополняем и конкретизируем эти правила.
Алгоритм составления формул структурных изомеров:
1. Изобразить структурную формулу вещества в развернутом виде – изомер №1.
2. Уменьшить основную углеродную цепь на один атом углерода.
3. Подставить этот атом углерода ко второму атому в основной цепи. Получится изомер №2.
4. Рассмотреть вариант подстановки этого атома к третьему атому углерода основной цепи (будет ли новый изомер отличаться от изомера №2). Возможно, получится изомер №3.
5. Продолжить подставлять атом углерода к четвертому и т.д. атомам углерода в зависимости от длины основной углеродной цепи.
6. Уменьшить основную цепь еще на один атом углерода. Обратиться к изомеру №2. Подставить второй «свободный» атом углерода к третьему атому углерода основной углеродной цепи.
7. Менять положения двух «свободных» атомов углерода по отношению друг к другу.
8. По возможности (исходя из длины основной углеродной цепи) уменьшить ее длину еще на один атом углерода. Повторить действия, описанные в пп.3-7.
9. Дать названия всем полученным изомерам по современной номенклатуре.
Например:
1. СН3- СН2 – СН2 – СН2 - СН3
н-пентан
2.СН3- СН – СН2 – СН3
ï
СН3
2-метилбутан
3. СН3
½
СН3- С – СН3
ï
СН3
2,2 – диметилпропан
Непредельные углеводороды – это углеводороды, в молекулах которых имеются атомы углерода, связанные двойной (алкены), тройной (алкины) или двумя двойными (диеновые) связями.
Алкены (этиленовые УВ, олефины) - это ациклические углеводороды, содержащие в молекуле одну двойную связь между атомами углерода. Имеют общую формулу СnН2n. Углерод находится в sp2 – гибридизации, угол связи 1200, длина двойной связи составляет 0,132 нм. Двойная связь между атомами углерода в молекулах алкенов состоит из 1 σ – и 1 π – связи. Наличие двойной связи обуславливает высокую химическую активность олефинов. Изомерия алкенов обусловлена не только строением углеродной цепи, но и положением двойной связи в молекуле. Например, изомерами являются вещества:
СН2 = СН - СН2 - СНз и СН3-СН = СН-СН3
Бутен 1 бутен 2
Есть еще цис - и транс – изомерия (пространственная).
Алкины (ацетиленовые УВ) – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp – гибридизации и связаны друг с другом тройной связью: -С≡ С-, состоит из 1 σ – и 2 π – связи. Общая формула СnН2n-2. Длина связи С≡ С в алкинах равна 0,120нм, валентный угол – 1800.
Изомерия ацетиленовых углеводородов обусловлена двумя причинами: положением тройной связи в молекуле, строением углеродной цепи.
Ароматическими соединениями называют вещества, в молекулах которых содержится особая группировка из шести атомов углерода, называемая бензольным ядром, или бензольным кольцом. Большое значение имеют правила замещения в бензольном кольце. При изучении реакций замещения в бензольном ядре было установлено, что если в бензольном ядре уже содержится какая- либо замещеющая группа, то вторая вводимая вступает в кольцо в совершенно определенное положение в зависимости от характера первого заместителя. Каждый заместитель в бензольном кольце обладает направляющим, ориентирующим действием. Все заместители по характеру своего направляющего действия делятся на две группы:
1.Заместители первого рода направляют последующие вводимые группы в орто- и пара- положение:
К заместителям первого рода относятся следующие группы:
- NR2 ; - NH2; - ОН; - СН3 и другие радикалы, I; С1 ; Вr.
Для получения орто – и пара – изомеров в бензольное кольцо надо вначале ввести заместитель первого рода.
Например, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и ортоположения:
2. Заместители второго рода направляют последующие вводимые группы в мета – положение:
К заместителям второго рода относятся следующие группы: -NO2; -C≡ N; -SО3Н; - СOН, -COOH.
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение :
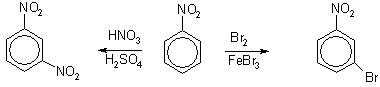
Для получения мета- изомера надо вначале ввести в бензольное ядро заместитель второго рода. Правила замещения в бензольном ядре дают возможность выбрать правильный путь синтеза того или иного нужного вещества. Например, надо решить задачу: в какой последовательности должны быть проведены реакции галогенирования и сульфирования для получения орто – изомера из бензола, ортохлорбензолсульфокислоты. В бензольное ядро надо ввести заместитель первого рода. В данном случае заместителем первого рода является хлор. Значит, сначала бензол надо хлорировать, а затем полученный хлорбензол – сульфировать.
Упражнения.
1. Напишите структурные формулы: а) 2-метилбутан; б) 2,3 – диметилбутан; в) 3-пропилгептана.
2. Напишите структурные формулы: а) 2-метилбутен-2; б) 2,3 – диметилгексен-3; в) 2,2,6-триметил-4-этилгептен-3
3. Напишите структурные формулы: а) бутин-1; б) пентин-2; в) 4,4 диметилпентина-2.
4. Составьте структурные формулы изомеров гексана и назовите их по номенклатуре ИЮПАК.
5. Какие вещества являются изомерами и какие гомологами (допишите атомы водорода в веществах и назовите их):
а) С – С – С - С б) С – С – С – С – С в) С – С – С
ï
С
С
ï
г) С – С – С – С д) С – С – С
ï ï
С С
6. При помощи, каких реакций можно осуществить следующие превращения?
а) Метан→ бромэтан→ н-бутан→ оксид углерода (IV)
б) С→ СН4→ СН3Cl → С2Н6→ С2Н4→ С2Н5OH
↓
ацетилен
7.Назовите по номенклатуре ИЮПАК следующие углеводороды и напишите их сокращенную структурную формулу:
а) С – С – С –С = С б) С – С ≡ С –С – С – С
│ | |
С С С- С
8.Построить структурную формулу 2,4,4- триметилпентана и найти в этой формуле первичные, вторичные, третичные и четвертичные атомы углерода.
9.Массовые доли элементов в соединении составляют С – 82,8%, Н – 17,2%. 10.Относительная плотность паров этого вещества по водороду равна 29. Определите формулу этого соединения.
11.Рассчитать массовые доли С в соединениях: а)С2Н2; б) пропилене.
12.В какой последовательности должны быть проведены реакции хлорирования и нитрования для получения из бензола ортонитрохлорбензола?
13.В какой последовательности должны быть проведены реакции бромирования и нитрования для получения из бензола метабромнитробензола?
Тема 1. 2. Производные углеводородов
Спирты (алкоголи) – это производные углеводородов, в которых один или несколько атом водорода замещены на гидроксильную группу – ОН.
Спирты можно классифицировать по:
1. числу гидроксильных групп – одноатомные СН3ОН- метанол; двухатомные
СН2 – СН2 – этандиол-1,2;
│ │
ОН ОН
трехатомные СН2 – СН2 –СН2 – пропантриол-1,2,3;
│ │ │
ОН ОН ОН
2. характеру УВ радикала – предельные – СН3 – СН2 – ОН этанол; непредельные – СН2 = СН – СН2- ОН аллиловый спирт; ароматические – С6Н5 – СН2 – ОН – фенилметанол.
3. Характеру атома углерода, с которым связана гидроксильная группа – первичные – СН3 – СН2 – СН2 – ОН – пропанол-1
вторичные СН3 – СН – СН3 – пропанол-2
│
ОН
Третичные СН3 2-метилпропанол-2
│
СН3 – С – СН3
│
ОН
Общая формула одноатомных предельных спиртов СпН2п +1ОН. Функциональной группой спиртов является гидроксильная группа - ОН и она определяет их важнейшие свойства. Введением этой группы обуславливается большая химическая активность спиртов.
Основные принципы названия спиртов по международной номенклатуре:
Название спирта = название УВ +(префикс) + ол + (n1,n2,n3….nn), где префикс обозначает число гидроксильных групп в молекуле – ди, три, тетра, - указывает положение гидроксильных групп в главной углеродной цепи. Например:
СН3 – СН – СН2 –СН - СН2- СН3
│ │
ОН ОН
гександиол-2,4
Упражнения.
1. Напишите структурные формулы следующих соединений:
а)2-метилпропанол-2; б) 3-этилпентанол-3; в)2,2,4,4-тетраметилгептанол-1;
г)2-метилбутандиол-1,4; д)2-этилгексантриол-1,3,5; е)2-метил-4-этилгексанол-2.
2. Напишите уравнения реакций получения следующих простых эфиров:
а) метилэтилового; б)этилпропилового; в)моноэтилового эфира этиленгликоля
3. Напишите структурные формулы сложных эфиров, образующихся из: а) уксусной кислоты и пропанола-1; б) муравьиной кислоты и этанола. Назовите сложные эфиры.
4. Сколько мл 40%-ной азотной кислоты (плотность 1,2г/см3) потребуется для получения 11,35г тринитрата глицерина? Ответ 8мл.
5. Сколько граммов этилового спирта нужно взять для получения 200 г диэтилового эфира, если выход эфира равен 80% от теоретически возможного? Ответ: 310,8г
6. Напишите структурные формулы вторичных спиртов с эмпирической формулой С5Н11ОН. Назовите изомеры по номенклатуре ИЮПАК.
7. Осуществите следующие превращения:
С→ СаС2→ С2Н2 →С2Н4 →С2Н5ОН →С2Н5ОNa
Альдегиды и кетоны.
Альдегиды – органические соединения, молекулы которых содержат карбонильную группу >С=О, соединенную с углеводородным радикалом и водородом.
O
//
Общая формула альдегидов R-C –Н (R –СОН). Название альдегидов по международной номенклатуре образуется от названия соответствующего алкана с добавлением окончания – аль. Нумерацию углеродной цепи начинают от карбонильной группы (альдегидной группы -–СОН).
У кетонов карбонильная группа связана с двумя радикалами R –СО- R1. В названии окончание –он. Нумерацию начинают с того атома углерода, к которому ближе располагается карбонильная группа.
Упражнения.
1. Напишите структурные формулы следующих соединений:
а) 2-метилпропаналь; б) 3-этилпентаналь; в) 2,3-диметилгептаналь; г) бутанон-2;
д) 2-этилгексанон-3.
2. Напишите структурные формулы изомерных альдегидов и кетонов с молекулярной формулой С5Н10О. Назовите изомеры по номенклатуре ИЮПАК.
3. В двух пробирках находятся уксусной альдегид и этиленгликоль. С помощью каких реакций можно определить эти вещества? Напишите уравнения реакций.
4. Сколько граммов металлического серебра выделится при реакции «серебреного зеркала», если в нее вступили 200 г ацетальдегида?
5. Какой объем займет муравьиный альдегид ( н.у.), полученный из 100г метилового спирта?
Карбоновые кислоты – производные УВ, содержащие функциональную карбоксильную группу - СООН.
Общая формула предельных одноосновных кислот: CnH2n+1COOH или R – СООН, или Сn Н2nО2
Изомерия одноосновных предельных карбоновых кислот начинается с масляной кислоты; она обусловлена различным строением углеводородного радикала. По международной номенклатуре к названию соответствующего углеводорода добавляется окончание овая, нумерацию углеродной цепи начинают с атома углерода карбоксильной группы.
Водород в карбоксильной группе отличается большой подвижностью, поэтому карбоновые кислоты диссоциируют на катион водорода и анион кислотного остатка:
R - СООН ↔R СОО- + Н+
Анион остатка уксусной кислоты СН3СОО- называется ацетат-ион; муравьиной кислоты НСОО- – формиат-ион.
Сложные эфиры – это вещества, которые образуются в результате взаимодействия органических кислот со спиртами (реакция этерификация).
СН3 - СОО - С2Н5 - этилацетат, или этиловый эфир уксусной кислоты;
С2Н5- СОО - СН3 - метилпропинат, или метиловый эфир пропионовой кислоты.
Упражнения.
1. Напишите структурные формулы кислот с молекулярной формулой С7Н14О2, содержащих главные цепи из пяти и шести атомов углерода. Назовите кислоты по международной номенклатуре.
2. Напишите уравнения реакций следующих превращений и назовите продукты реакций:
С2Н6 → С2Н5Сl → С2Н5ОН→ СН3-СОН →СН3СООН→ СН3-СОО-С3Н7
3. Составьте уравнения реакций получения сложных эфиров: а)этилформиата; б)пропилпропионата.
4. Какие массы этановой кислоты и этанола потребуются для получения 8,8 г эфира, если выход составляет 90%? (Ответ: 5,4г; 4,14г)
5. Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола?
Оксикислоты - соединения со смешенными функциями. Они содержат одновременно гидроксильные и карбоксильные группы т.е обладают и свойствами карбоновых кислот, и свойствами спиртов.
Аминокислоты – это производные УВ, содержащие аминогруппу -NH2 и карбоксильную группу–СООН. Общая формула( NH2) n R( СООН) m. Являются амфотерными соединениями, обладают одновременно основными и кислотными свойствами.
Упражнения.
1.Напишите уравнения реакций взаимодействия аланина с: а) гидроксидом натрия;
б) хлороводородной кислотой.
2.Напишите уравнение реакции взаимодействия молочной кислоты с:
а) гидроксидом натрия; б) уксусной кислотой; в) этиловым спиртом. Назовите полученные вещества.
3.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН2=СН2 → СН3-СН2-ОН → СН3СОН → СН3СООН → СН2BrСООН → СН2NH2СООН
4.При восстановлении 92,25г нитробензола получили 66г анилина по реакции Зинина. Какой выход (в %) продукта реакции? (Отвт: 94,6%)
Тема 1.3. Биоорганические соединения
Белки – высокомолекулярные органические соединения, построенные из остатков α-аминокислот, соединенных пептидной связью.
Липиды - это группа органических веществ различной структуры, не растворимых в воде, но растворяющих в органических растворителях. К липидам относят жиры и масла, фосфатиды, воски и стерины.
Наибольшее внимание следует уделить изучению жиров и масел.
Жиры представляют собой смеси сложных эфиров, образованных трехатомным спиртом глицерином и высшими жирными кислотами. Изучите структуру природных жиров, являющихся смесью различных глицеридов. В состав жиров входят, в основном, триглицериды, но присутствуют моно- и диглицериды
Углеводы - обширный класс природных соединений, которые играют важную роль в жизни человека, животных и растений. В состав углеводов входят три элемента: водород, углерод и кислород. Состав большинства углеводов можно выразить общей формулой C n (H2О) m т.е. формально являются соединениями углерода и воды.
Углеводы подразделяются на две группы: простые углеводы (или простые сахара) и сложные углеводы (или сложные сахара). В основу классификации углеводов положена реакция гидролиза.
Простыми углеводами (моносахаридами или монозами), называют такие углеводы, которые не способны гидролизоваться. Наиболее распространенными являются глюкоза и фруктоза – С6Н12О6.
Сложные углеводы - это углеводы, молекулы которых состоят из двух или большего числа остатков моносахаридов и способны гидролизоваться с образованием более простых углеводов.
Дисахариды - сложные сахара, каждая молекула которых при гидролизе распадается на две молекулы моносахарида. Наибольшее значение имеет сахароза – свекловичный или тростниковый сахар С12Н22О11.
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
глюкоза фруктоза
Полисахариды – высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (гексоз). Наибольшее значение имеет крахмал и клетчатка (С6Н10О5) n.
(С6Н10О5) n + n Н2О → n С6Н12О6
глюкоза
Упражнения.
1. Напишите структурные формулы и назовите дипептиды, которые могут быть получены из следующих аминокислот: а)глицина и фенилаланина; б) аланина и валина; в)аланина и аланина.
2. Напишите структурную формулу сложного эфира, образованного глицерином с пальмитиновой, стеариновой и масляной кислотами.
3. Составьте уравнения реакций, идущих по схеме:
крахмал → глюкоза → этанол → оксид углерода(IV) → крахмал
4. При спиртовом брожении глюкозы выделилось 5,6л углекислого газа (н.у). Чему равна масса глюкозы, подвергшейся брожению?
5. Какая масса жира трибутироата получится при взаимодействии 4,6г глицерина с масляной кислотой? (Ответ: 15,1г)
6. Напишите уравнения реакций, характеризующих фруктозу как многоатомный спирт.
7. Напишите уравнения реакций, характеризующих глюкозу как альдегид.
8. Напишите уравнения реакций спиртового и молочнокислого брожения глюкозы.
9. Напишите уравнение реакции взаимодействия целлюлозы с тремя молекулами азотной кислоты.
10. Используя формулу Хеуорса, напишите реакцию взаимодействия глюкозы с этанолом. Назовите полученное вещество.
11. Даны: глицерин, сахароза, этанол, глюкоза, этиленгликоль. Какое из этих соединений при нагревании с гидроксидом меди (II) образует осадок красного цвета? Какие из этих соединений при обычной температуре растворяют Сu(ОН)2 с образованием сине-фиолетового раствора? Напишите уравнения реакции.
12. Сколько килограммов сахарозы надо взять для получения 30кг инвертного сахара, если выход инверта равен 70% от теоретически возможного? Ответ 40,7кг
Методика решения задач по химии
При решении задач необходимо руководствоваться несколькими простыми правилами:
1. Внимательно прочитать условие задачи;
2. Записать, что дано;
3. Перевести, если это необходимо, единицы физических величин в единицы системы СИ (некоторые внесистемные единицы допускаются, например литры);
4. Записать, если это необходимо, уравнение реакции и расставить коэффициенты;
5. Решать задачу, используя понятие о количестве вещества, а не метод составления пропорций;
6. Записать ответ.
В целях успешной подготовки по химии следует внимательно рассмотреть решения задач, приводимых в тексте, а также самостоятельно решить достаточное число их. Именно в процессе решения задач будут закреплены основные теоретические положения курса химии.
Решать задачи необходимо на протяжении всего времени изучения химии и подготовки к экзамену.
Моль, молярная масса
Молярная масса – это отношение массы вещества к количеству вещества, т.е. М(х) = m(x)/ν(x),
где М(х) – молярная масса вещества Х,
m(x) – масса вещества Х,
ν(x) – количество вещества Х.
Единица СИ
молярной массы – кг/моль, однако обычно используется единица г/моль. Единица массы – г, кг. Единица СИ количества вещества – моль.
Любая задача по химии решается через количество вещества.
Необходимо помнить основную формулу:
ν(x) = m(x)/ М(х) или ν(x) = V(x)/Vm или ν(x) = N/NA,
где V(x) – объем вещества Х(л),
Vm – молярный объем газа (л/моль),
N – число частиц,
NA – постоянная Авогадро.
Расчеты по химическим формулам. Массовая доля.
Массовая доля вещества – отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) =m(Х)/m,
где ω(X)– массовая доля вещества Х,
m(X) – масса вещества Х,
m – масса всей системы.
Массовая доля – безразмерная величина. Её выражают в долях от единицы или в процентах.
Задача №1. Массовая доля атомного кислорода составляет 0,42, или 42%, т.е. ω(О)=0,42.
Массовая доля атомного хлора в хлориде натрия составляет 0,607, или 60,7%, т.е. ω(Cl)=0,607. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O.
Решение:
Молярная масса BaCl2 • 2H2O составляет:
М(BaCl2 • 2H2O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль
Из формулы BaCl2 • 2H2O следует, что 1 моль дигидрата хлорида бария содержит
2 моль Н2О.
Отсюда можно определить массу воды, содержащейся в BaCl2 • 2H2O:
m(H2O) = 2 • 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O.
ω(H2O) = m(H2O)/ m(BaCl2 • 2H2O) = 36/244 = 0,1475 = 14,75%.
Ответ: ω(H2O) = 0,1475 = 14,75%.
Вывод формул соединений
Задача №2. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7, 34,8 и 40,5%.
Дано:
ω(K) =24,7%;
ω(Mn) =34,8%;
ω(O) =40,5%.
Найти:
формулу соединения.
Решение:
Для расчетов выбираем массу соединения, равную 100 г, т.е. m=100 г. Массы калия, марганца и кислорода составят:
m (К) = m •ω(К); m (К) = 100 • 0,247= 24,7 г;
m (Mn) = m •ω(Mn); m (Mn) =100 • 0,348=34,8 г;
m (O) = m •ω(O); m (O) = 100 • 0,405 = 40,5 г.
Определяем количества веществ атомных калия, марганца и кислорода:
ν(К)= m(К)/ М( К) = 24,7/39= 0,63 моль
ν(Mn)= m(Mn)/ М( Mn) = 34,8/ 55 = 0,63 моль
ν(O)= m(O)/ М(O) = 40,5/16 = 2,5 моль
Находим отношение количеств веществ:
ν(К) : ν(Mn) : ν(O) = 0,63 : 0,63 : 2,5.
Разделив правую часть равенства на меньшее число (0,63) получим:
ν(К) : ν(Mn) : ν(O) = 1 : 1 : 4.
Следовательно, простейшая формула соединения KMnO4.
Ответ: формула соединения KMnO4.
или
Задача №3
Найти эмпирическую формулу оксида марганца MnхOу, содержащего 63,2% марганца.
Дано:
ω(Mn) =63,2%
Найти: формулу MnхOу
Решение.
Атомные массы марганца и кислорода равны соответственно 55 и 16. Поэтому массы марганца и кислорода в составе оксида относятся как 55х : 16у. Массовая доля марганца равна 63,2%, тогда массовая доля кислорода равна:
100% - 63,2% = 36,8%
Следовательно: 55х : 16у = 63,2 : 36,8,
Откуда х : у =
![]() :
: ![]() = 1,15 : 2,3
= 1,15 : 2,3
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них:
х : у = ![]() :
: ![]() = 1 : 2
= 1 : 2
Таким образом эмпирическая (простейшая) формула оксида марганца: MnO2.
Ответ: MnO2
Определение химической формулы вещества по продуктам его сгорания.
Задача №4. При сгорании органического вещества массой 4,8 г образовалось 3,36 л CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества.
Решение.
Продукты сгорания вещества состоят из трех элементов: углерода, водорода, кислорода. При этом очевидно, что в состав этого соединения входил весь углерод, содержащийся в CO2, и весь водород, перешедший в воду. А вот кислород мог присоединиться во время горения из воздуха, а мог и частично содержаться в самом веществе. Для определения простейшей формулы соединения нам необходимо знать его элементный состав. Найдем количество продуктов реакции (в моль):
ν (CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль
ν (H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль
Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: ν(H) = 2ν(H2O), так как в одной молекуле воды содержатся два атома водорода. Вычислим их массы по формуле:
m = ν х M
m(H) = 0,6 моль х 1 г/моль = 0,6 г
m(С) = 0,15 моль х 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного вещества:
m(O) = 4,8 - (0,6 + 1,8) = 2,4 г
Найдем число моль атомов кислорода:
ν (O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям:
ν (CO2) : ν(H) : ν (O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на нее.
Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдем значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы:
x = M(CH4O)х / M(CH4O)
Зная относительную плотность исходного вещества по водороду, найдем молярную массу вещества:
M(CH4O)х = M(H2) х D(H2) = 2 г/моль х 16 = 32 г/моль
x = 32 г/моль / 32 г/моль = 1
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x = 32; 32 x = 32; x = 1
Ответ. Формула исходного органического вещества CH4O.
Растворы. Массовая доля компонента раствора
Задача №5.Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2–тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде.
Дано:
m = 20 г;
m(C2H2Br )=86,5 г.
Найти:
ω(СаC2) =?
Решение:
Записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC2 +2 H2O = Ca(OH)2 + C2H2
C2H2 +2 Br2 = C2H2Br4
Находим количество вещества тетрабромэтана.
ν(C2H2Br4) = m(C2H2Br4)/ М(C2H2Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что
ν(C2H2Br4) =ν(C2H2) = ν(СаC2) =0,25 моль.
Отсюда мы можем найти массу чистого карбида кальция (без примесей). m(СаC2) = ν(СаC2) • М(СаC2) = 0,25• 64 = 16 г.
Определяем массовую долю СаC2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Ответ: ω(СаC2) = 80%
Задача №6. В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Дано:
V(C6H6) =170 мл;
m(S) = 1,8 г;
ρ(С6Н6)=0,88 г/мл.
Найти:
ω(S) =?
Решение:
Для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора:
Определяем массу бензола
m(С6C6) = ρ(С6C6) •V(C6H6) = 0,88•170=149,6 г.
Находим общую массу раствора
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
Ответ: ω(S) = 1,19%
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. Однако в реальных химических процессах из-за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции (или массовая доля выхода) – это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т.е. η = [mp(X) •100]/m(X)
Где η– выход продукта, %;
mp(X) - масса продукта Х, полученного в реальном процессе;
m(X) – рассчитанная масса вещества Х.
В тех задачах, где выход продукта не указан, предполагается, что он – количественный (теоретический), т.е. η=100%.
Теория и реальность (задачи на выход продукта)
Схемы расчетов по химическим уравнениям основываются на законе сохранения массы веществ и справедливы, если в реакцию вступают абсолютно чистые вещества и их взаимодействие протекает без потерь. Однако на практике продуктов реакции всегда образуется меньше, чем должно было получиться в соответствии с расчетами. Поэтому одна из важнейших характеристик химико-технологического процесса - практический выход продукта реакции т.е. η = [mp(X) •100]/m(X) (4)
Где η– выход продукта, %;
mp(X) - масса продукта Х, полученного в реальном процессе;
m(X) – рассчитанная масса вещества Х.
В тех задачах, где выход продукта не указан, предполагается, что он – количественный (теоретический), т.е. η=100%.
Задача №7.При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход продукта реакции.
Дано: V(H2S)=2,8 л;
m(осадка)= 11,4 г; н.у.
Найти:
η =?
Решение:
Записываем уравнение реакции взаимодействия сероводорода и сульфата меди (II).
H2S + CuSO4 = CuS ↓+ H2SO4
Определяем количество вещества сероводорода, участвующего в реакции:
ν(H2S) = V(H2S) / Vm = 2,8/22,4 = 0,125 моль.
Из уравнения реакции следует, что ν(H2S) = ν(СuS) = 0,125 моль.
Значит можно найти теоретическую массу СuS.
m(СuS) = ν(СuS) • М(СuS) = 0,125 • 96 = 12 г.
Теперь определяем выход продукта, пользуясь формулой (4):
η = [mp(X) •100]/m(X)= 11,4 • 100/ 12 = 95%.
Ответ: η = 95%
Задача №8. В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола.
Решение.
3C2H2 (650 оС, активированный уголь) = C6H6
ν (C2H2) = V(C2H2)/ VM = 120 л : 22,4 л/моль = 5,35 моль
ν (C6H6)теор = 1/3 х ν(C2H2) = 1/3 х 5,35 моль = 1,785 моль
ν (C6H6)практ = m(C6H6)/ M(C6H6) = 60 г : 78 г/моль = 0,77 моль
h = (nпракт : nтеор) х 100% = (0,77 : 1,785) х 100% = 43%
Ответ. 43%.
Реакции, в которых один из реагентов взят в избытке
Задача №9. Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность ρ = 0,8 г/мл).
Решение.
В условии задачи даны количества обоих реагентов - это верный признак того, что какой-нибудь из них находится в избытке. Найдем массу этанола, введенного в реакцию:
m(раствора) = V х ρ = 100 мл х 0,8 г/мл = 80 г
m(C2H5OH) = {m(раствора) х w%} : 100% = 80 г х 0,96 = 76,8 г
(1) 2C2H5OH + 2Na = 2C2H5ONa + H2
на 2 моль этанола -- 2 моль натрия -- 1 моль водорода
Найдем заданное количество этанола в моль:
ν (C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль
Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного водорода будет определяться количеством этанола:
ν 1(H2) = 1/2 ν (C2H5OH) = 1/2 х 1,67 моль = 0,835 моль
V1(H2) = ν 1(H2) х VM = 0,835 моль х 22,4 л/моль = 18,7 л
Но это еще не окончательный ответ. Будьте внимательны!
Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
Найдем массу воды:
m(H2O) = {m(раствора) х w%} : 100% = 80 г х 0,04 = 3,2 г
ν (H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = = 0,178 моль
(2) 2H2O + 2Na = 2NaOH + H2
на 2 моль воды -- 2 моль натрия -- 1 моль водорода
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит:
ν (Na, остаток) = 2 моль - 1,67 моль = 0,33 моль
Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода, выделившегося по реакции (2):
ν 2(H2) = 1/2 ν (H2O) = 1/2 х 0,178 моль = 0,089 моль
V2(H2) = ν 2(H2) х VM = 0,089 моль х 22,4 л/моль = 1,99 л
Общий объем водорода:
V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л
Ответ: V(H2) = 20,69 л
Реакции, протекающие в газовой фазе
Для реакций, протекающих между газообразными веществами, отношение объемов реагирующих веществ и продуктов реакции равно отношению соответствующих коэффициентов уравнения реакции.
Задача №10. Какой объем воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена?
Решение.
(1) CH4 + 2O2 = CO2 + 2H2O
на 1 моль CH4 ---- 2 моль 2O2
(2) 2C2H2 + 5O2 = 4CO2 + 2H2O
на 2 моль 2C2H2 -- 5 моль 2O2
Объем кислорода, который пойдет на сжигание заданного объема метана V1(O2) и ацетилена V2(O2), составит:
V1(O2) = 2V(CH4) = 2 х 5 = 10 л
V2(O2) = 5/2 V(C2H2) = 5/2 х 15 = 37,5 л
V(O2) = V1(O2) + V2(O2) = 10 л + 37,5 л = 47,5 л
Отсюда рассчитаем объем воздуха на сжигание (содержание кислорода в воздухе принимаем равным 21% по объему):
V(воздуха) = V(O2) : 0,21 = 47,5 л : 0,21 = 226 л
Ответ. V(воздуха) = 226 л
Раздел 2. Физическая и коллоидная химия.
Агрегатное состояние вещества
Идеальные газы — это газы, в которых можно пренебречь силами взаимодействия между молекулами и объемом самих молекул. Идеальный газ — это очень разреженный газ. Свойства идеального газа зависят не от природы газа, а от температуры и давления.
Состояние газа характеризуется следующими параметрами: температурой (Т), давлением (р) и объемом (V).
Температура в международной системе единиц (СИ) выражается в градусах Кельвина (0К).
Соотношение между градусами Цельсия (°С) и Кельвина выражается уравнением
T = t °С+273.
Давление газа выражается в паскалях (Па) и ньютонах на квадратный метр (Н/м2) в системе СИ.
1ат = 760мм рт.ст. = 101325 Па
Объем выражается в м3
1л = 1000см3; 1м3 = 1000л; 1л = 1*10-3м3.
Нормальные условия (н.у) для газа характеризуются следующими параметрами:
температура t = 00С (Т0=2730К и давление р = 101325Па.
При нормальных условиях объем одного моля газа равен:
V0= 22,4л = 22,4*10-3м3
Отношение ![]() есть
величина постоянная и обозначается буквой R.
есть
величина постоянная и обозначается буквой R.
R – универсальная газовая постоянная, не зависит от природы газа
R = 8,314*103![]() (в
системе СИ)
(в
системе СИ)
R – показывает работу расширения, которую может произвести один моль газа при нагревании его на 10С при постоянном давлении.
Зависимость между объемом V, давлением р и температурой Т выражается уравнением состояния идеального газа и называется уравнением Менделеева – Клапейрона:
р* V = n*R*T,
где n- число молей
n
= ![]() ,
,
где m – масса газа;
М – молярная масса этого же газа.
После подстановки этих значений в уравнение Менделеева – Клапейрона, оно примет вид:
P*V
= ![]() *
R*T
*
R*T
При решении задач следует следить за тем, чтобы все единицы были соразмерны.
Задача №1. Определить молярную массу газа, 0,45 г которого при давлении 106660 Па и температуре 27оС занимает объем 0,38 л
|
Дано: m=0,45 г = 0,45 г *10-3 кг p=106,66*103 Па Т=273+27=300оК V=0,38 л = 0,38*10-3 м3 |
Решение: R=8,314*10-3 Дж/кмоль*К
|
|
М=? |
|
Ответ: М = 28кг/кмоль
Задача №2. Определить массу азота, занимающего объем 5 л при температуре 17оС и давлении 202650 Па.
|
Дано: V=5 л = 5*10-3 м3 Т=273+27=300оК p=202,65*103 Па
|
Решение: R=8,314*10-3 Дж/кмоль*К
|
|
m=? |
Ответ: m=
![]()
Задача №3. Определить давление в Па, под которым будет находиться 13,5 г оксида углерода (II) СО в сосуде емкостью 8 л при температуре 150оС
|
Дано: m=13,5 г = 13,5*10-3 кг
V=8 л = 8*10-3 м3 Т=273+150=423оК
|
Решение:
|
|
p=? |
|
Ответ: р= ![]()
Задача№4. В баллоне
емкостью 12 л находится кислород под давлением 141,85*![]() Па при температуре 10оС.
Какой объем займет это же количество газа при нормальных условиях?
Па при температуре 10оС.
Какой объем займет это же количество газа при нормальных условиях?
|
Дано: V=12 л = 12*10-3 м3 p=141,85*105 Па Т=273+10=273о К p0=101325 Па Т0= 273оК
|
Решение:
|
|
V0=? |
Ответ: V0 = 1,6м3
Свойства растворов
Закон Вант-Гоффа устанавливает, что осмотическое давление прямо пропорционально концентрации раствора и абсолютной температуре.
Росм. = C*R*T,
где Росм. — осмотическое давление, Па;
С — концентрация раствора, кмоль/м2;
R— универсальная газовая постоянная, R = =8,314 * 103 Дж/кмоль К;
Т — абсолютная температура, °К.
Концентрацию С можно выразить через массу растворенного вещества m (кг)
С = ![]()
где М — молярная масса растворенного вещества, кг/кмоль;
V — объем раствора, м3.
Росм *V = ![]() *R*T, тогда Росм =
*R*T, тогда Росм = ![]() * R*T.
* R*T.
Задача№5. Осмотическое давление раствора, содержащего 3 г сахара в 250 см3 раствора, составляет при температуре 12°С 83090 Па. Определить молярную массу сахара.
Дано:
m=3 г
V=250 мл=0,25*10-3 м3
Р осм =83090 Па
Т=273+12=285°К
R=8,314*103 Дж/кмоль К
М = ?
Решение
Росм = ![]() * R*T.
* R*T.
M = ![]() =
= ![]() =342 кг/кмоль
=342 кг/кмоль
Ответ: M = 342 кг/кмоль.
Важной характеристикой растворов является давление насыщенного пара.
При прочих равных условиях испарение с поверхности растворителя больше, чем с поверхности раствора, поэтому давление пара над раствором (Р) меньше, чем над чистым растворителем (Р0). Чем выше концентрация раствора, тем меньше давление насыщенного пара.
Согласно закону Рауля относительное понижение давления пара раствора прямо пропорционально количеству растворенного вещества.
Разность между давлением пара чистого растворителя и растворителя над раствором называют понижением давления насыщенного пара (ΔР).
ΔР = Ро —Р.
Зависимость понижения давления насыщенного пара от концентрации растворенного вещества установил Рауль в: виде следующего соотношения:
![]() =
= ![]() или
или ![]() =
= ![]()
где Р0 —давление пара над чистым растворителем;
Р — давление пара над раствором;
nа — число молей растворенного вещества;
nв — число молей растворителя;
nа и nв можно
определить делением массы вещества m на его молярную
массу М, то есть ![]()
Закон Рауля: в разбавленных растворах неэлектролитов при постоянной температуре относительное понижение давления пара растворителя над раствором равно отношению числа молей растворенного вещества к сумме числа молей растворенного вещества и растворителя.
Для сильно разбавленных растворов величина Па мала по сравнению с nв, поэтому этой величиной в знаменателе можно пренебречь. Тогда формула упрощается:
![]() =
= ![]()
Задача№6. Вычислить давление пара 1%-ного водного раствора мочевины CO(NH2)2 при t = 50°C. Давление паров воды при этой температуре равно 12330 Па.
|
Дано: mмоч = 1 г = 1 * 10-3 кг Mмоч = 60 кг/кмоль
p0 = 12330 Па |
Решение: 1%-ный раствор мочевины состоит из 1 части мочевины и 99 частей воды. Подсчитываем молярные масс: Определяем число молей: Мочевины Воды
P=12330 - 40=12290 Па Ответ: р=12290Па
|
|
Р=? |
Пользуясь законом Рауля, можно вычислить молярную массу растворенного вещества.
Температура замерзания и кипения растворов зависит от давления над растворами.
Чистые жидкости замерзают и кипят при постоянной температуре. Растворы кипят при более высокой температуре, чем чистые растворители, так как давление пара над чистым растворителем выше, чем над раствором и, чтобы достичь атмосферного давления, надо сильнее нагревать жидкость.
I закон Рауля. Повышение температуры кипения растворов прямо пропорционально моляльной концентрации
ΔtKип = Кэб * С,
Где Δt кип - повышение температуры кипения раствора по сравнению с чистым растворителем;
Кэб—эбулиоскопическая постоянная растворителя (для воды Кэ=0,52);
С—моляльная концентрация раствора
C = ![]()
где m — масса растворенного вещества;
М — молярная масса растворенного вещества, г/моль;
L—масса растворителя, г.
Подставив в формулу значение С, получим
Δt кип = Кэб*![]()
Температуру кипения раствора можно определить по формуле
![]() =
= ![]() + Δt кип
+ Δt кип
где ![]() температура кипения раствора;
температура кипения раствора;
![]() — температура кипения чистого
растворителя.
— температура кипения чистого
растворителя.
Температура замерзания раствора ниже, чем температура замерзания чистого растворителя. Вода замерзает при 0°С, раствор при более низкой температуре. Испарение происходит не только с поверхности жидкости, по и со льда. Всякая жидкость замерзает тогда, когда давление насыщенного пара над жидкостью станет равным давлению насыщенного пара надо льдом. Чем выше концентрация раствора, тем ниже температура его замерзания.
II закон Рауля. Понижение температуры замерзания раствора прямо пропорционально его моляльной концентрации
Δt зам = Ккр*С,
где Δt зам — понижение температуры замерзания раствора по сравнению с чистым растворителем;
Ккр—криоскопическая постоянная растворителя (для воды Ккр=1,86);
С—моляльная концентрация раствора.
Δt зам = Ккр*![]()
Понижение температуры замерзания раствора можно рассчитать по формуле
![]() =
= ![]() - Δt зам
- Δt зам
Исходя из законов Рауля, можно рассчитать молярную массу растворенного вещества, определив опытным путем понижение температуры замерзания раствора (криоскопический метод) или повышение температуры кипения раствора (эбулиоскопический метод).
M = ![]()
Задача №7. На сколько градусов повысится температура кипения, если в 100 г воды растворить 5 г сахара? Кэб=0,52.
|
Дано: m = 5 г L = 100 г Mсах = 342 г/моль Кэб = 0,52 |
Решение:
|
|
|
Ответ: Δt кип = 0,0790С
Задача №8. При какой температуре должен замерзать 20%-ный водный раствор уксусной
кислоты? Ккр = 1,86.
|
Дано: m = 20 г L = 80 г Mук = 60 г/моль Ккр = 1,86о |
Решение: 20%-ный водный раствор кислоты состоит из 20 г кислоты и 80 г воды. Молярная
масса уксусной кислоты Определяем понижение температуры замерзания
|
|
|
Понижение температуры замерзания раствора At зам равно разности температур замерзания растворителя и раствора
![]() -
- ![]()
![]() =
= ![]() - Δt зам
- Δt зам
Подставив в эту формулу значения, получим
![]() = 00 – 15,40
= - 15,40С
= 00 – 15,40
= - 15,40С
Ответ: tзам= -15,40С
Упражнения.
1. При какой температуре будет кипеть 10%-ный раствор мальтозы С12Н22О11?
Кэб = 0,52.
2. При какой температуре будет замерзать раствор, содержащий 3 г нафталина С10Н8 в 40г бензола. Температура замерзания бензола 5,50С. Ккр= 5,1.
3. При растворении 13г вещества в 400г воды температура кипения повысилась на 0,570С. Определить молярную массу вещества.
4. Сколько грамм глюкозы С6Н12О6 надо растворить в 52 г воды, чтобы повысить температуру кипения на 0,50С? Кэб = 0,52.
5. Найти температуру замерзания 7%-ного водного раствора глицерина С3Н8О3.
Ккр= 1,86.
Тема 2.4. Растворы высокомолекулярных соединений
Электрокинетические явления.
Пример. Составить формулу мицеллы сульфата бария, полученного при взаимодействии хлорида бария с избытком серной кислоты.
Решение.
Пишем уравнение реакции
BaCl2 + H2SО4 = BaSО4 ↓+ 2HCl
Ядро m(BaSО4) выпадает в осадок.
Стабилизатор золя H2SО4 взят в избытке.
Потенцналопределяющие ионы — SО42-, (общие в осадке и веществе, взятом в избытке), противоион — Н+.
Формула мицеллы сульфата бария примет вид
![]() [m
(BaSО4 * nSО42-
* 2 (n
— х)Н+]2- * 2хН+
[m
(BaSО4 * nSО42-
* 2 (n
— х)Н+]2- * 2хН+
![]()
![]() Ядро | адсорбционный | диффузный
Ядро | адсорбционный | диффузный
![]() слой
слой
![]()
![]() гранула
гранула
![]()
![]() мицелла
мицелла
Упражнения.
1. Приведите формулу и схему строения мицеллы хлорида серебра, полученного при взаимодействии NaCl с избытком AgNO3.
2. Приведите формулу и схему строения мицеллы хлорида серебра, полученного при взаимодействии AgNO3с избытком NaCl.
3. Приведите формулу и схему строения мицеллы карбоната кальция, полученного при взаимодействии CaCl2 с избытком Na2CO3.
4. Приведите формулу и схему строения мицеллы карбоната кальция, полученного при взаимодействии Na2CO3 с избытком CaCl2.
Раздел 3 Аналитическая химия
3.1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ
При изучении материала данной темы надо обратить внимание на то, что процесс диссоциации слабых электролитов и химические реакции, связанные с ней, протекают в двух взаимно противоположных направлениях до наступления химического равновесия. Момент наступления химического равновесия характеризуется постоянной величиной, называемой константой электролитической диссоциации. Напишем уравнение реакции диссоциации слабого электролита в общем виде:
АВ ↔ А+ + В-
Если обозначить концентрацию недиссоциированных молекул через [АВ], концентрацию ионов через [А+] и [В-], то выражение константы диссоциации принимает вид:
[А+] * [В-]
![]() Кд =
Кд =
[АВ]
Константа диссоциации - это отношение произведения концентрации ионов к концентрации недиссоциированных молекул.
Физический смысл константы диссоциации в том, что чем больше величина константы, тем сильнее диссоциирует слабый электролит.
Для того чтобы количественно охарактеризовать диссоциацию электролита, введено понятие степени диссоциации (α). Она равна отношению числа молекул, распавшихся на ионы (Сдис), к общему числу растворенных молекул (Собщ):
α= ![]()
Следует знать, что степень диссоциации выражается или в десятичных дробях или в процентах.
Между константой и степенью электролитической диссоциации слабого электролита существует следующая зависимость:
Кд = С* α2;
α = ![]()
где α - степень диссоциации;
К - константа диссоциации;
С - молярная концентрация слабого электролита.
Расчетные задачи.
Задача №1. Вычислить степень диссоциации сернистой кислоты, если в 1л 0, 5м раствора распадается на ионы 0, 01 молей.
Дано Решение
Собщ = 0, 5 м. Сдис 0, 01
![]()
![]() Сдис = 0, 01
м. α = = ;
α = 0,2 * 100% = 20%
Сдис = 0, 01
м. α = = ;
α = 0,2 * 100% = 20%
![]() Собщ
0,5
Собщ
0,5
α - ?
Ответ: α =20%
Задача №2. Вычислить степень диссоциации гидроокиси аммония в 2 м растворе, если константа диссоциации 1, 79 * 10-5.
![]()
![]() Дано Решение
Дано Решение
![]()
![]()
![]()
![]() С =
2м. 1, 79 *
10-5
С =
2м. 1, 79 *
10-5
![]()
![]() Кд = 1,
79 * 10-5 α =
Кд = 1,
79 * 10-5 α = ![]() = =
0,895 *10-5 = 2
= =
0,895 *10-5 = 2
α - ?
= 2, 9 * 10-3
Ответ: α =2, 9 * 10-3
Задача №3. Вычислить константу диссоциации гидроокиси аммония, если известно, что степень диссоциации в 0, 1м. растворе равна 2%.
Дано Решение
С = 0, 1 м. Кд = С α 2 = 0, 1 * (2 * 10-2)2 = 0, 4 * 10-4.
α![]() = 2% или 2 * 10-2
= 2% или 2 * 10-2
Кд = ?
Ответ: Кд= 0,4*10-4
Необратимой реакцией называется такая, которая протекает до конца. Реакции между растворами электролитов протекают до конца в тех случаях, если в результате образуется осадок, выделяется газ или образуется малодиссоциируемое вещество.
Например:
1. Реакции, идущие с образованием осадка (между нитратом серебра и соляной кислотой)
Запишем уравнение реакции в молекулярной форме:
AgNO3 + HCl = AgCl↓ + HNO3
Ионное уравнение реакции:
Ag+ + NO3- + H+ + Cl- = AgCl↓ + H+ + NO3-
Сокращенное ионное уравнение:
Ag+ + Cl- = AgCl↓
2.Реакции, идущие с образованием газа ( между карбонатом натрия и серной кислотой):
![]() H2O
H2O
![]() (молекулярная
форма) Na2CO3 + H2SO4
= Na2SO4 + H2CO3
(молекулярная
форма) Na2CO3 + H2SO4
= Na2SO4 + H2CO3
CO2↑
(ионная форма) 2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + H2O + CO2↑
(сокращенное ионная форма): CO32- + 2H+ = H2O + CO2↑
2. Реакции, идущие с образованием малодиссоцируемого вещества (между хлоридом аммония и гидроксидом натрия):
(молекулярная форма) NH4Cl + NaOH = NaCl + NH4OH
(ионная форма) NH4+ + Cl- + Na+ + OH- = Na+ + Cl- + NH4OH
(сокращенное ионная форма) NH4+ + OH- = NH4OH
Упражнения.
1. Напишите уравнение диссоциации следующих веществ: фосфорной кислоты H3PO4; хлорида алюминия AlCl3; нитрата калия KNO3; гидроксида бария Ba(OH)2; сульфата хрома (III) Cr2(SO4)3.
2. Напишите выражение константы диссоциации для следующих электролитов: сернистой кислоты H2SO3; гидроксида аммония NH4OH.
3. Константа диссоциации хлорноватистой кислоты равно 4*10-8. Найдите степень диссоциации раствора кислоты в 1M растворе.
4. Степень диссоциации 0,001M. муравьиной кислоты 36,8 %. Чему равна константа диссоциации кислоты?
5. Напишите ионные уравнения для реакции между:
а) хлоридом кальция СаCl2и сульфатом калия K2SO4;
б) нитратом алюминия Аl(NO3)3и и гидроксидом натрия КOH;.
в) карбонатом натрия Na2CO3и соляной кислотой HCl.
Произведение растворимости.
Нужно научиться по произведению растворимости вычислять растворимость вещества, а по растворимости - произведение растворимости.
В расчетах можно использовать следующие математические выражения:
ПР
= Р2; Р = ![]()
где ПР - произведение растворимости малорастворимого электролита;
Р - растворимость этого электролита, моль/л.
Эта формула применима, если растворимость выражена в моль/л, если же
Р г/л
![]() растворимость выражена в
г/л, Рмоль/л =
растворимость выражена в
г/л, Рмоль/л =
М
Задача №4. Растворимость хлорида серебра при 200С равна 1, 25 * 10-5 моль/ л. Вычислить произведение растворимости AgCl.
Дано Решение
РAgCl = 1, 25 * 10-5моль/л Так как для AgCl концентрация ионов
![]() t
= 200С [Ag+] и [Cl-]
будет численно равна раст-
t
= 200С [Ag+] и [Cl-]
будет численно равна раст-
воримости AgCl, то [Ag+] = [Cl-] = Р =
ПР - ? = 1, 25 * 10-5 моль/л.
ПРAgCl = [Ag+] * [Cl-] = P2 = (1, 25 * 10-5)2 = 1, 56 * 10-10.
Ответ: ПРAgCl=1,56*10-10
Задача №5. Вычислить растворимость углекислого бария, выраженную в молях/л и в г/л, если произведение растворимости углекислого бария равно 8 * 10-9.
Дано Решение
![]() ПРBaCO3 = 8 * 10-9 1.
Вычисляем растворимость BaCO3, вы-
ПРBaCO3 = 8 * 10-9 1.
Вычисляем растворимость BaCO3, вы-
раженную в моль/л:
![]()
![]() Р BaCO3 - ?
Р BaCO3 - ?
![]() Р = ПР BaCO3 =
8 * 10-9 = 8,945 * 10-5 моль/л.
Р = ПР BaCO3 =
8 * 10-9 = 8,945 * 10-5 моль/л.
2.Вычисляем растворимость данного вещества, выраженную в г/л:
М BaCO3 = 197, 35 г/моль;
Рг/л = Рмоль/л * М BaCO3 = 8, 9 * 10-5 * 197, 35 = 1, 76г/л.
Ответ: Р = 8,9*10-5моль/л; Р = 1,76г/л
Ионное произведение воды.
Произведение концентраций ионов водорода и гидроксид-ионов в воде называют ионным произведением воды.
Кв = [H+]*[OH-] = 10-14
[H+]*[OH-] = 10-14
Отсюда, зная концентрацию одного из ионов, можно вычислить концентрацию другого иона в растворе:
[H+] = ![]() [OH-] =
[OH-] = ![]()
Для измерения концентрации ионов водорода введена особая единица, называемая водородным показателем.
Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода и обозначается pH:
pH= -lg[H+].
В нейтральной среде pH=7; в кислой - pH < 7, в щелочной - pH > 7.
Во всяком водном растворе pH + pOH = 14.
Задача №6. Вычислить pH раствора, в котором концентрация ионов [H+] равна 0, 01 моль/л. Указать среду.
Решение. Число 0, 01 можно представить как 1*10-2,
тогда pH = - lg [H+] = - lg [10-2] = - [-2] = 2.
Так как pH < 7, то среда раствора кислая.
Задача №7. pH = 10. Определить концентрацию ионов водорода.
Решение. pH = - lg [H+]; [H+] = 10-10.
Задача №8. pH раствора равен 2. Что надо добавить к этому раствору (кислоту или щелочь), чтобы довести pH до 10?
Решение. Если pH = 2, то реакция среды кислая. При pH = 10 реакция среды щелочная, поэтому надо к раствору добавить щелочь.
Гидролиз
Гидролизом соли называется реакция взаимодействия ионов соли с водой, приводящая к образованию слабого электролита, Любую соль можно представить как продукт взаимодействия кислоты и основания.
Гидролиз происходит в том случае, если в результате реакции образуется малодиссоциированное вещество.
Рассмотрим гидролиз разных видов солей.
Соль, образованная сильным основанием и слабой кислотой
В результате гидролиза такой соли в растворе находятся сильно диссоциирующее основание и слабо диссоциирующая кислота. Следовательно, образуется больше ионов ОН-, чем ионов Н+, и раствор имеет щелочную реакцию ( pH > 7 ).
Например: СН3СООК + НОН ↔ КОН + СН3СООН
СН3СОО- + НОН ↔ СН3СООН + ОН-.
При этом образуется слабодиссоциирующая уксусная кислота и сильно диссоциирующий едкий калий.
Соль, образованная слабым основанием и сильной кислотой
В результате гидролиза такой соли в растворе образуются слабодиссоциирующее основание и сильная кислота. Следовательно, в растворе будет больше ионов Н+, чем ионов ОН-, и он приобретает кислую реакцию ( pH < 7 ).
Например: NH4Cl + HOH ↔ NH4OH + HCl
NH4+ + HOH ↔ NH4OH + H+
В растворе образуются слабо диссоциирующий гидроксид аммония и сильно диссоциирующая соляная кислота, поэтому реакция раствора кислая (PH < 7).
Продукты гидролиза такой соли – слабая кислота и слабое основание. При этом, в зависимости от степени диссоциации продуктов гидролиза (кислоты или основания), в растворе преобладают ионы Н+ или ионы ОН-, и реакция соответственно слабокислая, слабощелочная или нейтральная ( это зависит от константы диссоциации электролита ).
Например: а) гидролиз карбоната аммония идет ступенчато.
![]() (NH4)2CO3
+ H2O = NH4HCO3 + NH4OH
(NH4)2CO3
+ H2O = NH4HCO3 + NH4OH
![]() NH4
++CO3-2 + HOH = HCO3- +
NH4OH I ступень
NH4
++CO3-2 + HOH = HCO3- +
NH4OH I ступень
NH4HCO3 + HOH = NH4OH = NH4OH + H2CO3 – II ступень
Раствор имеет слабощелочную реакцию среды;
б) ацетат аммония в результате гидролиза образует уксусную кислоту и гидроксид аммония.
CH3COONH4 + HOH = NH4OH + CH3COOH
CH3COO- + NH4 ++ HOH = NH4OH + CH3COOH.
В данном случае степени диссоциации растворов почти одинаковы, поэтому среда нейтральная (pH ~ 7).
Соли, образованные многоосновыными кислотами и основаниями
Такие соли вступают в реакцию гидролиза ступенчато. В качестве промежуточных продуктов образуются кислые и основные соли.
Например: а) в обычных условиях гидролиз карбоната натрия протекает практически по первой ступени: ионы СО32- связывают ионы Н+ воды, образуя сначала ион НСО3-, а не молекулу Н2СО3. Это объясняется тем, что ионы НСО3- диссоциируют гораздо труднее, чем молекулы Н2СО3.
Na2CO3 + H2O ↔ NaHCO3 + NaOH – I ступень
гидрокарбонат натрия
CO32- + HOH ↔ HCO3- + OH-.
гидрокарбонат ион
Раствор имеет щелочную реакцию ( pH > 7 );
б) FeCl3 + HOH ↔ FeOHCl2 + HCl – I ступень
гидроксихлорид железа ( III )
Fe3+ + HOH ↔ FeOH2+ + H+.
гидроксид железа (III) ион
Раствор имеет кислую реакцию (pH < 7).
Упражнения.
1. Растворимость карбоната кальция СаCO3 равно 0,0069 г/л. Найдите произведение растворимости карбоната кальция.
2. Произведение растворимости сульфата свинца PbSO4 равно 2,2*10-8. Чему равна его растворимость? Растворимость выразить в г/л и моль/л.
3. Приведите математическое выражение произведения растворимости хлорида серебра AgCl, сульфата кальция CaSO4, сульфида меди CuS.
4. Чему равен водородный показатель, если [OH-]= 10-6 г-ион/л. Укажите реакцию среды.
5. Водородный показатель равен 4.Чему равна [OH-]?
6. Вычислите рН раствора, в котором концентрация ионов [OH-] равна 0,00001 г-ион/л.
7. Чему равен гидроксидный показатель, если концентрация ионов водорода 0,0000001 г-ион/л?
8. Концентрация ионов водорода 10-2г-ион/л. Чему равен водородный показатель?
9. Какие соли подвергаются гидролизу: K2SO4, K2CO3, Mg(NO3)2? Подтвердите уравнениями реакций.
10. Напишите уравнение гидролиза следующих солей: нитрата аммония NH4NO3, хлорида меди CuCl2, фосфата калия К3РО4. Укажите реакцию среды.
Окислительно-восставновительные реакции
Химические процессы, при которых элементы или ионы, участвующие в реакции, изменяют свою степень окисления, называются реакциями окисления – восстановления.
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит из ионов. Степень окисления может иметь отрицательное, положительное и нулевое значение. При составлении окислительно – восстановительных реакций нужно иметь в виду:
1. Атомы элементов до отдачи или присоединения электронов заряда не имеют ( Н20; Cl20; Fe0; Al0 );
2. При отдаче атомом электронов количество протонов в ядре будет больше количества электронов – атом превращается в положительно заряженный ион. Атом, отдающий электроны, называется восстановителем;
Na0 – ē = Na+ (Na0 – восстановитель)
3. Атом, получивший лишние электроны, будет заряжен отрицательно, т. к. при этом общая сумма электронов, вращающаяся вокруг ядра, будет больше заряда ядра. Атом, присоединяющий электроны, называется окислителем.
Cl0 + ē = Cl- (Cl0 – окислитель)
4. Процесс отдачи атомом, молекулой или ионов электронов, называется окислением, процесс присоединения электронов – восстановлением.
Аl0 – 3ē = Аl3+ - окисление
S0 + 2ē = S2- - восстановление
Оба процесса протекают одновременно – окислитель восстанавливается, а восстановитель окисляется. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Происходит лишь перераспределение электронов.
5. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
Степень окисления атомов в сложных соединениях легко вычислить. Например, степень окисления азота в азотной кислоте (HNO3) равна +5; т. к. степень окисления водорода +1, кислорода –2, то азота Х, тогда +1+Х+(-2*3) = 0; Х = +5
H+1NO3-2 H+1N+5O3-2
При составлении уравнения окислительно – восстановительной реакции методом электронного баланса необходимо соблюдать следующую последовательность действий:
1. Установить состав и формулы взятых и полученных веществ;
2. Определить степень окисления участвующих в реакции элементов в исходных и полученных веществах;
3. Установить, что является окислителем и восстановителем в данной реакции, а также определить количество перемещенных электронов;
4. Подобрать коэффициенты в левой части уравнения на основе правила электронного баланса и в правой части – согласно закону сохранения массы ( баланса атомов ).
Задача №1. Составить уравнение окислительно – восстановительной реакции между хлоридом железа и хлором.
Решение. 1. Записываем схему реакции:
FeCl2 + Cl2 → FeCl3
2. Определяем степень окисления участвующих в реакции элементов:
Fe 2+Cl2 + Cl20 → Fe3+Cl3-
3. Составляем электронные уравнения и определяем окислитель и восстановитель в данной реакции:
![]()
![]() Fe2+
- ē = Fe3+ 2 окисление
Fe2+
- ē = Fe3+ 2 окисление
Cl20 + 2 ē = 2Cl- 1 восстановление
Следовательно, катион Fe2+ - восстановитель; молекула Cl20 – окислитель.
4. Находим коэффициенты при окислителе и восстановителе.
Уравнение принимает вид: 2FeCl2 + Cl2 = 2FeCl3.
Задача № 2. Составить уравнение реакции окисления сульфата железа (II ) перманганатом калия в кислой среде.
Решение. Реакция идет по схеме:
Fe+2SO4 + KMn+7O4 + H2SO4 → Fe+3(SO4)3 + Mn+2SO4 + K2SO4 + H2O.
2. Составляем электронные уравнения:
![]()
![]() Fe+2
- ē → Fe+3 5
окисление
Fe+2
- ē → Fe+3 5
окисление
Mn+7 + 5ē → Mn+2 1 восстановление
Следовательно, катион Fe+2 – восстановитель; катион Mn+7 – окислитель.
3. Находим коэффициенты, и уравнение принимает вид:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
Упражнения.
Методом электронного баланса расставьте коэффициенты в уравнении реакций, укажите окислитель и восстановитель:
а) Cu + HNO3→ Cu(NO3)2 + NO2 + H2O
б) PbO2+HCl → PbCl2+Cl2+H2O.
в) HCl+MnO2→Cl2+MnCl2+H2O.
г) H2S+KMnO4+H2SO4-→ S+MnSO4+K2SO4+H2O.
3.3. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Титриметрический (объемный) анализ
Концентрация растворов - количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
Существуют различные способы точного выражения концентрации растворов: процентная (по массе и объему), нормальная, молярная.
Процентная концентрация (по массе) выражается количеством граммов растворенного вещества, содержащегося в 100 г раствора.
Процентная концентрация (по объему) выражается количеством граммов растворенного вещества, содержащегося в 100 мл раствора.
Молярная концентрация, или молярность выражается числом молей растворенного вещества, содержащегося в 1 л раствора. Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется молярным (1м).
Нормальная концентрация, или нормальность выражается числом эквивалентов вещества, содержащегося в 1 л раствора. Раствор, в 1 л которого содержится 1 эквивалент растворенного вещества, называется нормальным (1н).
При титровании удобно выражать концентрацию растворов нормальностью, т. к. растворы одинаковой нормальности реагируют в равных объемах. При разных нормальностях эти растворы реагируют между собой в объемах, обратно пропорциональных их нормальностям.
N1 V2
![]()
![]() =
или N1 * V1
= N2 * V2,
=
или N1 * V1
= N2 * V2,
N2 V1
где N1 ; V1 – нормальность и объем одного раствора;
N2 ; V2 – нормальность и объем другого раствора.
Следует знать способы вычисления титра, нормальности, процентной концентрации вещества по массе и объему.
Вычисление титра ( Т ) производится:
а) если известна масса навески вещества в определенном объеме раствора, то по формуле:
m
![]() Т
= г/мл
Т
= г/мл
V
где m – масса навески вещества, г;
V – объем раствора, мл.
б) если известна нормальность раствора, то по формуле:
N * Э
![]() Т
= г/мл,
Т
= г/мл,
1000
где N – нормальность раствора;
Э – эквивалент растворенного вещества, г;
в) если известна плотность раствора, то по формуле:
а * p
![]() Т = г/мл
Т = г/мл
100
где а – концентрация вещества, %;
p – плотность раствора, г/см3.
Обучающийся должен помнить, что плотность раствора измеряется ареометром. По таблице «Плотность раствора», помещенной в конце учебника [4], определяют массовые проценты (и наоборот).
Титр рабочего раствора по определенному веществу можно вычислить по формуле:
Nр. в. * Эо. в
![]() Тр.
в/о. в = ,
Тр.
в/о. в = ,
1000
где Nр. в – нормальность рабочего раствора;
Эо. в – эквивалент определяемого вещества, г.
Титр рабочего раствора по определяемому веществу показывает, какое количество граммов определяемого вещества эквивалентно 1 мл рабочего раствора, например, титр 0, 1 н. раствора серной кислоты по NaOH равен 0, 04904 г/ мл, или ТH2SO4/NaOH = 0, 04904. Это значит, что 1 мл 0, 1 н. H2SO4 вступают в реакцию с 0, 04904 г NaOH.
Вычисление нормальности (N) производиться:
Т * 1000
![]() а) если известен титр
раствора, то по формуле N =
а) если известен титр
раствора, то по формуле N =
Э
где Т – титр раствора, г/мл;
Э – эквивалент вещества, г;
б) если известны объемы растворов реагирующих веществ и
нормальность одного из них, то по формуле N1V1 = N2V2, отсюда
N2 = ![]()
Вычисление массы навески вещества (m) для приготовления раствора с заданной нормальностью в данном объеме производится по формуле:
N * Э * V
![]() m = г.
m = г.
1000
где N – нормальность раствора;
Э – эквивалентность вещества, г;
V – объем раствора, мл.
Примеры решения задач.
Задача №1. На нейтрализацию 25 мл раствора едкого калия израсходовано 20, 5 мл 0, 2 н. соляной кислоты. Чему равна нормальность раствора едкого калия?
Дано Решение
VKOH = 25 мл NHCl * VHCl 0, 2 * 20, 5
![]()
![]() VHCl
= 20, 5 мл NKOH
= = = 0, 1640 н.
VHCl
= 20, 5 мл NKOH
= = = 0, 1640 н.
![]() NHCl
= 0, 2 н. VKOH 25
NHCl
= 0, 2 н. VKOH 25
NKOH - ?
Ответ: NКОН= 0,1640н
Задача №2. Найти нормальность соляной кислоты, если ТHCl равен 0, 003647 г/мл.
Дано Решение
0, 003645 * 1000
![]() ТHCl = 0, 003645 г/мл NHCl = ;
ТHCl = 0, 003645 г/мл NHCl = ;
![]() ЭHCl
ЭHCl
NHCl - ?
MHCl 0, 003645 * 1000
![]()
![]() ЭHCl
= = 36, 45 г; NHCl = =
0, 1000н.
ЭHCl
= = 36, 45 г; NHCl = =
0, 1000н.
1 36, 45
Ответ: NHCl= 0,1000н
Задача №3. Сколько мл азотной кислоты, плотность которой 1, 14 г/см3, нужно взять для приготовления 500 мл 0, 02 н. раствора?
Дано Решение
p = 1, 14 г/см3 1. По таблице «Плотность растворов
VHNO3 = 500 мл сильных кислот и щелочей» определяем
![]() NHNO3
= 0, 02 н. массовые проценты,
соответствующие
NHNO3
= 0, 02 н. массовые проценты,
соответствующие
плотности 1, 14 г/см3.
VHNO3 = ? а = 24%
2. Определяем титр раствора HNO3.
a * p 24 * 1, 14
![]()
![]() Т = ; THNO3 =
0, 2736 г/мл.
Т = ; THNO3 =
0, 2736 г/мл.
100 100
3. Определяем нормальность HNO3.
Т * 1000 0, 2736 * 1000
![]()
![]() N = ;
ЭHNO3 = 63
г; NHNO3 =
63 =4,34 н.
N = ;
ЭHNO3 = 63
г; NHNO3 =
63 =4,34 н.
Э
4. Определяем, сколько мл 4, 34 н. раствора HNO3 нужно взять для приготовления из него 500 мл 0, 02н. раствора.
V1 * N1 500 * 0, 02
![]()
![]() V2 = = =
2, 3 мл
V2 = = =
2, 3 мл
N2 4, 34
Ответ: VHNO3= 2,3 мл
Задача №4. Определить титр 0, 1 н. соляной кислоты по едкому натрию.
Дано. Решение
![]() NHCl
= 0, 1 н. NHCl * ЭNaOH
NHCl
= 0, 1 н. NHCl * ЭNaOH
![]() ТHCl/NaOH =
; ЭNaOH
= 40 г.
ТHCl/NaOH =
; ЭNaOH
= 40 г.
ТHcl/NaOH - ? 1000
0, 1 * 40
![]() ТHCl/NaOH
= = 0, 004 г/мл.
ТHCl/NaOH
= = 0, 004 г/мл.
1000
Ответ: ТHCl/NaОН=0,004г/мл
Методы окисления-восстановления (оксидиметрии)
Окислительно-восстановительные методы объемного анализа, объединяемые общим названием «оксидиметрия», основаны на применении окислительно-восстановительных реакций. Рабочими растворами являются растворы окислителей или восстановителей.
Необходимо знать, что в реакциях окисления-восстановления, по закону эквивалентности, эквивалент окислителя реагирует с эквивалентом восстановителя, а так как сущность окислительно-восстановительных процессов сводится к перераспределению электронов между атомами (или ионами) реагирующих веществ, то и подсчет эквивалентов окислителей и восстановителей следует вести, исходя из количества электронов, получаемых или отдаваемых при реакции одной молекулой реагирующего вещества.
Эквивалент (Э) окислителя (восстановителя) находят путем деления молярной массы на число принятых (отданных) им в данной химической реакции электронов:
Э
= ![]()
где М – молярная масса окислителя (восстановителя), г/моль;
n – число электронов, принятых (отданных) одной молекулой.
Метод перманганатометрии.
Следует знать, что перманганатометрическим методом титриметрического анализа называют метод, в котором главным рабочим раствором является раствор перманганата калия (КмnО4).
В зависимости от условий, в которых протекает реакция окисления – восстановления, ионы МnО4- могут принимать различное число электронов.
1.Кислая среда
КМn7+О4 + 5 ē → Мn2+SO4 (бледно-розовый или бесцветный);
МKMnO4 158, 04
![]()
![]() Э
= ; Э = = 31, 61
г.
Э
= ; Э = = 31, 61
г.
5 5
2. Нейтральная среда
КМn7+О4 + 3 ē → Мn4+O2 (бурый осадок);
МKMnO4 158, 04
![]()
![]() Э
= ; Э = = 52, 68
г.
Э
= ; Э = = 52, 68
г.
3 3
3. Щелочная среда
КМn7+О4 + 1 ē → МnO42- (коричневый цвет);
МKMnO4 158, 04
![]()
![]() Э
= ; Э = = 158, 04
г.
Э
= ; Э = = 158, 04
г.
1 1
Практически окисление перманганатом ведут в кислой среде, т. к. МnО2 темно-бурого цвета, что затрудняет определение конца реакции.
Необходимо помнить, что приготовить титрованный раствор КМnО4 по точной навеске нельзя; его готовят приблизительной концентрации. А нормальность и титр устанавливают по оксалату натрия или щавелевой кислоте.
Определение нормальности КМnО4 по щавелевой кислоте ( х. ч. ) основано на реакции:
2KMnO4 + 5 H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 8H2O
![]()
MnO4- + 8H+ + 5 ē = Mn2+ + 4H2O 2
C2O42- - 2 ē = 2CO2 0 5
MnO4- - окислитель;
C2O42- - восстановитель.
Перманганатометрия – один из важнейших методов количественного определения Fe (II). Реакция между KMnO4 и солью Мора (в этой соли содержится железо) в кислой среде следующая:
10(NH4)2Fe(SO4)2 * 6H2O + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 +
K2SO4 + 10(NH4)2SO4 + 14H2O
![]()
![]() MnO4-
+ 8H+ + 5 ē = Mn2+
+ 4H2O 1 2
MnO4-
+ 8H+ + 5 ē = Mn2+
+ 4H2O 1 2
Fe2+ - ē = Fe3+ 5 10
MnO4- -окислитель;
Fe2+ - восстановитель.
Иодометрический метод анализа, основан на реакциях, в ходе которых используют окислительно- восстановительные свойства иода или его соединений.
Реакция образования (окисления) иода следующая:
2I- - 2 ē = I20
иодид-ион молекула иода
(бесцветный) (коричневый)
Реакция восстановления иода следующая:
I20 + 2 ē = 2I-
Рабочими растворами в этом методе будут раствор иода (I2) являющийся окислителем, и раствор тиосульфата натрия (Na2S2O3 * 5H2O), который является восстановителем. Индикатор метода – крахмальный клейстер.
Реакция взаимодействия между тиосульфатом натрия и иодом выражается уравнением:
2Na2S2O3 + I2 = 2NaI + Na2S2O6
![]()
![]() 2S22-O3 – 2 ē = S42-O6
2 1
2S22-O3 – 2 ē = S42-O6
2 1
I20 + 2 ē = 2I- 2 1
В этой реакции сложный тиосульфат-ион (S2O32-) окисляется, а атомы иода восстанавливаются до иодид-ионов (I-).
Более подробно разберите методы титрования: прямое, обратное и по замещению.
Следует знать, что при прямом титровании происходит непосредственное взаимодействие рабочего раствора с определяемым веществом; титрование по остатку (или обратное титрование) основано на применении двух рабочих растворов; а метод замещения основан на том, что определяемый окислитель (К2Сr2О7) замещают эквивалентным количеством другого окислителя (I2), который титруют раствором восстановителя (Na2S2O3).
В иодометрии методом замещения определяют количественное содержание окислителя, например:
K2Cr2O7 + 6KI + 7H2SO4 ↔ 4K2SO4 + Cr2(SO4)3 + 3I2 + 7H2O
![]()
![]()
Cr2O72- + 3 ē * 2 + 14H+ = 2Cr3+ + 7H2O 1 2
2I- - 1 ē * 2 = I20 3 6
Выделившийся иод титруют рабочим раствором тиосульфата натрия (Na2S2O3).
Задача №5. Сколько граммов перманганата калия нужно взять, чтобы приготовить 500 мл 0, 1н. раствора (среда кислая).
Дано Решение
VKMnO4 = 50 мл 1. Определяем эквивалент KMnO4 в кислой среде:
![]() NKMnO4
= 0, 1н.
NKMnO4
= 0, 1н.
М 158, 04
![]()
![]() m -? Э
= ; Э KMnO4
= = 31, 61 г.
m -? Э
= ; Э KMnO4
= = 31, 61 г.
5 5
2. Рассчитываем массу навески
N * Э * V 0, 1*31,61*500
![]()
![]() m = =
= 1, 5805 г.
m = =
= 1, 5805 г.
1000 1000
Ответ: m=1,5805г
Задача №6. Определить титр перманганата по железу, если на титрование 10 мл
0, 1 н. щавелевой кислоты израсходовано 8, 00 мл раствора перманганата.
Дано Решение
VH2C2O4 = 10, 00 мл 1. Определяем нормальность KMnO4:
NH2C2O4 = 0, 1 н. VH2C2O4 * NH2C2O4 10*0,1
![]()
![]()
![]() VKMnO4
= 8, 00мл N KMnO4 = =
=
VKMnO4
= 8, 00мл N KMnO4 = =
=
VKMnO4 8
TKMnO4/Fe - ?
= 0, 1250 н.
2. Определяем титр перманганата по железу:
Nр.в * Эо.в
![]() Тр.в/о.в
= ;
Тр.в/о.в
= ;
1000
NKMnO4 * ЭFe 0, 25 * 55, 85
![]()
![]() ТKMnO4/Fe = =
= 0, 006981 г/моль.
ТKMnO4/Fe = =
= 0, 006981 г/моль.
1000 1000
Ответ: ТKMnO4/Fe= 0,006981г/моль
Задача №7. Сколько граммов тиосульфата натрия нужно взять для приготовления 250 мл 0, 1 н. раствора?
Дано Решение
VNa2S2O3 = 250 мл 1. Вычисляем эквивалент Na2S2O3:
![]() NNa2S2O3
= 0, 1 н. М 248, 19
NNa2S2O3
= 0, 1 н. М 248, 19
![]()
![]() Э = ; Э Na2S2O3 = = 248, 19
г.
Э = ; Э Na2S2O3 = = 248, 19
г.
m - ? 1 1
2. Вычисляем массу Na2S2O3:
N * Э * V 0, 1 * 248, 19 * 250
![]()
![]() m = = 6,
2 г.
m = = 6,
2 г.
1000 1000
Ответ: m = 6,2г
Упражнения.
1. Сколько миллилитров 38%-ной соляной кислоты (ρ = 1,19г/см3) нужно взять для приготовления 500мл 0,3н раствора?
2. Титр раствора едкого натрия равен 0,0040г/мл. Найти его титр по азотной кислоте.
3. Какую навеску щавелевой кислоты следует взять для приготовления 25 мл 0,05н раствора?
4. На нейтрализацию 25,0 мл 0.1125н раствора серной кислоты израсходовано 28,5 мл раствора едкого калия. Какова его нормальность?
5. В 1 литре раствора содержится 2,8640г едкого калия. Чему равен титр едкого калия?
6. Плотность раствора соляной кислоты равен 1,057 г/см3. Вычислите нормальность и титр этого раствора.
7. Сколько граммов перманганата калия нужно взять для приготовления 5л раствора? Титр перманганата калия по железу равен 0,005585 г/мл.
8. Сколько граммов перманганата калия потребуется для приготовления 750мл 0,05н раствора?
9. При определении титра раствора тиосульфата натрия взято 1,1789 г дихромата калия (х.ч) и растворено в мерной колбе объемом 250 мл. На титрование 25,00 мл этого раствора израсходовано 23,38 мл раствора тиосульфата натрия. Чему равна нормальность тиосульфата натрия?
ЛИТЕРАТУРА
Основные источники:
1.Кудряшева, Н. С. Физическая и коллоидная химия : учебник и практикум для СПО / Н. С. Кудряшева, Л. Г. Бондарева. — 2-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 379 с. Режим доступа: https:// biblio-online.ru/book/72CA68BF-9F1C-405D-9725-2CE497E5EEF8
2. Никитина, Н. Г. Аналитическая химия : учебник и практикум для СПО / Н. Г. Никитина, А. Г. Борисов, Т. И. Хаханина ; под ред. Н. Г. Никитиной. — 4-е изд., перераб. и доп. — [Электронный ресурс] — Электрон. дан. —М. : Издательство Юрайт, 2017. — 394 с. Режим доступа: https:// biblio-online.ru/book/26720D82-A41A-43A0-83E6-2FB7129B060E
3. Хаханина, Т. И. Органическая химия : учебное пособие для СПО / Т. И. Хаханина, Н. Г. Осипенкова. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 396 с. Режим доступа: https:// biblio-online.ru/book/FD017744-5BA8-43EC-A5CC-478A5262A741
Дополнительные источники:
1.Александрова, Э. А. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа : учебник и практикум для СПО / Э. А. Александрова, Н. Г. Гайдукова. — 2-е изд., испр. и доп. ——[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 551 с. Режим доступа: https:// biblio-online.ru/book/AC648233-762B-4860-88AE-AED256523957
2. Александрова, Э. А. Аналитическая химия в 2 книгах. Книга 2. Физико-химические методы анализа : учебник и практикум для СПО / Э. А. Александрова, Н. Г. Гайдукова. — 2-е изд., испр. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 359 с. Режим доступа: https://biblio-online.ru/book/C8AA2771-4B4F-4FE5-8AE5-812C90E34D37
3. Борисов, А. Н. Аналитическая химия. Расчеты в количественном анализе : учебник и практикум для СПО / А. Н. Борисов, И. Ю. Тихомирова. — 2-е изд., испр. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 118 с. Режим доступа: https://biblio-online.ru/book/32E4797E-E52E-4065-B345-A6013C34646E
4.Гавронская, Ю. Ю. Коллоидная химия : учебник и практикум для СПО / Ю. Ю. Гавронская, В. Н. Пак. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 287 с. Режим доступа: https:// biblio-online.ru/book/B19A4FB7-18AD-48F2-8659-97AEE0D7A393
5. Грандберг, И. И. Органическая химия. Практические работы и семинарские занятия : учебное пособие для СПО / И. И. Грандберг, Н. Л. Нам. — 6-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 349 с. Режим доступа: https:// biblio-online.ru/book/2D02E3DD-35E0-4CB2-B6CC-8E05192B3206.
Интернет-ресурсы:
1. Договор от 13.06.2017 № 435/17 на предоставление доступа к электронно-библиотечной системе ООО «Издательство Лань» (https://e.lanbook.com/)
2. Договор от 01.03.2018 № 13 – УТ/2018 по обеспечению доступа к электронным информационным ресурсам ФГБНУ ЦНСХБ
3. Дополнительное соглашение от 12.04.2018 № ПДД 18/19 к Лицензионному договору от 04.07.2013 № 27 на предоставление доступа к электронно-библиотечной системе «AgriLib» ФГБОУ ВО РГАЗУ (http://ebs.rgazu.ru/)
4. Контракт от 20.03.2018 №0702/2222-2018 на оказание услуг попредоставлению доступа к электронным базам данных«Национальный цифровой ресурс «Руконт» Коллекция «Базовый массив» (https://rucont.ru/)
5. Договор от 12.05.2017 № 2949 на оказание услуг по предоставлению доступа к ЭБС «Электронно-библиотечной системе «ЭБС ЮРАЙТ www.biblio-onlaine.ru» (www.biblio-onlaine.ru)
6.Программы АСТ-тестирования для рубежного контроля и промежуточной аттестации обучающихся (договор Л-21/16 от 18.10. 2016)
7.Программные комплексы НИИ мониторинга качества образования: «Федеральный интернет-экзамен в сфере профессионального образования (ФЭПО)» (договор №ИАС -2018/1/0205 от 15 марта 2018 г.)
8.Договор № 9012 /13900/ЭС поставки и сопровождения экземпляров систем Консультант Плюс от 20.02.2018
9.Договор № 194 – 01/2018СД на услуги по сопровождению Электронного периодического справочника «Система ГАРАНТ» от 09.01.2018
6. Приложения. Задания для оценки освоения дисциплины
Приложение 1: Комплект тестовых заданий
Приложение 2. Домашняя контрольная работа для обучающихся заочной формы обучения
Приложение 3. Задачи для самостоятельного решения
Приложение 4. Темы рефератов, докладов
Приложение 5. Вопросы для подготовки к экзамену
Приложение 6. Методические рекомендации для написания рефератов, докладов, сообщений
Приложение 7. Таблицы
Приложение 1
Комплект тестовых заданий
Теория строения органических соединений
1. Бутен-1 и 2-метилпропен являются
1) одним и тем же веществом
2) гомологами
3) структурными изомерами
4) геометрическими изомерами
2. Из приведённых утверждений:
А. Атомы и группы атомов в молекулах оказывают друг на друга взаимное влияние.
Б. Изомеры - это вещества с разным строением, но одинаковыми свойствами.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
3. Из приведённых утверждений:
А. Свойства веществ определяются не только составом, но и строением их молекул.
Б. Изомеры имеют одинаковый состав, но разное строение.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
4. Геометрические (цис-транс-) изомеры имеет
1) 2-хлорбутен-2
2) бутин-2
3) пропен
4) гексан
5. Пентен-1 и гексен-1 являются
1) одним и тем же веществом
2) структурными изомерами
3) геометрическими изомерами
4) гомологами
6. Циклобутан и транс-бутен-2 являются
1) геометрическими изомерами
2) одним и тем же веществом
3) гомологами
4) структурными изомерами
7. Геометрические (цис-транс-) изомеры имеет
1) 2-метилбутен-1
2) пентен-2
3) пропин
4) бутан
8. Для пентанола не характерна изомерия
1) геометрическая
2) углеродного скелета
3) положения гидроксильной группы
4) межклассовая
9. Для этанола характерна изомерия
1) углеродного скелета
2) геометрическая
3) положения гидроксильной группы
4) межклассовая
10. Гомолог бутаналя - это
1) бутандиол-1,2
2) бутанол-1
3) 2-метилпропаналь
4) гексаналь
11. Гомологами являются
1) глицерин и этиленгликоль
2) уксусная кислота и уксусный альдегид
3) бутен и бутадиен
4) пропаналь и бутаналь
12. Изомерами являются
1) метилацетат и пропановая кислота
2) пропанол и пропанон
3) бутен-1 и пропен-1
4) пентан и циклопентан
13. Ацетальдегид и этаналь - это
1) гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и то же вещество
14. Гомологом уксусной кислоты является
1) CH3COOH
2) CH2=CH - COOH
3) HOOC - COOH
4) C17H35COOH
15. Изомером циклопентана является
1) циклобутан
2) пентен-1
3) пентанон
4) пентин
16. Этилацетат и бутановая кислота - это
1) гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и то же вещество
17. Гомологами являются
1) пропанол-1 и пропанол-2
2) формальдегид и ацетальдегид
3) пропановая кислота пропеновая кислота
4) бутан и циклобутан
18. Изомерами являются
1) олеиновая кислота и стеариновая кислота
2) пропанон и ацетон
3) диэтиловый эфир и этиловый спирт
4) циклобутан и бутен-1
19. Метилформиат и метиловый эфир муравьиной кислоты - это
1) гомологи
2) структурные изомеры
3) геометрические изомеры
4) одно и тоже вещество
20. Изомером пропаналя является
1) CH2=CH - CH2OH
2) CH3-CH2 - CH=O
3) CH3-CH=O
4) CH3-CH2 - CH2OH
21. Этановая кислота и уксусная кислота являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
22. Соединения бутанол-1 и 2-метилпропанол-2 являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
23. Пропеновая кислота метилацетат являются
1) гомологами
2) структурными изомерами
3) пространственными изомерами
4) одним и тем же веществом
24. Толуол и этилбензол являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
25. Структурный изомер нормального гексана имеет название
1) 3-этилпентан
2) 2-метилпропан
3) 2,2-диметилпропан
4) 2,2-диметилбутан
26. Метаналь и формальдегид являются
1) гомологами
2) структурными изомерами
3) геометрическими изомерами
4) одним и тем же веществом
27. Структурным изомером бутена-1 является
1) бутин-1
2) 2-метилпропан
3) 2-метилпропен
4) 3-метилбутен-1
28. К соединениям, имеющим общую формулу CnH2n
1) бензол
2) циклогексан
3) гексан
4) гексин
29. Изомером метилциклопентана является
1) пентан
2) гексан
3) гексен
4) гексин
30. Изомерами являются
1) метилциклопропан и метилпропен
2) бутен-1 и пентен-1
3) метан и этан
4) метилпропан и бутан
31. Число σ-связей в молекуле бензола
1) 3 2) 6 3) 9 4) 12
32. Только sp2-гибридные атомы углерода содержит молекула
1) пропена
2) бутадиена-1,3
3) толуола
4) полиэтилена
33. Число π-связей в молекуле пропеновой кислоты равно
1) 1 2) 2 3) 3 4) 4
34. Атом углерода в состоянии sp-гибридизации содержит молекула
1) ацетальдегида
2) бензола
3) бутадиена-1,2
4) анилина
35. Не содержит sp2-гибридные атомы углерода содержит молекула
1) этанола
2) этаналя
3) уксусной кислоты
4) анилина
36. Только σ-связи содержатся в молекуле
1) ацетальдегида
2) фенола
3) уксусной кислоты
4) этанола
37. Пять σ-связей содержит молекула
1) этилена
2) ацетальдегида
3) формальдегида
4) этанола
38. Атом углерода в состоянии sp2-гибридизации содержит молекула
1) этанола
2) этаналя
3) этиленгликоля
4) этина
39. Число π-связей в молекуле ацетилена равно
1) 1 2) 2 3) 3 4) 4
40. Из приведённых утверждений:
А. В бензольном кольце три непрочные π-связи легко разрываются в реакциях окисления раствором KMnO4.
Б. В молекуле толуола бензольное кольцо оттягивает электронную плотность от метильной группы, облегчая её окисление.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
41. Атомы углерода в sp-гибридном состоянии имеются в молекулах
1) бензола
2) толуола
3) пропадиена
4) ацетона
42. 6 σ-связей содержится в молекуле
1) пропина
2) этанола
3) этана
4) бензола
43. Атомы углерода только в sp3-гибридном состоянии имеются в молекулах
1) циклогексана
2) толуола
3) бутена
4) бутадиена-1,3
44. Из приведённых утверждений:
А. Из-за влияния метила в молекуле толуола облегчено замещение в мета-положениях бензольного кольца.
Б. Замещение в бензольном кольце протекает по свободнорадикальному механизму.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
45. Бутен-1-ин-3 содержит в молекуле
1) 7 σ-связей и 3 π-связи
2) 7 σ-связей и 2 π-связи
3) 5 σ-связей и 5 π-связей
4) 3 σ-связи и 2 π-связи
46. Только σ-связи содержатся в молекуле
1) толуола
2) пропина
3) полиэтилена
4) бутена
47. Число π-связей в молекуле бутина-1 равно
1) 1 2) 2 3) 3 4) 4
48. Оцените справедливость утверждений:
А. Из-за влияния метила в молекуле толуола облегчено замещение в орто- и пара-положениях бензольного кольца.
Б. Присоединение хлора к бензольному кольцу протекает по свободнорадикальному механизму.
1) верно только А
2) верно только Б
3) верно А и Б
4) неверны оба утверждения
49. Угол С-С-С в молекуле СH=C-CH3 равен
1) 90° 2) 109° 28 ' 3) 120° 4) 180°
50. Число σ- и π-связей в молекуле этилена соответственно
1) 4 и 1 2) 4 и 2 3) 5 и 1 4) 5 и 2
51. В молекуле 2,2-диметилбутана тип гибридизации атомных орбиталей атомов углерода
1) только sp3
2) только sp2
3) sp3 и sp2
4) sp3, sp2 и sp
52 Число π-связей в молекуле пропина равно
1) 1 2) 2 3) 3 4) 4
53. Две π-связи содержатся в молекуле
1) этена 2) бутана 3) бутена 4) этина
54. Число σ- и π-связей в молекуле пропадиена соответственно равно
1) 4 и 1 2) 4 и 2 3) 5 и 1 4) 6 и 2
55. В молекуле ацетилена имеются
1) две σ- и две π-связи
2) две σ- и три π-связи
3) три σ- и одна π-связь
4) три σ- и две π-связи
Ответы: 1-1, 2-1, 3-3, 4-1, 5-4, 6-4, 7-2, 8-1, 9-4, 10-4, 11-4, 12-1, 13-4, 14-4, 15-2, 16-2, 17-2, 18-4, 19-4, 20-1, 21-4, 22-2, 23-2, 24-1, 25-4, 26-4, 27-3, 28-2, 29-3, 30-1, 31-4, 32-2,33-2, 34-3, 35-1, 36-4, 37-1, 38-2, 39-2, 40-2, 41-3, 42-1, 43-1, 44-4, 45-1, 46-3, 47-2, 48-3, 49-3, 50-3, 51-1, 52-2, 53-4, 54-4, 55-4.
Характерные химические свойства углеводородов
1. При гидрировании алкенов образуются
1) алканы 2) алкины 3) алкадиены 4) спирты
2. При взаимодействии 1 моль пропина с 2 моль хлора образуется
1) 1,1-дихлорпропан
2) 1,2-дихлорпропан
3) 1,1,2-трихлорпропан
4) 1,1,2,2-тетрахлорпропан
3. Наличием двойной связи обусловлена возможность алкенов вступать в реакцию
1) горения
2) замещения водорода на галоген
3) дегидрирования
4) полимеризации
4. При взаимодействии 1 моль CH4 c 2 моль Cl2 при освещении получается преимущественно
1) хлорметан 2) дихлорметан 3) хлороформ 4) тетрахлорэтан
5. Реакции присоединения характерны для
1) алканов
2) предельных одноосновных карбоновых кислот
3) фенолов
4) алкинов
6. Среди продуктов нитрования 2-метилбутана по М.И. Коновалову будет преобладать
1) 3-нитро-2-метилбутан 3) 2-нитро-2-метилбутан
2) 1-нитро-2-метибутан 4) 1-нитро-3-метилбутан
7. Реакция, приводящая к обрыву цепи при бромировании метана
1) Br2 Br· + Br·
2) Br· + CH4 →CH3· + HBr
3) CH3· + Br· → CH3Br
4) CH3· + Br2 → CH3Br + Br·
8. С каждым из веществ: водой, бромоводородом, водородом—может реагировать
1) пропан
2) хлорметан
3) этан
4) бутен
9. И бутан и бутилен реагируют с
1) бромной водой
2) водным раствором перманганата калия
3) водородом
4) хлором
10. Продуктом реакции пропена с хлором является
1) 1,2-дихлорпропен
2) 2-хлорпропен
3) 2-хлорпропан
4) 1,2-дихлорпропан
11.Продуктом реакции бутена-1 с хлором является
1) 2-хлорбутен-1
2) 1,2-дихлорбутан
3) 1,2-дихлорбутен-1
4) 1,1-дихлорбутан
12. Превращение бутана в бутен относится к реакции
1) полимеризации
2) дегидрирования
3) дегидратации
4) изомеризации
13. При гидрировании алкенов образуются
1) алканы
2) алкины
3) алкадиены
4) спирты
14. Бутан в отличие от бутена-2
1) реагирует с кислородом
2) не вступает в реакцию гидрирования
3) не реагирует с хлором
4) имеет структурный изомер
15. Среди циклоалканов наиболее реакционноспособным является
1) циклобутан
2) циклопропан
3) циклопентан
4) циклогексан
16. 1-пентен и 1-пентин можно различит действием
1) бромной воды 3) аммиачного раствора оксида серебра
2) фенолфталеина 4) раствора перманганата калия
17. Реакция гидрирования невозможна для
1) цис-бутена-2 2) транс-бутена-2
3) бутена-1 4) бутана
18. С перманганатом калия в растворе взаимодействуют
1) пропин, пропен, пропан 3) 2-бутин, 2-бутен, 1,3-бутадиен
2) этан, этен, ацетилен 4) этин, 1-пентен, пентан
19. Обесцвечивание бромной воды не произойдет при действии на нее
1) гексена 2) гексана 3) бутена 4) пропина
20. И бутан, и бутилен реагируют с
1)бромной водой 2)раствором KMnO4
3)водородом 4)хлором
21.Продуктом реакции пропена с хлором является
1)1,2-дихлорпропен
2)2-хлорпропен
3)2-хлорпропан
4)1,2-дихлорпропан
22. Продуктом реакции бутена-1 с хлором является
1)2-хлорбутен-1
2)1,2-дихлорбутан
3)1,2-дихлорбутен-1
4)1,1-дихлорбутан
23. При гидрировании алкенов образуются
1)алканы
2)алкины
3)алкадиены
4)спирты
24. 2-хлорбутан преимущественно образуется при взаимодействии
1) бутена-1 и хлора
2) бутена-1 и хлороводорода
3) бутена-2 и хлора
4) бутина-2 и хлороводорода
25. Раствор перманганата калия не обесцвечивает
1) бензол
2) толуол
3) бутадиен-1,3
4) 1,2-диметилбензол
26. Метан вступает в реакцию
1) с хлороводородом
2) с водяным паром на катализаторе
3) изомеризации
4) с бромной водой
27. Бензол реагирует с
1) бромной водой
2) хлороводородом
3) этанолом
4) азотной кислотой
28. При гидратации пропина образуется
1) пропанол-1
2) пропанол-2
3) пропанон
4) пропаналь
29. При гидратации 3-метилпентена-2 образуется преимущественно
1) 3-метипентанол-3
2) 3-метилпентанол-2
3) 3-метилпентадиол-2,3
4) 3-метилпентанол-1
30. При действии воды на бутен-2 образуется
1) 1-бромбутан
2) 2-бромбутан
3) 1,2-дибромбутан
4) 2,3-дибромбутан
31. При окислении толуола раствором перманганата калия в присутствии серной кислоты при нагревании образуется
1) фенол
2) бензол
3) бензиловый спирт
4) бензойная кислота
32. Для алканов нехарактерна реакция
1) изомеризация
2) присоединения
3) радикального замещения
4) горения
33. Этиленовые углеводороды можно отличить от алканов с помощью
1) бромной воды
2) медной спирали
3) этанола
4) лакмуса
34. В реакцию полимеризации вступает
1) толуол
2) стирол
3) бензол
4) 1,2-диметилбензол
35. В реакцию полимеризации не вступает
1) изопрен
2) этилен
3) пропилен
4) этан
36. Не горит при поджигании на воздухе
1) метан
2) этилен
3) тетрахлорметан
4) 2-метилпропан
37. При взаимодействии 2-метилбутена-2 с бромоводородом преимущественно образуется
1) 2-бром-2-метилбутан
2) 1-бром-2-метилбутан
3) 2,3-дибром-2-метилбута
4) 2-бром-3-метилбутан
38. Какое из веществ вступает в реакцию гидратации в соответствии с правилом Марковникова?
1)CH3 - CH = CH2
2) CF3 - CH = CH2
3) CH2 = CH - CНО
4) CH2 = CH - CООН
39. При взаимодействии бутена-1 с бромоводородом водород присоединяется к атому углерода, номер которого
1) 1 2) 2 3) 3 4) 4
40. Вопреки правилу Марковникова присоединяет воду
1) 3,3,3-трифтопропен
2) 3,3-диметилбутен-1
3) 2-метилпропен
4) бутен-1
41. Реакция присоединения бромоводорода возможна для
1) циклопропана
2) пропана
3) бензола
4) гексана
42. Как бензол, так и толуол реагируют с
1) раствором KMnO4 (H2SO4 конц)
2) бромной водой
3) азотной кислотой (H2SO4 конц)
4) соляной кислотой
43. Пропан от пропена можно отличить с помощью
1) гидроксида меди (II)
2) этанола
3) раствора лакмума
4) бромной воды
44. 2-хлорпропан преимущественно образуется в результате взаимодействия хлороводорода с
1) пропаном
2) пропеном
3) пропанолом-1
4) пропином
Ответы: 1-1, 2-4, 3-4, 4-2, 5-4, 6-3, 7-3, 8-4, 9-4, 10-4, 11-2, 12-2, 13-1, 14-2, 15-2, 16-3, 17-4, 18-3, 19-1, 20-4, 21-4,22-2, 23-1, 24-2, 25-1, 26-1, 27-4, 28-3, 29-1, 30-4, 31-4, 32-2, 33-1, 34-2, 35-4, 36-3, 37-1, 38-1, 39– 1, 40-1, 41-1, 42-3, 43-4, 44-2.
Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола.
1. При окислении пропанола-1 образуется
1) пропилена
2) пропанон
3) пропаналь
4) пропан
2. В схеме реакции
NaOH + X → C2H5OH + NaCl веществом «Х» является
1) хлорэтан
2) 1,2-дибромэтан
3) ацетилен
4) этаналь
3. В результате дегидратации пропанола-1 образуется
1) пропанол-2 2) пропан 3) пропен 4) пропин
4. В схеме превращений пропанол-1→ X → пропанол-2
веществом «X» является
1) 2-хлорпропан
2) пропановая кислота
3) пропин
4) пропен
5. Атом кислорода в молекуле фенола образует
1) одну σ-связь
2) две σ-связи
3) одну σ- и одну π-связи
4) две π-связи
6. С гидроксидом натрия реагируют оба вещества
1) уксусная кислота и фенол
2) фенол и глицерин
3) глицерин и пропанол
4) пропанол и анилин
7. С гидроксидом меди(II) реагирует
1) CH2OH - CH2OH
2) C6H5 - OH
3) CH3 - OH
4) CH3 - O - CH3
8. В порядке усиления кислотных свойств расположены вещества
1) фенол - этанол - глицерин
2) этанол - глицерин - фенол
3) глицерин - этанол - фенол
4) глицерин - фенол - этанол
9. В результате нагревания пропанола-1 с концентрированной серной кислотой при температуре свыше 140° образуется преимущественно
1) простой эфир
2) сложный эфир
3) алкен
4) альдегид
10. Бутанол-2 можно получить
1) восстановлением бутаналя
2) щёлочным гидролизом 1-хлорбутана
3) восстановлением бутановой кислоты
4) гидратацией бутена-1
11. Этанол не взаимодействует с
1) Na 2) NaOH 3) CuO 4) HCl
12. Фенол реагирует с каждым из веществ
1) бромная вода и гидроксид натрия
2) гидроксид натрия и вода
3) вода и соляная кислота
4) соляная кислота и бромная вода
13. Пропанол-2 взаимодействует с
1) Cu(OH)2 2) NaOH 3) HCl 4) H2
14. В результате нагревания бутанола-1 с концентрированной серной кислотой при температуре менее 140° образуется преимущественно
1) простой эфир
2) сложный эфир
3) алкен
4) альдегид
15. Высокий выход пропанола-1 не достигается при
1) щёлочном гидролизе 1-хлорпропана
2) восстановлении пропаналя
3) щёлочном гидролизе пропилового эфира карбоновой кислоты
4) гидратации пропена
16. C помощью гидроксида меди(II) можно обнаружить в растворе
1) пропилен
2) пропанол
3) фенол
4) пропандиол-1,2
17. Метанол реагирует с
1) KOH 2) Cu(OH)2 3) CH3COOH 4) Cu
18. При окислении пропанола-1 образуется
1) CH3-CHOH-CH2OH
2) CH3-CH2-CH=O
3) CH3-CH=CH2
4) CH3-CO-CH3
19. Среди утверждений:
А. Гидроксильная группа оттягивает электронную плотность с бензольного кольца фенола.
Б. Влияние бензольного кольца на гидроксильную группу в молекуле фенола приводит к усилению кислотных свойств.
1) верно только А
2) верно только Б
3) верны А и Б
4) неверны оба утверждения
20. Влияние бензольного кольца на гидроксильного группу в молекуле фенола доказывает реакция фенола с
1) гидроксидом натрия
2) формальдегидом
3) бромной водой
4) азотной кислотой
21. При дегидратации этилового спирта образуется
1) бутан 2) этен 3) этин 4) пропен
22. К фенолам относится вещество, формула которого
1) C6H5 - O - CH3
2) C6H13 - OH
3) C6H5 - OH
4) C6H5 - CH3
23. Фенол в водном растворе является
1) сильной кислотой
2) слабой кислотой
3) слабым основанием
4) сильным основанием
24. Наличие группы - OH в составе фенола
1) облегчает протекание реакции замещения
2) затрудняет протекание реакции замещения
3) не влияет на протекание реакции замещения
4) способствует протеканию реакции присоединения
25. Фенол реагирует с
1) Br2 2) Na2CO3 3) NaCl 4) Cu(OH)2
26. Этанол можно получить из этилена в результате реакции
1) гидратации
2) гидрирования
3) галогенирования
4) гидрогалогенирования
27. При щёлочном гидролизе 2-хлорбутана преимущественно образуется
1) бутанол-2
2) бутанол-1
3) бутаналь
4) бутен-2
28. При щёлочном гидролизе 1,2-дихлорпропана образуется
1) пропанол-1
2) пропанол-2
3) пропаналь
4) пропандиол-1,2
29. Для предельных одноатомных спиртов характерно взаимодействие с
1) NaOH (p-p) 2) Na 3) Cu(OH)2 4) Cu
30. Пропанол не взаимодействует с
1) Hg 2) O2 3) HCl 4) K
Ответы: 1-3, 2-1, 3-3, 4-4, 5-2, 6-1, 7-1, 8-2, 9-3, 10-4, 11-2, 12-1, 13-3, 14-1, 15-4, 16-4, 17-3, 18-2, 19-2, 20-3,
21-2, 22-3, 23-2, 24-1, 25-1, 26-1, 27-1, 28-4, 29-2, 30-1.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биоорганические соединения: жиры, белки, углеводы.
1.Дисахаридом является
1) фруктоза
2) клетчатка
3) крахмал
4) сахароза
2. Вещество, подвергающееся гидролизу, - это
1) α-глюкоза
2) β-глюкоза
3) фруктоза
4) сахароза
3. В порядке усиления кислотных свойств расположены кислоты
1) стеариновая - уксусная - трихлоруксусная
2) уксусная - стеариновая - трихлоруксусная
3) трихлоруксусная - уксусная - стеариновая
4) стеариновая - трихлоруксусная - уксусная
4. Жидкие растительные масла не вступают в реакцию с
1) водородом
2) раствором перманганата калия
3) глицерином
4) раствором гидроксида натрия
5. При кислотном гидролизе этилацетата образуются
1) этанол и муравьиная кислота
2) этанол и уксусная кислота
3) метанол и муравьиная кислота
4) метанол и уксусная кислота
6.Формиат калия не получится при действии на муравьиную кислоту
1) гидроксида калия
2) карбоната калия
3) сульфата калия
4) калия
7.Твёрдые жиры можно получить из жидких масел
1) гидролизом
2) угарного газа с кислородом
3) гидратацией
4) гидрогенизацией
8.С помощью гидроксида меди(II) можно различить
1) толуол и пропанол
2) ацетон и винилбензол
3) пропанол и пропаналь
4) муравьиный альдегид и пропионовый альдегид
9.Фруктоза образуется в результате гидролиза
1) крахмала
2) целлюлозы
3) сахарозы
4) жиры
10. Среди утверждений:
А. В карбонильной группе альдегидов электронная плотность смещена к атому кислорода.
Б. Для предельных альдегидов характерна геометрическая (цис-транс-) изомерия.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) неверны оба утверждения
11. Ацетальдегид не реагирует с
1) аммиачным раствором оксида серебра
2) гидроксидом меди(II)
3) водородом
4) гидроксидом натрия
12. В порядке усиления кислотных свойств расположены кислоты
1) уксусная – трихлоруксусная- муравьиная
2) уксусная - муравьиная- трихлоруксусная
3) трихлоруксусная - уксусная - муравьиная
4) трихлоруксусная -муравьиная- уксусная
13. Гидратацией алкина может быть получен
1) формальдегид
2) ацетальдегид
3) пропионовый альдегид
4) масляный альдегид
14. Уксусная кислота не реагирует с
1) пропанолом
2) магнием
3) хлоридом натрия
4) карбонатом калия
15.Продуктом восстановления пропаналя является
1) пропанол
2) пропановая кислота
3) пропанон
4) пропан
16. В цепи превращений
C2H5OH → X → CH3COOH
веществом Х является
1) этан
2) этанол
3) этаналь
4) этиленгликоль
17. Спирт может быть получен при взаимодействии альдегида
1) с гидроксидом меди(II)
2) со щёлочью
3) с водородом на катализаторе
4) с хлороводородом
18.В цепи превращений
CH3COOH → X → H2N-CH2-COOH
веществом Х является
1) уксусный альдегид
2) этанол
3) нитроэтан
4) хлоруксусная кислота
19. Для формальдегида характерны реакции
1) замещения
2) окисления
3) отщепления
4) гидролиза
20. В цепи превращений
CH3COOH + Na2CO3 →X1
Х1+ конц. H2SO4 →X2
веществами Х1 и Х2 являются соответственно
1) CO2 и H2CO3
2) CH3COONa и CH3COOH
3) CH3COONa и C2H5OH
4) CH3CH=O и C2H5OH
21.Формальдегид не реагирует с
1) C6H5 - OH 2) Cu(OH)2 3) H2 4) NaOH
22. С гидрокарбонатом натрия реагирует каждое из веществ
1) HCOOH и CH3COOH
2) CH3COOH и C2H5OH
3) C2H5OH и C6H5OH
4) C6H5OH и CH2OH - CH2OH
23. Продуктом окисления пропаналя является
1) пропанол
2) пропановая кислота
3) пропанон
4) пропан
24. Муравьиная кислота реагирует с
1) хлоридом натрия
2) аммиачным раствором оксида серебра
3) медью
4) гексаном
25. Свойства альдегида не проявляет
1) HCOO-CH3
2) HCOOH
3) CH3-CO-CH3
4) HCHO
26. Ацетат натрия не получится при действии на уксусную кислоту
1) натрия
2) гидроксида натрия
3) хлорида натрия
4) карбоната натрия
27. Вступают с водородом в реакцию присоединения
1) пропанол и бензол
2) бензол и ацетальдегид
3) ацетальдегид и пропан
4) пропан и метиламин
28. Для муравьиной кислоты не характерна реакция
1) этерификации
2) «серебряного зеркала»
3) гидратации
4) нейтрализации
29. С аммиачным раствором оксида серебра реагирует
1) пропин
2) уксусная кислота
3) пропанол
4) фруктоза
30. Уксусная кислота реагирует с
1) хлором
2) водородом
3) медью
4) хлоридом натрия
Ответы: 1-4, 2-4, 3-1, 4-3, 5-2, 6-3, 7-4, 8-3, 9-3, 10-1, 11-1, 12-2, 13-2, 14-3, 15-1, 16-3, 17-3, 18-4, 19-2, 20-2, 21-4, 22-1, 23-2, 24-2, 25-3, 26-3, 27-2, 28-2, 29-1, 30-1.
Критерии оценки:
- оценка «отлично» выставляется обучающемуся, если выполнены правильно 90 – 100% заданий;
- оценка «хорошо» - 75 – 89%;
- оценка «удовлетворительно» - 60 – 74 %;
- оценка «неудовлетворительно» - менее 60% заданий.
Раздел 2. Физическая и коллоидная химия
Вариант № 1
1. Коллоидная химия изучает…
а) дисперсные системы и процессы, протекающие в них;
б) изменение агрегатного состояния вещества;
в) физические свойства вещества;
г) изменение формы вещества.
2. Физическая химия изучает….
а) изменение агрегатного состояния вещества;
б) изменение формы вещества;
в) физические свойства вещества;
г) связь химических и физических свойств веществ.
3. Первый автор закона сохранения вещества…
а) Лавуазье;
б) Ломоносов;
в) Ньютон;
г) Авогадро.
4. Вещество –это…. 5. Растворы – это…
а) то, из чего состоят физические тела; а) гетерогенные системы;
б) то, из чего состоят атомы; б) гомогенные системы;
в) то, из чего состоят молекулы; в) твердые системы;
г) то, из чего состоят формулы. г) газообразные системы.
6. Периодический закон и периодическая система элементов Д.И. Менделеева была опубликована…
а) в 1860 г.; б) в 1869 г.; в) в 1865 г.; г) в 1879 г.
7. Молекулярные кристаллические решётки характерны для…
а) с ковалентной связью;
б) с ионной связью;
в) с водородной связью;
г) с металлической связью.
8. Определите тип кристаллической решётки у соединения Na Br…
а) молекулярная;
б) атомная;
в) ионная;
г) элементная.
9. Возникновение физической химии относится к середине….
а) XX века; б) XV века; в) XVIII века; г) XIX века.
10. Коллоидная химия, как самостоятельная наука возникла…..
а) в начале 20 века; б) в конце 20 века; в) в середине 19 века; г) в начале 18 века.
11. Переход вещества из твердого в жидкое состояние называется….
а) парообразованием;
б) плавлением;
в) затвердеванием;
г) сублимацией.
12. Процесс перехода вещества из жидкого в газообразное состояние называется….
а) затвердеванием;
б) сжижением;
в) парообразованием;
г) не имеет названия.
13. Процесс перехода вещества из жидкого в газообразное состояние называется….
а) парообразованием;
б) не имеет названия;
в) затвердеванием;
г) сжижением.
14. Сублимация – это…
а) переход вещества из жидкого состояния в твердое состояние;
б) переход вещества из твердого состояния в жидкое состояние;
в) в природе нет такого явления;
г) переход из твердого в газообразное состояние.
15. Переход вещества из твердого в газообразное состояние минуя жидкое называется….
а) сжижением;
б) парообразованием;
в) сублимацией;
г) десублимацией.
16. Десублимация – это процесс обратный….
а) сжижению;
б) парообразованию;
в) сублимации;
г) плавлению.
17. Изменение агрегатного состояния вещества в природе происходит при повышении…
а) давления;
б) температуры;
в) атомов вещества;
г) влажности.
18. Агрегатных состояний веществ бывает….
а) 5; б) 2; в) 3; г) 4.
19. Плазма бывает…
а) 2 видов; б) 4 видов; в) 1 вида; г) 3 видов.
20. Температура Кельвина равна…
а) 760 0 С; б) 273 0 К; в) 270 0 С; г) 272 0 К .
Вариант № 2
1. Химическая реакция –это:
а) изменение степени окисления;
б) изменение агрегатного состояния;
в) превращение одних веществ в другие;
г) аллотропные превращения.
2. Скорость химической реакции – это:
а) изменение количества вещества продуктов реакции к моменту окончания реакции;
б) изменение количества вещества реагентов к моменту окончания реакции;
в) время, за которое полностью расходуется один из реагентов;
г) изменение концентрации одного из реагентов в единицу времени в единицу объема.
3. При химическом равновесии:
а) масса реагентов равна массе продуктов реакции;
б) внутренняя энергия равна нулю;
в) концентрации исходных веществ и продуктов реакции остаются неизменными;
г) количество вещества реагентов равно количеству вещества продуктов реакции.
4. Химические реакции, протекающие в противоположных направлениях, называются:
а) термохимическими;
б) кинетическими;
в) каталитическими;
г) обратимыми.
5. Идеальный газ – это …
а) очень разряженный газ;
б) очень опасный газ;
в) очень плохой газ;
г) реальный газ.
6. Уравнением состояния идеального газа называется уравнение….
а) Пуазейля;
б) Ньютона;
в) Авогадро;
г) Менделеева – Клапейрона.
7. Универсальная газовая не зависит…
а) от давления;
б) от температуры;
в) от природы газа;
г) от объема газа.
8. Какой ученый объяснил причины отступления реальных газов от законов идеальных газов?
а) Ван-дер-Ваальс;
б) Ньютон;
в) Ломоносов;
г) Вант – Гофф.
9. Изотермой называется кривая, которая показывает…
а) зависимость температуры от объема при постоянном давлении;
б) зависимость объема от давления при постоянной температуре;
в) зависимость давления от объема;
г) отсутствие изменения параметров.
10. Свободная энергия единицы поверхности называется…
а) внутренним давлением;
б) поверхностной энергией;
в) поверхностным натяжением;
г) вязкостью жидкости.
11. Вязкость –это….
а) внутреннее давление;
б) внутреннее трение;
в) работа;
г) избыточная энергия.
12. Нормально вязкие жидкости подчиняются законам….
а) Вант – Гоффа;
б) Ван- дер- Вальса;
в) Коновалова;
г) Ньютона и Пуазейля.
13. Прибор для определения вязкости называется…
а) сталагмометр;
б) вискозиметр;
в) прибор А.П. Рибендера;
г) пипетка.
14. Прибор для определения поверхностного натяжения называется….
а) сталагмометр;
б) вискозиметр;
в) прибор А.П. Рибендера;
г) пипетка.
15. Внутреннее трение жидкости – это…
а) вязкость;
б) поверхностное натяжение;
в) работа жидкости;
г) поверхностная энергия.
16. Нормально вязкие жидкости подчиняются законам….
а) Вант – Гоффа;
б) Рибендера;
в) Лукъянова;
г) Ньютона и Пуазейля.
17. Если молекулы жидкости полярны, то происходит….
а) суммарный эффект;
б) диссоциация;
в) разделение молекул;
г) ассоциация.
Критерии оценки:
- оценка «отлично» выставляется обучающемуся, если выполнены правильно 90 – 100% заданий;
- оценка «хорошо» - 75 – 89%;
- оценка «удовлетворительно» - 60 – 74 %;
- оценка «неудовлетворительно» - менее 60% заданий.
Раздел 3. Аналитическая химия
Качественный анализ
Тема: «Катионы»
I уровень (ответы оцениваются в 1 балл)
а) I аналитической группе
б) II аналитической группе
в) III аналитической группе катионов.
Установите соответствие:
1. фиолетовый цвет а) барий.
2. желтый цвет б) кальций.
3. желто-зеленый цвет в) натрий
4. кирпично-красный цвет г) калий
Ответы: 1…, 2…., 3…., 4…
а) I аналитической группы б) II аналитической группы в) III аналитической группы
а) I аналитической группы б) II аналитической группы в) III аналитической группы
а) серной кислотой – H2SO4 б) бихроматом калия K2Cr2O7 в) щелочью – NaOH
Установите соответствие:
1. темно-синей осадок берлинской лазури а) Al3+
2. темно-синей осадок турнбулева синь б) Fe3+
3. кроваво-красный раствор в) Fe2+
4. белый аморфный осадок
Ответы: 1…, 2…., 3…., 4….
II уровень (ответы оцениваются в 2 балла)
Закончите предложение:
III уровень (ответы оцениваются в 6 баллов)
1. Напишите уравнения реакций действия: а) на KNO3 раствором NaHC4H4O6,
б) на полученный в предыдущей реакции осадок H2SO4, а также NaOH
2. Напишите в молекулярном и сокращенном ионном виде уравнения наиболее характерных реакций ионов Fe2+ и Fe3+
Рейтинговая оценка знаний по 30 бальной шкале:
10 баллов - оценка 2 (неуд).
11-17 баллов - оценка 3 (удов).
18-25 баллов - оценка 4 (хор). 26-30 баллов - оценка 5 (отл).
Качественный анализ
Тема: «Анионы»
I уровень (ответы оцениваются в 1 балл)
Установите соответствие:
1. Группа анионы
1) I аналитическая группа а) SO42-, CO32-, PO43-
2) II аналитическая группа б) NO3-, NO2-
3) III аналитическая группа в) Cl-, Br-,J-
Ответ: 1…, 2…, 3….
4. В чем растворяется осадок сульфата бария – BaSO4?
а) серной кислоте - H2SO4 б) соляной кислоте – HCl в) щелоче – NaOН
Установите соответствие:
1) I аналитическая группа а) AgNО3
2) II аналитическая группа б) отсутствует
3) III аналитическая группа в) BaCl2
Ответ: 1…, 2…, 3…
а)НСl б)AgNO3 в) Ag2CO3 г) Ag3PO4
Установите соответствие:
Ответ: 1…, 2…., 3…
а) да б) нет в) трудно сказать
II уровень (ответы оцениваются в 4 балла)
б) медью в) карбонатом калия г) цинком. Напишите уравнения реакций
III уровень (ответы оцениваются в 6 баллов)
Рейтинговая оценка знаний по 30 бальной шкале:
10 баллов - оценка 2 (неуд).
11-17 баллов - оценка 3 (удов).
18-25 баллов - оценка 4 (хор).
26-30 баллов - оценка 5 (отл).
Метод нейтрализации
Тема: «Стандартизация раствора гидроксида натрия по щавелевой кислоте»
Входной тестовый контроль
|
№ |
Задание теста |
Ответ |
Рецензирование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Если количественный анализ позволяет определить количественное содержание отдельных элементов в соединениях, то можно ли его использовать для определения содержания азота, фосфора, калия в минеральных удобрениях? |
|
|
|
2. |
Зная требования предъявляемые к стандартным веществам, можно ли приготовить стандартный раствор перманганата калия, если он содержит примеси? |
|
|
|
3. |
Так как в основе кислотно-основного титрования лежит реакция Н+ + ОН- = Н2О, то можно ли назвать этот метод методом нейтрализации?
|
|
|
|
4. |
Какие из перечисленных определений можно осуществить методом титриметрического анализа: а) влажность продукта; б) зольность зерна, муки; в) кислотность растительного сырья?
|
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Титром раствора называется.......................................................................................... |
|
|
|
2 |
Точку эквивалентности устанавливают ......................................................................... |
|
|
|
3. |
Различают следующие методы титриметрического анализа ………………………… |
|
|
|
4. |
Укажите, какие стандартные вещества используются для установления титра растворов кислот и растворов щелочей ………………………………………………… |
|
|
|
5. |
Напишите формулы, по которым можно рассчитать массу и нормальность раствора ............................................................................................................................... |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Рассчитать эквивалентные массы Мg(ОН)2; Н2СО3; AlCl3.
|
|
|
|
2. |
На титрование 20 мл. раствора НNO3 затрачено 15 мл. 0,12 н. раствора NaОН. Вычислите нормальную концентрацию, титр и массу НNO3 в 250 мл. раствора.
|
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Тема: «Стандартизация раствора гидроксида натрия по щавелевой кислоте»
Выходной тестовый контроль
|
№ |
Задание теста. |
Ответ |
Рецензи‑рование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Если индикатор обладает свойством присоединять протон, JndОН + + Н- = Jnd+ + Н2О то является ли он основным индикатором? |
|
|
|
2. |
Если показатели титрования индикатора не входят в предел скачка на кривой, то можно ли его использовать для этого случая титрования?
|
|
|
|
3. |
В каком из перечисленных титрований точка эквивалентности соответствует рН=7 а) HCl + NaOH б) СН3СООН + NaОН в) КОН + НNО3 |
|
|
|
4. |
При титровании уксусной кислоты гидроксидом калия, какой индикатор следует брать? (предел скачка на кривой титрования 8-10 рН) а) фенолфталеин б)метиловый красный в) метиловый оранжевый г) лакмус |
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Индикаторами являются …………………………………………………………………. |
|
|
|
2. |
Стандартизированными называются такие растворы ………………………………….. |
|
|
|
3. |
Показателем титрования называется ……………………………………………………. |
|
|
|
4. |
Объясните, почему готовится стандартизированный раствор гидроксида натрия, а не стандартный? |
|
|
|
5.
|
Рассчитайте, какой объем раствора NaОН плотностью 1,37 г/см3 надо взять для приготовления 200 мл. 0,1 н. раствора? |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Почему кривые титрования многоосновных кислот или многокислотных оснований имеют несколько перегибов?
|
|
|
|
2. |
Какую массовую долю (%) карбоната натрия содержит образец загрязненной соды, если на нейтрализацию навески ее в 0,2648 г. израсходовано 24,45 мл. 0,1970 н. НCl?
|
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Методы окисления-восстановления
Тема: «Стандартизация перманганата калия по щавелевой кислоте»
Входной тестовый контроль 1-й вариант
|
№ |
Задание теста |
Ответ |
Рецензирование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Какие из перечисленных определений можно осуществить методами редоксметрии: а)влажность продукта; б)окисляемость воды, спирта; в) кислотность растительного сырья? |
|
|
|
2. |
Какие реакции называются окислительно-восстановительными: а)реакции соединения протонов Н+ и гидроксид-ионов ОН- с образованием малодиссоциирующих молекул воды; б)реакции, при которых определяемые илоны образуют комплексные соединения с некоторыми органическими соединениями; в)реакции, при которых электроны переходят от одних атомов или ионов к другим. |
|
|
|
3. |
В каких соединениях марганец проявляет степень окисления +7: а)MnO2 б) НMnO4 в)MnSO4 |
|
|
|
4. |
Какая реакция является окислительно-восстановительной: а) NO +O2 ® NO2 б) HCl + NaOH = NaCl +H2O |
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Различают следующие методы редоксметрии .................................... |
|
|
|
2 |
Стандартными называются такие растворы ........................ . |
|
|
|
3. |
Эквивалент окислителя равен ...... |
|
|
|
4. |
Точку эквивалентности устанавливают........................................ |
|
|
|
5. |
Напишите формулы, по которым можно рассчитать титр раствора .................................................... |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Определите эквивалент окислителя в реакции K2MnO4 + Cl2 ®KMnO4 + KCl |
|
|
|
2. |
На титрование 25 мл. 0,1 н раствора NaOH пошло 25,5 мл. раствора НNO3. Вычислить нормальность HNOз и количество ее взятое в 250 мл. раствора. |
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Входной контроль 2-й вариант
|
№ |
Задание теста |
Ответ |
Рецензирование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Какие из перечисленных определений можно осуществить методами редоксметрии: а)жесткость воды; б)зольность зерна; в) ионы Fe2+, Cu2+ содержащихся в сельскохозяйственных ядах |
|
|
|
2. |
Какие реакции называются окислительно-восстановительными: а)реакции соединения протонов Н+ и гидроксид-ионов ОН- с образованием малодиссоциирующих молекул воды; б)реакции, при которых определяемые ионы образуют комплексные соединения с некоторыми органическими соединениями; в)реакции, при которых электроны переходят от одних атомов или ионов к другим. |
|
|
|
3. |
Степень окисления марганца в соединении K2MnO4 равна: а)+7 б) +6 в) +4 |
|
|
|
4. |
Какая реакция является окислительно-восстановительной: а) СаO +Н2O = Са(ОН)2 б) H2 + Cl2 = 2НCl |
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Рабочим раствором метода перманганатометрии является................................ |
|
|
|
2 |
Стандартизированными называются такие растворы ......................... |
|
|
|
3. |
Эквивалент восстановителя равен ...... |
|
|
|
4. |
Титрование это........................................ |
|
|
|
5. |
Напишите формулы, по которым можно рассчитать массу и нормальность раствора .................................................... |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Определите эквивалент восстановителя в реакции K2MnO4 + Cl2 ®KMnO4 + KCl |
|
|
|
2. |
Вычислить нормальность раствора H2SO4 с r = 1,395
|
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Тема: «Стандартизация перманганата калия по щавелевой кислоте»
Выходной тестовый контроль
|
№ |
Задание теста. |
Ответ |
Рецензи‑рование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Перманганатометрические определения проводят в среде а) щелочной; б) кислой; в)нейтральной |
|
|
|
2. |
Для подкисления титруемых растворов в методе перманганатометрии применяется: а) азотная кислота; б) соляная кислота в) серная кислота |
|
|
|
3. |
Можно ли приготовить стандартный раствор перманганата калия? а) да; б) нет; в) трудно сказать |
|
|
|
4. |
Перманганат калия является: а) восстановителем б) окислителем в) окислителем и восстановителем |
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Исходными веществами для определения точной концентрации раствора перманганата калия являются ........... ... .......... |
|
|
|
2. |
Точку эквивалентности в методе перманганатометрии определяют по………………………….. |
|
|
|
3. |
Напишите схему химической реакции при титровании щавелевой кислоты перманагнатом калия
|
|
|
|
4. |
Объясните, почему готовится стандартизированный раствор перманганата калия? |
|
|
|
5. |
Объясните, почему перманганатометрические определения проводят в кислой среде? |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Определите г-эквивалент окислителя и восстановителя в уравнении реакции КМпО4 + Nа2С2О4 + Н2SО4 = МпSО4 + СО2 + К2SО4 + Na2SО4 + Н2О
|
|
|
|
2. |
Определить титр перманганата калия по железу, если на титрование 10,00 мл 0,1 н. раствора щавелевой кислоты израсходовано 8,00 мл раствора перманганата калия.
|
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Тема: «Определение общей жесткости воды комплексонометрическим методом»
Входной тестовый контроль
|
№ |
Задание теста. |
Ответ |
Рецензирование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Перманганат калия является: а) окислителем б) восстановителем в) окислителем и восстановителем г) трудно сказать |
|
|
|
2. |
Можно ли приготовить стандартный раствор перманганата калия?: а) да; б) нет; в) трудно сказать |
|
|
|
3. |
Перманганатометрические определения проводят в среде а) щелочной; б) кислой; в)нейтральной г) слабощелочной |
|
|
|
4. |
Для подкисления титруемых растворов в методе перманганатометрии применяется: а) азотная кислота; б) соляная кислота в) серная кислота г) угольная кислота |
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Исходными веществами для определения точной концентрации раствора перманганата калия являются ........... ... .......... |
|
|
|
2. |
Почему не нужен индикатор при перманганатометрическом определении ………………………….. |
|
|
|
3. |
Закончите схему химической реакции при титровании щавелевой кислоты перманагнатом калия КМпО4 + Н2С2О4 + Н2SО4 →
|
|
|
|
4. |
Объясните, почему готовится стандартизированный раствор перманганата калия? ............................................................................................ |
|
|
|
5. |
Объясните, почему перманганатометрические определения проводят в кислой среде? …………………………………………………… |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Определите г-эквивалент окислителя в уравнении реакции 2КМпО4 + 5Nа2С2О4 + 8Н2SО4 = 2МпSО4 +10СО2 + К2SО4 + 5Na2SО4 + 8Н2О
|
|
|
|
2. |
Навеску КМпО4 массой 1,8750 г растворили и довели объем раствора водой до 500 мл. Вычислите нормальность раствора для реакции в кислой среде.
|
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Тема: «Определение общей жесткости воды комплексонометрическим методом»
Выходной тестовый контроль
|
№ |
Задание теста |
Ответ |
Рецензирование |
|
|
Тесты 1 уровня |
|
|
|
1. |
Комплексонометрическим методом можно определить: а)влажность продукта; б)окисляемость воды; в) кислотность растительного сырья г) жесткость воды |
|
|
|
2. |
Рабочим раствором в методе комплесонометрии используется: а)аммонийно-буферная смесь; б)сульфат магния; в)трилон Б; г) хлорид кальция |
|
|
|
3. |
Жесткость воды выражается в следующих единица: а) градусах б) мг-экв/л в) массовых долях г) ответ дан в пунктах 1 и 2 |
|
|
|
4. |
В точке эквивалентности при титровании трилоном Б с индикатором хромогеном черным наблюдается аналитический эффект: а) синее окрашивание раствора б) красное окрашивание раствора в) осадок синего цвета г) осадок красного цвета |
|
|
|
|
Тесты II уровня. Закончите предложение. |
|
|
|
1. |
Карбонатная жесткость ........................................................................ |
|
|
|
2 |
Некарбонатная жесткость ................................................................
|
|
|
|
3. |
Закончите уравнение химической реакции: Са (НСО3)2 ® |
|
|
|
4. |
Точку эквивалентности устанавливают........................................ |
|
|
|
5. |
Напишите формулу расчета жесткости воды Ж = .................................................... |
|
|
|
|
Тесты III уровня. |
|
|
|
1. |
Механизм действия индикатора хромогена черного в трилонометрическом методе. |
|
|
|
2. |
На титрование 100 мл. природной воды пошло в среднем 17, 60 мл.0,0502 н раствора трилона Б. Вычислить жесткость воды. |
|
|
Рейтинговая оценка знаний по 20 бальной шкале:
Тест I уровня - 1 б.
Тест II уровня - 2 б.
Тест III уровня –3б.
5 баллов - оценка 2 (неуд).
6-12 баллов - оценка 3 (удов).
13-17 баллов - оценка 4 (хор).
18-20 баллов - оценка 5 (отл).
Приложение 2
Домашняя контрольная работа для обучающихся заочной формы обучения
Вариант № 1
1. Что такое маргарин, где его применяют. Какова его пищевая ценность?
2. Напишите уравнения реакций взаимодействия 2-бромпропана с:
а) водой при кипячении; б) металлическим натрием; в) спиртовым раствором гидроксида калия.
3. Напишите структурные формулы следующих углеводородов:
а) 2,2,3,4–тетраметил пентана; б)2-метил-3-изопропилгексана. Изомерами каких нормальных углеводородов они являются?
4. Сколько граммов этанола надо взять для получения 200г диэтилового эфира, если выход эфира равен 80% от теоретически возможного?
5. В результате брожения глюкозы получено 92г этилового спирта. Какой объем займет при нормальных условиях образовавшийся при этом диоксид углерода?
6. Расшифруйте следующие превращения:
Ацетилен ![]() А
А ![]() Б
Б![]() В
В
Приведите уравнения соответствующих реакций и назовите полученные вещества.
7. Приведите краткую характеристику водорастворимых витаминов и укажите их физиологическое значение.
8. Определить молярную массу растворенного вещества, если раствор, содержащий 12,2г вещества в 1л при температуре 170С обладает осмотическим давлением 489000 Па.
9. Приведите формулу и схему строения мицеллы бромида серебра, полученного при взаимодействии КBr с избытком AgNO3.
Вариант № 2
1. Основные физико-химические свойства белков. Питательная ценность белков.
2. Составьте структурные формулы всех изомерных спиртов, отвечающих формуле С5Н11ОН. Назовите их по номенклатуре ИЮПАК.
3. Какое количество брома необходимо для получения 85г бензилбромида, если выход продукта реакции составляет 70% от теоретического? При каких условиях получают из толуола бензилбромид?
4. Напишите уравнения реакций присоединения водорода, синильной кислоты, гидросульфита натрия к следующим соединениям:
а) пропионовый альдегид; б)ацетон. Назовите полученные вещества.
5. Выразите уравнениями следующие превращения:
Этилен →этанол→ этаналь→ этановая кислота→ацетамид
6. Сколько граммов глюкозы можно получить теоретически при гидролизе 32,4 г крахмала?
7. Какими различными способами можно осуществить омыление жиров? Какие продукты получаются при этом?
8. Рассчитать при какой температуре будет замерзать раствор, содержащий 20 г сахарозы С12Н22О11 в 250 г воды Ккр = 1,86.
9. Приведите формулу и схему строения мицеллы хлорида серебра, полученного при взаимодействии AgNO3 с избытком КCl.
10. Что такое коагуляция, какие факторы ее вызывают и использование ее в промышленности.
Вариант № 3
1. Физико-химические характеристики и свойства простых липидов.
2. Какие простые эфиры могут образовываться при нагревании смеси этилового и пропилового спиртов с концентрированной серной кислотой? Составьте уравнения реакций.
3. Какой максимальный объем водорода может быть выделен в результате реакции взаимодействия металлического натрия с одним молем глицерина?
4. Напишите структурные формулы изомерных углеводородов состава С7Н16, главная цепь которых состоит из пяти углеродных атомов. Назовите их по номенклатуре ИЮПАК.
5. Как при помощи гидроксида меди (II) можно распознать глицерин и уксусный альдегид? Приведите уравнения соответствующих реакций.
6. Сколько тонн олеодистеарина потребуется для получения 5 г глицерина, если выход глицерина равен 90% от возможного теоретически?
7. Какие вещества входят в состав крахмальной патоки? Где применяется крахмальная патока?
8. Сколько глюкозы С6Н12О6 содержится в 100г воды, если раствор кипит при температуре 1010С. Кэб = 0,52.
9. Приведите формулу и схему строения мицеллы хлорида серебра, полученного при взаимодействии NaCl с избытком AgNO3.
10. Опишите набухание растворов ВМС. Перечислите явления, сопровождающие набухание.
Вариант № 4
1. Что такое витаминизация пищевых продуктов? Для чего она производится?
2. Напишите структурные формулы изомерных углеводородов состава С6Н12. Назовите углеводороды по номенклатуре ИЮПАК.
3. Получите реакцией Вюрца следующие углеводороды:
а)3-метилпентан; б)2,3 –диметилбутан.
4. Какое количество брома необходимо для получения 200г бромбензола, если выход продукта составляет 85% от теоретического?
5. Напишите уравнения реакций получения уксусной кислоты: а)окислением спирта; б)окислением альдегида; в)гидролизом сложного эфира.
6. Определите выход молочной кислоты, если при брожении 300г глюкозы получилось 120 г молочной кислоты.
7. Какое применение находят терпены в пищевой промышленности, парфюмерии, медицине?
8. Найти температуру замерзания 7% водного раствора глицерина С3Н8О3. Ккр = 1,860С.
9. Приведите формулу и схему строения мицеллы карбоната кальция, полученного при взаимодействии CaCl2 с избытком Na2CO3.
10. Какие дисперсные системы называются пенами? Что такое пенообразователи, пеногасители?
Вариант № 5
1. Напишите структурные формулы альдегидов состава С6Н12О, содержащих главные цепи из четырех атомов углерода. Назовите их по номенклатуре ИЮПАК.
2. Какие витамины относятся к водорастворимым? Приведите краткую характеристику витаминов группы В.
3. Укажите условия осуществления следующих превращений:
Бутан →бутадиен-1,3→ бутадиеновый каучук
4. Сколько тонн стеариновой кислоты можно получить при омылении 4 т тристеарина, если выход стеариновой кислоты равен 60% от возможного теоретически?
5. Напишите, пользуясь структурными формулами, уравнения реакций окисления и восстановления глюкозы.
6. Какие эфиры используются в качестве синтетических пищевых эссенций? Приведите их формулы и названия.
7. Составьте уравнения реакций муравьиной кислоты с: а) цинком; б)гидроксидом калия; в)карбонатом натрия; г)этиловым спиртом. Назовите полученные продукты.
8. Зная, что давление пара воды при температуре 250С равна 3168 Па. Определить давление 8% водного раствора глюкозы С6Н12О6.
9. Приведите формулу и схему строения мицеллы сульфида цинка, полученного при взаимодействии ZnCl2 с избытком H2S.
10. Опишите явление тиксотропии в студнях и дайте ему объяснение.
Вариант № 6
1. Сформулируйте правило замещения в бензольном ядре. Приведите заместители первого и второго рода. Покажите их действие на конкретных примерах.
2. Как отличить этан от этилена при помощи химических реакций? Напишите уравнения этих реакций и укажите условия их проведения.
3. Сколько граммов 2-хлорбутана потребуется для получения 148г бутанола-2, если выход спирта составит 70% от возможного теоретически?
4. Выразите уравнениями следующие превращения:
этилен →этиловый спирт→ этилат натрия→диэтиловый эфир
5. Сколько килограммов инвертного сахара получится при инверсии 100кг сахарозы? Укажите значение этой реакции.
6. Напишите структурные формулы и названия всех сложных эфиров состава С5Н10О2.
7. Напишите уравнение реакции молочнокислого брожения. Чем вызывается этот процесс и какое значение он имеет в пищевой промышленности?
8. Сколько глюкозы С6Н12О6 должно содержать 2 л раствора, чтобы осмотическое давление при t = 100С было равно 488400 Па?
9. Приведите формулу и схему строения мицеллы сульфата бария, полученного при взаимодействии BaCl2 с избытком Na2SO4.
Вариант № 7
1. Основные представители ароматобразующих веществ. Ароматизация пищи.
2. Какие три простых эфира получатся при нагревании смеси метилового и этилового спиртов с концентрированной серной кислотой? Приведите уравнения реакций и назовите полученные вещества.
3. Напишите структурные формулы всех изомерных углеводородов состава С6Н14. Назовите углеводороды по номенклатуре ИЮПАК, укажите изомеры, содержащие третичные атомы углерода.
4. Из 10 литров ацетилена получено 10г ацетальдегида. Вычислите выход альдегида в процентах.
5. Расшифруйте следующую схему превращений:
СН3ОН![]() А
А ![]() Б
Б ![]() В
В
Приведите уравнения соответствующих реакций.
6. Сколько граммов молочной кислоты получится при брожении 300г глюкозы, если выход молочной кислоты составляет 70% от возможного теоретически?
7. Как получают маргарин в промышленности? Перечислите компоненты, входящие в его состав.
8. В 150 г воды растворили 42г тростникового сахара С12Н22О11 при температуре 300С. Вычислите давление пара этого раствора, если давление паров воды при этой температуре равно 4242 Па.
9. Приведите формулу и схему строения мицеллы иодида серебра, полученного при взаимодействии NaJ с избытком AgNO3.
10. Каковы причины адсорбции?
Вариант № 8
1. Восстанавливающие и невосстанавливающие дисахариды. Сахароза, ее строение, свойства, нахождение в природе.
2. Сколько литров кислорода (н.у.) потребуется для полного сгорания 200г пентана?
3. Напишите уравнения реакций взаимодействия 2-хлорбутана с:
а) цианидом калия; б) аммиаком; в) металлическим натрием;
г) водою (при кипячении). Назовите полученные вещества.
4. Сколько тонн глицерина получится при омылении 3 т тристеарина, если выход глицерина равен 90% от возможного теоретически.
5. Напишите уравнения реакций взаимодействия α–аланина с:
а) гидроксидом меди (II); б) соляной кислотой.
6. Напишите структурную формулу сложного эфира глюкозы и уксусной кислоты (используя циклическую формулу глюкозы), если известно, что в состав эфира входят пять остатков уксусной кислоты.
7. В какой последовательности должны быть проведены реакции хлорирования и нитрования бензола для получения ортохлорнитробензола?
8. Вычислите осмотичеcкое давление раствора фруктозы С6Н12О6 при температуре 250С,если в 180см3 содержится 5,5 г фруктозы.
9. Рассчитать при какой температуре будет замерзать раствор, содержащий 20 г сахарозы С12Н22О11 в 250 г воды Ккр = 1,86.
10. В чем специфичность растворов высокомолекулярных соединений (ВМС)?
Вариант № 9
1. Какие витамины относятся к жирорастворимым? Приведите их краткую характеристику.
2. Получите реакцией Вюрца следующие углеводороды:
а) 2,3-диметилпентан; б)2-метилгексан. Изомерами каких нормальных углеводородов они являются?
3. Сколько граммов гидроксида натрия потребуется для полной нейтрализации 180г щавелевой кислоты?
4. В чем заключается гидрирование жиров, для чего оно проводится? Где применятся саломас (гидрожир)?
5. Напишите уравнение реакций взаимодействия молочной кислоты с : а)пропионовой кислотой; б)этиловым спиртом. Назовите полученные продукты.
6. Сколько граммов 70%-ного карбида кальция надо взять для получения 100г ацетилена?
7. Напишите уравнения и укажите условия осуществления следующих превращений:
8. метан→ацетилен →бензол →толуол
9. Температура замерзания чистого бензола 5,50С. Раствор, содержащий 0,22 г полиэфира в 29,5г бензола замерзает при температуре 5,350С. Определить молярную массу полиэфира Ккр = 5,1.
10. Приведите формулу и схему строения мицеллы гидроксида железа (III), полученного при взаимодействии NaOH с избытком FeCl3.
11. Объясните моющее действие мыла.
Вариант № 10
1. Приведите классификацию белков по составу и строению.
2. Напишите для углеводорода состава С6Н14 структурные формулы:
а) изомера, содержащего три первичных атома углерода;
б) изомера с одним вторичным атомом углерода;
в) изомера с двумя третичными атомами углерода.
3. Сколько граммов этилового спирта получится в результате спиртового брожения 180г глюкозы, если выход спирта составляет 65%?
4. Составьте уравнения реакций получения уксусной кислоты из метана.
5. Напишите уравнение реакции получения трипептида из следующих аминокислот: α-аминоуксусная; α–аминопропионовая и α– аминомасляная.
6. Сколько граммов муравьиной кислоты надо взять для получения 150г этилформиата, если выход эфира равен 65% от теоретически возможного?
7. При помощи каких химических реакций можно отличить друг от друга этиловый спирт, глицерин и фенол?
8. Осмотическое давление раствора, содержащего 18г растворенного вещества в 500см3 воды равно при температуре 00С 9*105Па. Определить молярную массу вещества.
9. Сколько грамм глицерина С3Н8О3 надо прибавить к 0,5 л воды, чтобы понизить температуру замерзания на – 0,50С. Ккр = 1,86.
10. Что называется катализом? Перечислите виды катализа.
Приложение 3.
Упражнения и задачи для самостоятельного решения
Раздел 1. Органическая химия
Тема 1.1. Углеводороды
6. Напишите структурные формулы: а) 2-метилбутан; б) 2,3 – диметилбутан; в) 3-пропилгептана.
7. Напишите структурные формулы: а) 2-метилбутен-2; б) 2,3 – диметилгексен-3; в) 2,2,6-триметил-4-этилгептен-3
8. Напишите структурные формулы: а) бутин-1; б) пентин-2; в) 4,4 диметилпентина-2.
9. Составьте структурные формулы изомеров гексана и назовите их по номенклатуре ИЮПАК.
10. Какие вещества являются изомерами и какие гомологами (допишите атомы водорода в веществах и назовите их):
а) С – С – С - С б) С – С – С – С – С в) С – С – С
ï
С
С
ï
г) С – С – С – С д) С – С – С
ï ï
С С
6. При помощи, каких реакций можно осуществить следующие превращения?
а) Метан→ бромэтан→ н-бутан→ оксид углерода (IV)
б) С→ СН4→ СН3Cl → С2Н6→ С2Н4→ С2Н5OH
↓
ацетилен
7.Назовите по номенклатуре ИЮПАК следующие углеводороды и напишите их сокращенную структурную формулу:
а) С – С – С –С = С б) С – С ≡ С –С – С – С
│ | |
С С С- С
8.Построить структурную формулу 2,4,4- триметилпентана и найти в этой формуле первичные, вторичные, третичные и четвертичные атомы углерода.
9.Массовые доли элементов в соединении составляют С – 82,8%, Н – 17,2%. 10.Относительная плотность паров этого вещества по водороду равна 29. Определите формулу этого соединения.
11.Рассчитать массовые доли С в соединениях: а)С2Н2; б) пропилене.
12.В какой последовательности должны быть проведены реакции хлорирования и нитрования для получения из бензола ортонитрохлорбензола?
13.В какой последовательности должны быть проведены реакции бромирования и нитрования для получения из бензола метабромнитробензола?
Тема 1. 2. Производные углеводородов
8. Напишите структурные формулы следующих соединений:
а)2-метилпропанол-2; б) 3-этилпентанол-3; в)2,2,4,4-тетраметилгептанол-1;
г)2-метилбутандиол-1,4; д)2-этилгексантриол-1,3,5; е)2-метил-4-этилгексанол-2.
9. Напишите уравнения реакций получения следующих простых эфиров:
а) метилэтилового; б)этилпропилового; в)моноэтилового эфира этиленгликоля
10. Напишите структурные формулы сложных эфиров, образующихся из: а) уксусной кислоты и пропанола-1; б) муравьиной кислоты и этанола. Назовите сложные эфиры.
11. Сколько мл 40%-ной азотной кислоты (плотность 1,2г/см3) потребуется для получения 11,35г тринитрата глицерина? Ответ 8мл.
12. Сколько граммов этилового спирта нужно взять для получения 200 г диэтилового эфира, если выход эфира равен 80% от теоретически возможного? Ответ: 310,8г
13. Напишите структурные формулы вторичных спиртов с эмпирической формулой С5Н11ОН. Назовите изомеры по номенклатуре ИЮПАК.
14. Осуществите следующие превращения:
С→ СаС2→ С2Н2 →С2Н4 →С2Н5ОН →С2Н5ОNa
Альдегиды и кетоны.
6. Напишите структурные формулы следующих соединений:
а) 2-метилпропаналь; б) 3-этилпентаналь; в) 2,3-диметилгептаналь; г) бутанон-2;
д) 2-этилгексанон-3.
7. Напишите структурные формулы изомерных альдегидов и кетонов с молекулярной формулой С5Н10О. Назовите изомеры по номенклатуре ИЮПАК.
8. В двух пробирках находятся уксусной альдегид и этиленгликоль. С помощью каких реакций можно определить эти вещества? Напишите уравнения реакций.
9. Сколько граммов металлического серебра выделится при реакции «серебреного зеркала», если в нее вступили 200 г ацетальдегида?
10. Какой объем займет муравьиный альдегид ( н.у.), полученный из 100г метилового спирта?
Карбоновые кислоты
6. Напишите структурные формулы кислот с молекулярной формулой С7Н14О2, содержащих главные цепи из пяти и шести атомов углерода. Назовите кислоты по международной номенклатуре.
7. Напишите уравнения реакций следующих превращений и назовите продукты реакций:
С2Н6 → С2Н5Сl → С2Н5ОН→ СН3-СОН →СН3СООН→ СН3-СОО-С3Н7
8. Составьте уравнения реакций получения сложных эфиров: а)этилформиата; б)пропилпропионата.
9. Какие массы этановой кислоты и этанола потребуются для получения 8,8 г эфира, если выход составляет 90%? (Ответ: 5,4г; 4,14г)
10. Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола?
Оксикислоты и Аминокислоты
1. Напишите уравнения реакций взаимодействия аланина с: а) гидроксидом натрия;
б) хлороводородной кислотой.
2.Напишите уравнение реакции взаимодействия молочной кислоты с:
а) гидроксидом натрия; б) уксусной кислотой; в) этиловым спиртом. Назовите полученные вещества.
3.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН2=СН2 → СН3-СН2-ОН → СН3СОН → СН3СООН → СН2BrСООН → СН2NH2СООН
4.При восстановлении 92,25г нитробензола получили 66г анилина по реакции Зинина. Какой выход (в %) продукта реакции? (Отвт: 94,6%)
Приложение 4.
Темы докладов, рефератов
Задание: Проанализировать первоисточники и подготовить доклад, реферат на предложенную тему:
Раздел «Органическая химия
1. Жизнь и деятельность А.М. Бутлерова.
2. Современные представления о теории химического строения.
3. Роль отечественных ученых в становлении и развитии мировой органической химии.
4. Химия углеводородного сырья и моя будущая профессия.
5. Синтетические каучуки: история, многообразие и перспективы.
6. Этанол величайшее благо и страшное зло.
7. Алкоголизм и его профилактика.
8. Многоатомные спирты и моя будущая профессиональная деятельность.
9. История получения уксусной кислоты.
10. Жизнь и деятельность Н.Н. Зинина.
11. Ароматические оксикислоты в пищевой промышленности, медицине.
12. Заменимые и незаменимые аминокислоты в технологии переработки продовольственных продуктов.
13. Синтетические волокна на аминокислотной основе.
14. Дефицит белка в пищевых продуктах и его преодоление в рамках глобальной продовольственной программы.
15. Структура белка и его деструктурирование.
16. «Жизнь – это способ существавания белковых тел..», биологические функции белков.
17. Жиры как продукт питания, химическое сырье.
18. Сложные эфиры в природе и производстве.
19. Углеводы и их роль в живой природе.
20. Развитие сахарной промышленности в России.
21. Роль углеводов в моей будущей профессиональной деятельности.
22. Сложные эфиры клетчатки.
23. История открытия витаминов. Работы Н.И. Лунина.
24. Роль витаминов в питании человека: водорастворимые и жирорастворимые.
25. Пищевые красители.
26. Ароматизаторы.
27. Подслащивающие вещества.
a. II.Раздел «Физическая и коллоидная химия»
28. «Жидкие кристаллы».
29. «Защита окружающей среды и охрана труда».
30. «Химия и сельское хозяйство».
31. «Растения и почва».
32. «Влияние катализа на технологии различных пищевых производств».
33. Химическая промышленность и химическая технология.
34. Важнейшие составляющие химического производства (сырьё, вода, энергия).
35. Современные удобрения и их классификация.
36. «Моющие и чистящие средства»,
37. «Химические средства гигиены и косметики (дезодоранты, косметические средства)».
38. «Влияние дисперсности на свойства дисперсных систем»,
39. «Значение исследований броуновского движения для обоснования материалистического мировоззрения».
40. «Распределение коллоидных частиц по высоте».
41. «Действие электролита на золи».
42. «Химия в производстве продуктов питания».
43. Структурно-механические свойства эмульсий».
44. «Плазменное состояние вещества».
45. «Свободный пробег молекул газа».
46. «Конденсация газов».
47. «Белковые кристаллы».
a. III.Раздел «Аналитическая химия»
48. «Роль металлов в живой природе».
49. «Роль металлов в истории человеческой цивилизации».
50. «Химия неметаллов в моей профессиональной деятельности».
51. Рождающие соли – галогены.
52. «Перманганат калия в нашей жизни».
53. «Вода как реагент и как среда в бродильном производстве».
54. «Роль воды в бродильном производстве».
55. «Жесткость воды: плюсы и минусы».
56. «Методы устранение жесткости воды на промышленных предприятиях».
57. Многоликий карбонат кальция: в природе, промышленности, быту.
58. Применение колориметрического (рефрактометрического, поляриметрического) методов анализа в технохимическом контроле пищевых производств».
59. «Жизнь и деятельность М.С. Цвета».
60. «История открытия хроматографии».
61. «Хроматографические методы анализа в промышленности».
62. «Влияние нитратов на здоровье человека».
Приложение 5.
Содержание экзаменационных билетов
по дисциплине -I семестр
1. Краткий исторический очерк развития органической химии. Теория химического строения органических соединений А.М. Бутлерова. Классификация органических соединений
2. Предельные углеводороды (алканы). Строение. Общая формула, понятие о гомологическом ряде, изомерия. Номенклатура алканов. Физические и химические свойства.
3. Алкены. Гомологический ряд, строение, номенклатура и изомерия алкенов. Понятие о природе двойной связи. Пи-связь. Методы получения алкенов. Физические и химические свойства алкенов.
4. Алкины. Гомологический ряд, строение, изомерия, номенклатура алкинов. Понятие о природе тройной связи. Получение алкинов. Физические и химические свойства алкинов.
5. Ароматические углеводороды ряда бензола. Гомологический ряд, строение, номенклатура, изомерия. Современные электронные представления о строении молекулы бензола. Способы получения бензола. Физические и химические свойства бензола.
6. Правила замещения в бензольном ядре. Направляющее действие заместителей. Применение бензола и его гомологов.
7. Спирты. Классификация. Понятие о функциональной группе. Одноатомные спирты. Общая формула, гомологический ряд, изомерия и номенклатура. Способы получения спиртов.
8. Физические и химические свойства одноатомных спиртов. Применение.
9. Многоатомные спирты. Отдельные представители: этиленгликоль, глицерин, ксилит, сорбит. Их применение в производстве пищевых продуктов. Свойства многоатомных спиртов.
10.Фенолы. Классификация, изомерия, номенклатура. Получение, физические и химические свойства, применение.
11.Альдегиды: строение, общая формула, гомологический ряд, номенклатура, изомерия. Способы получения. Физические и химические свойства. Применение.
12.Кетоны: строение, общая формула, гомологический ряд, номенклатура, изомерия. Способы получения. Физические и химические свойства. Применение.
13.Карбоновые кислоты: классификация, природа карбоксильной группы. Одноосновные карбоновые кислоты. Гомологический ряд, общая формула, изомерия, номенклатура. Нахождение в природе. Способы получения. Физические и химические свойства карбоновых кислот.
14.Сложные эфиры. Получение, физические и химические свойства. Применение. Пищевые эссенции.
15.Оксикислоты: строение их молекул, номенклатура. Понятие об атомности и основности оксикислот. Оптическая изомерия оксикислот. Оптические антиподы. Рацематы. Получение.
16.Физические и химические свойства оксикислот. Отдельные представители оксикислот: молочная, яблочная кислота, винная, лимонная, салициловая, галловая кислоты, их применение в технологии переработки продовольственных продуктов.
17.Аминокислоты: строение молекул, классификация, номенклатура. Распространение в природе. Получение аминокислот.
18.Физические и химические свойства аминокислот. Понятие о незаменимых и заменимых аминокислотах. Влияние состава и содержания аминокислот на биологическую ценность пищевых продуктов.
19.Распространение белков в природе. Биологическое значение. Состав и строение белков. Работы Э.Фишера и Л. Полинга. Структура белков: первичная, вторичная, третичная и четвертичная. Биологическая ценность белков. Полноценные и неполноценные белки.
20.Свойства белков: денатурация, растворимость, амфотерность, меланоидинообразование, гидролиз, цветные реакции. Классификация белков: протеины и протеиды. Характеристика отдельных представителей простых и сложных белков. Использование белков в технологии производства продовольственных продуктов.
21.Простые липиды, их структура, состав и классификация. Жидкие и твердые жиры. Химические константы жиров: кислотное, иодное число и число омыления. Химические изменения в жирах происходящих при хранении и кулинарной обработке. Рафинация масел.
22.Химические свойства жиров: гидролиз, переэтерификация, окисление, гидрирование. Способы получения жиров. Маргарин, его свойства, получение, пищевая ценность.
23.Углеводы. Их распространение в природе и биологическое значение. Классификация углеводов. Моносахариды. Их строение и классификация. Способы получения моносахаридов.
24.Понятие об оптической стериоизомерии моносахаридов, таутомерия, мутаротация. Физические и химические свойства моносахаридов.
25.Брожение. Виды брожения: спиртовое, молочнокислое, маслянокислое, лимоннокислое. Роль процесса брожения в пищевой промышленности и сельском хозяйстве.
26.Олигосахариды их классификация, строение молекул дисахаридов. Определение и свойства. Восстанавливающие и невосстанавливающие дисахариды. Химические свойства. Инверсия сахарозы, карамелизация. Применение в технологии продовольственных продуктов
27.Полисахариды. Крахмал, его распространение в природе и биологическое значение. Строение крахмала. Физические и химические свойства крахмала. Использование крахмала и продуктов гидролиза в пищевой промышленности. Гликоген и инулин. Их распространение и биологическое значение.
28.Клетчатка (целлюлоза), ее строение и распространение в природе. Гидролиз клетчатки. Понятие о сложных эфирах клетчатки: нитроцеллюлоза, ацетилклетчатка. Ксантогенат клетчатки. Целлофан. Понятие об искусственных волокнах.
29.Пектиновые вещества. Распространение в природе, строение и использование в пищевой промышленности.
30.История открытия витаминов. Классификация витаминов по растворимости, основные источники витаминов. Отдельные представители. Применение витамина Е в качестве антиокислителя жиров. Антивитамины и их значение.
31.Ферменты, их классификация. Особенности действия ферментов как биологических катализаторов. Факторы, влияющие на активность ферментов. Роль ферментов в технологии производства продовольственных продуктов и сырья.
32.Пищевые добавки, их классификация. Природные и синтетические красители. Представители, использование в пищевой промышленности.
33.Вкусовые добавки, их значение, основные представители в технологии. Ароматобразующие: значение в технологии производства продовольственных продуктов.
34.Пищевые добавки. Их классификация. Вещества, изменяющие структуру и физико-химические свойства пищевых продуктов.
35.Подслащивающие вещества и ароматизаторы.
36.Общая характеристика основных агрегатных состояний вещества.
37.Предмет физической химии. Основные этапы развития физической химии. Значение физической химии в развитии технологии пищевых производств и в осуществлении мероприятий по охране окружающей среды.
38.Газообразное состояние вещества. Идеальные и реальные газы.
39.Жидкое состояние вещества. Внутреннее давление. Общая характеристика.
40.Поверхностное натяжение жидкости и методы его определения.
41.Вязкость жидкостей. Методы определения вязкости жидкости.
42.Твердое состояние вещества. Кристаллические и аморфные тела.
43.Основные понятия термодинамики. Первое начало термодинамики. Энтальпия.
44.Термохимия. Закон Гесса.
45.Следствие из закона Гесса. Теплоты образования и сгорания химических соединений.
46.Второе начало термодинамики.
47.Термодинамические факторы, определяющие направления процессов. Термодинамические потенциалы.
48.Растворы. Общая характеристика. Количественный состав растворов.
49.Растворы газов в жидкостях. Закон Генри.
50.Взаимная растворимость жидкостей.
51.Растворы твердых веществ в жидкостях.
52.Диффузия и осмос в растворах. Закон Вант-Гоффа.
53.Осмос. Практическое значение осмоса.
54.Давление насыщенного пара над раствором. Закон Рауля.
55.Температура замерзания и кипения растворов. Криоскопическая и эбуллиоскопическая постоянная растворителя.
56.Катализ, его виды. Ингибиторы. Автокатализ.
57.Гомогенный катализ, его стадии.
58.Гетерогенный катализ. Активные центры. Стадии.
59.Ферментативный катализ. Значение.
60.Скорость и константа скорости химической реакции.
61.Зависимость скорости химической реакции от природы реагирующих веществ и от температуры. Энергия активации.
62.Высокомолекулярные соединения. Природные и синтетические ВМС. Строение молекул. Эластичность и пластичность.
63.Набухание и его стадии. Вязкость.
64. Образование студней. Коацервация.
65.Высокомолекулярные электролиты. Белки. Изоэлектрическая точка. Роль ВМС и их значение в пищевом производстве.
Содержание экзаменационных билетов
по дисциплине – 2 семестр
1. История развития коллоидной химии. Коллоидные системы, их основные признаки.
2. Классификация дисперсных систем: по дисперсности, межфазному взаимодействию, агрегатному состоянию.
3. Методы получения коллоидных систем.
4. Методы очистки коллоидных систем.
5. Оптические и молекулярно-кинетические свойства коллоидных систем.
6. Электрокинетические явления в коллоидных системах. Опыт Рейса. Электрофорез, электроосмос.
7. Коагуляция золей электролита. Правила. Применение.
8. Суспензии, особенности, применение.
9. Эмульсии, их классификация, особенности, применение.
10. Пены. Пенообразование. Разрушение пен. Применение.
11. Аэрозоли, их общая характеристика и свойства. Применение.
12. Порошки, их основные свойства, применение.
13. Поверхностно-активные вещества, их свойства, строение.
14. Строение мицелл коллоидных ПАВ. Практическое значение коллоидных ПАВ. Моющее действие мыла
15. Сорбция и её виды: адсорбция, абсорбция, хемосорбция, десорбция. Адсорбент. Адсорбтив. Особенности адсорбции и ее значение.
16. Предмет аналитической химии. Методы анализа вещества: физические, химические, физико-химические.
17. Качественный химический анализ. Методы. Аналитические реакции и способы их выполнения.
18. Задачи и методы количественного анализа. Метрологические характеристики измерений (правильность, воспроизводимость и точность анализа).
19. Сущность и операции гравиметрического (весового) анализа. Применение весового анализа в технохимическом контроле пищевых производств.
20. Влажность. Определение влажности сырья методом высушивания.
21. Сущность титриметрического анализа. Титрование. Точка эквивалентности. Методы анализа. Стандартные и стандартизированные растворы.
22. Сущность метода нейтрализации. Индикаторы. Теория индикаторов.
23. Мерная посуда объемного анализа, ее назначение и правила работы с ней. Порядок титрования.
24. Приготовление 0,1н рабочего раствора NaOH.
25. Приготовление 0,1н исходного стандартного раствора на примере щавелевой кислоты.
26. Методы редоксиметрии. Перманганатометрия. Сущность метода.
27. Приготовление рабочего раствора перманганата калия. Применение перманганата калия.
28. Иодометрия. Сущность метода. Применение метода.
29. Условия проведения иодометрических определений.
30. Жесткость воды, виды жесткости, единицы измерения, значение ее определения для предприятий пищевой промышленности.
31. Сущность комплексонометрического метода. Понятие о компексонах. Трилон Б. Индикаторы комплексонометрии.
32. Определение общей жесткости воды трилонометрическим методом.
33. Физико-химические методы анализа. Классификация. Преимущества, их роль в автоматизации производства.
34. Колориметрия. Визуальные методы колориметрии. Определение содержания меди в растворе сульфата меди методом стандартных серий.
35. Рефрактометрический метод. Устройство лабораторного рефрактометра, принцип работы. Применение.
36. Сущность поляриметрического метода анализа. Устройство поляриметра-сахариметра, правила работы. Применение.
37. Потенциометрический метод анализа. Устройство рН метра, принцип работы. Применение.
38. Хроматографический метод анализа. Классификация. Ионообменная хроматография, особенности метода, устройство хроматографической колонки. Применение.
Приложение 6
Методические рекомендации для написания рефератов, докладов, эссе
Методические рекомендации для написания рефератов
Очень часто во время учебного процесса приходится писать рефераты по изучаемой дисциплине. Практика показала, что приблизительно половина всех обучающихся не знают, как правильно написать и оформить реферат.
Написание реферата требует от обучающихся определенных общеобразовательных навыков и умений.
Реферат – это только первая ступенька в научно-исследовательской работе. Умение правильно его выполнить станет полезным при написании курсовой и дипломной работ в будущем.
Что такое реферат
Реферат (от лат.еfеrо – «сообщаю») – краткое изложение в письменном виде или форме публичного доклада содержания книги, статьи или нескольких работ, научного труда, литературы по общей тематике.
Реферат - это самостоятельная научно-исследовательская работа обучающихся, где автор раскрывает суть исследуемой проблемы; приводит различные точки зрения, а также собственные взгляды на нее. Содержание материала должно быть логичным, изложение материала носит проблемно-поисковый характер.
Для начала нужно определиться с темой реферата. Тематика рефератов определяется преподавателем, а право выбора темы реферата предоставляется самому обучающемуся. Прежде чем выбрать тему реферата, автору необходимо выяснить свой интерес, определить, над какой проблемой он хотел бы поработать, более глубоко ее изучить. Название реферата, поданного преподавателю, может не совпадать с названием из предлагаемого списка, но должно соответствовать тематике и временным рамкам изучаемой дисциплины, а также предварительно согласовано с преподавателем. Для написания реферата необходимо подобрать соответствующий материал, провести несколько лабораторных опытов, составить таблицы и подобрать иллюстрации. Все рассуждения и факты, которые содержит реферат, должны сопровождаться подробным описанием и примерами.
Преподаватель должен ознакомить обучающихся с требованиями, предъявляемыми к форме написания реферата, определить его примерный объем, количество первоисточников, которые будут проанализированы в работе. Помощь в выборе литературы для реферата также входит в компетенцию преподавателя.
Требования к выполнению реферата
Реферат является научной работой, поскольку содержит в себе элементы научного исследования, а потому к нему предъявляются требования, как к научной работе. Правила оформления научных работ являются общими для всех отраслей знаний и регламентируются государственными стандартами, в частности ГОСТом 7.1 - 84. «Библиографическое описание документа: Общие требования и правила составления», «Правилами составления библиографического описания».
При оформлении реферата необходимо соблюдать правила цитирования, правильное оформление ссылок, библиографического списка, правила сокращения.
Работа (эссе или реферат) считается списанной, если в ней присутствуют цитаты длинной в одно предложение без кавычек или пересказ чужих мыслей без указания ссылки на источник в тексте.
Оформить реферат можно двумя способами – печатным (текст, распечатанный на листах) и компьютерным (презентация). Немаловажным моментом является и защита выполненной работы. Ваш текст должен быть продуманным, понятным для слушателей. Не старайтесь просто прочитать текст, лучше объясните своими словами.
Работа открывается титульным листом, где указывается полное название ведомства, колледжа, специальность, дисциплина, тема реферата, фамилии автора и преподавателя, место и год написания. На следующей странице, которая не нумеруется, помещается оглавление с точным названием каждой главы и указанием начальных страниц.
Общий объем реферата не должен превышать 15-20 страниц для печатного варианта (обычно опытный обучающийся укладывается в 10-12 страниц). При печатании текста реферата абзац должен равняться четырем знакам (1,25 см.). Поля границы: левое - 2 см., правое - 2 см., нижнее 2 см., верхнее - 2 см. до номера страницы. Текст печатается через 1-1,5 интервала. Если текст реферата набирается в текстовом редакторе Microsoft Word, рекомендуется использовать шрифты: Times New Roman или Arial, размер шрифта - 14 пт. При работе с другими текстовыми редакторами шрифт выбирается самостоятельно, исходя из требований - 60 строк на лист (через 1-1,5 интервала).
Каждая структурная часть реферата (введение, главная часть, заключение и т.д.) начинается с новой страницы. Расстояние между главой и следующей за ней текстом, а также между главой и параграфом составляет 2 интервала. После заголовка, располагаемого посредине строки, не ставится точка. Не допускается подчеркивание заголовка и переносы в словах заголовка. Страницы реферата нумеруются в нарастающем порядке. Номера страниц ставятся вверху или внизу в середине листа. Титульный лист реферата включается в общую нумерацию, но номер страницы на нем не проставляется.
Этапы работы над рефератом
1) Формулирование темы (тема должна быть не только актуальной по своему значению, но оригинальной, интересной по содержанию. Подбор и изучение основных источников по теме (как правило, не менее 8-10-и).
2) Составление библиографии.
3) Обработка и систематизация информации.
4) Разработка плана реферата.
5) Написание реферата.
6) Публичное выступление с результатами исследования.
Структура и правила оформления реферата
Структура
Введение
Введение – своеобразная презентация работы. Раздел должен содержать постановку проблемы в рамках выбранной темы и обоснование выбора проблемы и темы. Здесь дается краткая характеристика исследуемой темы, обосновывается ее актуальность и личная заинтересованность автора в ее исследовании, отмечается практическая ценность ее содержания. В разделе указываются конкретные задачи, которые предстоит решить в соответствии с поставленной целью.
Основная часть
В данном разделе должна быть раскрыта тема реферата. Здесь необходимо полностью изложить накопленный и проанализированный материал, суть проблемы, точки зрения других исследователей и собственное мнение по данной проблеме. Каждая часть данного раздела должна описывать определенную задачу и приводить к соответствующим выводам.
Заключение
В данном разделе подводятся итоги всей работы, делаются выводы, содержащие четкие и проанализированные ответы на поставленные цели. Здесь же указываются итоговые выводы и обобщения по всей теме, отмечается то новое, что получено в результате проделанной работы. Заключение по объему не должно превышать введение.
Список литературы
Текст должен содержать ссылки на цитируемые источники, которые все приводятся в данном разделе. В списке литературы обязательно указывать источник, из которого была взята статья.
Список составляется в алфавитном порядке по фамилиям авторов. При наличии нескольких работ одного автора их названия располагаются по годам изданий. Если использовались отдельные страницы из книги, то указываются именно они. Иностранные источники (материалы, изданные на иностранном языке) перечисляются в конце всего списка.
Методические рекомендации для написания докладов
Доклад есть достаточно неизученная, но довольно часто встречающаяся работа в учебных заведениях. Различают устный и письменный доклад (по содержанию близкий к реферату).
Доклад - вид самостоятельной научно - исследовательской работы, где автор раскрывает суть исследуемой проблемы; приводит различные точки зрения, а также собственные взгляды на нее.
В докладе соединяются три качества исследователя: умение провести исследование, умение преподнести результаты слушателям и квалифицированно ответить на вопросы.
Отличительной
чертой доклада является научный, академический стиль.
Академический стиль - это совершенно особый способ подачи текстового материала,
наиболее подходящий для написания учебных и научных работ. Данный стиль
определяет следующие нормы: а) предложения могут быть длинными и сложными; б)
часто употребляются слова иностранного происхождения, различные термины; в)
употребляются вводные конструкции типа “по всей видимости”, “на наш взгляд”; г)
авторская позиция должна быть как можно менее выражена, то есть должны
отсутствовать местоимения “я”, “моя (точка зрения)”; д) в тексте могут
встречаться штампы и общие слова.
Этапы работы над докладом
1) Подбор и изучение основных источников по теме (рекомендуется использовать не менее 3 – 4-х источников).
2) Составление библиографии.
3) Обработка и систематизация материала. Подготовка выводов и обобщений.
4) Разработка плана доклада.
5) Написание.
6) Публичное выступление с результатами исследования.
Общая структура доклада
1. Формулировка темы исследования (причем она должна быть не только актуальной, но и оригинальной, интересной по содержанию).
2. Актуальность исследования (чем интересно направление исследований, в чем заключается его важность, какие ученые работали в этой области, каким вопросам в данной теме уделялось недостаточное внимание, почему учащимся выбрана именно эта тема).
3. Цель работы (в общих чертах соответствует формулировке темы исследования и может уточнять ее).
4. Задачи исследования (конкретизируют цель работы, “раскладывая” ее на составляющие).
5. Гипотеза (научно обоснованное предположение о возможных результатах исследовательской работы). Формулируется в том случае, если работа носит экспериментальный характер.
6. Методика проведения исследования (подробное описание всех действий, связанных с получением результатов).
7. Результаты исследования. Краткое изложение новой информации, которую получил исследователь в процессе наблюдения или эксперимента. При изложении результатов желательно давать четкое и немногословное истолкование новым фактам. Полезно привести основные количественные показатели и продемонстрировать их на используемых в процессе доклада графиках и диаграммах.
8. Выводы исследования. Умозаключения, сформулированные в обобщенной, конспективной форме. Они кратко характеризуют основные полученные результаты и выявленные тенденции. Выводы желательно пронумеровать: обычно их не более 4 или 5.
Требования к оформлению доклада
Советы о том, как блестяще выступить перед аудиторией
· Если вам нужно время, чтобы собраться с мыслями, то, наличие заранее подготовленных карт, схем, диаграммы, фотографии и прочих материалов поможет вам выиграть драгоценное время для формулировки ответа, а иногда и дать готовый ответ.
При соблюдении этих правил у вас должно получиться интересное выступление, которое, несомненно, будет высоко оценено аудиторией.
Методически рекомендации по оформлению портфолио по дисциплине
Портфолио – это собрание личных достижений обучающихся по дисциплине, которое формируется лично обучающимся и реально показывает его уровень подготовленности и активности в различных учебных и внеучебных видах деятельности в колледже и за его пределами.
Портфолио – это современная форма оценивания образовательных результатов в учебной, творческой, социальной, исследовательской и других видов деятельности.
Основные цели портфолио:
· отслеживание, учет, оценивание индивидуальных достижений обучающихся;
· активация их разноплановой деятельности, повышение образовательной активности обучающихся;
· индивидуализация образования и социализация обучающегося;
Основные задачи портфолио:
· формирование умения учиться: ставить цели, планировать и организовывать свою деятельность;
· формирование и поддержка учебной мотивации обучающихся;
· организация воспитательного процесса с учетом личных стремлений и достижений обучающихся;
· расширение возможностей контрольно-оценочных средств образования, введение альтернативных форм оценивания;
· развитие навыков рефлексивной, оценочной деятельности обучающихся.
Структура Портфолио:
Раздел 1 «Общие данные личности»:
· первый (титульный) лист (фамилия, имя, отчество, год рождения);
· самопрезентация, резюме, автобиография (по выбору обучающихся).
Раздел 2. «Рабочее портфолио»:
- коллекция выполненных заданий самостоятельной работы по изучению дисциплины,
- аудио, видеозаписи;
- фотографии;
- электронные версии работ.
Раздел 3. «Перечень моих достижений»:
· исследовательские проекты, статьи, творческие работы и прочее;
· грамоты, дипломы, свидетельства, удостоверения, сертификаты и другие документы, демонстрирующие высокую результативность в области изучения дисциплины;
· фотографии, вырезки, копии из средств массовой информации: газет, журналов и других изданий.
Раздел 4 . «Отзывы»:
· отзывы;
· рецензии на выполненные работы работ;
· рекомендательные письма;
· письма поддержки.
Раздел 5. «Рейтинговый лист».
Оформление Портфолио.
Портфолио оформляется самим обучающимся в папке-накопителе с файлами на бумажных носителях и/или в электронном виде. Каждый отдельный материал, включенный в портфолио, должен датироваться и визироваться (кроме грамот, благодарностей). По необходимости, работа обучающихся с портфолио сопровождается помощью преподавателя, в ходе совместной работы которых устанавливается отношения партнерства, сотрудничества. Это позволяет обучающимся постепенно развивать самостоятельность, брать на себя контроль и ответственность.
Приложение 6
Таблица1
Периодическая система Д.И. Менделеева
Таблица 2
Таблица растворимости кислот, оснований и солей
Таблица3
Плотность растворов кислот, оснований и аммиака
|
Массовая доля (%) |
H2SO4 |
HNO3 |
HCl |
KOH |
NaOH |
NH3 |
|
2 |
1,013 |
1,011 |
1,009 |
1,016 |
1,023 |
0,992 |
|
4 |
1,027 |
1,022 |
1,019 |
1,033 |
1,046 |
0,983 |
|
6 |
1,040 |
1,033 |
1,029 |
1,048 |
1,069 |
0,973 |
|
8 |
1,055 |
1,044 |
1,039 |
1,065 |
1,092 |
0,967 |
|
10 |
1,069 |
1,056 |
1,049 |
1,082 |
1,115 |
0,960 |
|
12 |
1,083 |
1,068 |
1,059 |
1,100 |
1,137 |
0,953 |
|
14 |
1,098 |
1,080 |
1,069 |
1,118 |
1,159 |
0,956 |
|
16 |
1,112 |
1,093 |
1,079 |
1,137 |
1,181 |
0,939 |
|
18 |
1,127 |
1,106 |
1,083 |
1,156 |
1,213 |
0,932 |
|
20 |
1,143 |
1,119 |
1,100 |
1,176 |
1,225 |
1,926 |
|
22 |
1,158 |
1,132 |
1,110 |
1,196 |
1,247 |
0,919 |
|
24 |
1,174 |
1,145 |
1,121 |
1,217 |
1,268 |
0,913 |
|
26 |
1,190 |
1,158 |
1,132 |
1,240 |
1,289 |
0,908 |
|
28 |
1,205 |
1,171 |
1,142 |
1,263 |
1,310 |
0,903 |
|
30 |
1,224 |
1,184 |
1,152 |
1,286 |
1,332 |
0,898 |
|
32 |
1,238 |
1,198 |
1,163 |
1,310 |
1,352 |
0,893 |
|
34 |
1,255 |
1,211 |
1,173 |
1,334 |
1,374 |
0,889 |
|
36 |
1,273 |
1,225 |
1,183 |
1,358 |
1,395 |
0,884 |
|
38 |
1,290 |
1,238 |
1,194 |
1,384 |
1,416 |
|
|
40 |
1,307 |
1,251 |
|
1,411 |
1,437 |
|
|
42 |
1,324 |
1,264 |
|
1,437 |
1,458 |
|
|
44 |
1,342 |
1,277 |
|
1,460 |
1,478 |
|
|
46 |
1,361 |
1,290 |
|
1,485 |
1,499 |
|
|
48 |
1,380 |
1,303 |
|
1,511 |
1,519 |
|
|
50 |
1,399 |
1,316 |
|
1,538 |
1,540 |
|
|
52 |
1,419 |
1,328 |
|
1,564 |
1,560 |
|
|
54 |
1,439 |
1,340 |
|
1,590 |
1,580 |
|
|
56 |
1,460 |
1,351 |
|
1,616 |
1,601 |
|
|
58 |
1,482 |
1,362 |
|
|
1,622 |
|
|
60 |
1,503 |
1,373 |
|
|
1,643 |
|
|
62 |
1,525 |
1,384 |
|
|
|
|
|
64 |
1,547 |
1,394 |
|
|
|
|
|
66 |
1,571 |
1,403 |
|
|
|
|
|
68 |
1,594 |
1,412 |
|
|
|
|
|
70 |
1,617 |
1,421 |
|
|
|
|
|
72 |
1,640 |
1,429 |
|
|
|
|
|
74 |
1,664 |
1,437 |
|
|
|
|
|
76 |
1,687 |
1,445 |
|
|
|
|
|
78 |
1,710 |
1,453 |
|
|
|
|
|
80 |
1,732 |
1,460 |
|
|
|
|
|
82 |
1,755 |
1,467 |
|
|
|
|
|
84 |
1,776 |
1,474 |
|
|
|
|
|
88 |
1,808 |
1,486 |
|
|
|
|
|
90 |
1,819 |
1,491 |
|
|
|
|
|
92 |
1,830 |
1,496 |
|
|
|
|
|
94 |
1,837 |
1,500 |
|
|
|
|
|
98 |
1,841 |
1,510 |
|
|
|
|
|
100 |
1,838 |
1,522 |
|
|
Лист согласования
Дополнения и изменения к комплекту ФОС на учебный год
Дополнения и изменения к комплекту ФОС на __________ учебный год по дисциплине ___________________________________________________
В комплект ФОС внесены следующие изменения:
________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________
Дополнения и изменения в комплекте ФОС обсуждены на заседании ЦМК _______________________________________________________
«_____» ____________ 20_____г. (протокол № _______ ).
Председатель ЦМК ________________ /___________________/
Фонд оценочных средств разработан на основе Федерального государственного образовательного стандарта по специальности 19.02.05 Технология бродильных производств и виноделие, утвержденного приказом Министерства образования и науки Российской Федерации от 22.04. 2014 года № 375, рабочей программы дисциплины.
Автор:
Филиппова Т.И. преподаватель
высшей квалификационной категории
![]() центра–колледжа
прикладных квалификаций
центра–колледжа
прикладных квалификаций
ФГБОУ ВО Мичуринский ГАУ ______ Т.И. Филиппова
Рецензент:
Родюкова Е.Н. преподаватель
высшей
![]() квалификационной
категории
квалификационной
категории
центра–колледжа прикладных квалификаций
ФГБОУ ВО Мичуринский ГАУ _________ Е.Н. Родюкова
Фонд оценочных средств рассмотрен на заседании ЦМК специальностей «Агрономия», «Земельно-имущественные отношения», «Технология бродильных производств и виноделие»
протокол № 1 от « 29 » августа 2014 г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВПО МичГАУ
протокол № 1 от « 9 » сентября 2014 г.
Фонд оценочных средств рассмотрен на заседании ЦМК специальностей «Агрономия», «Земельно-имущественные отношения», «Технология бродильных производств».
протокол № 9 от «20» апреля 2015г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол № 8 от «24 » апреля 2015 г.
Фонд оценочных средств рассмотрен на заседании ЦМК специальностей «Агрономия», «Земельно-имущественные отношения», «Технология бродильных производств и виноделие»
протокол № 11 от «14» июня 2016 г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол №1 от «30» августа 2016 г.
Фонд оценочных средств рассмотрен на заседании ЦМК специальностей «Агрономия», «Земельно-имущественные отношения», «Технология бродильных производств и виноделие»
протокол № 8 от «22» марта 2017 г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол № 8 от «24» марта 2017 г.
Фонд оценочных средств рассмотрен на заседании ЦМК технических специальностей
протокол № 8 от «20» марта 2018 г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол № 7 от «23» марта 2018 г.
Фонд оценочных средств рассмотрен на заседании ЦМК технических специальностей
протокол № 8 от «22» марта 2019 г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол № 8 от «29» марта 2019 г.
Фонд оценочных средств рассмотрен на заседании ЦМК технических специальностей
протокол № 9 от «17» апреля 2020 г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол № 8 от «20» апреля 2020 г.
Фонд оценочных средств рассмотрен на заседании ЦМК технических специальностей
протокол №9 от 19.04.2021г.
Фонд оценочных средств утвержден на заседании учебно-методической комиссии центра-колледжа прикладных квалификаций ФГБОУ ВО Мичуринский ГАУ
протокол № 8 от « 21» апреля 2021 г.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.