
Конспект урока химии в 9 классе: Обобщение знаний по теме «Неметаллы»
Тип урока: обобщение и систематизация знаний
Учитель:Белоножко Тамара Николаевна, учитель химии МБОУ «Дивовская СОШ»Мглинского района Брянской области
Тема урока: Обобщение знаний по теме «Неметаллы»
Тип урока: обобщение и систематизация знаний
Данная разработка представляет собой урок обобщающего повторения и систематизации знаний учащихся о неметаллах на основе сравнительной характеристики состава, строения и свойств неметаллов.
Конспект урока химии по теме: «Обобщение знаний по теме «Неметаллы»
Цели урока:
образовательная: повторить, обобщить и систематизировать знания учащихся о строении атомов неметаллов, свойствах неметаллов и их соединений, формировать умения систематизировать и анализировать информацию, полученную на уроках химии; рассмотреть значение неметаллов в жизни человека.
развивающая: развивать логическое мышление, способность обобщать, речь, коммуникативные способности, самостоятельность, познавательный интерес;
воспитательная: воспитывать культуру умственного труда, ответственность за результаты своей работы.
Оборудование: компьютер, мультимедийный проектор, таблица для заполнения, карточки для учащихся четырех групп, периодическая таблица химических элементов Д.И.Менделеева, таблица растворимости.
Ход урока
I. Организационная часть урока.
Учитель рассказывает о значении неметаллов для современных отраслей промышленности, повседневной жизни людей и вместе с учащимися определяет тему и цели урока.
II. Повторение и обобщение пройденного материала.
Учащиеся класса разбиваются на 4 группы для работы над учебным материалом.
Учитель предлагает вспомнить строение неметаллов и выводит на экран задание:
Задание 1
Провести сравнительную характеристику неметаллов на примере углерода, азота, серы и хлора. Каждая группа получает таблицу и заполняет один столбец (по жребию) и совместно проверяем.

Вывод: для атомов неметаллов характерны четыре и более электрона на внешнем энергетическом уровне, тенденция к приёму недостающих до 8 электронов, атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
Неметаллы имеют 2 типа кристаллических решёток:
- молекулярные ( O2, O3, N2, Cl2),
- атомные (алмаз, графит).
Для неметаллов – простых веществ характерна ковалентная неполярная химическая связь.
Задание 2
Учитель зачитывает определения, относящиеся к загаданному химическому элементу неметаллу. Если ответ готов после первого определения, то команда получает 5 баллов, после второго – 4, после третьего – 3,после четвертого – 2, после пятого – 1, не угадано вещество – 0.
Задание для группы №1
- Его простое вещество называют всесъедающим.
- Он обладает высокой химической активностью.
- Его соединения входят в состав зубных паст.
- Он входит в состав фреона.
-Его находят в тефлоновых покрытиях.
О т в е т. Фтор
Задание для группы №2
- Это распространенный неметалл.
- Его атомы входят в состав белков.
- Простое вещество горит синеватым пламенем.
- Используют в производстве резины.
-Используют в производстве спичек.
О т в е т. Сера
Задание для группы №3
- Простое газообразное вещество оказывает сильное раздражающее действие на слизистую оболочку глаз и дыхательную систему.
- Он входит в состав некоторых гербицидов, инсектицидов и пестицидов.
- Простое вещество получают главным образом в результате электролиза солей.
- Войска Антанты и германские войска применяли это вещество в боевых действиях.
- Соединения этого элемента используют для дезинфекции воды в плавательных бассейнах.
О т в е т. Хлор
Задание для группы № 4
- Этот неметалл образует аллотропные модификации.
- Академик А.Е. Ферсман навал его «элементом жизни и мысли»
- Входит в состав костей.
- Открыт в 1669 году немецким алхимиком Брандом.
- Одна из аллотропных модификаций светится в темноте.
О т в е т. Фосфор
Задание 3
Химические свойства неметаллов и их соединений повторяем, играя в «крестики-нолики». Уравнения реакций представители команд записывают на доске. Правильное выполнение задания оценивается в 5 баллов.
Задание для группы №1
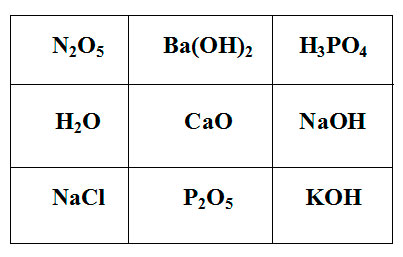
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с оксидом серы (IV). Составьте уравнения реакций взаимодействия оксида серы (IV) с веществами, формулы которых составляют выигрышный путь.
Задание для группы №2
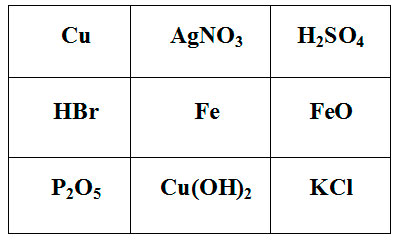
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с соляной кислотой. Составьте уравнения реакций взаимодействия соляной кислоты с веществами, формулы которых составляют выигрышный путь.
Задание для группы №3
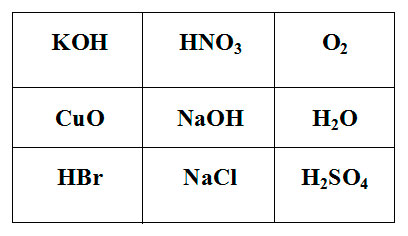
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с аммиаком. Составьте уравнения реакций взаимодействия аммиака с веществами, формулы которых составляют выигрышный путь.
Задание для группы №4
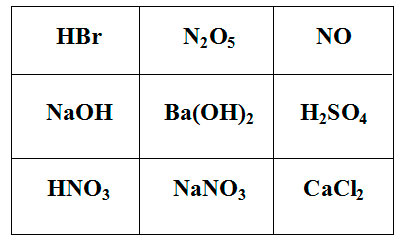
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с карбонатом калия. Составьте уравнения реакций взаимодействия карбоната калия с веществами, формулы которых составляют выигрышный путь.
Задание 4
Учитель загадывает загадки, а команды отвечают. Право отвечать первым дается тому, кто быстрее поднимет руку. За каждый правильный ответ – 1 балл.
1) Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья,
Ярче в нем горит свеча,
Угадайте Вы меня! (Кислород)
2) Из меня состоит все живое,
Графит, антрацит и алмаз.
Я на улице, в школе и в поле,
Я в деревьях и в каждом из вас. (Углерод)
3) Тяжелый, жидкий и пахучий,
Подвижный, сильно ядовит.
Удушлив и весьма летучий
Сквозь поры пробки он летит.
Лечебным действием заметен
И всем известен потому. (Бром.)
4) Я - газ легчайший и бесцветный,
Неядовитый и безвредный.
Рождаю воду, когда сгораю,
Аэростаты наполняю,
А с кислородом образую
Я смесь горящую, взрывную. (Водород)
5) Гулять в грозу - какой резон?
Подышим воздухом, дружище.
В природе словно стало чище,
Повсюду в воздухе ... (Озон.)
6) Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня, и под водой
Оксид мой станет кислотой. (Фосфор)
7) Предупреждаю вас заранее:
Я не пригоден для дыхания!
Но все как будто бы не слышат
И постоянно мною дышат. (Азот)
Задание 5
Напишите уравнения реакций, с помощью которых можно осуществить превращения.

Посмотрим на результаты. Представитель команды записывает на доске уравнения и все проверяют (за каждое уравнение – 1 балл).
Знаете ли вы, что:
1) …алхимикам удалось получить серную кислоту еще в Х в. при прокаливании некоторых сульфатов (купоросов). Отсюда и произошло историческое название купоросное масло.
2) …самое обыкновенное средство тушения пожаров – вода – горит в струе фтора светло-фиолетовым пламенем;
3) …алхимики называли серу «желчью бога Вулкана»;
Задание 6
«Реши задачу»
Учитель выдаёт командам карточки с условием задачи. Группа решает задачу. Решения записывают в свою рабочую тетрадь. Через 5 минут работы учитель собирает решения.
Какой объем водорода (н.у.) выделится при взаимодействии алюминия с 49г 20% раствора серной кислоты?
III. Подведение итогов.
Учитель оценивает работу групп и выставляет оценки.
IV. Домашнее задание:
1) повторить п. 27-31
2) подготовиться к контрольной работе.
Литература
1. Габриелян О.С. Химия, 9 класс. М. Дрофа, 2008
2. Девяткин В.В., Ляхова Ю.М. Химия для любознательных. Ярославль: Академия развития, 2000.
3. Зайковский И.И. Занимательная химия. М.: Учпедгиз, 1961
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.